化学人教版九上:2.3制取氧气 (第二课时)作业(含解析)
文档属性
| 名称 | 化学人教版九上:2.3制取氧气 (第二课时)作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 97.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-28 15:36:32 | ||
图片预览


文档简介
制取氧气(第二课时)
一、基础训练
1.关于催化剂的下列说法中,正确的是()
A.化学反应后催化剂本身的质量减少
B.化学反应后催化剂本身的质量增加
C.催化剂可改变化学反应速率
D.化学反应后催化剂的化学性质发生变化
2.下列反应属于分解反应的是()
A.铁 +氧气四氧化三铁
B.水氢气+氧气
C.甲烷+氧气水+二氧化碳
D.二氧化碳+水碳酸
3.小华采用加热氯酸钾的方法制取氧气,错把高锰酸钾当做二氧化锰放入氯酸钾内,其结果与只加氯酸钾相比,正确的是()
A.反应速率不变
B.生成氧气的质量不变
C.反应速率加快,生成氧气的质量不变
D.反应速率加快,生成氧气的质量增加
4.下列有关催化剂的叙述正确的是()
A.在化学反应里能加快其他物质的化学反应速率,而本身质量和性质在反应前后都没改变的物质叫催化剂
B.二氧化锰是一切化学反应的催化剂
C.在过氧化氢的分解反应前后,二氧化锰的质量和化学性质都没有发生改变
D.要使过氧化氢分解放出氧气,必须加入二氧化锰,否则就不能发生反应
5.工业上用分离液态空气制取氧气的依据是()
A.氧气与氮气的化学性质不同
B.氧气与氮气在水中的溶解度不同
C.氧气与氮气的密度不同
D.氧气与氮气的沸点不同
6.小华在做加热氯酸钾与二氧化锰的混合物制取氧气的实验时,错把高锰酸钾当作了二氧化锰,结果发现氯酸钾的分解速率同样被加快了。以下推论中错误的是()
A.完全反应后所得到的氧气比用二氧化锰作催化剂时多
B.高锰酸钾也可作氯酸钾制氧气反应的催化剂
C.反应过程中试管中的固体物质最多可达五种
D.完全反应后试管内的固体物质有三种
7.工业上制取大量氧气的方法是()
A.加热氯酸钾 B.加热高锰酸钾
C.分离液态空气 D.加热二氧化锰
8.催化剂在化学反应中所起的作用是()
A.加快化学反应速率 B.使生成物质量增加
C.改变化学反应速率 D.减慢化学反应速率
9.下列对催化剂的描述正确的是()
A.二氧化锰可作为各种化学反应的催化剂
B.在化学反应前后,催化剂本身的质量和所有性质均未改变
C.并不是所有化学反应都需要催化剂,但分解反应一定需要催化剂
D.某些化学反应可以有多种催化剂,某些催化剂可催化多个化学反应
10.实验室制取氧气与工业制取氧气比较,下列叙述正确的是()
A.生产原料不同 B.制取产物完全不同
C.都是化学反应 D.都利用了物质的化学性质
11.下列对化学反应类型的判断中,不正确的是()
A.碳酸→水+二氧化碳(分解反应)
B.过氧化氢→水+氧气(分解反应)
C.铁+氧气→四氧化三铁(化合反应、氧化反应)
D.石蜡+氧气→二氧化碳+水(化合反应、氧化反应)
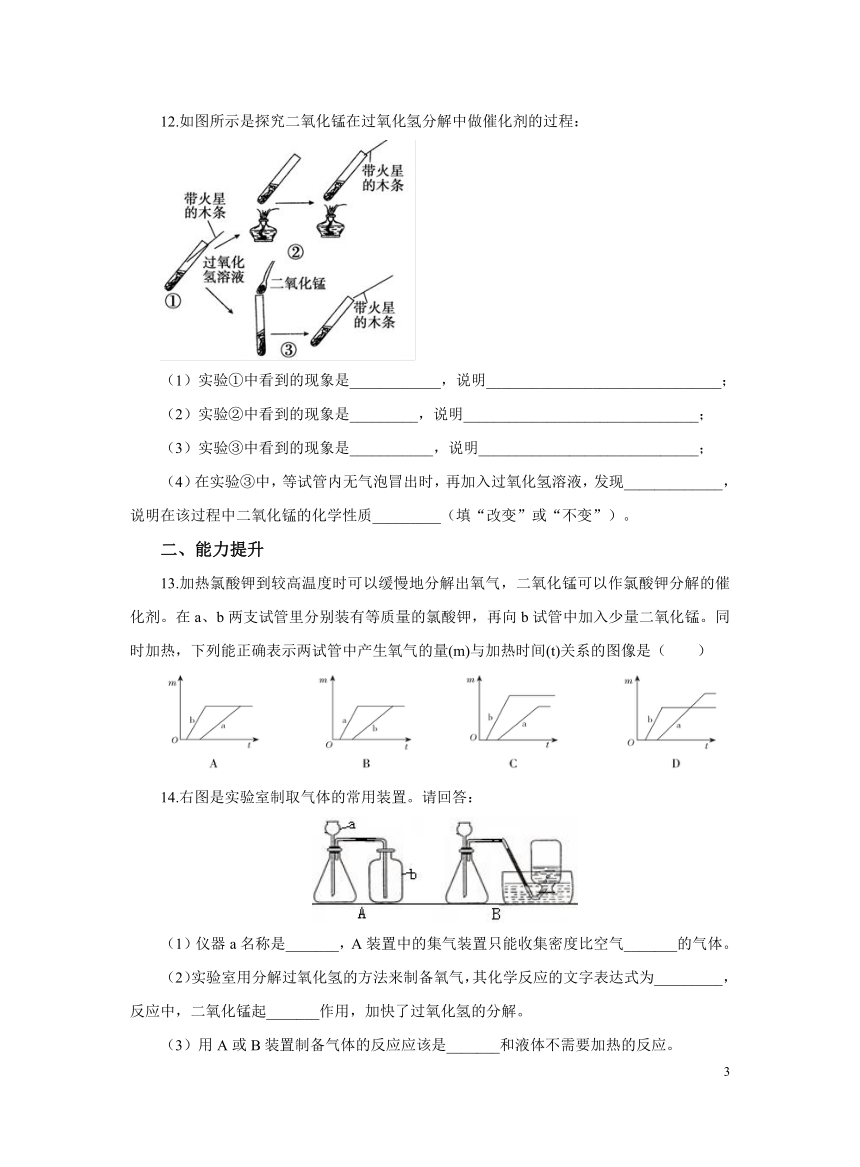
12.如图所示是探究二氧化锰在过氧化氢分解中做催化剂的过程:
(1)实验①中看到的现象是____________,说明_______________________________;
(2)实验②中看到的现象是_________,说明_______________________________;
(3)实验③中看到的现象是___________,说明_____________________________;
(4)在实验③中,等试管内无气泡冒出时,再加入过氧化氢溶液,发现_____________,说明在该过程中二氧化锰的化学性质_________(填“改变”或“不变”)。
二、能力提升
13.加热氯酸钾到较高温度时可以缓慢地分解出氧气,二氧化锰可以作氯酸钾分解的催化剂。在a、b两支试管里分别装有等质量的氯酸钾,再向b试管中加入少量二氧化锰。同时加热,下列能正确表示两试管中产生氧气的量(m)与加热时间(t)关系的图像是( )
14.右图是实验室制取气体的常用装置。请回答:
(1)仪器a名称是_______,A装置中的集气装置只能收集密度比空气_______的气体。
(2)实验室用分解过氧化氢的方法来制备氧气,其化学反应的文字表达式为_________,反应中,二氧化锰起_______作用,加快了过氧化氢的分解。
(3)用A或B装置制备气体的反应应该是_______和液体不需要加热的反应。
15.化学实验小组的同学们对催化剂产生了兴趣,通过查阅资料了解到氧化铁也能加速氯酸钾的分解。为了探究氧化铁能否加快过氧化氢的分解,他们设计了实验装置,并进行气体的制备和测量实验。实验时均以生成40 mL气体为标准,相关实验数据记录如下表:
实验序号 过氧化氢溶液浓度/% 过氧化氢溶液体积/mL 过氧化氢溶液温度/℃ 氧化铁的用量/g 收集40 mL氧气所需时间/s
① 5 10 20 0 128.5
② 5 10 20 1.2 16.8
③ 15 10 20 1.2 10.5
④ 5 10 70 0 32.7
(1)完成上述实验及数据的测定需要用到下图中的部分装置,请按组装顺序写出所用到的装置代号。
(2)通过实验①和④对比可知,化学反应速率与温度的关系是 ;通过实验②和③对比可知,化学反应速率与 有关;通过实验和对比可知,氧化铁可以加快过氧化氢分解释放氧气的速率。
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总量 (选填“减小”“不变”或“增大”)。
(4)若是要证明氧化铁是过氧化氢分解的催化剂,还需要验证氧化铁在该反应前后
的 和 未发生改变。
(5)同学们还想探究催化剂的颗粒大小对化学反应速率是否有影响,请你帮他们设计实验方案进行探究:
。
参考答案与解析
一、基础训练
1.C
【解析】A.化学反应后催化剂本身的质量不变,故选项说法错误;
B.化学反应后催化剂本身的质量不变,故选项说法错误;
C.催化剂可改变化学反应速率,故选项说法正确;
D.化学反应后催化剂的化学性质不变,故选项说法错误。故选C。
2.B
【解析】分解反应指的是一种物质反应后生成两种或两种以上的物质,其特点可总结为“一变多”,据此可知B选项为分解反应。故选B。
3.D
【解析】高锰酸钾在加热条件下分解生成锰酸钾、二氧化锰和氧气,二氧化锰可作为氯酸钾制取氧气的催化金,加快化学反应速率。故选D。
4.C
【解析】A.催化剂能改变化学反应的速率,但反应前后催化剂的质量、化学性质不变,故A错误;
B.催化剂只是某些反应的催化剂,而不是全部反应的催化剂,故B错误;
C.二氧化锰在过氧化氢分解反应中的催化剂,反应前后,质量与化学性质没有发生改变,故C正确;
D.催化剂能改变化学反应的速率,反应能否发生只有物质本身的性质来决定,二氧化锰只是加快反应的进行,故D错误。故选C。
5.D
【解析】工业上制取氧气利用了氧气和氮气的沸点不同,从而分离液态空气的方法得到氧气。故选D。
6.B
【解析】根据高锰酸钾分解生成的二氧化锰可作为氯酸钾分解的催化剂分析,高锰酸钾分解也释放出氧气。故选B。
7.C
【解析】大量氧气的制备即工业制备氧气,一般采用分离液态空气法。A、B都是实验室制备少量氧气的方法;D无法得到氧气。故选C。
8.C
【解析】催化剂可以改变化学反应速率,在生产上我们一般要求加快反应速率,在其他领域则需要用催化剂降低化学反应速率;如食品的防腐、橡胶的防老化等领域。故选C。
9.D
【解析】A.不是所有反应都需要催化剂,不同反应也需要不同的催化剂,故A不符合;
B.催化剂反应前后质量和化学性质不变,而物理性质发生改变,故B不符合
C.并不是所有的化学反应都需要催化剂,故C不符合。故选D。
10.A
【解析】实验室制取氧气和实验室制取氧气生产原料不同;制取的产物相同,都是氧气;实验室制氧气为化学反应,工业制氧气为物理变化;实验室制氧气利用化学性质,工业制氧气利用物理性质。故选A。
11.D
【解析】物质跟氧气发生的反应一定是氧化反应,但反应生成物是两种,所以不是化合反应。故选D。
12.(1)木条不复燃;过氧化氢在常温下产生氧气较少;(2)木条复燃;过氧化氢在加热条件下产生氧气;(3)木条复燃;过氧化氢在二氧化锰作用下产生氧气;(4)仍能产生气泡;不变。
【解析】(1)实验①中看到的现象是木条不复燃,说明过氧化氢在常温下产生氧气较少;
(2)实验②中看到的现象是木条复燃,说明过氧化氢在加热条件下产生氧气;
(3)实验③中看到的现象是木条复燃,说明过氧化氢在二氧化锰作用下产生氧气;
(4)在实验③中,等试管内无气泡冒出时,再加入过氧化氢溶液,发现仍能产生气泡,明在该过程中二氧化锰的化学性质不变。
二、能力提升
13.A
【解析】二氧化锰作为催化剂,可加快氯酸钾分解,但不能改变生成氧气的质量。故选A。
14.(1)长颈漏斗;大;(2)过氧化氢水+氧气;催化;(3)固体。
【解析】(1)标号的仪器是添加液体的长颈漏斗,A装置中收集法是向上排空气法,可收集密度比空气大的气体;
(2)过氧化氢制取氧气中,二氧化锰为催化剂;
(3)A、B制取气体的发生装置属于固体和液体混合不需要加热制取气体的装置。
15.(1)ABE;(2)温度越高,反应速率越快;反应物浓度;①;②;(3)不变; (4)质量;化学性质;(5)将等体积、等浓度且温度相同的过氧化氢溶液与颗粒大小不同但质量相同的氧化铁混合,测定生成40 mL氧气所需时间即可
【解析】根据影响化学反应速率的因素以及实验的现象、催化剂的特点等知识进行分析解答即可。设计实验要注意控制变量,反应物的质量不变,则生成物质的质量不变。
1
一、基础训练
1.关于催化剂的下列说法中,正确的是()
A.化学反应后催化剂本身的质量减少
B.化学反应后催化剂本身的质量增加
C.催化剂可改变化学反应速率
D.化学反应后催化剂的化学性质发生变化
2.下列反应属于分解反应的是()
A.铁 +氧气四氧化三铁
B.水氢气+氧气
C.甲烷+氧气水+二氧化碳
D.二氧化碳+水碳酸
3.小华采用加热氯酸钾的方法制取氧气,错把高锰酸钾当做二氧化锰放入氯酸钾内,其结果与只加氯酸钾相比,正确的是()
A.反应速率不变
B.生成氧气的质量不变
C.反应速率加快,生成氧气的质量不变
D.反应速率加快,生成氧气的质量增加
4.下列有关催化剂的叙述正确的是()
A.在化学反应里能加快其他物质的化学反应速率,而本身质量和性质在反应前后都没改变的物质叫催化剂
B.二氧化锰是一切化学反应的催化剂
C.在过氧化氢的分解反应前后,二氧化锰的质量和化学性质都没有发生改变
D.要使过氧化氢分解放出氧气,必须加入二氧化锰,否则就不能发生反应
5.工业上用分离液态空气制取氧气的依据是()
A.氧气与氮气的化学性质不同
B.氧气与氮气在水中的溶解度不同
C.氧气与氮气的密度不同
D.氧气与氮气的沸点不同
6.小华在做加热氯酸钾与二氧化锰的混合物制取氧气的实验时,错把高锰酸钾当作了二氧化锰,结果发现氯酸钾的分解速率同样被加快了。以下推论中错误的是()
A.完全反应后所得到的氧气比用二氧化锰作催化剂时多
B.高锰酸钾也可作氯酸钾制氧气反应的催化剂
C.反应过程中试管中的固体物质最多可达五种
D.完全反应后试管内的固体物质有三种
7.工业上制取大量氧气的方法是()
A.加热氯酸钾 B.加热高锰酸钾
C.分离液态空气 D.加热二氧化锰
8.催化剂在化学反应中所起的作用是()
A.加快化学反应速率 B.使生成物质量增加
C.改变化学反应速率 D.减慢化学反应速率
9.下列对催化剂的描述正确的是()
A.二氧化锰可作为各种化学反应的催化剂
B.在化学反应前后,催化剂本身的质量和所有性质均未改变
C.并不是所有化学反应都需要催化剂,但分解反应一定需要催化剂
D.某些化学反应可以有多种催化剂,某些催化剂可催化多个化学反应
10.实验室制取氧气与工业制取氧气比较,下列叙述正确的是()
A.生产原料不同 B.制取产物完全不同
C.都是化学反应 D.都利用了物质的化学性质
11.下列对化学反应类型的判断中,不正确的是()
A.碳酸→水+二氧化碳(分解反应)
B.过氧化氢→水+氧气(分解反应)
C.铁+氧气→四氧化三铁(化合反应、氧化反应)
D.石蜡+氧气→二氧化碳+水(化合反应、氧化反应)
12.如图所示是探究二氧化锰在过氧化氢分解中做催化剂的过程:
(1)实验①中看到的现象是____________,说明_______________________________;
(2)实验②中看到的现象是_________,说明_______________________________;
(3)实验③中看到的现象是___________,说明_____________________________;
(4)在实验③中,等试管内无气泡冒出时,再加入过氧化氢溶液,发现_____________,说明在该过程中二氧化锰的化学性质_________(填“改变”或“不变”)。
二、能力提升
13.加热氯酸钾到较高温度时可以缓慢地分解出氧气,二氧化锰可以作氯酸钾分解的催化剂。在a、b两支试管里分别装有等质量的氯酸钾,再向b试管中加入少量二氧化锰。同时加热,下列能正确表示两试管中产生氧气的量(m)与加热时间(t)关系的图像是( )
14.右图是实验室制取气体的常用装置。请回答:
(1)仪器a名称是_______,A装置中的集气装置只能收集密度比空气_______的气体。
(2)实验室用分解过氧化氢的方法来制备氧气,其化学反应的文字表达式为_________,反应中,二氧化锰起_______作用,加快了过氧化氢的分解。
(3)用A或B装置制备气体的反应应该是_______和液体不需要加热的反应。
15.化学实验小组的同学们对催化剂产生了兴趣,通过查阅资料了解到氧化铁也能加速氯酸钾的分解。为了探究氧化铁能否加快过氧化氢的分解,他们设计了实验装置,并进行气体的制备和测量实验。实验时均以生成40 mL气体为标准,相关实验数据记录如下表:
实验序号 过氧化氢溶液浓度/% 过氧化氢溶液体积/mL 过氧化氢溶液温度/℃ 氧化铁的用量/g 收集40 mL氧气所需时间/s
① 5 10 20 0 128.5
② 5 10 20 1.2 16.8
③ 15 10 20 1.2 10.5
④ 5 10 70 0 32.7
(1)完成上述实验及数据的测定需要用到下图中的部分装置,请按组装顺序写出所用到的装置代号。
(2)通过实验①和④对比可知,化学反应速率与温度的关系是 ;通过实验②和③对比可知,化学反应速率与 有关;通过实验和对比可知,氧化铁可以加快过氧化氢分解释放氧气的速率。
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总量 (选填“减小”“不变”或“增大”)。
(4)若是要证明氧化铁是过氧化氢分解的催化剂,还需要验证氧化铁在该反应前后
的 和 未发生改变。
(5)同学们还想探究催化剂的颗粒大小对化学反应速率是否有影响,请你帮他们设计实验方案进行探究:
。
参考答案与解析
一、基础训练
1.C
【解析】A.化学反应后催化剂本身的质量不变,故选项说法错误;
B.化学反应后催化剂本身的质量不变,故选项说法错误;
C.催化剂可改变化学反应速率,故选项说法正确;
D.化学反应后催化剂的化学性质不变,故选项说法错误。故选C。
2.B
【解析】分解反应指的是一种物质反应后生成两种或两种以上的物质,其特点可总结为“一变多”,据此可知B选项为分解反应。故选B。
3.D
【解析】高锰酸钾在加热条件下分解生成锰酸钾、二氧化锰和氧气,二氧化锰可作为氯酸钾制取氧气的催化金,加快化学反应速率。故选D。
4.C
【解析】A.催化剂能改变化学反应的速率,但反应前后催化剂的质量、化学性质不变,故A错误;
B.催化剂只是某些反应的催化剂,而不是全部反应的催化剂,故B错误;
C.二氧化锰在过氧化氢分解反应中的催化剂,反应前后,质量与化学性质没有发生改变,故C正确;
D.催化剂能改变化学反应的速率,反应能否发生只有物质本身的性质来决定,二氧化锰只是加快反应的进行,故D错误。故选C。
5.D
【解析】工业上制取氧气利用了氧气和氮气的沸点不同,从而分离液态空气的方法得到氧气。故选D。
6.B
【解析】根据高锰酸钾分解生成的二氧化锰可作为氯酸钾分解的催化剂分析,高锰酸钾分解也释放出氧气。故选B。
7.C
【解析】大量氧气的制备即工业制备氧气,一般采用分离液态空气法。A、B都是实验室制备少量氧气的方法;D无法得到氧气。故选C。
8.C
【解析】催化剂可以改变化学反应速率,在生产上我们一般要求加快反应速率,在其他领域则需要用催化剂降低化学反应速率;如食品的防腐、橡胶的防老化等领域。故选C。
9.D
【解析】A.不是所有反应都需要催化剂,不同反应也需要不同的催化剂,故A不符合;
B.催化剂反应前后质量和化学性质不变,而物理性质发生改变,故B不符合
C.并不是所有的化学反应都需要催化剂,故C不符合。故选D。
10.A
【解析】实验室制取氧气和实验室制取氧气生产原料不同;制取的产物相同,都是氧气;实验室制氧气为化学反应,工业制氧气为物理变化;实验室制氧气利用化学性质,工业制氧气利用物理性质。故选A。
11.D
【解析】物质跟氧气发生的反应一定是氧化反应,但反应生成物是两种,所以不是化合反应。故选D。
12.(1)木条不复燃;过氧化氢在常温下产生氧气较少;(2)木条复燃;过氧化氢在加热条件下产生氧气;(3)木条复燃;过氧化氢在二氧化锰作用下产生氧气;(4)仍能产生气泡;不变。
【解析】(1)实验①中看到的现象是木条不复燃,说明过氧化氢在常温下产生氧气较少;
(2)实验②中看到的现象是木条复燃,说明过氧化氢在加热条件下产生氧气;
(3)实验③中看到的现象是木条复燃,说明过氧化氢在二氧化锰作用下产生氧气;
(4)在实验③中,等试管内无气泡冒出时,再加入过氧化氢溶液,发现仍能产生气泡,明在该过程中二氧化锰的化学性质不变。
二、能力提升
13.A
【解析】二氧化锰作为催化剂,可加快氯酸钾分解,但不能改变生成氧气的质量。故选A。
14.(1)长颈漏斗;大;(2)过氧化氢水+氧气;催化;(3)固体。
【解析】(1)标号的仪器是添加液体的长颈漏斗,A装置中收集法是向上排空气法,可收集密度比空气大的气体;
(2)过氧化氢制取氧气中,二氧化锰为催化剂;
(3)A、B制取气体的发生装置属于固体和液体混合不需要加热制取气体的装置。
15.(1)ABE;(2)温度越高,反应速率越快;反应物浓度;①;②;(3)不变; (4)质量;化学性质;(5)将等体积、等浓度且温度相同的过氧化氢溶液与颗粒大小不同但质量相同的氧化铁混合,测定生成40 mL氧气所需时间即可
【解析】根据影响化学反应速率的因素以及实验的现象、催化剂的特点等知识进行分析解答即可。设计实验要注意控制变量,反应物的质量不变,则生成物质的质量不变。
1
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
