1.2硫酸的工业制备 浓硫酸的性质 课件(共46张PPT)高中化学苏教版必修第一册专题四第1单元 第2课时
文档属性
| 名称 | 1.2硫酸的工业制备 浓硫酸的性质 课件(共46张PPT)高中化学苏教版必修第一册专题四第1单元 第2课时 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-28 22:56:20 | ||
图片预览







文档简介
(共46张PPT)
第一单元 含硫化合物的性质
第2课时 硫酸的工业制备
浓硫酸的性质
课标定位素养阐释
1.硫酸的工业制法及工业制备要求。
2.从微观粒子角度探析稀硫酸的性质。
3.从实验探究视角认识浓硫酸的三大特性。
一、硫酸的制备
1.古代制法。
早在1 000年以前,我国就用加热胆矾(CuSO4·5H2O)或绿矾(FeSO4·7H2O)的方法来制取硫酸,如根据有关史书记载,可通过如下反应实现:
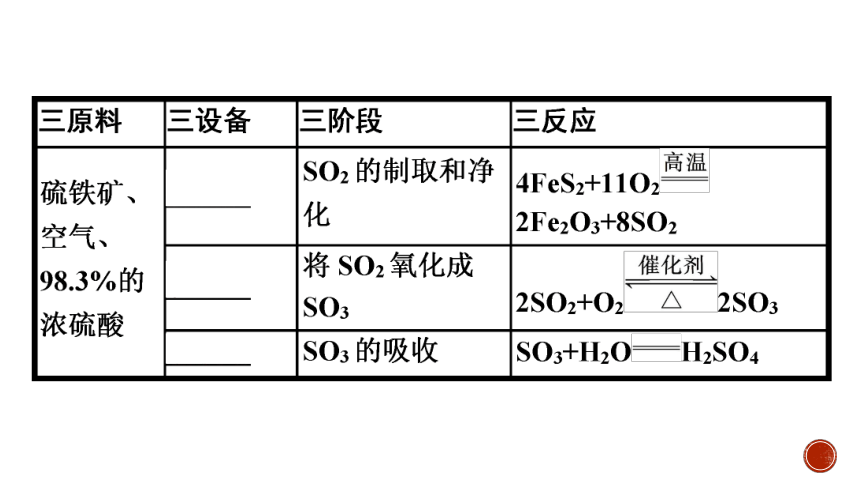
2.目前工业制法——接触法。
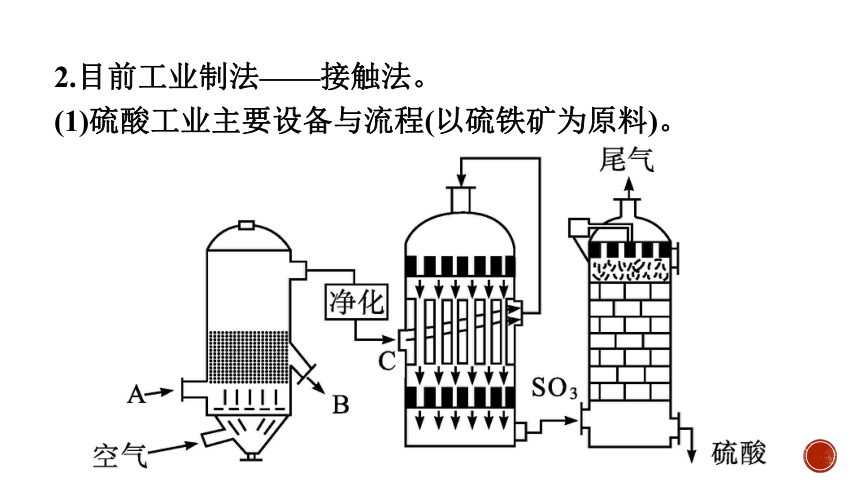
(1)硫酸工业主要设备与流程(以硫铁矿为原料)。
(2)化学工业制备的要求。
①原料廉价且稳定,最好能结合本地地理环境的优势资源,以降低运输成本。
②从环保、成本等角度选择合适的化学反应,设计合理的反应装置,对原料进行粉碎等预处理,使得原料尽可能地被富集,保证在反应中能充分接触。
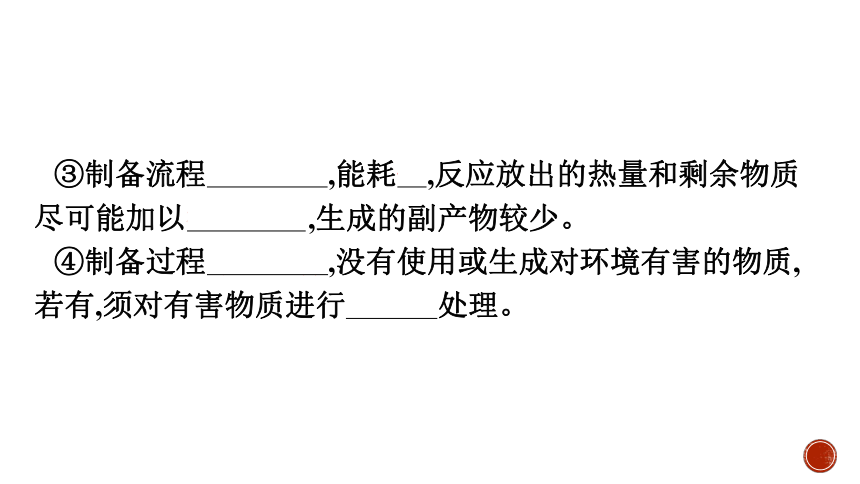
③制备流程简单高效,能耗低,反应放出的热量和剩余物质尽可能加以循环利用,生成的副产物较少。
④制备过程绿色环保,没有使用或生成对环境有害的物质,若有,须对有害物质进行无害化处理。
二、稀硫酸的性质
1.硫酸的电离。
H2SO4是二元强酸,在水中的电离方程式为
2.稀硫酸的性质(具有酸的通性)。
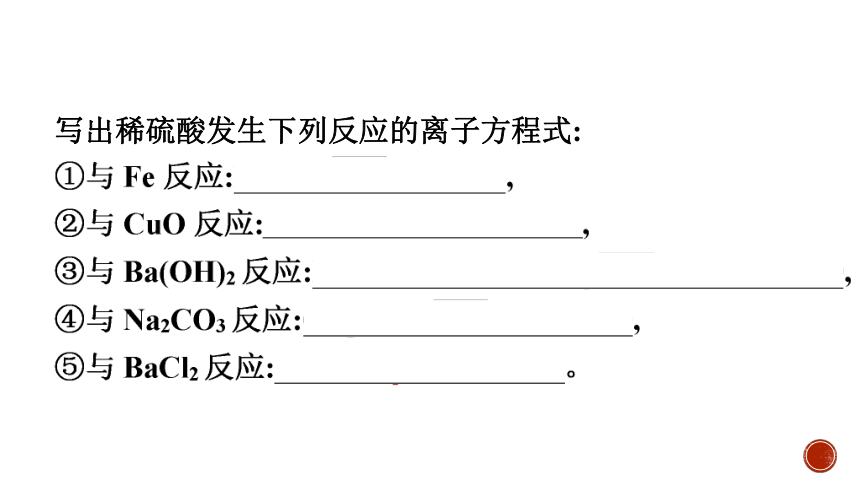
写出稀硫酸发生下列反应的离子方程式:
三、浓硫酸的“三大”特性
1.浓硫酸的特性。
(1)吸水性:浓硫酸能够吸收气体、液体中的水分子及固体中的结晶水,故常用作干燥剂。
(2)脱水性:浓硫酸能按水的组成比,夺取某些有机物中的
氢、氧元素,形成水分子,可使蔗糖、纤维素等物质脱水。
(3)强氧化性。
①与金属的反应:除金、铂以外的绝大多数金属都能与浓硫酸作用,如浓硫酸与铜反应:
②常温下,冷的浓硫酸能使Fe、Al发生钝化。
③与非金属的反应:
加热时与木炭反应的化学方程式为
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
2.硫酸的用途。
(1)重要的化工原料,实验室必备的重要试剂。
(2)工业上可用于制化肥、医药、农药等。
(3)用于精炼石油、金属加工前的酸洗及制取各种挥发性酸,作干燥剂等。
【自主思考1】 为什么要用98.3%的浓硫酸吸收三氧化硫而不用水 浓硫酸为什么从塔顶喷下
提示:防止三氧化硫溶于水或稀硫酸时反应放出大量热,形成酸雾,降低吸收效率。浓硫酸从塔顶喷下,目的是增大三氧化硫与吸收剂浓硫酸的接触面积,提高吸收效率。
【自主思考2】 浓硫酸的吸水性与脱水性有什么区别
提示:(1)吸水性:浓硫酸能吸收物质中游离的水,如气体、液体中的水分子,以及固体中的结晶水等。可以是物理变化,也可以是化学变化,如浓硫酸吸收CuSO4·5H2O晶体中的结晶水。
(2)脱水性:物质中本来无水分子,浓硫酸可将有机物中的H、O原子按2∶1比例以“H2O”的形式脱去,如可以使蔗糖、纤维素、纸张等脱水炭化。
【自主思考3】 浓硫酸有强氧化性,常温下应如何储运浓硫酸
提示:因常温下,浓硫酸能使Fe、Al“钝化”,故可用铁罐车或铝槽车储运。
【效果自测】
1.在硫酸工业生产中,SO3的吸收过程是在
吸收塔(如图)中进行的,吸收塔里还装入了
大量瓷环。下列有关说法不正确的是( )。
A.从①处通入SO3,整个吸收操作采取逆流
的形式
B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积
C.从③处导出的气体只含有少量SO2,可直接排入空气
D.从④处流出的是可用水或稀硫酸稀释的硫酸
C
解析:首先明确该装置(设备)在吸收SO3过程中是采用逆流原理进行吸收的,即98.3%的硫酸是从吸收塔顶喷下,而SO3是从吸收塔底部通入的。这样有利于气、液的充分接触,吸收效果好。从吸收塔上部导出的气体是N2、没有起反应的O2和少量SO2,直接排入空气会污染环境,所以应用吸收剂吸收或循环使用。
2.下列物质的变化中,加入稀硫酸不能一步实现的是( )。
A.Zn→ZnSO4
B.CuO→CuSO4
C.块状大理石→制取大量CO2
D.Ba(OH)2→BaSO4
答案:C
解析:块状大理石与硫酸反应时,由于生成的CaSO4微溶于水,覆盖在CaCO3的表面,阻止了硫酸与CaCO3的进一步反应,故不能用大理石与稀硫酸反应制取大量CO2。
3.将下列现象与硫酸所表现出来的性质连接起来。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(1)浓硫酸在常温下使铁、铝钝化 ;
(2)浓硫酸滴在纸上,使纸变黑 ;
(3)浓硫酸干燥SO2气体 ;
(4)锌粒放入稀硫酸中有气体放出 ;
(5)盛有浓硫酸的烧杯敞口放置一段时间后,质量增加 ;
(6)把木炭放入热的浓硫酸中有气体放出 。
答案:(1)D (2)C (3)B (4)A (5)B (6)D
4.下列关于浓硫酸的叙述正确的是( )。
A.浓硫酸具有吸水性,因而能使蔗糖脱水
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气、氯气等气体
D.浓硫酸沸点高,难挥发
答案:D
解析:A项,浓硫酸具有脱水性,能使蔗糖脱水;B项,浓硫酸与Cu在加热条件下才能反应;C项,H2SO4与NH3反应,因此浓硫酸不能干燥NH3。
问题引领
化学探究小组在研究Al与H2SO4的反应时,进行了如图所示的实验。
探究任务 浓硫酸的性质
1.实验Ⅰ中现象是什么 写出反应的离子方程式。
提示:实验现象是有大量气泡产生;离子方程式为2Al+6H+══2Al3++3H2↑。
2.实验Ⅱ中,铝丝表面迅速变白,并无其他明显现象。其原因是什么 体现了浓硫酸的什么性质
提示:变白是因为浓硫酸使铝丝迅速生成一层致密的氧化物薄膜,这个过程叫钝化;体现了浓硫酸的强氧化性。
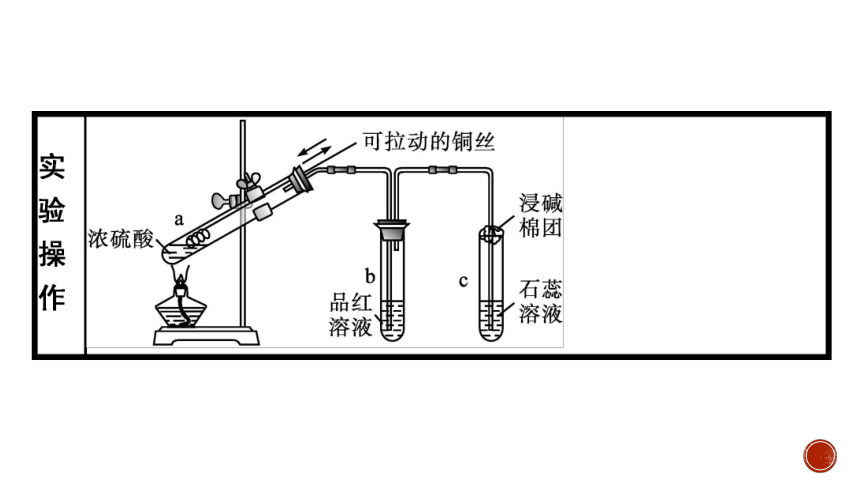
3.实验Ⅲ中,装置C的作用是什么 B中的品红溶液红色逐渐褪色,检测到D处有可燃性气体,说明了什么问题
提示:作用是吸收尾气中的SO2气体,防止污染环境。说明A中生成SO2气体,硫酸变稀后与铝反应产生H2。浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于+6价的硫元素,被还原得到SO2;而稀硫酸的氧化性源于H+,被还原得到的产物是H2。
归纳提升
探析浓硫酸的特性
1.浓硫酸吸水性、脱水性的区别。
由此看出:二者的根本区别在于物质本身是否存在水分子。
2.浓硫酸的强氧化性。
(1)本质。
浓硫酸具有强氧化性,是因为H2SO4分子中硫元素的化合价为+6价,具有很强的得电子能力。
(2)反应规律。
①Fe、Al的钝化。常温下,当Fe、Al遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。
②常温下与活泼金属反应(铁、铝除外)表现强氧化性和酸性,生成硫酸盐和SO2,硫酸浓度变小后,生成的气体为H2。
③与不活泼金属和非金属反应的规律。
a.反应需要加热,否则不反应。
b.还原产物一般是SO2,一般金属被氧化为高价态的硫酸盐,非金属被氧化为高价态氧化物或含氧酸。
c.浓硫酸与金属反应时,既表现酸性,又表现强氧化性;而与非金属反应时,只表现强氧化性。
d.随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,反应即停止。
④与具有还原性的化合物反应,如与H2S、HI、HBr、FeCl2等物质反应。
稀释浓硫酸的方法是把浓硫酸沿器壁慢慢注入水中,并不断搅拌。不能把水注入浓硫酸中。
典型例题
【例题1】 下列事实与原因(括号中)对应关系正确的是
( )。
A.在空气中敞口久置的浓硫酸,溶液质量增大(浓硫酸具有难挥发性)
B.向某样品溶液中先滴加过量的稀盐酸无现象,再滴加BaCl2溶液后出现白色沉淀(样品溶液中含有 )
C.蔗糖与浓硫酸的反应中有海绵状的炭生成(浓硫酸具有吸水性)
D.浓硫酸可与铜反应(只显示浓硫酸的强氧化性)
B
解析:在空气中敞口久置的浓硫酸,溶液质量增大是因为浓硫酸的吸水性,A项错误;向样品溶液中加入稀盐酸,没有任何现象,说明一定没有Ag+,再加入少量BaCl2溶液,生成白色沉淀,此时溶液为酸性,而BaSO4既不溶于水也不溶于酸,则白色沉淀为BaSO4,溶液中含有 ,B项正确;蔗糖与浓硫酸的反应中有海绵状的炭生成,主要是因为浓硫酸的脱水性,C项错误;浓硫酸与金属铜的反应中既表现浓硫酸的强氧化性,又显示浓硫酸的强酸性,D项错误。
【例题2】 (双选)下列关于硫酸性质的描述中,正确的是
( )。
A.浓硫酸有氧化性,稀硫酸无氧化性
B.由于浓硫酸具有脱水性,故可用来与蔗糖反应做“黑面包”实验
C.稀硫酸与铁、铝反应,浓硫酸在常温下不与铁、铝反应
D.浓硫酸与Cu的反应中有少量黑色固体生成,可能是CuO
答案:BD
解析:浓硫酸具有强氧化性,稀硫酸中H+具有氧化性,A错误;浓硫酸可将有机物中H、O两种元素按水的组成比脱去,使蔗糖炭化变黑而成“黑面包”,表现了浓硫酸的脱水性,B正确;浓硫酸在常温下可将铁、铝氧化,在其表面形成致密的氧化物薄膜而出现“钝化”现象,C错误;在加热条件下浓硫酸与Cu发生氧化还原反应,反应中有少量黑色固体生成,可能是CuO,D正确。
素养提升 浓、稀硫酸的鉴别方法
各取少量试样,进行下列实验。
(1)称重法:利用二者密度不同,因为浓硫酸比稀硫酸的密度大(98%的浓硫酸密度为1.84 g·cm-3),所以取等体积的试液,质量大的为浓硫酸。
(2)铁铝法:分别取少许试液加入试管中,加入铁丝或铝片,无明显现象的是浓硫酸,有气泡冒出的是稀硫酸。
(3)脱水法:分别用玻璃棒蘸取两种酸在纸(或木材或棉布)上写字,一段时间后,纸变黑的是浓硫酸。
(4)吸水法:分别取两支试管,加入少许胆矾,再分别加入少量酸,晶体溶解且溶液变蓝色的是稀硫酸,晶体表面变白的是浓硫酸。
(5)氧化性:分别取两支试管,加入铜片或木炭后,再分别加入酸,加热,能够产生有刺激性气味气体的是浓硫酸。
(6)稀释法:在小烧杯中加入10 mL水,沿烧杯内壁慢慢加入酸(切不可将水加到酸中),稀释时放出大量热的是浓硫酸。
【变式训练1】 判断正误,正确的画“√”,错误的画“×”。
(1)配制稀硫酸时,可以先将浓硫酸加入烧杯中,后加入蒸馏水稀释。( )
(2)SO2具有氧化性,所以可用于漂白纸浆。( )
(3)在未知液中滴加BaCl2溶液出现白色沉淀,加稀硫酸,沉淀不溶解,说明该未知液中存在 。( )
(4)浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗。( )
(5)H2、SO2、CO2三种气体都可用浓硫酸干燥。( )
×
×
×
×
√
【变式训练2】 某研究小组成员设计鉴别浓硫酸和稀硫酸的如下方案,不合理的是( )。
答案:B
解析:向稀硫酸中加入金属铝片后,产生无色无味的氢气,B错误。
【变式训练3】 为了验证木炭可被浓硫酸氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置:
(1)如按气流由左向右流向,连接上述装置的顺序是(填各接口字母): 接 , 接 , 接 。
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2
乙中 ,丙中 。
(3)丁中酸性KMnO4溶液的作用是 。
(4)写出甲中反应的化学方程式: 。
答案:(1)A F E C D B
(2)出现白色沉淀 品红溶液未褪色
(3)吸收SO2
解析:(1)木炭与浓硫酸反应生成CO2、SO2和水,由于SO2也能使澄清石灰水变浑浊,所以在检验CO2之前首先要除去SO2,因SO2具有还原性,可以用酸性高锰酸钾溶液氧化除去。为验证SO2是否除尽,需要将气体再通过品红溶液检验,所以装置连接的正确顺序是A、F、E、C、D、B。
(2)根据以上分析可知乙中出现白色沉淀,而丙中品红溶液未褪色时,即可表明已检验出CO2。
(3)根据以上分析可知,丁中酸性KMnO4溶液的作用是吸收SO2。
(4)甲中反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
第一单元 含硫化合物的性质
第2课时 硫酸的工业制备
浓硫酸的性质
课标定位素养阐释
1.硫酸的工业制法及工业制备要求。
2.从微观粒子角度探析稀硫酸的性质。
3.从实验探究视角认识浓硫酸的三大特性。
一、硫酸的制备
1.古代制法。
早在1 000年以前,我国就用加热胆矾(CuSO4·5H2O)或绿矾(FeSO4·7H2O)的方法来制取硫酸,如根据有关史书记载,可通过如下反应实现:
2.目前工业制法——接触法。
(1)硫酸工业主要设备与流程(以硫铁矿为原料)。
(2)化学工业制备的要求。
①原料廉价且稳定,最好能结合本地地理环境的优势资源,以降低运输成本。
②从环保、成本等角度选择合适的化学反应,设计合理的反应装置,对原料进行粉碎等预处理,使得原料尽可能地被富集,保证在反应中能充分接触。
③制备流程简单高效,能耗低,反应放出的热量和剩余物质尽可能加以循环利用,生成的副产物较少。
④制备过程绿色环保,没有使用或生成对环境有害的物质,若有,须对有害物质进行无害化处理。
二、稀硫酸的性质
1.硫酸的电离。
H2SO4是二元强酸,在水中的电离方程式为
2.稀硫酸的性质(具有酸的通性)。
写出稀硫酸发生下列反应的离子方程式:
三、浓硫酸的“三大”特性
1.浓硫酸的特性。
(1)吸水性:浓硫酸能够吸收气体、液体中的水分子及固体中的结晶水,故常用作干燥剂。
(2)脱水性:浓硫酸能按水的组成比,夺取某些有机物中的
氢、氧元素,形成水分子,可使蔗糖、纤维素等物质脱水。
(3)强氧化性。
①与金属的反应:除金、铂以外的绝大多数金属都能与浓硫酸作用,如浓硫酸与铜反应:
②常温下,冷的浓硫酸能使Fe、Al发生钝化。
③与非金属的反应:
加热时与木炭反应的化学方程式为
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
2.硫酸的用途。
(1)重要的化工原料,实验室必备的重要试剂。
(2)工业上可用于制化肥、医药、农药等。
(3)用于精炼石油、金属加工前的酸洗及制取各种挥发性酸,作干燥剂等。
【自主思考1】 为什么要用98.3%的浓硫酸吸收三氧化硫而不用水 浓硫酸为什么从塔顶喷下
提示:防止三氧化硫溶于水或稀硫酸时反应放出大量热,形成酸雾,降低吸收效率。浓硫酸从塔顶喷下,目的是增大三氧化硫与吸收剂浓硫酸的接触面积,提高吸收效率。
【自主思考2】 浓硫酸的吸水性与脱水性有什么区别
提示:(1)吸水性:浓硫酸能吸收物质中游离的水,如气体、液体中的水分子,以及固体中的结晶水等。可以是物理变化,也可以是化学变化,如浓硫酸吸收CuSO4·5H2O晶体中的结晶水。
(2)脱水性:物质中本来无水分子,浓硫酸可将有机物中的H、O原子按2∶1比例以“H2O”的形式脱去,如可以使蔗糖、纤维素、纸张等脱水炭化。
【自主思考3】 浓硫酸有强氧化性,常温下应如何储运浓硫酸
提示:因常温下,浓硫酸能使Fe、Al“钝化”,故可用铁罐车或铝槽车储运。
【效果自测】
1.在硫酸工业生产中,SO3的吸收过程是在
吸收塔(如图)中进行的,吸收塔里还装入了
大量瓷环。下列有关说法不正确的是( )。
A.从①处通入SO3,整个吸收操作采取逆流
的形式
B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积
C.从③处导出的气体只含有少量SO2,可直接排入空气
D.从④处流出的是可用水或稀硫酸稀释的硫酸
C
解析:首先明确该装置(设备)在吸收SO3过程中是采用逆流原理进行吸收的,即98.3%的硫酸是从吸收塔顶喷下,而SO3是从吸收塔底部通入的。这样有利于气、液的充分接触,吸收效果好。从吸收塔上部导出的气体是N2、没有起反应的O2和少量SO2,直接排入空气会污染环境,所以应用吸收剂吸收或循环使用。
2.下列物质的变化中,加入稀硫酸不能一步实现的是( )。
A.Zn→ZnSO4
B.CuO→CuSO4
C.块状大理石→制取大量CO2
D.Ba(OH)2→BaSO4
答案:C
解析:块状大理石与硫酸反应时,由于生成的CaSO4微溶于水,覆盖在CaCO3的表面,阻止了硫酸与CaCO3的进一步反应,故不能用大理石与稀硫酸反应制取大量CO2。
3.将下列现象与硫酸所表现出来的性质连接起来。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(1)浓硫酸在常温下使铁、铝钝化 ;
(2)浓硫酸滴在纸上,使纸变黑 ;
(3)浓硫酸干燥SO2气体 ;
(4)锌粒放入稀硫酸中有气体放出 ;
(5)盛有浓硫酸的烧杯敞口放置一段时间后,质量增加 ;
(6)把木炭放入热的浓硫酸中有气体放出 。
答案:(1)D (2)C (3)B (4)A (5)B (6)D
4.下列关于浓硫酸的叙述正确的是( )。
A.浓硫酸具有吸水性,因而能使蔗糖脱水
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气、氯气等气体
D.浓硫酸沸点高,难挥发
答案:D
解析:A项,浓硫酸具有脱水性,能使蔗糖脱水;B项,浓硫酸与Cu在加热条件下才能反应;C项,H2SO4与NH3反应,因此浓硫酸不能干燥NH3。
问题引领
化学探究小组在研究Al与H2SO4的反应时,进行了如图所示的实验。
探究任务 浓硫酸的性质
1.实验Ⅰ中现象是什么 写出反应的离子方程式。
提示:实验现象是有大量气泡产生;离子方程式为2Al+6H+══2Al3++3H2↑。
2.实验Ⅱ中,铝丝表面迅速变白,并无其他明显现象。其原因是什么 体现了浓硫酸的什么性质
提示:变白是因为浓硫酸使铝丝迅速生成一层致密的氧化物薄膜,这个过程叫钝化;体现了浓硫酸的强氧化性。
3.实验Ⅲ中,装置C的作用是什么 B中的品红溶液红色逐渐褪色,检测到D处有可燃性气体,说明了什么问题
提示:作用是吸收尾气中的SO2气体,防止污染环境。说明A中生成SO2气体,硫酸变稀后与铝反应产生H2。浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于+6价的硫元素,被还原得到SO2;而稀硫酸的氧化性源于H+,被还原得到的产物是H2。
归纳提升
探析浓硫酸的特性
1.浓硫酸吸水性、脱水性的区别。
由此看出:二者的根本区别在于物质本身是否存在水分子。
2.浓硫酸的强氧化性。
(1)本质。
浓硫酸具有强氧化性,是因为H2SO4分子中硫元素的化合价为+6价,具有很强的得电子能力。
(2)反应规律。
①Fe、Al的钝化。常温下,当Fe、Al遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。
②常温下与活泼金属反应(铁、铝除外)表现强氧化性和酸性,生成硫酸盐和SO2,硫酸浓度变小后,生成的气体为H2。
③与不活泼金属和非金属反应的规律。
a.反应需要加热,否则不反应。
b.还原产物一般是SO2,一般金属被氧化为高价态的硫酸盐,非金属被氧化为高价态氧化物或含氧酸。
c.浓硫酸与金属反应时,既表现酸性,又表现强氧化性;而与非金属反应时,只表现强氧化性。
d.随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,反应即停止。
④与具有还原性的化合物反应,如与H2S、HI、HBr、FeCl2等物质反应。
稀释浓硫酸的方法是把浓硫酸沿器壁慢慢注入水中,并不断搅拌。不能把水注入浓硫酸中。
典型例题
【例题1】 下列事实与原因(括号中)对应关系正确的是
( )。
A.在空气中敞口久置的浓硫酸,溶液质量增大(浓硫酸具有难挥发性)
B.向某样品溶液中先滴加过量的稀盐酸无现象,再滴加BaCl2溶液后出现白色沉淀(样品溶液中含有 )
C.蔗糖与浓硫酸的反应中有海绵状的炭生成(浓硫酸具有吸水性)
D.浓硫酸可与铜反应(只显示浓硫酸的强氧化性)
B
解析:在空气中敞口久置的浓硫酸,溶液质量增大是因为浓硫酸的吸水性,A项错误;向样品溶液中加入稀盐酸,没有任何现象,说明一定没有Ag+,再加入少量BaCl2溶液,生成白色沉淀,此时溶液为酸性,而BaSO4既不溶于水也不溶于酸,则白色沉淀为BaSO4,溶液中含有 ,B项正确;蔗糖与浓硫酸的反应中有海绵状的炭生成,主要是因为浓硫酸的脱水性,C项错误;浓硫酸与金属铜的反应中既表现浓硫酸的强氧化性,又显示浓硫酸的强酸性,D项错误。
【例题2】 (双选)下列关于硫酸性质的描述中,正确的是
( )。
A.浓硫酸有氧化性,稀硫酸无氧化性
B.由于浓硫酸具有脱水性,故可用来与蔗糖反应做“黑面包”实验
C.稀硫酸与铁、铝反应,浓硫酸在常温下不与铁、铝反应
D.浓硫酸与Cu的反应中有少量黑色固体生成,可能是CuO
答案:BD
解析:浓硫酸具有强氧化性,稀硫酸中H+具有氧化性,A错误;浓硫酸可将有机物中H、O两种元素按水的组成比脱去,使蔗糖炭化变黑而成“黑面包”,表现了浓硫酸的脱水性,B正确;浓硫酸在常温下可将铁、铝氧化,在其表面形成致密的氧化物薄膜而出现“钝化”现象,C错误;在加热条件下浓硫酸与Cu发生氧化还原反应,反应中有少量黑色固体生成,可能是CuO,D正确。
素养提升 浓、稀硫酸的鉴别方法
各取少量试样,进行下列实验。
(1)称重法:利用二者密度不同,因为浓硫酸比稀硫酸的密度大(98%的浓硫酸密度为1.84 g·cm-3),所以取等体积的试液,质量大的为浓硫酸。
(2)铁铝法:分别取少许试液加入试管中,加入铁丝或铝片,无明显现象的是浓硫酸,有气泡冒出的是稀硫酸。
(3)脱水法:分别用玻璃棒蘸取两种酸在纸(或木材或棉布)上写字,一段时间后,纸变黑的是浓硫酸。
(4)吸水法:分别取两支试管,加入少许胆矾,再分别加入少量酸,晶体溶解且溶液变蓝色的是稀硫酸,晶体表面变白的是浓硫酸。
(5)氧化性:分别取两支试管,加入铜片或木炭后,再分别加入酸,加热,能够产生有刺激性气味气体的是浓硫酸。
(6)稀释法:在小烧杯中加入10 mL水,沿烧杯内壁慢慢加入酸(切不可将水加到酸中),稀释时放出大量热的是浓硫酸。
【变式训练1】 判断正误,正确的画“√”,错误的画“×”。
(1)配制稀硫酸时,可以先将浓硫酸加入烧杯中,后加入蒸馏水稀释。( )
(2)SO2具有氧化性,所以可用于漂白纸浆。( )
(3)在未知液中滴加BaCl2溶液出现白色沉淀,加稀硫酸,沉淀不溶解,说明该未知液中存在 。( )
(4)浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗。( )
(5)H2、SO2、CO2三种气体都可用浓硫酸干燥。( )
×
×
×
×
√
【变式训练2】 某研究小组成员设计鉴别浓硫酸和稀硫酸的如下方案,不合理的是( )。
答案:B
解析:向稀硫酸中加入金属铝片后,产生无色无味的氢气,B错误。
【变式训练3】 为了验证木炭可被浓硫酸氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置:
(1)如按气流由左向右流向,连接上述装置的顺序是(填各接口字母): 接 , 接 , 接 。
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2
乙中 ,丙中 。
(3)丁中酸性KMnO4溶液的作用是 。
(4)写出甲中反应的化学方程式: 。
答案:(1)A F E C D B
(2)出现白色沉淀 品红溶液未褪色
(3)吸收SO2
解析:(1)木炭与浓硫酸反应生成CO2、SO2和水,由于SO2也能使澄清石灰水变浑浊,所以在检验CO2之前首先要除去SO2,因SO2具有还原性,可以用酸性高锰酸钾溶液氧化除去。为验证SO2是否除尽,需要将气体再通过品红溶液检验,所以装置连接的正确顺序是A、F、E、C、D、B。
(2)根据以上分析可知乙中出现白色沉淀,而丙中品红溶液未褪色时,即可表明已检验出CO2。
(3)根据以上分析可知,丁中酸性KMnO4溶液的作用是吸收SO2。
(4)甲中反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
