5.3利用化学方程式的简单计算(第一课时)课件(共20张PPT)-2023-2024学年人教版化学上册
文档属性
| 名称 | 5.3利用化学方程式的简单计算(第一课时)课件(共20张PPT)-2023-2024学年人教版化学上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-28 15:55:37 | ||
图片预览








文档简介
(共20张PPT)
第五单元 化学方程式
课 题 3 利用化学方程式的简单计算
学习目标:
1、给定某物质质量,求其它物质的质量
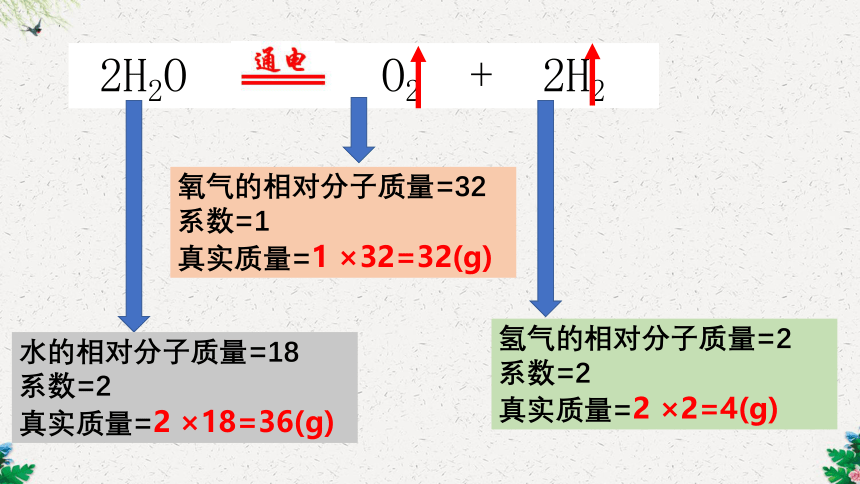
2H2O O2 + 2H2
水的相对分子质量=18
系数=2
真实质量=2 ×18=36(g)
氧气的相对分子质量=32
系数=1
真实质量=1 ×32=32(g)
氢气的相对分子质量=2
系数=2
真实质量=2 ×2=4(g)
通过学习,已经了解到:
参与反应的物质有各自的质量配比
2H2O O2 + 2H2
36(g)
32(g)
4(g)
如果给定的质量不是36克呢?
氧气和氢气还会是32和4克吗?
发生反应为:2H2O ===O2 + 2H2
如果有65克水发生了分解,将会得到氧气多少克?
2H2O O2 + 2H2
36(g)
32(g)
4(g)
参与反应的水和氧气质量比为36 :32= 9 :8
则有:65:X=9:8 从而求出X=57.7克
计算的规范步骤:
6克镁在氧气中充分燃烧,
可以生成多少克氧化镁?
解:设可生成氧化镁的质量为X
0.5分
2 Mg + O 2 == 2MgO
点燃
48 80
2分
48
--- = ---
80
X
1分
X = 10g
答:3克镁在氧气中充分燃烧可生成氧化镁 10g。
1分
0.5分
6g X
6g
1、设(问谁设谁为X)
2、配(按要求配平方程)
3、标(标质量)
4、比(相对质量比真实质量)
5、答(求解X并解答)
1、设(所求质量设为X)【X不能带单位“克”】
2、配(按要求配平方程【条件、符号、系数不能少】)
3、标(标质量)
【第一行 对应相对分子质量;第二行对应真实质量】
4、比(相对分子质量比真实质量)
5、答(求解X并解答)
重点、难点:标质量
质量标在:两种物质下方
质量标在哪?怎么标?
一:写在设了未知数X的物质下方
二:有确切质量(数值)的物质下方
一:写在设了未知数X的物质下方
二:有确切质量(数值)的物质下方
若含6.8g过氧化氢的过氧化氢溶液完全分解,最多可制得氧气多少克?
2H2O2 O2 + 2H2O
因为
氧气设了X
因为过氧化氢
给了数值6.8g
1 . 加热分解6.3g高锰酸钾,可以得到多少克氧气?
解:
设加热分解 6.3g高锰酸钾可以得到氧气的质量为x
2KMnO4 K2MnO4+MnO2+O2↑
△
6.3g
x
316
32
6.3g
316
x
32
=
x=0.6g
答:加热分解 6.3g高锰酸钾,可以得到0.6g氧气。
已知量
待求量
x
2 ×(39+55+16×4)
1×(16×2)
解:
设可以产生 x g水
8
x
8
x
32
20
=
20
32
=5g
x
8g氢气完全燃烧可以产生多少克水?
找出下列解题过程中的问题
1. x不能带单位
2. 方程式没配平
4. 没标在对应物质下方
3. 计算错误
5. 已知量没带单位
6. 没有作答
36
解:
设可以产生水的质量为 x
8g
x
4
36
=
=72g
x
8g氢气完全燃烧可以产生多少克水?
解:
设可以产生水的质量为 x
8 g
x
答:8g氢气完全燃烧可以产生72克水.
36
4
=72g
x
答:8g氢气完全燃烧可以产生72克水.
理论质量比
实际质量比
少了两行
少 了比例式
找出下列解题过程中的问题
化学方程式计算相关的进阶题型:
一:不给已知的真实质量(间接求质量再计算)
二:剩余质量(用剩余质量求气体质量再计算)
三:混合不纯物(用质量分数求溶质质量再计算)
分解解2L 过氧化氢,能得到氢气多少克?(H2O2密度:1.7g/L)
如果给定的数值是体积,要利用密度公式转化为质量
①:将体积转化为质量 质量=密度*体积
m=2*17=3.4g
②:根据相似比求质量
题型一:不给质量给体积
分解解20L 过氧化氢,能得到氢气多少克?(H2O2密度:1.7g/L)
2 H2O2 2H2O + O2 ↑
通电
34
3.4
X
32
36
32g
3.4
x
=
X=3.2g
设能得到氢气的质量为X
题型二:残留固体质量(混合质量)
将氯酸钾、二氧化锰的混合物26g,加热至完全反应,得剩余固体的质量为16.4g。 求:生成的氧气质量为多少g
由方程可知 26克:是氯酸钾、二氧化锰的混合质量
16.4克:是氯化钾、二氧化锰的混合质量
△
MnO2
2KClO3
=====
2KCl
+ 3O2
↑
如果给定质量是残留质量:不能直接用
给残留的目的:求出气体质量
(总质量-残留质量=气体质量)【大-小】
26g
KCl
O2
MnO2
KClO3
MnO2
剩余固体16.4g
26g-16.4g=9.6g
反应前
反应后
=
26g
26g
△
MnO2
2KClO3
=====
2KCl
+ 3O2
↑
题型三:样品不纯有杂质【求质量分数】
不纯的
样品
杂质 【不参加反应】
纯物质【参加反应被耗尽】
如何判断样品不纯?
1、出现 粗铁、粗铜 等“粗”字 一定不纯
2、铝矿、赤铁矿、“…矿”一定不纯
3、有百分数(百分号:%)
实验室里用8.0g粗锌与足量稀硫酸反应制得氢气0.2g,该反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑(粗锌所含的杂质不跟稀硫酸反应)。计算粗锌中锌的质量分数。
粗锌
杂质【不参加反应】
纯锌【参加反应Zn+H2SO4═ZnSO4+H2↑ 】
问谁就设谁:设锌的质量分数为x%
“锌”的质量=m总* x%
遇到“ % ”要:质量分数 乘 真实质量
谢谢观看
第五单元 化学方程式
课 题 3 利用化学方程式的简单计算
学习目标:
1、给定某物质质量,求其它物质的质量
2H2O O2 + 2H2
水的相对分子质量=18
系数=2
真实质量=2 ×18=36(g)
氧气的相对分子质量=32
系数=1
真实质量=1 ×32=32(g)
氢气的相对分子质量=2
系数=2
真实质量=2 ×2=4(g)
通过学习,已经了解到:
参与反应的物质有各自的质量配比
2H2O O2 + 2H2
36(g)
32(g)
4(g)
如果给定的质量不是36克呢?
氧气和氢气还会是32和4克吗?
发生反应为:2H2O ===O2 + 2H2
如果有65克水发生了分解,将会得到氧气多少克?
2H2O O2 + 2H2
36(g)
32(g)
4(g)
参与反应的水和氧气质量比为36 :32= 9 :8
则有:65:X=9:8 从而求出X=57.7克
计算的规范步骤:
6克镁在氧气中充分燃烧,
可以生成多少克氧化镁?
解:设可生成氧化镁的质量为X
0.5分
2 Mg + O 2 == 2MgO
点燃
48 80
2分
48
--- = ---
80
X
1分
X = 10g
答:3克镁在氧气中充分燃烧可生成氧化镁 10g。
1分
0.5分
6g X
6g
1、设(问谁设谁为X)
2、配(按要求配平方程)
3、标(标质量)
4、比(相对质量比真实质量)
5、答(求解X并解答)
1、设(所求质量设为X)【X不能带单位“克”】
2、配(按要求配平方程【条件、符号、系数不能少】)
3、标(标质量)
【第一行 对应相对分子质量;第二行对应真实质量】
4、比(相对分子质量比真实质量)
5、答(求解X并解答)
重点、难点:标质量
质量标在:两种物质下方
质量标在哪?怎么标?
一:写在设了未知数X的物质下方
二:有确切质量(数值)的物质下方
一:写在设了未知数X的物质下方
二:有确切质量(数值)的物质下方
若含6.8g过氧化氢的过氧化氢溶液完全分解,最多可制得氧气多少克?
2H2O2 O2 + 2H2O
因为
氧气设了X
因为过氧化氢
给了数值6.8g
1 . 加热分解6.3g高锰酸钾,可以得到多少克氧气?
解:
设加热分解 6.3g高锰酸钾可以得到氧气的质量为x
2KMnO4 K2MnO4+MnO2+O2↑
△
6.3g
x
316
32
6.3g
316
x
32
=
x=0.6g
答:加热分解 6.3g高锰酸钾,可以得到0.6g氧气。
已知量
待求量
x
2 ×(39+55+16×4)
1×(16×2)
解:
设可以产生 x g水
8
x
8
x
32
20
=
20
32
=5g
x
8g氢气完全燃烧可以产生多少克水?
找出下列解题过程中的问题
1. x不能带单位
2. 方程式没配平
4. 没标在对应物质下方
3. 计算错误
5. 已知量没带单位
6. 没有作答
36
解:
设可以产生水的质量为 x
8g
x
4
36
=
=72g
x
8g氢气完全燃烧可以产生多少克水?
解:
设可以产生水的质量为 x
8 g
x
答:8g氢气完全燃烧可以产生72克水.
36
4
=72g
x
答:8g氢气完全燃烧可以产生72克水.
理论质量比
实际质量比
少了两行
少 了比例式
找出下列解题过程中的问题
化学方程式计算相关的进阶题型:
一:不给已知的真实质量(间接求质量再计算)
二:剩余质量(用剩余质量求气体质量再计算)
三:混合不纯物(用质量分数求溶质质量再计算)
分解解2L 过氧化氢,能得到氢气多少克?(H2O2密度:1.7g/L)
如果给定的数值是体积,要利用密度公式转化为质量
①:将体积转化为质量 质量=密度*体积
m=2*17=3.4g
②:根据相似比求质量
题型一:不给质量给体积
分解解20L 过氧化氢,能得到氢气多少克?(H2O2密度:1.7g/L)
2 H2O2 2H2O + O2 ↑
通电
34
3.4
X
32
36
32g
3.4
x
=
X=3.2g
设能得到氢气的质量为X
题型二:残留固体质量(混合质量)
将氯酸钾、二氧化锰的混合物26g,加热至完全反应,得剩余固体的质量为16.4g。 求:生成的氧气质量为多少g
由方程可知 26克:是氯酸钾、二氧化锰的混合质量
16.4克:是氯化钾、二氧化锰的混合质量
△
MnO2
2KClO3
=====
2KCl
+ 3O2
↑
如果给定质量是残留质量:不能直接用
给残留的目的:求出气体质量
(总质量-残留质量=气体质量)【大-小】
26g
KCl
O2
MnO2
KClO3
MnO2
剩余固体16.4g
26g-16.4g=9.6g
反应前
反应后
=
26g
26g
△
MnO2
2KClO3
=====
2KCl
+ 3O2
↑
题型三:样品不纯有杂质【求质量分数】
不纯的
样品
杂质 【不参加反应】
纯物质【参加反应被耗尽】
如何判断样品不纯?
1、出现 粗铁、粗铜 等“粗”字 一定不纯
2、铝矿、赤铁矿、“…矿”一定不纯
3、有百分数(百分号:%)
实验室里用8.0g粗锌与足量稀硫酸反应制得氢气0.2g,该反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑(粗锌所含的杂质不跟稀硫酸反应)。计算粗锌中锌的质量分数。
粗锌
杂质【不参加反应】
纯锌【参加反应Zn+H2SO4═ZnSO4+H2↑ 】
问谁就设谁:设锌的质量分数为x%
“锌”的质量=m总* x%
遇到“ % ”要:质量分数 乘 真实质量
谢谢观看
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
