湖南省益阳市名校2022-2023年高一下学期期末考试化学试题(含答案)
文档属性
| 名称 | 湖南省益阳市名校2022-2023年高一下学期期末考试化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 813.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-28 00:00:00 | ||
图片预览


文档简介
益阳市名校2022-2023年高一下学期期末考试
化学
时量:75分钟 满分:100分
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Cu:64
一、选择题(本题包括14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与科学、技术、社会、环境密切相关,下列说法错误的是( )
A.用浸泡过高锰酸钾溶液的硅藻土保鲜水果,其作用是吸收水果释放出的乙烯
B.“以火烧之,紫青烟起,乃真硝石也”这是利用“焰色试验”来鉴别硝石()
C.“大漠孤烟直,长河落日圆”中的“烟”与“发烟”硝酸中的“烟”成分相同
D.我国提出网络强国战略,光缆线路总长超三千万公里,其原料是二氧化硅
2.下列化学用语表示正确的是( )
A.甲烷分子的空间填充模型: B.的电子式:
C.二氧化碳的结构式: D.硫原子结构示意图:
3.在工业生产或实验中,下列做法与调控化学反应速率无关的是( )
A.煅烧矿石时,向炉膛中鼓入空气增强火势
B.将与稀反应中的稀换成稀
C.食品抽真空包装
D.实验室制氢气时,用锌粉代替锌块
4.下列说法正确的是( )
A.与为同一种物质
B.互为同分异构体
C.和互为同系物
D.与互为同分异构体
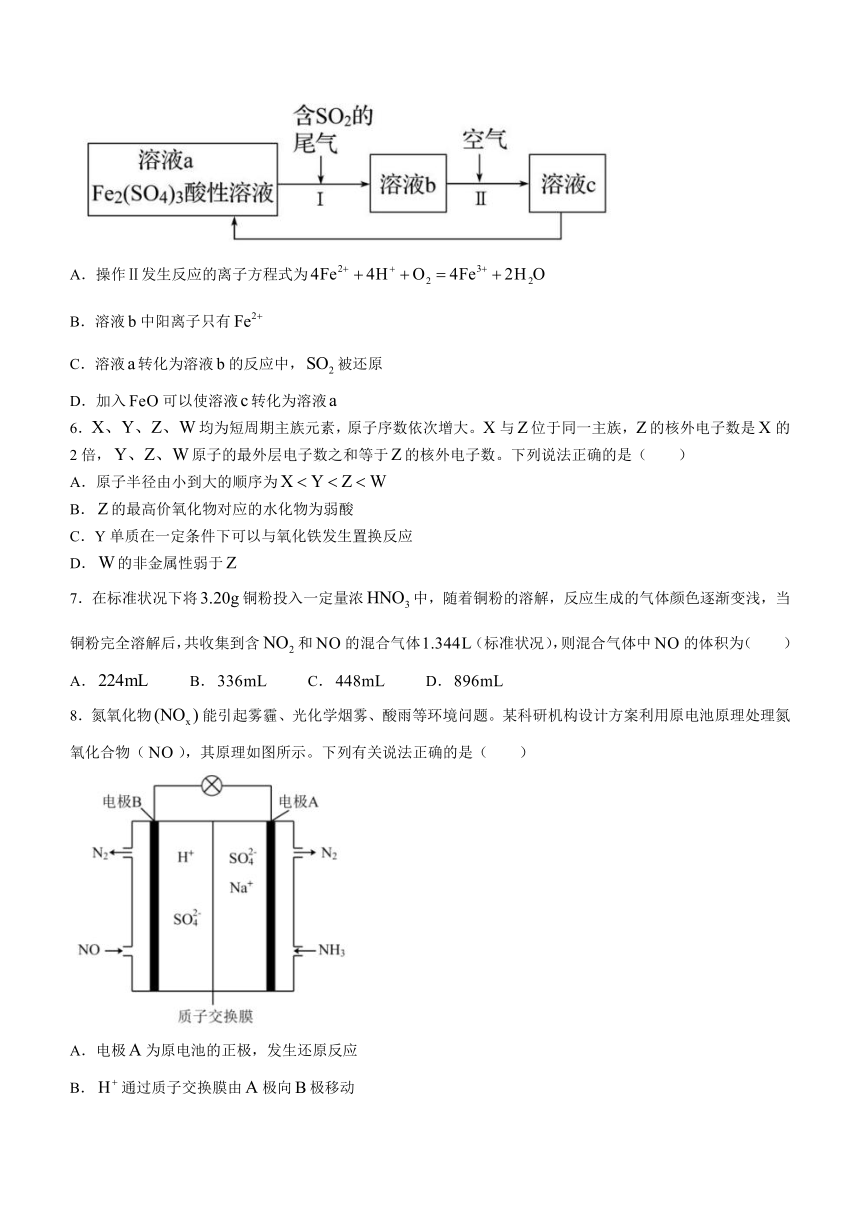
5.如图是一种综合处理废气的工艺流程。下列说法正确的是( )
A.操作Ⅱ发生反应的离子方程式为
B.溶液中阳离子只有
C.溶液转化为溶液的反应中,被还原
D.加入可以使溶液转化为溶液
6.均为短周期主族元素,原子序数依次增大。与位于同一主族,的核外电子数是的2倍,原子的最外层电子数之和等于的核外电子数。下列说法正确的是( )
A.原子半径由小到大的顺序为
B.的最高价氧化物对应的水化物为弱酸
C.Y单质在一定条件下可以与氧化铁发生置换反应
D.的非金属性弱于
7.在标准状况下将铜粉投入一定量浓中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后,共收集到含和的混合气体(标准状况),则混合气体中的体积为( )
A. B. C. D.
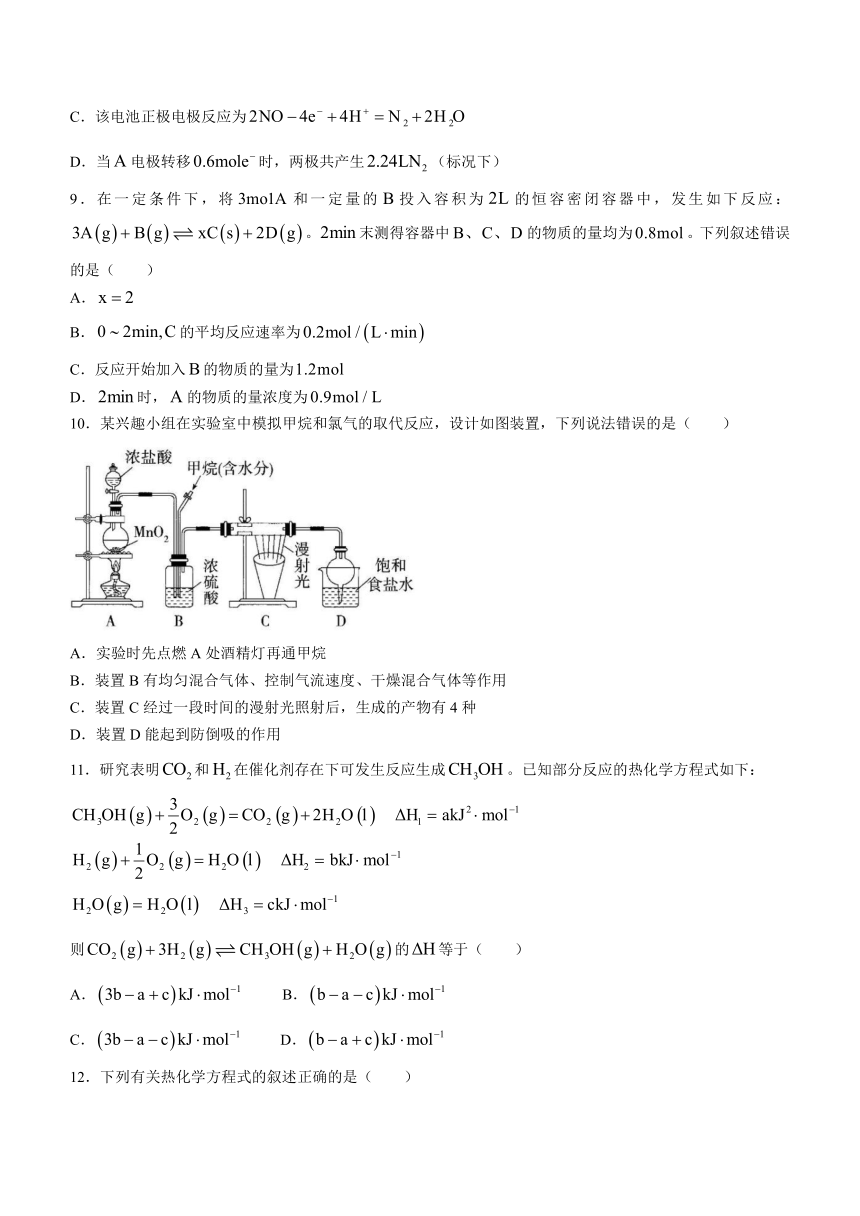
8.氮氧化物能引起雾霾、光化学烟雾、酸雨等环境问题。某科研机构设计方案利用原电池原理处理氮氧化合物(),其原理如图所示。下列有关说法正确的是( )
A.电极为原电池的正极,发生还原反应
B.通过质子交换膜由极向极移动
C.该电池正极电极反应为
D.当电极转移时,两极共产生(标况下)
9.在一定条件下,将和一定量的投入容积为的恒容密闭容器中,发生如下反应:。末测得容器中的物质的量均为。下列叙述错误的是( )
A.
B.的平均反应速率为
C.反应开始加入的物质的量为
D.时,的物质的量浓度为
10.某兴趣小组在实验室中模拟甲烷和氯气的取代反应,设计如图装置,下列说法错误的是( )
A.实验时先点燃A处酒精灯再通甲烷
B.装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
C.装置C经过一段时间的漫射光照射后,生成的产物有4种
D.装置D能起到防倒吸的作用
11.研究表明和在催化剂存在下可发生反应生成。已知部分反应的热化学方程式如下:
则的等于( )
A. B.
C. D.
12.下列有关热化学方程式的叙述正确的是( )
A.可以表示氢气的燃烧热
B.已知石墨,金刚石,,则金刚石比石墨稳定
C.含的稀溶液与稀盐酸完全中和,放出的热量,则该反应的热化学方程式为:
D.已知;;则
13.受热分解常用于实验室制备。工业制备中,首先以软锰矿(主要成分为)为原料生成,进而利用“酸性歧化法”生成,流程如下图所示。
实验室中模拟以上工业流程制备。下列说法正确的是( )
A.熔融过程温度较高,可以选用石英坩埚作反应容器
B.“酸化”时若改用盐酸,则反应为
C.“结晶”获取晶体时采用蒸发结晶
D.该流程中涉及到的化学反应都是氧化还原反应
14.向溶液中通入一定量的气体,经充分反应后,再向所获得的溶液中逐滴加入的盐酸,产生的体积与所加盐酸体积之间关系如图所示。下列判断不正确的是( )
A.原溶液的物质的量浓度为
B.通入在标准状况下的体积为
C.V(盐酸)的范围内发生的离子反应为:
D.所得溶液的溶质成分为和
二、非选择题(本题包括4小题,共58分,每空2分)
15.(14分)化学反应速率和限度与生产、生活密切相关。
(1)某温度下,恒容密闭容器中,X、Y、Z三种物质的物质的量随反应时间的变化曲线如图所示。
①从反应开始到内,用的浓度变化表示的平均反应速率为_________。
②该反应的化学方程式为_________.
③若均为气体,在时,向容器中通入氩气(容器体积不变),的反应速率将_________(填“变大”、“不变”或“变小”)。
④若均为气体,下列能说明该反应达到平衡状态的是_________(填字母)。
a.三种气体的浓度相等
b.混合气体的质量不随时间变化
c.混合气体的密度不随时间变化
d.单位时间内消耗X和的物质的量之比为
(2)实验室用溶液与溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知):
实验序号 体积/ 温度/ 溶液出现浑浊的时间/s
溶液 水 溶液
1 2.0 0.0 2.0 25
2 2.0 0.0 2.0 50
3 1.0 V 2.0 T
①对比实验1和2可探究_________因素对化学反应速率的影响。
②对比实验1和3来探究浓度对化学反应速率的影响,则_________,_________.
16.(14分)金属矿物资源的利用有着非常重要的意义。
(1)金属铜常用的冶炼方法是_________(填序号);
A.热分解法 B.热还原法 C.电解法 D.湿法冶金
(2)工业上由黄铜矿(主要成分)冶炼铜的主要流程如下:
①气体A中的大气污染物可选用下列试剂中的_________吸收(填序号)。
a.浓 b.稀 c.溶液 d.氨水
②用稀浸泡熔渣,取少量所得溶液,滴加溶液后呈红色,说明溶液中存在_________(填离子符号)。
③根据上述流程图所示,由泡铜冶炼粗铜的化学反应方程式为_________。
(3)已知灼热的氧化铜可以与氨反应得到氮气和金属铜,用下图中的装置可以实现该反应。A中生成氨气的化学方程式是_________,写出C中发生反应的化学方程式:_________.
试管中收集到的物质是_________.
17.(14分)亚硝酸钠在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业中的用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①;
②气体液化的温度:为,为。
(1)为了检验装置中生成的气体产物,仪器的连接顺序(按左右连接)为_________、_________、B。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是___________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有,依据的现象是___________;
②装置E的作用是___________。
(4)如果向D中通入过量,则装置B中发生反应的化学方程式为___________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是___________。
18.(16分)A是一种重要的有机化工原料,其产量通常用来衡量一个国家的石油化学工业发展水平,通过一系列化学反应,可以制得成千上万种有用的物质。结合下图物质间转化关系回答问题。
(1)A结构简式为___________。
(2)③的反应类型为___________,E中的官能团名称是___________。
(3)高分子化合物G是一种常见的合成纤维——丙纶,其结构简式为___________。
(4)B→X的化学方程式为。
(5)写出步骤②的化学方程式:___________________________。
(6)与足量的金属完全反应,生成标准状况下氢气的体积为___________L。
(7)写出E与发生加成反应所有产物的结构简式:___________。
参考答案
1-14 CCBAA CCBBC CDDB
15.(1)0.075 不变 d
(2)温度 1.0 25
16.(1)BD (2)cd
(3) 氮气
17.(1)E D
(2)排出装置中的空气,防止可能产生的被氧化成
(3)①开始时装置D中无色,通入氧气后出现红棕色气体
(2)降温冷凝,使完全液化,除去气体中的,避免干扰的检验
(4)
(5)
18.(1)
(2)取代反应 碳碳双键、酯基
(3)
(4),
(5)
(6)4.48
(7)、
化学
时量:75分钟 满分:100分
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Cu:64
一、选择题(本题包括14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与科学、技术、社会、环境密切相关,下列说法错误的是( )
A.用浸泡过高锰酸钾溶液的硅藻土保鲜水果,其作用是吸收水果释放出的乙烯
B.“以火烧之,紫青烟起,乃真硝石也”这是利用“焰色试验”来鉴别硝石()
C.“大漠孤烟直,长河落日圆”中的“烟”与“发烟”硝酸中的“烟”成分相同
D.我国提出网络强国战略,光缆线路总长超三千万公里,其原料是二氧化硅
2.下列化学用语表示正确的是( )
A.甲烷分子的空间填充模型: B.的电子式:
C.二氧化碳的结构式: D.硫原子结构示意图:
3.在工业生产或实验中,下列做法与调控化学反应速率无关的是( )
A.煅烧矿石时,向炉膛中鼓入空气增强火势
B.将与稀反应中的稀换成稀
C.食品抽真空包装
D.实验室制氢气时,用锌粉代替锌块
4.下列说法正确的是( )
A.与为同一种物质
B.互为同分异构体
C.和互为同系物
D.与互为同分异构体
5.如图是一种综合处理废气的工艺流程。下列说法正确的是( )
A.操作Ⅱ发生反应的离子方程式为
B.溶液中阳离子只有
C.溶液转化为溶液的反应中,被还原
D.加入可以使溶液转化为溶液
6.均为短周期主族元素,原子序数依次增大。与位于同一主族,的核外电子数是的2倍,原子的最外层电子数之和等于的核外电子数。下列说法正确的是( )
A.原子半径由小到大的顺序为
B.的最高价氧化物对应的水化物为弱酸
C.Y单质在一定条件下可以与氧化铁发生置换反应
D.的非金属性弱于
7.在标准状况下将铜粉投入一定量浓中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后,共收集到含和的混合气体(标准状况),则混合气体中的体积为( )
A. B. C. D.
8.氮氧化物能引起雾霾、光化学烟雾、酸雨等环境问题。某科研机构设计方案利用原电池原理处理氮氧化合物(),其原理如图所示。下列有关说法正确的是( )
A.电极为原电池的正极,发生还原反应
B.通过质子交换膜由极向极移动
C.该电池正极电极反应为
D.当电极转移时,两极共产生(标况下)
9.在一定条件下,将和一定量的投入容积为的恒容密闭容器中,发生如下反应:。末测得容器中的物质的量均为。下列叙述错误的是( )
A.
B.的平均反应速率为
C.反应开始加入的物质的量为
D.时,的物质的量浓度为
10.某兴趣小组在实验室中模拟甲烷和氯气的取代反应,设计如图装置,下列说法错误的是( )
A.实验时先点燃A处酒精灯再通甲烷
B.装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
C.装置C经过一段时间的漫射光照射后,生成的产物有4种
D.装置D能起到防倒吸的作用
11.研究表明和在催化剂存在下可发生反应生成。已知部分反应的热化学方程式如下:
则的等于( )
A. B.
C. D.
12.下列有关热化学方程式的叙述正确的是( )
A.可以表示氢气的燃烧热
B.已知石墨,金刚石,,则金刚石比石墨稳定
C.含的稀溶液与稀盐酸完全中和,放出的热量,则该反应的热化学方程式为:
D.已知;;则
13.受热分解常用于实验室制备。工业制备中,首先以软锰矿(主要成分为)为原料生成,进而利用“酸性歧化法”生成,流程如下图所示。
实验室中模拟以上工业流程制备。下列说法正确的是( )
A.熔融过程温度较高,可以选用石英坩埚作反应容器
B.“酸化”时若改用盐酸,则反应为
C.“结晶”获取晶体时采用蒸发结晶
D.该流程中涉及到的化学反应都是氧化还原反应
14.向溶液中通入一定量的气体,经充分反应后,再向所获得的溶液中逐滴加入的盐酸,产生的体积与所加盐酸体积之间关系如图所示。下列判断不正确的是( )
A.原溶液的物质的量浓度为
B.通入在标准状况下的体积为
C.V(盐酸)的范围内发生的离子反应为:
D.所得溶液的溶质成分为和
二、非选择题(本题包括4小题,共58分,每空2分)
15.(14分)化学反应速率和限度与生产、生活密切相关。
(1)某温度下,恒容密闭容器中,X、Y、Z三种物质的物质的量随反应时间的变化曲线如图所示。
①从反应开始到内,用的浓度变化表示的平均反应速率为_________。
②该反应的化学方程式为_________.
③若均为气体,在时,向容器中通入氩气(容器体积不变),的反应速率将_________(填“变大”、“不变”或“变小”)。
④若均为气体,下列能说明该反应达到平衡状态的是_________(填字母)。
a.三种气体的浓度相等
b.混合气体的质量不随时间变化
c.混合气体的密度不随时间变化
d.单位时间内消耗X和的物质的量之比为
(2)实验室用溶液与溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知):
实验序号 体积/ 温度/ 溶液出现浑浊的时间/s
溶液 水 溶液
1 2.0 0.0 2.0 25
2 2.0 0.0 2.0 50
3 1.0 V 2.0 T
①对比实验1和2可探究_________因素对化学反应速率的影响。
②对比实验1和3来探究浓度对化学反应速率的影响,则_________,_________.
16.(14分)金属矿物资源的利用有着非常重要的意义。
(1)金属铜常用的冶炼方法是_________(填序号);
A.热分解法 B.热还原法 C.电解法 D.湿法冶金
(2)工业上由黄铜矿(主要成分)冶炼铜的主要流程如下:
①气体A中的大气污染物可选用下列试剂中的_________吸收(填序号)。
a.浓 b.稀 c.溶液 d.氨水
②用稀浸泡熔渣,取少量所得溶液,滴加溶液后呈红色,说明溶液中存在_________(填离子符号)。
③根据上述流程图所示,由泡铜冶炼粗铜的化学反应方程式为_________。
(3)已知灼热的氧化铜可以与氨反应得到氮气和金属铜,用下图中的装置可以实现该反应。A中生成氨气的化学方程式是_________,写出C中发生反应的化学方程式:_________.
试管中收集到的物质是_________.
17.(14分)亚硝酸钠在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业中的用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①;
②气体液化的温度:为,为。
(1)为了检验装置中生成的气体产物,仪器的连接顺序(按左右连接)为_________、_________、B。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是___________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有,依据的现象是___________;
②装置E的作用是___________。
(4)如果向D中通入过量,则装置B中发生反应的化学方程式为___________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是___________。
18.(16分)A是一种重要的有机化工原料,其产量通常用来衡量一个国家的石油化学工业发展水平,通过一系列化学反应,可以制得成千上万种有用的物质。结合下图物质间转化关系回答问题。
(1)A结构简式为___________。
(2)③的反应类型为___________,E中的官能团名称是___________。
(3)高分子化合物G是一种常见的合成纤维——丙纶,其结构简式为___________。
(4)B→X的化学方程式为。
(5)写出步骤②的化学方程式:___________________________。
(6)与足量的金属完全反应,生成标准状况下氢气的体积为___________L。
(7)写出E与发生加成反应所有产物的结构简式:___________。
参考答案
1-14 CCBAA CCBBC CDDB
15.(1)0.075 不变 d
(2)温度 1.0 25
16.(1)BD (2)cd
(3) 氮气
17.(1)E D
(2)排出装置中的空气,防止可能产生的被氧化成
(3)①开始时装置D中无色,通入氧气后出现红棕色气体
(2)降温冷凝,使完全液化,除去气体中的,避免干扰的检验
(4)
(5)
18.(1)
(2)取代反应 碳碳双键、酯基
(3)
(4),
(5)
(6)4.48
(7)、
同课章节目录
