4.1 第2课时 常见化学电源(一)——一次电池和二次电池(共22张PPT)-2023-2024学年高二化学人教版选择性必修1课件
文档属性
| 名称 | 4.1 第2课时 常见化学电源(一)——一次电池和二次电池(共22张PPT)-2023-2024学年高二化学人教版选择性必修1课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-29 00:00:00 | ||
图片预览






文档简介
(共22张PPT)
空间站太阳能电池板
第一节 原电池
第2课时 常见化学电源(一)——一次电池和二次电池
第四章 化学反应与电能
[学习目标]
1.了解化学电源种类并认识化学电源在实际生活中的应用。
2.掌握一次电池、二次电池的反应原理并能书写电极反应式(重、难点)。
新课导入
日常生活中你用过哪些电池,你知道如何选择电池吗?
视频导学
一、一次电池及工作原理
1.化学电源概述
分类:
(2) 判断电池优劣的主要标准
①比能量:单位质量或单位体积所能输出电能的多少。
②比功率:单位质量或单位体积所能输出功率的大小。
③电池可储存时间的长短。
一次电池 二次电池 燃料电池
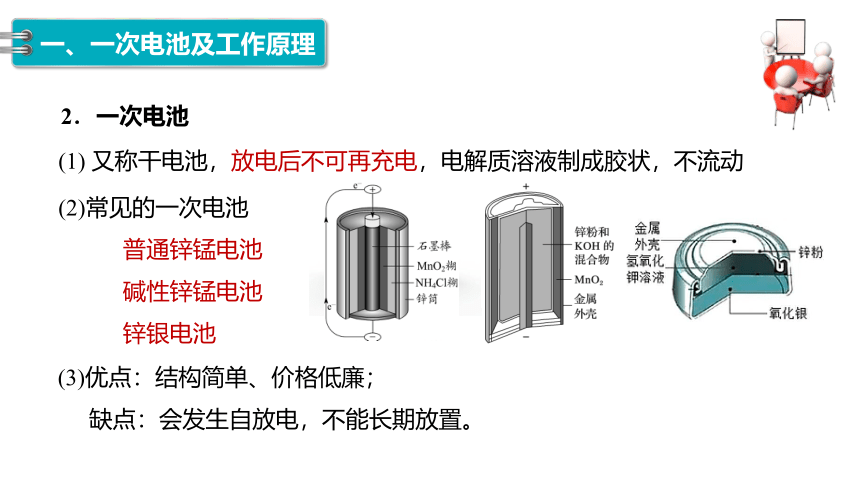
2.一次电池
(2)常见的一次电池
普通锌锰电池
碱性锌锰电池
锌银电池
(1) 又称干电池,放电后不可再充电,电解质溶液制成胶状,不流动
(3)优点:结构简单、价格低廉;
缺点:会发生自放电,不能长期放置。
一、一次电池及工作原理
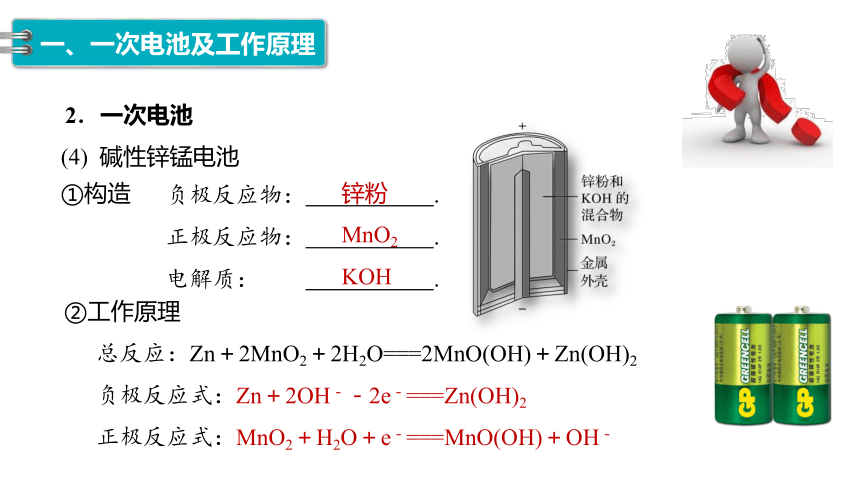
(4) 碱性锌锰电池
①构造
负极反应物: .
正极反应物: .
电解质: .
②工作原理
总反应:Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2
负极反应式:Zn+2OH--2e-===Zn(OH)2
正极反应式:MnO2+H2O+e-===MnO(OH)+OH-
锌粉
MnO2
KOH
一、一次电池及工作原理
2.一次电池
思考交流
1.普通锌锰电池的电池反应一般认为是Zn+2MnO2+2NH4Cl===
Zn(NH3)2Cl2+2MnO(OH),其构造如图。
根据电池反应及构造图,解答:
(1)负极材料是_____,
负极反应式:_______________________________。
(2)正极材料是_______,
正极反应式:_________________________________。
(3)电解质溶液是_________。
锌筒
Zn-2e-+
石墨棒
2MnO2+2H++2e-===2MnO(OH)
NH4Cl糊
0
+2
+4
+3
一、一次电池及工作原理
思考交流
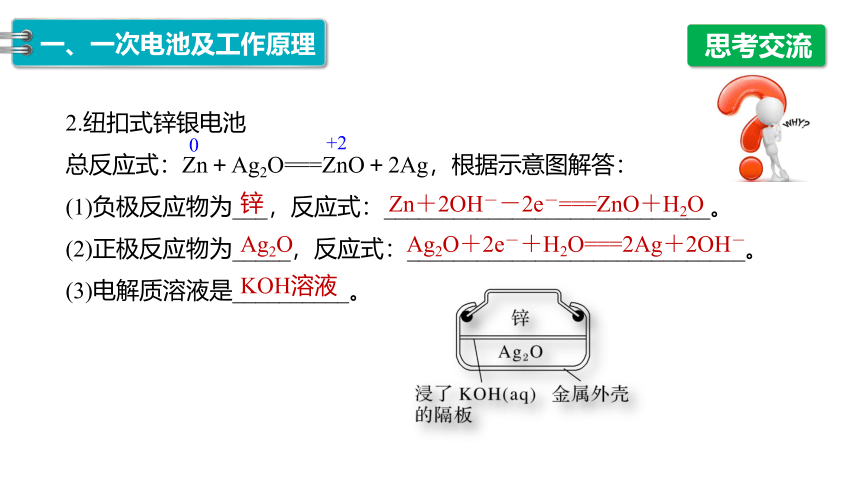
2.纽扣式锌银电池
总反应式:Zn+Ag2O===ZnO+2Ag,根据示意图解答:
(1)负极反应物为___,反应式:____________________________。
(2)正极反应物为_____,反应式:_____________________________。
(3)电解质溶液是__________。
锌
Zn+2OH--2e-===ZnO+H2O
Ag2O
Ag2O+2e-+H2O===2Ag+2OH-
KOH溶液
0
+2
一、一次电池及工作原理
归纳总结
已知原电池总反应式,书写电极反应式的方法
(1)分析元素化合价变化,找出氧化剂及其对应的还原产物,氧化剂发生的反应为正极反应;找出还原剂及其对应的氧化产物,还原剂发生的反应为负极反应。
(2)若某一电极反应较难书写,可先写出较简单的电极反应式,然后利用总反应式减去该电极反应式即可得到另一电极反应式。
一、一次电池及工作原理
二、二次电池
1. 二次电池
又称可充电电池或蓄电池,放电后可再充电而反复使用
2.实例分析——铅酸蓄电池
(1) 构造
充、放电总反应:Pb+PbO2+2H2SO4 2PbSO4+2H2O
0
+2
Pb
+4
PbO2
(2)放电反应原理
①负极反应式: ;
②正极反应式: ;
③放电过程中,负极质量变化 ,稀H2SO4的浓度 。
充、放电总反应:Pb+PbO2+2H2SO4 2PbSO4+2H2O
0
+2
+4
探究讨论
2.实例分析——铅酸蓄电池
增大
减小
PbSO4难溶于水
二、二次电池
铅酸蓄电池如何充电?如何书写充电时的电极反应式?
探究思考
+ ─
充电总反应:
2PbSO4(s)+2H2O(l)===Pb(s)+PbO2(s)+2H2SO4(aq)
充电时,正极与直流电源正极相连,负极与直流电源负极相连
PbSO4 (s) +2e- === Pb(s) + (aq)
阴极:
阳极:
PbSO4 (s)+2H2O(l) -2e- === PbO2(s) + 4H+(aq)+ (aq)
二、二次电池
2.实例分析——铅酸蓄电池
(3)充电反应原理:充电过程与其放电过程相反。
(4)铅酸蓄电池的优缺点
①优点:电压稳定、使用方便、安全可靠、价格低廉。
②缺点:比能量低、笨重。
二、二次电池
二、二次电池
思考交流
1.一种可充电锂离子电池——钴酸锂-石墨锂电池,其电池反应为LixCy+Li1-xCoO2===LiCoO2+Cy。
(1)写出电池放电时的电极反应式。
负极: ;
正极: 。
(2)简述放电和充电过程中Li+运动情况。
LixCy-xe-===xLi++Cy
Li1-xCoO2+xLi++xe-===LiCoO2
放电时,锂离子由石墨中脱嵌移向正极,嵌入钴酸锂晶体中;充电时,锂离子从钴酸锂晶体中脱嵌,由正极回到负极,嵌入石墨中。
(1)放电时,负极是_________,Li+移向_________电极,正极的电极反应式为__________________________________________。
(2)充电时,原电池的负极称为阴极,正极称为阳极。
阴极反应式为____________________________________;
阳极反应式为______________________________________。
二、二次电池
思考交流
2.磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,电池总反应为
Li1-xFePO4+LixC6 LiFePO4+C6,
其原理如图所示:
石墨电极
磷酸铁锂
Li1-xFePO4+xe-+xLi+===LiFePO4
C6+xLi++xe-=== LixC6
LiFePO4-xe-===Li1-xFePO4+xLi+
归纳总结
(1) 二次电池充电时的电极连接方法——正接正,负接负。
(2) 充电时的电极反应式的书写
放电时的负极反应式 充电时的阴极反应式
放电时的正极反应式 充电时的阳极反应式
颠倒过来
颠倒过来
二、二次电池
自我测试
1.一种锌锰碱性电池,其电池总反应式为Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s),下列说法错误的是
A.电池工作时,锌失去电子
B.电池工作时,电子由正极通过外电路流向负极
C.电池负极上发生氧化反应
D.外电路中每通过0.4 mol电子,锌的质量理论上减小13.0 g
√
电子由负流向正
65 g Zn反应转移电子为2 mol
负极失电子发生氧化反应
自我测试
电子由负流向正
2. 化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是
A.甲中H+移向铜电极
B.乙中正极反应式为Ag2O+2e-+2H+===2Ag+H2O
C.丙中锌筒作负极,发生氧化反应,锌筒会变薄
D.丁使用一段时间后电解质溶液的酸性减弱
√
负 正
Ag2O+H2O+2e-===2Ag+2OH-
Zn-2e-===Zn2+
总反应中硫酸被消耗
铜为原电池的正极,溶液中氢离子移向正极铜
自我测试
3.下列关于铅酸蓄电池的说法正确的是
A.放电时,正极发生的反应是 Pb+-2e-===PbSO4
B.放电时,该电池的负极材料是铅板
C.充电时,电池中硫酸的浓度不断减小
D.放电时,负极质量减轻
√
PbO2作正极
充电:2PbSO4+2H2O===Pb+PbO2+2H2SO4,硫酸浓度不断增大
正、负极质量均增加
4.锂电池是新一代高能电池,目前已研发出多种锂电池。某种锂电池的总反应式为Li+MnO2===LiMnO2,下列说法正确的是
A.Li是正极,MnO2是负极
B.放电时负极的反应:Li-e-===Li+
C.放电时正极发生氧化反应
D.电池放电时,能量转化率可达到100%
自我测试
电子从负极经外电路流向正极
√
锂失电子,作负极
还原反应
常伴随热量变化,则能量转化率小于100%
自我测试
5.Al-Ag2O电池是一种可用作水下动力的优良电
源,其原理如图所示。该电池工作时总反应式为
2Al+3Ag2O+2NaOH===2NaAlO2+6Ag+H2O,
则下列说法错误的是
A.Al电极作负极,电极反应式为Al-3e-+4OH-===Al+2H2O
B.工作时电解液中的OH-移向Ag2O/Ag电极
C.工作时正极发生还原反应,负极不断减重
D.当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol
√
- +
OH-向负极(Al电极)移动
Ag2O+H2O+2e-===2Ag+2OH- 可知正极增重
本节内容结束
空间站太阳能电池板
第一节 原电池
第2课时 常见化学电源(一)——一次电池和二次电池
第四章 化学反应与电能
[学习目标]
1.了解化学电源种类并认识化学电源在实际生活中的应用。
2.掌握一次电池、二次电池的反应原理并能书写电极反应式(重、难点)。
新课导入
日常生活中你用过哪些电池,你知道如何选择电池吗?
视频导学
一、一次电池及工作原理
1.化学电源概述
分类:
(2) 判断电池优劣的主要标准
①比能量:单位质量或单位体积所能输出电能的多少。
②比功率:单位质量或单位体积所能输出功率的大小。
③电池可储存时间的长短。
一次电池 二次电池 燃料电池
2.一次电池
(2)常见的一次电池
普通锌锰电池
碱性锌锰电池
锌银电池
(1) 又称干电池,放电后不可再充电,电解质溶液制成胶状,不流动
(3)优点:结构简单、价格低廉;
缺点:会发生自放电,不能长期放置。
一、一次电池及工作原理
(4) 碱性锌锰电池
①构造
负极反应物: .
正极反应物: .
电解质: .
②工作原理
总反应:Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2
负极反应式:Zn+2OH--2e-===Zn(OH)2
正极反应式:MnO2+H2O+e-===MnO(OH)+OH-
锌粉
MnO2
KOH
一、一次电池及工作原理
2.一次电池
思考交流
1.普通锌锰电池的电池反应一般认为是Zn+2MnO2+2NH4Cl===
Zn(NH3)2Cl2+2MnO(OH),其构造如图。
根据电池反应及构造图,解答:
(1)负极材料是_____,
负极反应式:_______________________________。
(2)正极材料是_______,
正极反应式:_________________________________。
(3)电解质溶液是_________。
锌筒
Zn-2e-+
石墨棒
2MnO2+2H++2e-===2MnO(OH)
NH4Cl糊
0
+2
+4
+3
一、一次电池及工作原理
思考交流
2.纽扣式锌银电池
总反应式:Zn+Ag2O===ZnO+2Ag,根据示意图解答:
(1)负极反应物为___,反应式:____________________________。
(2)正极反应物为_____,反应式:_____________________________。
(3)电解质溶液是__________。
锌
Zn+2OH--2e-===ZnO+H2O
Ag2O
Ag2O+2e-+H2O===2Ag+2OH-
KOH溶液
0
+2
一、一次电池及工作原理
归纳总结
已知原电池总反应式,书写电极反应式的方法
(1)分析元素化合价变化,找出氧化剂及其对应的还原产物,氧化剂发生的反应为正极反应;找出还原剂及其对应的氧化产物,还原剂发生的反应为负极反应。
(2)若某一电极反应较难书写,可先写出较简单的电极反应式,然后利用总反应式减去该电极反应式即可得到另一电极反应式。
一、一次电池及工作原理
二、二次电池
1. 二次电池
又称可充电电池或蓄电池,放电后可再充电而反复使用
2.实例分析——铅酸蓄电池
(1) 构造
充、放电总反应:Pb+PbO2+2H2SO4 2PbSO4+2H2O
0
+2
Pb
+4
PbO2
(2)放电反应原理
①负极反应式: ;
②正极反应式: ;
③放电过程中,负极质量变化 ,稀H2SO4的浓度 。
充、放电总反应:Pb+PbO2+2H2SO4 2PbSO4+2H2O
0
+2
+4
探究讨论
2.实例分析——铅酸蓄电池
增大
减小
PbSO4难溶于水
二、二次电池
铅酸蓄电池如何充电?如何书写充电时的电极反应式?
探究思考
+ ─
充电总反应:
2PbSO4(s)+2H2O(l)===Pb(s)+PbO2(s)+2H2SO4(aq)
充电时,正极与直流电源正极相连,负极与直流电源负极相连
PbSO4 (s) +2e- === Pb(s) + (aq)
阴极:
阳极:
PbSO4 (s)+2H2O(l) -2e- === PbO2(s) + 4H+(aq)+ (aq)
二、二次电池
2.实例分析——铅酸蓄电池
(3)充电反应原理:充电过程与其放电过程相反。
(4)铅酸蓄电池的优缺点
①优点:电压稳定、使用方便、安全可靠、价格低廉。
②缺点:比能量低、笨重。
二、二次电池
二、二次电池
思考交流
1.一种可充电锂离子电池——钴酸锂-石墨锂电池,其电池反应为LixCy+Li1-xCoO2===LiCoO2+Cy。
(1)写出电池放电时的电极反应式。
负极: ;
正极: 。
(2)简述放电和充电过程中Li+运动情况。
LixCy-xe-===xLi++Cy
Li1-xCoO2+xLi++xe-===LiCoO2
放电时,锂离子由石墨中脱嵌移向正极,嵌入钴酸锂晶体中;充电时,锂离子从钴酸锂晶体中脱嵌,由正极回到负极,嵌入石墨中。
(1)放电时,负极是_________,Li+移向_________电极,正极的电极反应式为__________________________________________。
(2)充电时,原电池的负极称为阴极,正极称为阳极。
阴极反应式为____________________________________;
阳极反应式为______________________________________。
二、二次电池
思考交流
2.磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,电池总反应为
Li1-xFePO4+LixC6 LiFePO4+C6,
其原理如图所示:
石墨电极
磷酸铁锂
Li1-xFePO4+xe-+xLi+===LiFePO4
C6+xLi++xe-=== LixC6
LiFePO4-xe-===Li1-xFePO4+xLi+
归纳总结
(1) 二次电池充电时的电极连接方法——正接正,负接负。
(2) 充电时的电极反应式的书写
放电时的负极反应式 充电时的阴极反应式
放电时的正极反应式 充电时的阳极反应式
颠倒过来
颠倒过来
二、二次电池
自我测试
1.一种锌锰碱性电池,其电池总反应式为Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s),下列说法错误的是
A.电池工作时,锌失去电子
B.电池工作时,电子由正极通过外电路流向负极
C.电池负极上发生氧化反应
D.外电路中每通过0.4 mol电子,锌的质量理论上减小13.0 g
√
电子由负流向正
65 g Zn反应转移电子为2 mol
负极失电子发生氧化反应
自我测试
电子由负流向正
2. 化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是
A.甲中H+移向铜电极
B.乙中正极反应式为Ag2O+2e-+2H+===2Ag+H2O
C.丙中锌筒作负极,发生氧化反应,锌筒会变薄
D.丁使用一段时间后电解质溶液的酸性减弱
√
负 正
Ag2O+H2O+2e-===2Ag+2OH-
Zn-2e-===Zn2+
总反应中硫酸被消耗
铜为原电池的正极,溶液中氢离子移向正极铜
自我测试
3.下列关于铅酸蓄电池的说法正确的是
A.放电时,正极发生的反应是 Pb+-2e-===PbSO4
B.放电时,该电池的负极材料是铅板
C.充电时,电池中硫酸的浓度不断减小
D.放电时,负极质量减轻
√
PbO2作正极
充电:2PbSO4+2H2O===Pb+PbO2+2H2SO4,硫酸浓度不断增大
正、负极质量均增加
4.锂电池是新一代高能电池,目前已研发出多种锂电池。某种锂电池的总反应式为Li+MnO2===LiMnO2,下列说法正确的是
A.Li是正极,MnO2是负极
B.放电时负极的反应:Li-e-===Li+
C.放电时正极发生氧化反应
D.电池放电时,能量转化率可达到100%
自我测试
电子从负极经外电路流向正极
√
锂失电子,作负极
还原反应
常伴随热量变化,则能量转化率小于100%
自我测试
5.Al-Ag2O电池是一种可用作水下动力的优良电
源,其原理如图所示。该电池工作时总反应式为
2Al+3Ag2O+2NaOH===2NaAlO2+6Ag+H2O,
则下列说法错误的是
A.Al电极作负极,电极反应式为Al-3e-+4OH-===Al+2H2O
B.工作时电解液中的OH-移向Ag2O/Ag电极
C.工作时正极发生还原反应,负极不断减重
D.当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol
√
- +
OH-向负极(Al电极)移动
Ag2O+H2O+2e-===2Ag+2OH- 可知正极增重
本节内容结束
