4.2 第1课时 电解原理(共26张PPT) -2023-2024学年高二化学人教版选择性必修1课件
文档属性
| 名称 | 4.2 第1课时 电解原理(共26张PPT) -2023-2024学年高二化学人教版选择性必修1课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 11.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-29 16:27:00 | ||
图片预览






文档简介
(共26张PPT)
第二节 电解池
第1课时 电解原理
第四章 化学反应与电能
空间站太阳能电池板
[学习目标]
化学 必修第一册 人民教育出版社
化学 必修第二册 人民教育出版社
1.了解电解及电解池的概念,熟悉电解池的构成条件。
2.理解电解原理及电解的规律,会判断电解的产物,掌握电解池电极反应式的书写(重、难点)。
新课导入
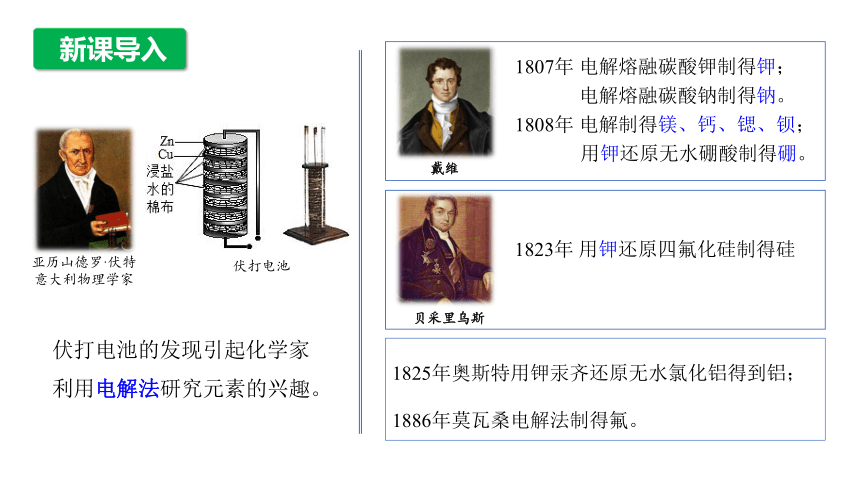
亚历山德罗·伏特
意大利物理学家
伏打电池
伏打电池的发现引起化学家利用电解法研究元素的兴趣。
1807年 电解熔融碳酸钾制得钾;
电解熔融碳酸钠制得钠。
1808年 电解制得镁、钙、锶、钡;
用钾还原无水硼酸制得硼。
戴维
贝采里乌斯
1823年 用钾还原四氟化硅制得硅
1825年奥斯特用钾汞齐还原无水氯化铝得到铝;
1886年莫瓦桑电解法制得氟。
一、电解原理
视频导学
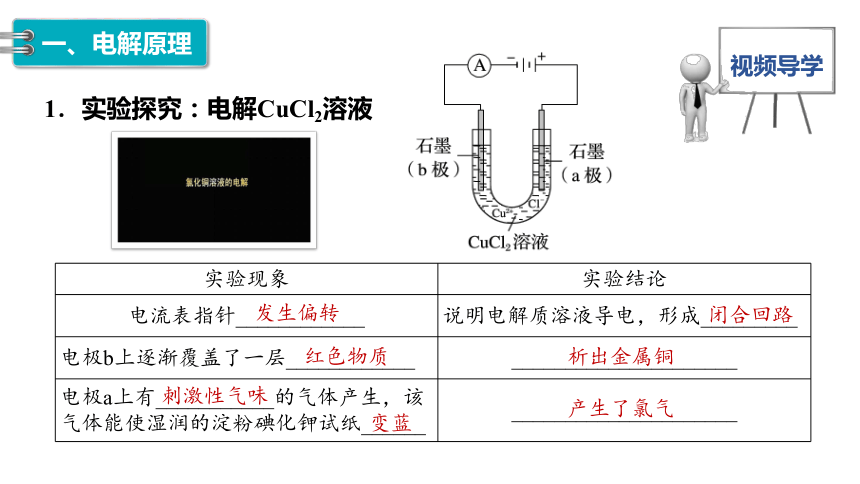
实验现象 实验结论
电流表指针____________ 说明电解质溶液导电,形成_________
电极b上逐渐覆盖了一层____________ _____________________
电极a上有___________的气体产生,该气体能使湿润的淀粉碘化钾试纸______ _____________________
1.实验探究:电解CuCl2溶液
发生偏转
红色物质
刺激性气味
变蓝
闭合回路
析出金属铜
产生了氯气
1.实验探究:电解CuCl2溶液
思考交流
(1)通电前,CuCl2溶液中存在哪些离子?
(2)通电后,溶液中Cl-的移动方向?
阳极电极反应式及反应类型?(“氧化反应”或“还原反应”,下同)
(3)通电后,溶液中Cu2+的移动方向?
阴极反应式及反应类型?
Cu2+、H+、Cl-、OH-
移向阳极
2Cl--2e-===Cl2↑ 氧化反应
移向阴极
Cu2++2e-===Cu 还原反应
一、电解原理
思考交流
(4)在CuCl2溶液中除了Cu2+和Cl-之外
还有H+和OH-,这两种离子为什么没得到或失去电子?
得电子能力:Cu2+>H+,故H+没有得到电子;
失电子能力:Cl->OH-,故OH-没有失去电子。
一、电解原理
1.实验探究:电解CuCl2溶液
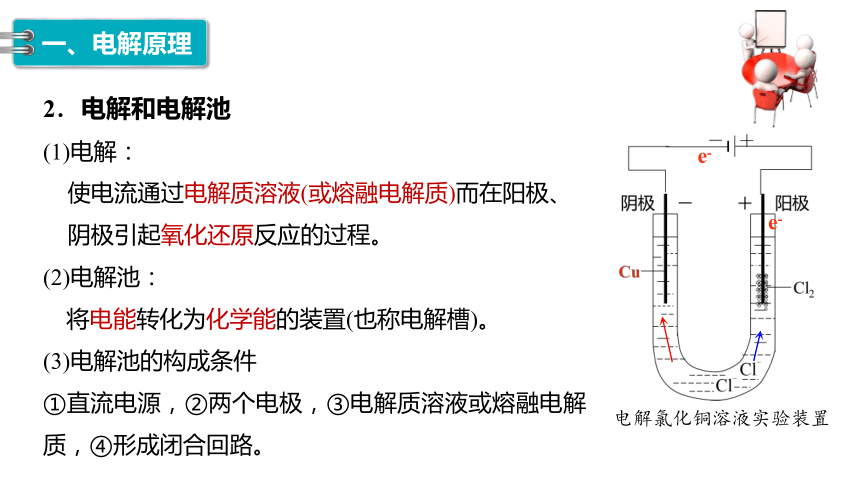
2.电解和电解池
(1)电解:
电解氯化铜溶液实验装置
e-
e-
使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
(2)电解池:
将电能转化为化学能的装置(也称电解槽)。
(3)电解池的构成条件
①直流电源,②两个电极,③电解质溶液或熔融电解质,④形成闭合回路。
一、电解原理
直流电源
阳极
阴极
阳离子
阴离子
e-
离子导体
e-
氧化反应
还原反应
失电子
得电子
一、电解原理
3.电解原理
特别提醒:
金属导电是物理变化;电解质溶液导电是化学变化,就是电解的过程。
思考交流
1.正误判断
(1)在电解池中与直流电源负极相连的电极是阴极
(2)电解质溶液的导电实验发生了化学变化
(3)原电池的负极和电解池的阳极均发生氧化反应
(4)电解池中电子的流向是负极→阴极→电解质溶液→阳极→正极
√
√
√
×
一、电解原理
思考交流
2.如图所示装置中属于电解池的是_______(填序号)。
③⑥
①②⑤无外接直流电源,不能构成电解池;
④无电解质溶液或熔融电解质;
⑦中蔗糖属于非电解质,不能构成电解池;
⑧没有形成闭合回路,不能构成电解池。
一、电解原理
思考交流
3.如图为用惰性电极电解CuCl2溶液并验证其产物的实验装置,则下列说法不正确的是
A.电源a极为负极
B.KI-淀粉溶液会变蓝色
C.Cl-向电极Ⅱ区域移动
D.电极Ⅰ上发生的电极反应为Cu-2e-===Cu2+
√
Cl2
Cu2++2e-===Cu
阳极
阴极
﹣ ﹢
一、电解原理
NaCl == Na+ +Cl-
H2O H+ + OH-
阳极 (C) :2Cl--2e-===Cl2↑
阴极 (Fe):2H+ + 2e-===H2↑
或2H2O + 2e- === H2↑+ 2OH-
如图所示,不同电极电解NaCl溶液,电极反应式如何书写?
已知:氧化性Cu2+ > H+ > Na+;还原性Cl- > OH-
问题讨论
阳极(Fe):Fe-2e- ===Fe2+
阴极 (C):2H+ +2e-===H2↑
电解规律?
二、电解规律
(1)阳极为惰性电极(如碳棒、Pt、稀土金属材料等)
①阳极:溶液中常见阴离子放电顺序
S2->I->Br->Cl->OH->含氧酸根离子
②阴极:溶液中常见阳离子放电顺序
Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>……
(2)阳极为活性电极(如Fe、Cu、Ag等)
电极本身先放电,电极反应式为M-ne-===Mn+
电极不放电
电极失电子放电
二、电解规律
1.放电规律
(1)电解水型
电解质 H2SO4 NaOH Na2SO4 阳极 反应式 2H2O-4e-== O2↑+4H+ 4OH--4e-== O2↑+2H2O 2H2O-4e-== O2↑+4H+ 阴极 反应式 4H++4e-===2H2↑ 4H2O+4e-===2H2↑+4OH- pH变化 减小 增大 不变
复原加入物质 加入H2O 思考填空
二、电解规律
2.用惰性电极电解电解质溶液的规律
思考填空
电解质 HCl CuCl2
阳极反应式 2Cl--2e-===Cl2↑ 阴极反应式 2H++2e-===H2↑ Cu2++2e-===Cu
pH变化 增大
复原加入物质 HCl CuCl2
二、电解规律
(2)电解电解质型
2.用惰性电极电解电解质溶液的规律
思考填空
电解质 NaCl CuSO4
阳极反应式 2Cl--2e-===Cl2↑ 2H2O-4e-===O2↑+4H+
阴极反应式 2H2O+2e-===H2↑+2OH- 2Cu2++4e-===2Cu
pH变化 增大 减小
复原加入物质 HCl CuO或CuCO3
二、电解规律
2.用惰性电极电解电解质溶液的规律
(3)电解质和水都发生电解型
思考交流
(一)电极产物的判断
1.下列各组中,每种电解质溶液电解时只生成氢气和氧气的是
A.HCl、CuCl2、Ba(OH)2 B.NaOH、CuSO4、H2SO4
C.NaOH、H2SO4、Ba(OH)2 D.NaBr、H2SO4、Ba(OH)2
√
电解电解质本身
放氢生碱
放氧生酸
二、电解规律
思考交流
(一)电极产物的判断
2.用惰性电极电解稀H2SO4、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上析出的物质分别是
A.H2和Cl2 B.Cu和Cl2
C.H2和O2 D.Cu和O2
√
放电顺序:阳离子为Cu2+>H+>Na+;阴离子为Cl->OH->S、N
最初阴极:Cu2++2e-===Cu,阳极:2Cl--2e-===Cl2↑
二、电解规律
思考交流
(二)电解后电解质溶液的复原
3.用惰性电极电解下列溶液一段时间后,再加入一定量的某种物质(方括号内物质),不能使溶液恢复到原来的成分和浓度的是
A.AgNO3溶液[AgOH(s)]
B.K2SO4溶液[H2O(l)]
C.KCl溶液[HCl(g)]
D.CuSO4溶液[CuCO3(s)]
√
阴极Ag+→Ag,阳极水电离出的OH-→ O2,应加入Ag2O使溶液复原
阳极OH-→O2,阴极H+ → H2,加水复原
阴极H+→H2,阳极Cl-→Cl2,加入一定量的HCl(g)能使溶液复原
阴极Cu2+→Cu,阳极OH-→O2,加入CuO或CuCO3(s)能使溶液复原
二、电解规律
思考交流
4.用石墨电解含有溶质0.1 mol的CuSO4溶液,在阴、阳两极各收集到2.24 L气体(标准状况下)后停止电解,若要恢复原电解质,溶液需要加入的物质和物质的量分别是_________________________、__________________________。
Cu(OH)2(或CuO、H2O)
0.1 mol
(或0.1 mol、0.1 mol)
二、电解规律
(二)电解后电解质溶液的复原
三、电解池电极反应式的书写
判断阴、阳极,分析阳极材料是惰性电极还是活性电极
分析电解质溶液或熔融电解质组成,找全离子分为阴、阳离子两组
确定阴极、阳极上的放电物质及放电顺序
分析电极反应,判断电极产物,写出电极反应式,要遵循原子守恒和电荷守恒
最后写出总反应方程式
阳极 阴极
放电顺序
H+>Na+
Cl->OH-
阳极 阴极
惰性电极
活性电极
思考交流
②③④
三、电解池电极反应式的书写
1.用惰性电极电解物质的量浓度相同、体积比为1∶3的CuSO4和NaCl的混合溶液,可能发生的反应有________(填序号)。
①2Cu2++2H2O ==== 2Cu+4H++O2↑
②Cu2++2Cl- ==== Cu+Cl2↑
③2Cl-+2H2O ==== H2↑+Cl2↑+2OH-
④2H2O ==== 2H2↑+O2↑
电解
电解
电解
电解
思考交流
2.用惰性电极电解MgCl2溶液
阳极反应式:__________________;
阴极反应式:_____________________________________;
总反应离子方程式:___________________________________________________。
2Cl--2e-===Cl2↑
2H2O+2e-+Mg2+===H2↑+Mg(OH)2↓
3.以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式:_____________________________;
阴极反应式:_________________;
总反应方程式:___________________________。
2Al-6e-+3H2O===Al2O3+6H+
2H++2e-===H2↑
三、电解池电极反应式的书写
Mg2++2Cl-+2H2O ==== Mg(OH)2↓+Cl2↑+H2↑
电解
2Al+3H2O ==== Al2O3+3H2↑
电解
自我测试
1.用铂电极电解下列溶液时,阴极和阳极上的主要产物分别为H2和O2的是
A.稀HCl溶液
B.稀Na2SO4溶液
C.CuCl2溶液
D.酸性AgNO3溶液
√
阴极产物为H2,阳极产物为Cl2
实际电解水
阴极产物为Cu,阳极产物为Cl2
阴极产物为Ag,阳极产物为O2
自我测试
2.下列关于如图所示电化学装置(碳棒作电极)的判断合理的是
A.若Z为氯化铜溶液,则X电极上发生还原反应
B.若Z为饱和食盐水,则X电极是阴极
C.若Z为氯化铜溶液,则Y电极上有红色物质析出
D.若Z为饱和食盐水,则碱在X电极附近生成
√
失电子
氧化反应
铜离子得电子生成单质铜
阳极 阴极
X电极:Cl-放电生成氯气
Y电极:H+得电子生成H2,OH-增加,则碱在Y电极附近生成
本节内容结束
第二节 电解池
第1课时 电解原理
第四章 化学反应与电能
空间站太阳能电池板
[学习目标]
化学 必修第一册 人民教育出版社
化学 必修第二册 人民教育出版社
1.了解电解及电解池的概念,熟悉电解池的构成条件。
2.理解电解原理及电解的规律,会判断电解的产物,掌握电解池电极反应式的书写(重、难点)。
新课导入
亚历山德罗·伏特
意大利物理学家
伏打电池
伏打电池的发现引起化学家利用电解法研究元素的兴趣。
1807年 电解熔融碳酸钾制得钾;
电解熔融碳酸钠制得钠。
1808年 电解制得镁、钙、锶、钡;
用钾还原无水硼酸制得硼。
戴维
贝采里乌斯
1823年 用钾还原四氟化硅制得硅
1825年奥斯特用钾汞齐还原无水氯化铝得到铝;
1886年莫瓦桑电解法制得氟。
一、电解原理
视频导学
实验现象 实验结论
电流表指针____________ 说明电解质溶液导电,形成_________
电极b上逐渐覆盖了一层____________ _____________________
电极a上有___________的气体产生,该气体能使湿润的淀粉碘化钾试纸______ _____________________
1.实验探究:电解CuCl2溶液
发生偏转
红色物质
刺激性气味
变蓝
闭合回路
析出金属铜
产生了氯气
1.实验探究:电解CuCl2溶液
思考交流
(1)通电前,CuCl2溶液中存在哪些离子?
(2)通电后,溶液中Cl-的移动方向?
阳极电极反应式及反应类型?(“氧化反应”或“还原反应”,下同)
(3)通电后,溶液中Cu2+的移动方向?
阴极反应式及反应类型?
Cu2+、H+、Cl-、OH-
移向阳极
2Cl--2e-===Cl2↑ 氧化反应
移向阴极
Cu2++2e-===Cu 还原反应
一、电解原理
思考交流
(4)在CuCl2溶液中除了Cu2+和Cl-之外
还有H+和OH-,这两种离子为什么没得到或失去电子?
得电子能力:Cu2+>H+,故H+没有得到电子;
失电子能力:Cl->OH-,故OH-没有失去电子。
一、电解原理
1.实验探究:电解CuCl2溶液
2.电解和电解池
(1)电解:
电解氯化铜溶液实验装置
e-
e-
使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
(2)电解池:
将电能转化为化学能的装置(也称电解槽)。
(3)电解池的构成条件
①直流电源,②两个电极,③电解质溶液或熔融电解质,④形成闭合回路。
一、电解原理
直流电源
阳极
阴极
阳离子
阴离子
e-
离子导体
e-
氧化反应
还原反应
失电子
得电子
一、电解原理
3.电解原理
特别提醒:
金属导电是物理变化;电解质溶液导电是化学变化,就是电解的过程。
思考交流
1.正误判断
(1)在电解池中与直流电源负极相连的电极是阴极
(2)电解质溶液的导电实验发生了化学变化
(3)原电池的负极和电解池的阳极均发生氧化反应
(4)电解池中电子的流向是负极→阴极→电解质溶液→阳极→正极
√
√
√
×
一、电解原理
思考交流
2.如图所示装置中属于电解池的是_______(填序号)。
③⑥
①②⑤无外接直流电源,不能构成电解池;
④无电解质溶液或熔融电解质;
⑦中蔗糖属于非电解质,不能构成电解池;
⑧没有形成闭合回路,不能构成电解池。
一、电解原理
思考交流
3.如图为用惰性电极电解CuCl2溶液并验证其产物的实验装置,则下列说法不正确的是
A.电源a极为负极
B.KI-淀粉溶液会变蓝色
C.Cl-向电极Ⅱ区域移动
D.电极Ⅰ上发生的电极反应为Cu-2e-===Cu2+
√
Cl2
Cu2++2e-===Cu
阳极
阴极
﹣ ﹢
一、电解原理
NaCl == Na+ +Cl-
H2O H+ + OH-
阳极 (C) :2Cl--2e-===Cl2↑
阴极 (Fe):2H+ + 2e-===H2↑
或2H2O + 2e- === H2↑+ 2OH-
如图所示,不同电极电解NaCl溶液,电极反应式如何书写?
已知:氧化性Cu2+ > H+ > Na+;还原性Cl- > OH-
问题讨论
阳极(Fe):Fe-2e- ===Fe2+
阴极 (C):2H+ +2e-===H2↑
电解规律?
二、电解规律
(1)阳极为惰性电极(如碳棒、Pt、稀土金属材料等)
①阳极:溶液中常见阴离子放电顺序
S2->I->Br->Cl->OH->含氧酸根离子
②阴极:溶液中常见阳离子放电顺序
Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>……
(2)阳极为活性电极(如Fe、Cu、Ag等)
电极本身先放电,电极反应式为M-ne-===Mn+
电极不放电
电极失电子放电
二、电解规律
1.放电规律
(1)电解水型
电解质 H2SO4 NaOH Na2SO4 阳极 反应式 2H2O-4e-== O2↑+4H+ 4OH--4e-== O2↑+2H2O 2H2O-4e-== O2↑+4H+ 阴极 反应式 4H++4e-===2H2↑ 4H2O+4e-===2H2↑+4OH- pH变化 减小 增大 不变
复原加入物质 加入H2O 思考填空
二、电解规律
2.用惰性电极电解电解质溶液的规律
思考填空
电解质 HCl CuCl2
阳极反应式 2Cl--2e-===Cl2↑ 阴极反应式 2H++2e-===H2↑ Cu2++2e-===Cu
pH变化 增大
复原加入物质 HCl CuCl2
二、电解规律
(2)电解电解质型
2.用惰性电极电解电解质溶液的规律
思考填空
电解质 NaCl CuSO4
阳极反应式 2Cl--2e-===Cl2↑ 2H2O-4e-===O2↑+4H+
阴极反应式 2H2O+2e-===H2↑+2OH- 2Cu2++4e-===2Cu
pH变化 增大 减小
复原加入物质 HCl CuO或CuCO3
二、电解规律
2.用惰性电极电解电解质溶液的规律
(3)电解质和水都发生电解型
思考交流
(一)电极产物的判断
1.下列各组中,每种电解质溶液电解时只生成氢气和氧气的是
A.HCl、CuCl2、Ba(OH)2 B.NaOH、CuSO4、H2SO4
C.NaOH、H2SO4、Ba(OH)2 D.NaBr、H2SO4、Ba(OH)2
√
电解电解质本身
放氢生碱
放氧生酸
二、电解规律
思考交流
(一)电极产物的判断
2.用惰性电极电解稀H2SO4、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上析出的物质分别是
A.H2和Cl2 B.Cu和Cl2
C.H2和O2 D.Cu和O2
√
放电顺序:阳离子为Cu2+>H+>Na+;阴离子为Cl->OH->S、N
最初阴极:Cu2++2e-===Cu,阳极:2Cl--2e-===Cl2↑
二、电解规律
思考交流
(二)电解后电解质溶液的复原
3.用惰性电极电解下列溶液一段时间后,再加入一定量的某种物质(方括号内物质),不能使溶液恢复到原来的成分和浓度的是
A.AgNO3溶液[AgOH(s)]
B.K2SO4溶液[H2O(l)]
C.KCl溶液[HCl(g)]
D.CuSO4溶液[CuCO3(s)]
√
阴极Ag+→Ag,阳极水电离出的OH-→ O2,应加入Ag2O使溶液复原
阳极OH-→O2,阴极H+ → H2,加水复原
阴极H+→H2,阳极Cl-→Cl2,加入一定量的HCl(g)能使溶液复原
阴极Cu2+→Cu,阳极OH-→O2,加入CuO或CuCO3(s)能使溶液复原
二、电解规律
思考交流
4.用石墨电解含有溶质0.1 mol的CuSO4溶液,在阴、阳两极各收集到2.24 L气体(标准状况下)后停止电解,若要恢复原电解质,溶液需要加入的物质和物质的量分别是_________________________、__________________________。
Cu(OH)2(或CuO、H2O)
0.1 mol
(或0.1 mol、0.1 mol)
二、电解规律
(二)电解后电解质溶液的复原
三、电解池电极反应式的书写
判断阴、阳极,分析阳极材料是惰性电极还是活性电极
分析电解质溶液或熔融电解质组成,找全离子分为阴、阳离子两组
确定阴极、阳极上的放电物质及放电顺序
分析电极反应,判断电极产物,写出电极反应式,要遵循原子守恒和电荷守恒
最后写出总反应方程式
阳极 阴极
放电顺序
H+>Na+
Cl->OH-
阳极 阴极
惰性电极
活性电极
思考交流
②③④
三、电解池电极反应式的书写
1.用惰性电极电解物质的量浓度相同、体积比为1∶3的CuSO4和NaCl的混合溶液,可能发生的反应有________(填序号)。
①2Cu2++2H2O ==== 2Cu+4H++O2↑
②Cu2++2Cl- ==== Cu+Cl2↑
③2Cl-+2H2O ==== H2↑+Cl2↑+2OH-
④2H2O ==== 2H2↑+O2↑
电解
电解
电解
电解
思考交流
2.用惰性电极电解MgCl2溶液
阳极反应式:__________________;
阴极反应式:_____________________________________;
总反应离子方程式:___________________________________________________。
2Cl--2e-===Cl2↑
2H2O+2e-+Mg2+===H2↑+Mg(OH)2↓
3.以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式:_____________________________;
阴极反应式:_________________;
总反应方程式:___________________________。
2Al-6e-+3H2O===Al2O3+6H+
2H++2e-===H2↑
三、电解池电极反应式的书写
Mg2++2Cl-+2H2O ==== Mg(OH)2↓+Cl2↑+H2↑
电解
2Al+3H2O ==== Al2O3+3H2↑
电解
自我测试
1.用铂电极电解下列溶液时,阴极和阳极上的主要产物分别为H2和O2的是
A.稀HCl溶液
B.稀Na2SO4溶液
C.CuCl2溶液
D.酸性AgNO3溶液
√
阴极产物为H2,阳极产物为Cl2
实际电解水
阴极产物为Cu,阳极产物为Cl2
阴极产物为Ag,阳极产物为O2
自我测试
2.下列关于如图所示电化学装置(碳棒作电极)的判断合理的是
A.若Z为氯化铜溶液,则X电极上发生还原反应
B.若Z为饱和食盐水,则X电极是阴极
C.若Z为氯化铜溶液,则Y电极上有红色物质析出
D.若Z为饱和食盐水,则碱在X电极附近生成
√
失电子
氧化反应
铜离子得电子生成单质铜
阳极 阴极
X电极:Cl-放电生成氯气
Y电极:H+得电子生成H2,OH-增加,则碱在Y电极附近生成
本节内容结束
