4.2 第2课时 电解原理的应用(共26张PPT) -2023-2024学年高二化学人教版选择性必修1课件
文档属性
| 名称 | 4.2 第2课时 电解原理的应用(共26张PPT) -2023-2024学年高二化学人教版选择性必修1课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-29 17:33:32 | ||
图片预览





文档简介
(共26张PPT)
空间站太阳能电池板
第二节 电解池
第2课时 电解原理的应用
第四章 化学反应与电能
[学习目标]
1.认识电解原理在氯碱工业、电镀及电冶金等工业生产中的实际应用(重点)。
2.深化对电解原理的理解(重、难点)。
化学 必修第一册 人民教育出版社
化学 必修第二册 人民教育出版社
温故知新
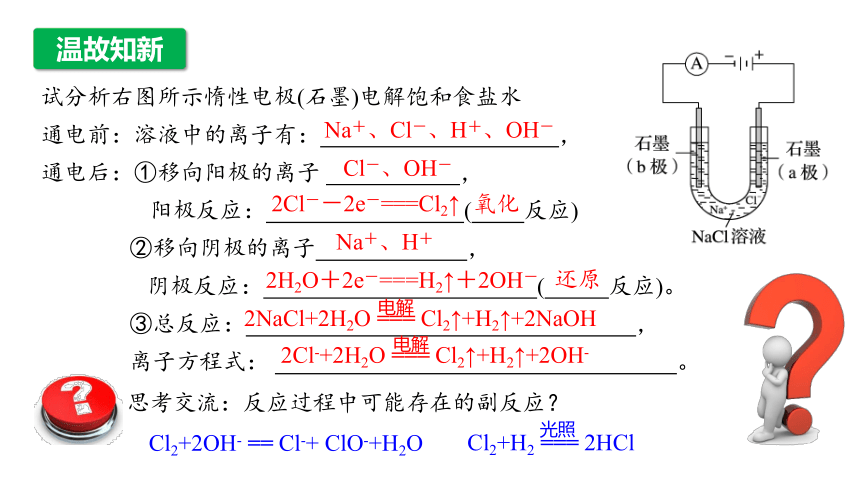
试分析右图所示惰性电极(石墨)电解饱和食盐水
通电前:溶液中的离子有: ,
通电后:①移向阳极的离子 ,
阳极反应: ( 反应)
②移向阴极的离子 ,
阴极反应: ( 反应)。
③总反应: ,
离子方程式: 。
2NaCl+2H2O === Cl2↑+H2↑+2NaOH
电解
2Cl-+2H2O === Cl2↑+H2↑+2OH-
电解
思考交流:反应过程中可能存在的副反应?
Cl2+2OH- == Cl-+ ClO-+H2O
Cl2+H2 === 2HCl
光照
Na+、Cl-、H+、OH-
Cl-、OH-
2Cl--2e-===Cl2↑
氧化
Na+、H+
2H2O+2e-===H2↑+2OH-
还原
一、电解饱和食盐水——氯碱工业
1. 氯碱工业的概念
习惯上把电解饱和食盐水的工业生产叫做氯碱工业
重要化工原料
阳极反应:2Cl--2e-===Cl2↑
阴极反应:2H2O+2e-===H2↑+2OH-
总反应:
2Cl-+2H2O === Cl2↑+H2↑+2OH-
电解
2. 电解饱和食盐水的原理(用惰性电极电解)
通电后Cl-、OH-移向阳极,Cl-放电;
Na+、H+移向阴极, H+放电;
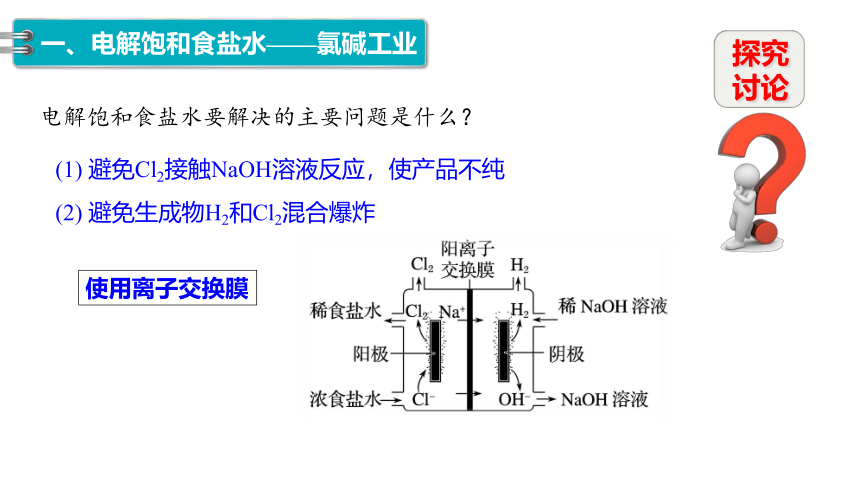
(2) 避免生成物H2和Cl2混合爆炸
(1) 避免Cl2接触NaOH溶液反应,使产品不纯
电解饱和食盐水要解决的主要问题是什么?
探究讨论
使用离子交换膜
一、电解饱和食盐水——氯碱工业
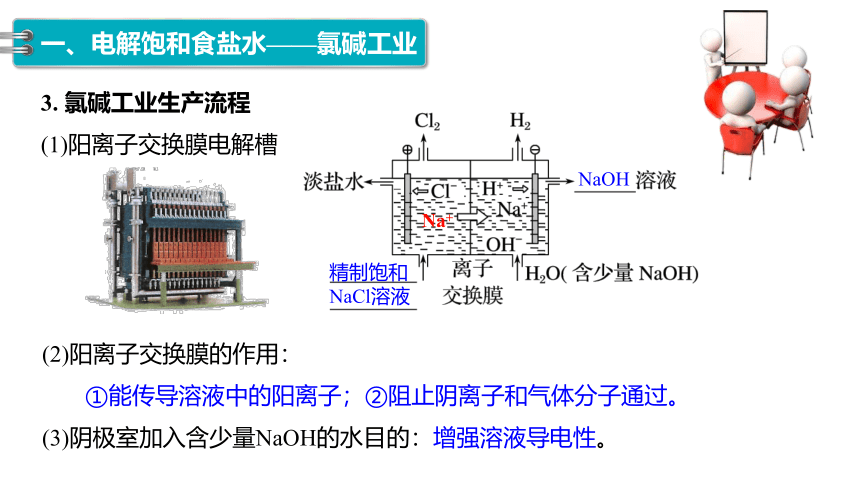
3. 氯碱工业生产流程
(1)阳离子交换膜电解槽
(2)阳离子交换膜的作用:
①能传导溶液中的阳离子;②阻止阴离子和气体分子通过。
(3)阴极室加入含少量NaOH的水目的:增强溶液导电性。
NaOH
精制饱和
NaCl溶液
Na+
一、电解饱和食盐水——氯碱工业
4. 氯碱工业产品及其应用
(1)氯碱工业产品主要有NaOH、Cl2、H2、盐酸、含氯漂白剂等。
(2)以电解饱和食盐水为原理的氯碱工业产品在有机合成、造纸、玻璃、肥皂、纺织、印染、农药、金属冶炼等领域中广泛应用。
一、电解饱和食盐水——氯碱工业
思考交流
1.正误判断
(1)电解饱和食盐水时,阴极发生氧化反应:2Cl--2e-===Cl2↑
(2)氯碱工业电解槽中滴入酚酞溶液,变红色的区域为阳极区
(3)电解饱和食盐水时,阳极和阴极都可以选择金属材料(如铁)
(4)电解饱和NaCl溶液可以制取金属钠
×
×
×
×
一、电解饱和食盐水——氯碱工业
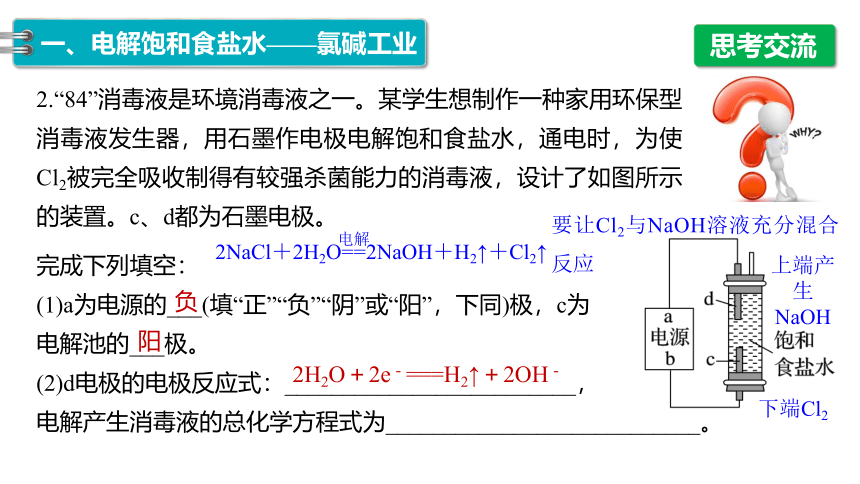
2.“84”消毒液是环境消毒液之一。某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和食盐水,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置。c、d都为石墨电极。
完成下列填空:
(1)a为电源的___(填“正”“负”“阴”或“阳”,下同)极,c为
电解池的___极。
(2)d电极的电极反应式:_________________________,
电解产生消毒液的总化学方程式为___________________________。
负
阳
2H2O+2e-===H2↑+2OH-
要让Cl2与NaOH溶液充分混合反应
2NaCl+2H2O==2NaOH+H2↑+Cl2↑
电解
下端Cl2
上端产生
NaOH
一、电解饱和食盐水——氯碱工业
思考交流
3.工业上常利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。电极B区电解液为______(填化学式)溶液,阳极电极反应式为__________________,电解过程中Li+向电极___(填“A”或“B”)迁移。
LiOH
2H2O+2e-===H2↑+2OH-
阴极
阳极
2Cl--2e-===Cl2↑
B
一、电解饱和食盐水——氯碱工业
思考交流
二、 电镀 电解精炼
如图所示 试分析在铁制钥匙上面镀铜
阳极材料:
电极反应:
阴极材料:
电极反应:
探究讨论
镀层金属Cu
Cu-2e-===Cu2+;
镀件铁制钥匙
Cu2++2e-===Cu。
电解质溶液Cu2+浓度如何变化?
1.电镀
(1)电镀:利用电解原理在某些金属表面镀上一薄层其他金属或合金的加工工艺。
(2)目的:使金属增强抗腐蚀能力,增加表面硬度和美观。
(3)电镀池的构成(在铁制钥匙上面镀铜):
阳极材料:镀层金属Cu
电极反应:Cu-2e-===Cu2+;
阴极材料:镀件铁制钥匙
电极反应:Cu2++2e-===Cu。
电解质溶液:Cu2+浓度保持不变。
二、 电镀 电解精炼
粗铜中含锌、银、金等杂质,结合电解原理如何设计电解池进行粗铜的精炼
问题探究
阴极
阳极
粗铜
纯铜
粗铜:Cu-2e-===Cu2+;纯铜:Cu2++2e-===Cu
CuSO4溶液
阳极粗铜中金属锌失电子吗?
二、 电镀 电解精炼
2. 电解精炼(粗铜含锌、银、金等杂质)
电解质溶液中Cu2+浓度减小
主要反应:Cu(粗铜)-2e-===Cu2+
Ag、Au等活动性较弱的金属在阳极沉积形成阳极泥
Cu2++2e-===Cu(精铜)
阳极
(粗铜)
其他反应:Zn-2e-===Zn2+等
阴极
(精铜)
二、 电镀 电解精炼
思考交流
1.正误判断
(1)在Fe上电镀Zn,应用Zn作阳极,用ZnSO4溶液作电镀液
(2)电解精炼铜时,粗铜作阳极,活泼性比Cu弱的杂质金属成为阳极泥沉在阳极区
(3)电解精炼铜时,电解质溶液的成分不发生变化
(4)电镀过程相当于金属的“迁移”,属于物理变化
√
√
×
×
二、 电镀 电解精炼
2.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,
可用电解法制备高纯度的镍,思考回答下列问题:
(1)阳极发生_____反应,其电极反应式:_____________________
________________________________。
(2)电解过程中,阳极减少的质量与阴极增加的质量_______ (填“相等”或“不相等”)。
(3)电解后,溶液中存在的金属阳离子有___________、Ni2+等。
(4)电解后,电解槽底部含有________等金属。
氧化
Ni-2e-===Ni2+,
Fe-2e- ===Fe2+,Zn-2e-===Zn2+
不相等
阳极Fe、Zn、Ni失电子,阴极析出镍,得失电子守恒
Fe2+、Zn2+
Cu、Pt
二、 电镀 电解精炼
思考交流
3.利用电解法制备超细银粉的示意图如下,Ag2SO4-H2SO4电解液中添加Ti3+/Ti4+,解决了高电流密度下阴极发生析氢反应的问题,并实现Ti3+/Ti4+循环利用。请结合化学用语解释阴极区附近生成超细银粉的原因:
____________________________________________________。
阳极:Ag-e-===Ag+,生成的Ag+与电解质溶液中的结合生成微溶物Ag2SO4,使得电解质溶液中c(Ag+)并不高,且存在Ag2SO4(s) 2Ag+(aq)+ (aq)。
阴极:Ti4++e-===Ti3+,生成的Ti3+具有较强的还原性,在阴极区附近发生反应Ti3++Ag+===Ag+Ti4+,c(Ag+)降低,促进Ag2SO4溶解,缓慢释放的Ag+被还原得到超细银粉
二、 电镀 电解精炼
思考交流
三、 电冶金
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
2Cl- - 2e- = Cl2
氧化反应
还原反应
Na++ e- = Na
2NaCl(熔融)===2Na + Cl2↑
电解
问题讨论
试分析惰性电极电解熔融氯化钠,离子迁移方向,电子移动路线,阴、阳极半反应
1. 电冶金的原理
Mn++ne-===M
2. 常用电解法制备的金属
电解法用于冶炼较活泼的金属,如钠、钙、镁、铝等。
(熔融)
电解
Mg + Cl2↑
MgCl2
阳极:2Cl- - 2e- == Cl2 ↑
阴极:Mg2++ 2e- == Mg
阳极:6O2- - 12e- == 3O2↑
阴极:Al3++3e- == Al
电解
冰晶石
2Al2O3(熔融) 4Al+ 3O2↑
2NaCl(熔融) 2Na + Cl2↑
电解
阳极:2Cl- - 2e- == Cl2 ↑
阴极:Na++ e- == Na
三、 电冶金
3. 实例分析——冶炼金属钠
(1)电解熔融NaCl装置示意图
阴极环绕在阳极外面,两极之间用隔膜D隔开。
NaCl
Cl2
阴
阳
阴
(2)电解时的反应
阳极:2Cl--2e-===Cl2↑;
阴极:2Na++2e-===2Na;
总反应:
__________________________。
2NaCl(熔融)===2Na + Cl2↑
电解
三、 电冶金
思考交流
1.正误判断
(1)活泼的金属往往采用电解法冶炼
(2)工业上常用钠与熔融的氯化镁反应制取金属镁
(3)工业冶炼金属铝时,电解熔融态AlCl3
2.金属镁的工业制备是电解熔融________(填“MgCl2”或“MgO”),原因是___________________________________。
MgCl2
熔融氧化镁需要的温度较高、耗能较大
√
×
×
三、 电冶金
3.如图为工业电解熔融氧化铝冶炼铝的装置示意图。
(1)写出电解时的电极反应式及总反应方程式:_____________________
_________________________________________________________。
(2)资料表明Al2O3的熔点为2 054 ℃,冰晶石(Na3AlF6)的熔点为1 000 ℃,用电解Al2O3制取金属铝时会加入冰晶石,其作用是____________________。
(3)该电解过程要在1 000 ℃以上进行,工业上冶炼铝过程中会发生阳极损耗,
试分析发生阳极损耗原因:
_______________________________________
_______________________________________。
阳极:6O2--12e-===3O2↑
阴极:4Al3++12e-==4Al
2Al2O3(熔融)===4Al +3O2↑
电解
作助熔剂,降低熔点
高温下,阳极产生的氧气与碳块反应生成CO、CO2
三、 电冶金
思考交流
自我测试
1.如图为电解饱和食盐水的简单装置,下列有关说法正确的是
A.电解一段时间后,向蛋壳内的溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕的铁丝上发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
√
碳棒作阳极:2Cl--2e-===Cl2↑,溶液的碱性不增强
氢气
阴极:2H+-+2e-===H2↑ 还原反应
自我测试
2.利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是
A.通电后,Ag+向阳极移动
B.银片与电源负极相连
C.该电解池的阴极反应可表示为Ag++e-===Ag
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
√
阳极
镀层不致密,反接后阳极上Cu、Ag均会溶解,铜牌不可能恢复如初
Ag+移向阴极
+ -
自我测试
3.21世纪是钛的世纪,在800~1 000 ℃时电解TiO2可制得钛,装置如图所示,下列叙述正确的是
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为TiO2+4e-===Ti+2O2-
D.每生成0.1 mol Ti,转移0.2 mol电子
√
负极 正极
0.4 mol
阴极 阳极
还原反应 氧化反应
本节内容结束
空间站太阳能电池板
第二节 电解池
第2课时 电解原理的应用
第四章 化学反应与电能
[学习目标]
1.认识电解原理在氯碱工业、电镀及电冶金等工业生产中的实际应用(重点)。
2.深化对电解原理的理解(重、难点)。
化学 必修第一册 人民教育出版社
化学 必修第二册 人民教育出版社
温故知新
试分析右图所示惰性电极(石墨)电解饱和食盐水
通电前:溶液中的离子有: ,
通电后:①移向阳极的离子 ,
阳极反应: ( 反应)
②移向阴极的离子 ,
阴极反应: ( 反应)。
③总反应: ,
离子方程式: 。
2NaCl+2H2O === Cl2↑+H2↑+2NaOH
电解
2Cl-+2H2O === Cl2↑+H2↑+2OH-
电解
思考交流:反应过程中可能存在的副反应?
Cl2+2OH- == Cl-+ ClO-+H2O
Cl2+H2 === 2HCl
光照
Na+、Cl-、H+、OH-
Cl-、OH-
2Cl--2e-===Cl2↑
氧化
Na+、H+
2H2O+2e-===H2↑+2OH-
还原
一、电解饱和食盐水——氯碱工业
1. 氯碱工业的概念
习惯上把电解饱和食盐水的工业生产叫做氯碱工业
重要化工原料
阳极反应:2Cl--2e-===Cl2↑
阴极反应:2H2O+2e-===H2↑+2OH-
总反应:
2Cl-+2H2O === Cl2↑+H2↑+2OH-
电解
2. 电解饱和食盐水的原理(用惰性电极电解)
通电后Cl-、OH-移向阳极,Cl-放电;
Na+、H+移向阴极, H+放电;
(2) 避免生成物H2和Cl2混合爆炸
(1) 避免Cl2接触NaOH溶液反应,使产品不纯
电解饱和食盐水要解决的主要问题是什么?
探究讨论
使用离子交换膜
一、电解饱和食盐水——氯碱工业
3. 氯碱工业生产流程
(1)阳离子交换膜电解槽
(2)阳离子交换膜的作用:
①能传导溶液中的阳离子;②阻止阴离子和气体分子通过。
(3)阴极室加入含少量NaOH的水目的:增强溶液导电性。
NaOH
精制饱和
NaCl溶液
Na+
一、电解饱和食盐水——氯碱工业
4. 氯碱工业产品及其应用
(1)氯碱工业产品主要有NaOH、Cl2、H2、盐酸、含氯漂白剂等。
(2)以电解饱和食盐水为原理的氯碱工业产品在有机合成、造纸、玻璃、肥皂、纺织、印染、农药、金属冶炼等领域中广泛应用。
一、电解饱和食盐水——氯碱工业
思考交流
1.正误判断
(1)电解饱和食盐水时,阴极发生氧化反应:2Cl--2e-===Cl2↑
(2)氯碱工业电解槽中滴入酚酞溶液,变红色的区域为阳极区
(3)电解饱和食盐水时,阳极和阴极都可以选择金属材料(如铁)
(4)电解饱和NaCl溶液可以制取金属钠
×
×
×
×
一、电解饱和食盐水——氯碱工业
2.“84”消毒液是环境消毒液之一。某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和食盐水,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置。c、d都为石墨电极。
完成下列填空:
(1)a为电源的___(填“正”“负”“阴”或“阳”,下同)极,c为
电解池的___极。
(2)d电极的电极反应式:_________________________,
电解产生消毒液的总化学方程式为___________________________。
负
阳
2H2O+2e-===H2↑+2OH-
要让Cl2与NaOH溶液充分混合反应
2NaCl+2H2O==2NaOH+H2↑+Cl2↑
电解
下端Cl2
上端产生
NaOH
一、电解饱和食盐水——氯碱工业
思考交流
3.工业上常利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。电极B区电解液为______(填化学式)溶液,阳极电极反应式为__________________,电解过程中Li+向电极___(填“A”或“B”)迁移。
LiOH
2H2O+2e-===H2↑+2OH-
阴极
阳极
2Cl--2e-===Cl2↑
B
一、电解饱和食盐水——氯碱工业
思考交流
二、 电镀 电解精炼
如图所示 试分析在铁制钥匙上面镀铜
阳极材料:
电极反应:
阴极材料:
电极反应:
探究讨论
镀层金属Cu
Cu-2e-===Cu2+;
镀件铁制钥匙
Cu2++2e-===Cu。
电解质溶液Cu2+浓度如何变化?
1.电镀
(1)电镀:利用电解原理在某些金属表面镀上一薄层其他金属或合金的加工工艺。
(2)目的:使金属增强抗腐蚀能力,增加表面硬度和美观。
(3)电镀池的构成(在铁制钥匙上面镀铜):
阳极材料:镀层金属Cu
电极反应:Cu-2e-===Cu2+;
阴极材料:镀件铁制钥匙
电极反应:Cu2++2e-===Cu。
电解质溶液:Cu2+浓度保持不变。
二、 电镀 电解精炼
粗铜中含锌、银、金等杂质,结合电解原理如何设计电解池进行粗铜的精炼
问题探究
阴极
阳极
粗铜
纯铜
粗铜:Cu-2e-===Cu2+;纯铜:Cu2++2e-===Cu
CuSO4溶液
阳极粗铜中金属锌失电子吗?
二、 电镀 电解精炼
2. 电解精炼(粗铜含锌、银、金等杂质)
电解质溶液中Cu2+浓度减小
主要反应:Cu(粗铜)-2e-===Cu2+
Ag、Au等活动性较弱的金属在阳极沉积形成阳极泥
Cu2++2e-===Cu(精铜)
阳极
(粗铜)
其他反应:Zn-2e-===Zn2+等
阴极
(精铜)
二、 电镀 电解精炼
思考交流
1.正误判断
(1)在Fe上电镀Zn,应用Zn作阳极,用ZnSO4溶液作电镀液
(2)电解精炼铜时,粗铜作阳极,活泼性比Cu弱的杂质金属成为阳极泥沉在阳极区
(3)电解精炼铜时,电解质溶液的成分不发生变化
(4)电镀过程相当于金属的“迁移”,属于物理变化
√
√
×
×
二、 电镀 电解精炼
2.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,
可用电解法制备高纯度的镍,思考回答下列问题:
(1)阳极发生_____反应,其电极反应式:_____________________
________________________________。
(2)电解过程中,阳极减少的质量与阴极增加的质量_______ (填“相等”或“不相等”)。
(3)电解后,溶液中存在的金属阳离子有___________、Ni2+等。
(4)电解后,电解槽底部含有________等金属。
氧化
Ni-2e-===Ni2+,
Fe-2e- ===Fe2+,Zn-2e-===Zn2+
不相等
阳极Fe、Zn、Ni失电子,阴极析出镍,得失电子守恒
Fe2+、Zn2+
Cu、Pt
二、 电镀 电解精炼
思考交流
3.利用电解法制备超细银粉的示意图如下,Ag2SO4-H2SO4电解液中添加Ti3+/Ti4+,解决了高电流密度下阴极发生析氢反应的问题,并实现Ti3+/Ti4+循环利用。请结合化学用语解释阴极区附近生成超细银粉的原因:
____________________________________________________。
阳极:Ag-e-===Ag+,生成的Ag+与电解质溶液中的结合生成微溶物Ag2SO4,使得电解质溶液中c(Ag+)并不高,且存在Ag2SO4(s) 2Ag+(aq)+ (aq)。
阴极:Ti4++e-===Ti3+,生成的Ti3+具有较强的还原性,在阴极区附近发生反应Ti3++Ag+===Ag+Ti4+,c(Ag+)降低,促进Ag2SO4溶解,缓慢释放的Ag+被还原得到超细银粉
二、 电镀 电解精炼
思考交流
三、 电冶金
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
2Cl- - 2e- = Cl2
氧化反应
还原反应
Na++ e- = Na
2NaCl(熔融)===2Na + Cl2↑
电解
问题讨论
试分析惰性电极电解熔融氯化钠,离子迁移方向,电子移动路线,阴、阳极半反应
1. 电冶金的原理
Mn++ne-===M
2. 常用电解法制备的金属
电解法用于冶炼较活泼的金属,如钠、钙、镁、铝等。
(熔融)
电解
Mg + Cl2↑
MgCl2
阳极:2Cl- - 2e- == Cl2 ↑
阴极:Mg2++ 2e- == Mg
阳极:6O2- - 12e- == 3O2↑
阴极:Al3++3e- == Al
电解
冰晶石
2Al2O3(熔融) 4Al+ 3O2↑
2NaCl(熔融) 2Na + Cl2↑
电解
阳极:2Cl- - 2e- == Cl2 ↑
阴极:Na++ e- == Na
三、 电冶金
3. 实例分析——冶炼金属钠
(1)电解熔融NaCl装置示意图
阴极环绕在阳极外面,两极之间用隔膜D隔开。
NaCl
Cl2
阴
阳
阴
(2)电解时的反应
阳极:2Cl--2e-===Cl2↑;
阴极:2Na++2e-===2Na;
总反应:
__________________________。
2NaCl(熔融)===2Na + Cl2↑
电解
三、 电冶金
思考交流
1.正误判断
(1)活泼的金属往往采用电解法冶炼
(2)工业上常用钠与熔融的氯化镁反应制取金属镁
(3)工业冶炼金属铝时,电解熔融态AlCl3
2.金属镁的工业制备是电解熔融________(填“MgCl2”或“MgO”),原因是___________________________________。
MgCl2
熔融氧化镁需要的温度较高、耗能较大
√
×
×
三、 电冶金
3.如图为工业电解熔融氧化铝冶炼铝的装置示意图。
(1)写出电解时的电极反应式及总反应方程式:_____________________
_________________________________________________________。
(2)资料表明Al2O3的熔点为2 054 ℃,冰晶石(Na3AlF6)的熔点为1 000 ℃,用电解Al2O3制取金属铝时会加入冰晶石,其作用是____________________。
(3)该电解过程要在1 000 ℃以上进行,工业上冶炼铝过程中会发生阳极损耗,
试分析发生阳极损耗原因:
_______________________________________
_______________________________________。
阳极:6O2--12e-===3O2↑
阴极:4Al3++12e-==4Al
2Al2O3(熔融)===4Al +3O2↑
电解
作助熔剂,降低熔点
高温下,阳极产生的氧气与碳块反应生成CO、CO2
三、 电冶金
思考交流
自我测试
1.如图为电解饱和食盐水的简单装置,下列有关说法正确的是
A.电解一段时间后,向蛋壳内的溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕的铁丝上发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
√
碳棒作阳极:2Cl--2e-===Cl2↑,溶液的碱性不增强
氢气
阴极:2H+-+2e-===H2↑ 还原反应
自我测试
2.利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是
A.通电后,Ag+向阳极移动
B.银片与电源负极相连
C.该电解池的阴极反应可表示为Ag++e-===Ag
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
√
阳极
镀层不致密,反接后阳极上Cu、Ag均会溶解,铜牌不可能恢复如初
Ag+移向阴极
+ -
自我测试
3.21世纪是钛的世纪,在800~1 000 ℃时电解TiO2可制得钛,装置如图所示,下列叙述正确的是
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为TiO2+4e-===Ti+2O2-
D.每生成0.1 mol Ti,转移0.2 mol电子
√
负极 正极
0.4 mol
阴极 阳极
还原反应 氧化反应
本节内容结束
