4.2元素周期律 课件(共30张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 4.2元素周期律 课件(共30张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 891.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-30 10:17:24 | ||
图片预览







文档简介
(共30张PPT)
第四章
第二节元素周期律
第二节 元素周期律
思考并讨论:
随着原子序数的递增,
原子的核外电子层排布呈现什么规律性的变化?
原子半径呈现什么规律性的变化?
元素的化合价呈现什么规律性的变化?
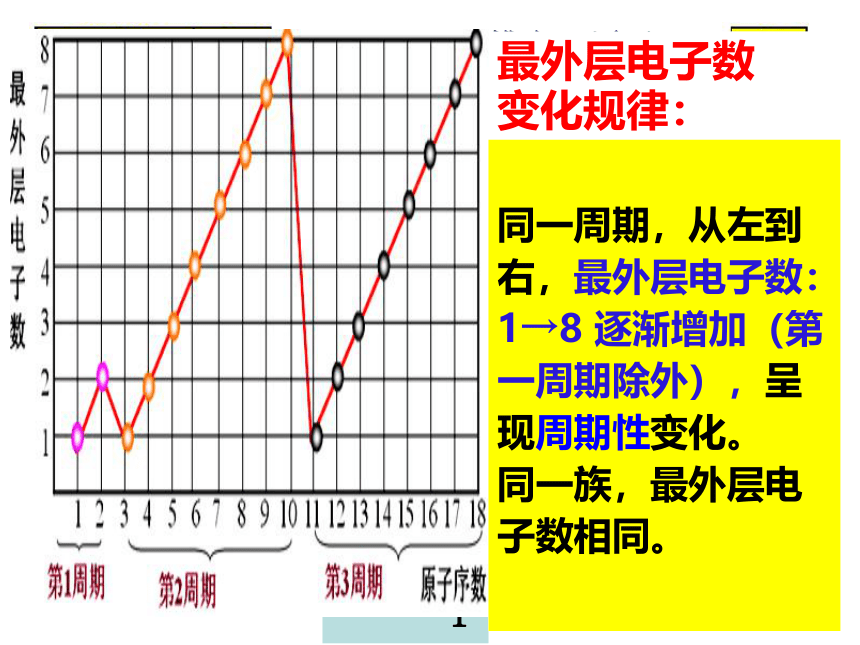
核外电子排布、原子半径和主要化合价
最外层电子数1→2
最外层电子数1→8
最外层电子数1→8
最外层电子数
变化规律:
同一周期,从左到右,最外层电子数:1→8 逐渐增加(第一周期除外),呈现周期性变化。
同一族,最外层电子数相同。
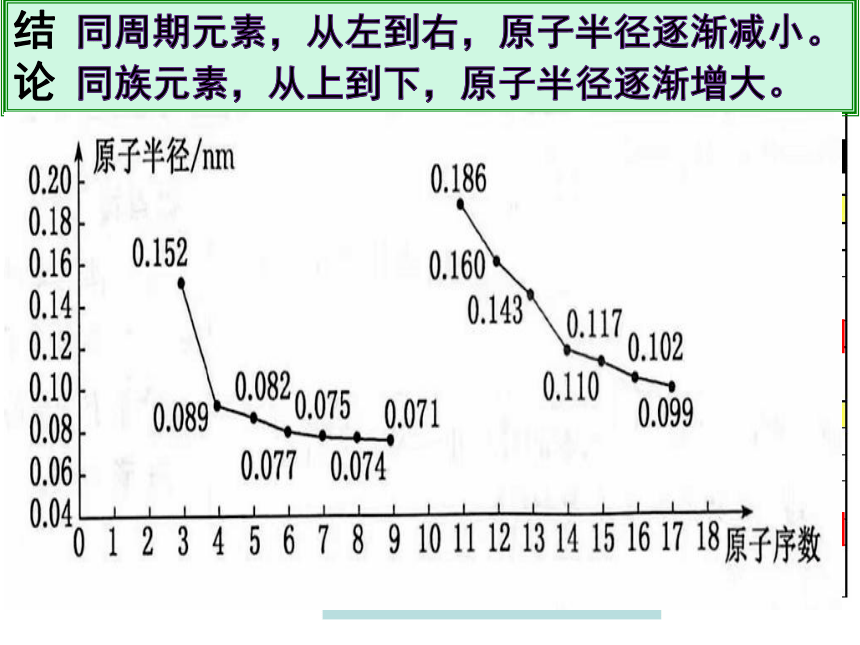
1~18号元素的核外电子排布、原子半径和主要化合价
原子半径 大→小
原子半径 大→小
结 同周期元素,从左到右,原子半径逐渐减小。
论 同族元素,从上到下,原子半径逐渐增大。
1~18号元素的核外电子排布、原子半径和主要化合价
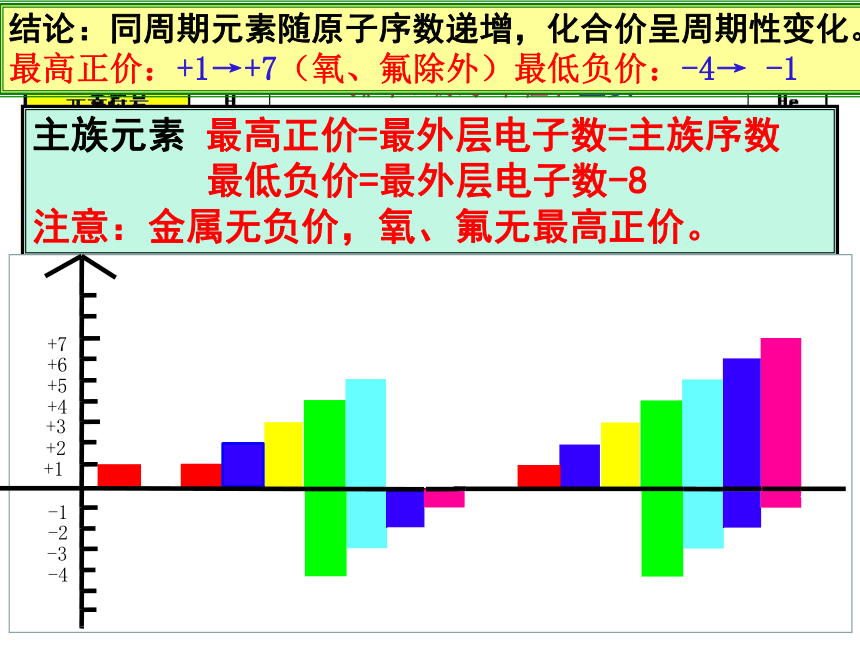
主要化合价:正价+1→0
主要化合价:正价+1→+5,
负价:-4 →-1 → 0
主要化合价:正价+1→+7,
负价:-4 →-1→0
结论:同周期元素随原子序数递增,化合价呈周期性变化。最高正价:+1→+7(氧、氟除外)最低负价:-4→ -1
主族元素 最高正价=最外层电子数=主族序数
最低负价=最外层电子数-8
注意:金属无负价,氧、氟无最高正价。
+1
+2
+3
+4
+5
+6
+7
-1
-2
-3
-4
结论2、随着元素原子序数的递增,电子层相同的元素主要化合价呈现周期性的变化。
①最高正价 = 最外层电子数
(氧,氟例外,氧、氟无最高正价)
③最低负价 = 最外层电子数—8
或缺几个电子稳定,最低负价则为几。
(金属元素无负价,H例外)
②当最外层电子数≥4,则出现负价
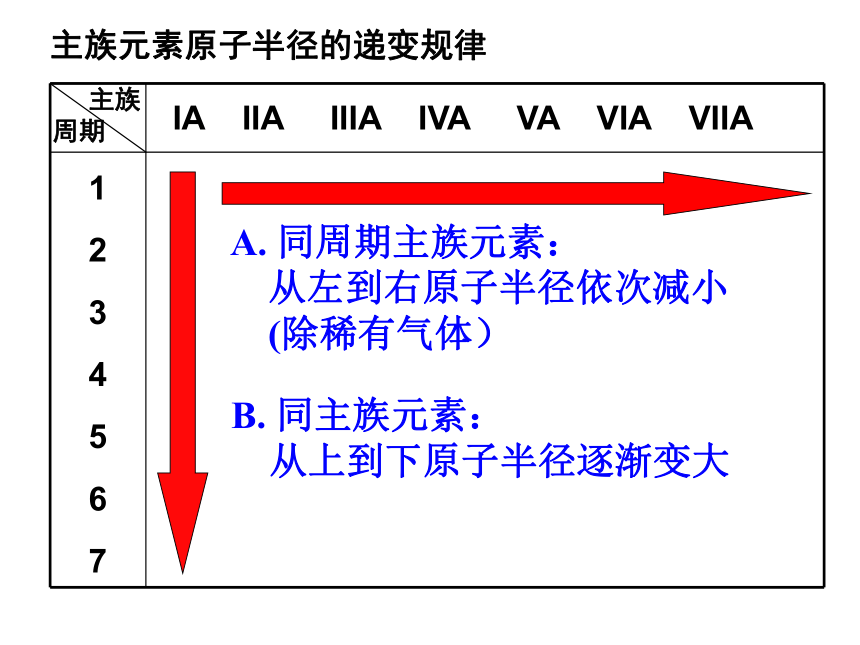
主族元素原子半径的递变规律
IA IIA IIIA IVA VA VIA VIIA
1 2 3 4 5 6 7
主族
周期
同周期主族元素:
从左到右原子半径依次减小
(除稀有气体)
B. 同主族元素:
从上到下原子半径逐渐变大
课堂达标1
CI、F、Br、I
Mg、Na 、CI、 S
比较下列粒子半径的大小
Na >Mg> S >CI
I>Br> CI >F
2.回顾碱金属元素和卤族元素的递变规律
碱金属
卤族元素
增大
增大
碱性增强
金属性增强
酸性减弱
非金属性减弱
稳定性减弱
放少许镁带于试管中,加2mL水,滴入2滴酚酞试液,观察现象;过一会加热至沸腾,再观察现象。
常温下,镁与水无明显反应。
加热时,有气泡产生,溶液变红。
Mg + 2H2O ==== Mg(OH)2 + H2↑
△
实验论证:第三周期元素性质的递变规律
金属性:钠>镁
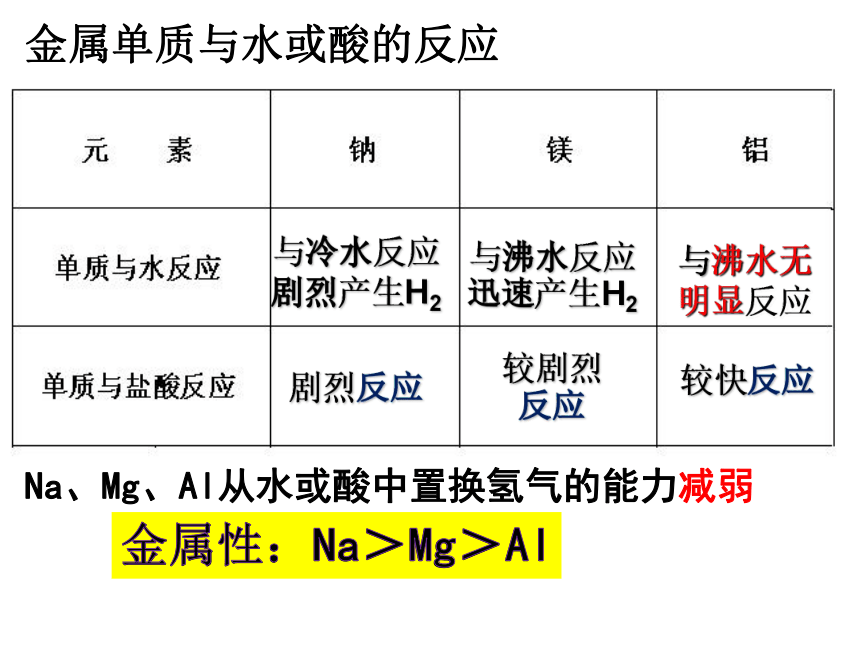
通过钠、镁与水反应难易程度,对比金属性
与冷水反应剧烈产生H2
与沸水反应迅速产生H2
较剧烈
反应
较快反应
Na、Mg、Al从水或酸中置换氢气的能力减弱
。
与沸水无明显反应
剧烈反应
金属性:Na>Mg>Al
金属单质与水或酸的反应
NaOH
Mg(OH)2
Al(OH)3
中强碱
( )
( )
最高价氧化物的水化物的碱性
强碱
两性氢氧化物
Na、Mg、Al的最高价氧化物的水化物的碱性减弱。
金属性:Na>Mg>Al
同一周期,从左到右,
元素的金属性逐渐减弱。
(1)氢氧化铝的制备
AlCl3溶液 + 氨水
Al(OH)3沉淀不溶于氨水(弱碱)
实验2: 在试管里加入2mL 1mol/L AlCl3溶液 ,滴加氨水,生成白色胶状物质。继续滴加氨水,直到不再产生沉淀为止。
AlCl3+3NH3 H2O=Al(OH)3↓ +3NH4Cl
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
氢氧化铝属于两性氢氧化物。
氢氧化铝不溶于弱酸、弱碱,能溶解在强酸、强碱中。
与酸反应:Al(OH)3+3HCl=AlCl3+3H2O
与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
偏铝酸钠
2Al(OH)3 = Al2O3+3H2O
Δ
两性氢氧化物:既能跟酸反应生成盐和水,
又能跟碱反应生成盐和水的氢氧化物
硫酸铝钾的电离:
KAl(SO4)2 = K++ Al3+ + 2SO42-
溶液中有三种自由移动的离子,两种阳离子,一种阴离子(复盐)。
明矾易水解生成氢氧化铝胶体可吸附水中悬浮杂质,是常用的净水剂
硫酸铝钾 KAl(SO4)2 KAl(SO4)2·12H2O(明矾)
非金属性强弱的比较
性质
单质与H2 反应条件
最高价氧化物的水化物(含氧酸) 酸性
Si
P
S
Cl
高温
H2SiO3
弱酸
加热成磷蒸气
H3PO4
中强酸
加热
H2SO4
强酸
光照/点燃发生爆炸
HClO4
最强酸
+4
+5
+6
+7
非金属性:Si<P<S<Cl
高氯酸
归纳小结 14Si 15P 16S 17Cl
对应最高价氧化物
最高价氧化物的水化物
酸性强弱
单质与H2反应条件
气态氢化物及稳定性
SiO2
P2O5
SO3
Cl2O7
H2SiO3
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
最强酸
酸性逐渐增强
高温
加热
加热
点燃/光照
PH3
H2S
HCl
稳定性逐渐增强
+4
+5
+6
+7
非金属性 Si<P<S<Cl
同一周期,从左到右,
元素的非金属性逐渐增强。
结论: Na Mg Al Si P S Cl
同一周期元素,从左到右,
元素金属性逐渐减弱,非金属性逐渐增强。
同一周期元素
根据实验,可得出第三周期元素金属性、非金属性的递变规律:
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
用结构观点解释:
同周期元素从左到右,电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对最外层电子的吸引力逐渐增强,原子失电子能力逐渐减弱,得电子能力逐渐增强.
Li Be B C N O F
Na Mg Al Si P S Cl
K Ca Ga Ge As Se Br
Rb Sr In Sn Sb Te I
Cs Ba Tl Pb Bi Po At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
4.元素的金属性和非金属性递变小结
元素的性质随着原子序数
的递增而呈现周期性的变化规律。
元素周期律——
元 素 周 期 律
实质:原子的核外电子排布周期性的变化。
原子序数的递增
核外电子排布
呈周期性变化
元素性质呈
周期性变化
元素周期律
最外层电子数1→8
(K层电子数1→2)
同周期元素原子半径:大→小
化合价:+1→+7 -4→-1
决定了
归纳出
引起了
元素的性质随着原子序数的递增而呈现周期性的变化.
元素的金属性、非金属性、
最高价氧化物对应的水化物的酸碱性、非金属元素氢化物的稳定性
1.X、Y两元素是同周期的非金属主族元素,如果X原子半径比Y的大,下面说法正确的是( )
A.最高价氧化物对应水化物的酸性,X的比Y的强
B.X的非金属性比Y的强
C.X的阴离子比Y的阴离子还原性强
D.X的气态氢化物比Y的稳定
C
课堂达标1
2.下列递变情况不正确的是( )
A.Na、Mg、Al原子最外层电子数依次增多,其简单离子的氧化性依次增强
B.P、S、Cl最高正化合价依次升高,对应的气态氢化物的稳定性依次增强
C.C、N、O原子半径依次减小
D.P、S、Cl氧化物对应的水化物酸性依次增强
D
3.下表所列是七种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)
元素代号 A B C D E F G
原子半径 0.037 0.160 0.143 0.102 0.099 0.074 0.075
主要 化合价 +1 +2 +3 +6、-2 +7、 -1 -2 +5、
-3
(1)C元素在元素周期表中的位置是第____周期____族。
(2)B的原子结构示意图为_________。
(3)D、E气态氢化物的稳定性强弱顺序为_______(填化学式,下同)。(4)上述七种元素的最高价氧化物的水化物中酸性最强的是_______
三
ⅢA
HCl > H2S
HClO4
H
Mg
Al
S
Cl
O
N
3、2019年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为1-18号元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.原子半径:WB.常温常压下,Y单质为固态
C.气态氢化物热稳定性:ZD.X的最高价氧化物的水化物是强碱
D
4.短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数之和。下列说法不正确的是 ( )
A. 最简单的氢化物的稳定性:X>W
B. 元素的非金属性:Z>W>Y
C. 简单离子的半径大小:Y>W>Z
D. 氧化物对应水化物的酸性:YD
5、在水溶液中,RO3n-和S2-发生反应的离子方程式如下:
RO3n-+3S2-+6H+=R-+3S↓+3H2O
则RO3n-中R元素的化合价是 ,R元素的原子最外层电子数是 。
+5
7
第四章
第二节元素周期律
第二节 元素周期律
思考并讨论:
随着原子序数的递增,
原子的核外电子层排布呈现什么规律性的变化?
原子半径呈现什么规律性的变化?
元素的化合价呈现什么规律性的变化?
核外电子排布、原子半径和主要化合价
最外层电子数1→2
最外层电子数1→8
最外层电子数1→8
最外层电子数
变化规律:
同一周期,从左到右,最外层电子数:1→8 逐渐增加(第一周期除外),呈现周期性变化。
同一族,最外层电子数相同。
1~18号元素的核外电子排布、原子半径和主要化合价
原子半径 大→小
原子半径 大→小
结 同周期元素,从左到右,原子半径逐渐减小。
论 同族元素,从上到下,原子半径逐渐增大。
1~18号元素的核外电子排布、原子半径和主要化合价
主要化合价:正价+1→0
主要化合价:正价+1→+5,
负价:-4 →-1 → 0
主要化合价:正价+1→+7,
负价:-4 →-1→0
结论:同周期元素随原子序数递增,化合价呈周期性变化。最高正价:+1→+7(氧、氟除外)最低负价:-4→ -1
主族元素 最高正价=最外层电子数=主族序数
最低负价=最外层电子数-8
注意:金属无负价,氧、氟无最高正价。
+1
+2
+3
+4
+5
+6
+7
-1
-2
-3
-4
结论2、随着元素原子序数的递增,电子层相同的元素主要化合价呈现周期性的变化。
①最高正价 = 最外层电子数
(氧,氟例外,氧、氟无最高正价)
③最低负价 = 最外层电子数—8
或缺几个电子稳定,最低负价则为几。
(金属元素无负价,H例外)
②当最外层电子数≥4,则出现负价
主族元素原子半径的递变规律
IA IIA IIIA IVA VA VIA VIIA
1 2 3 4 5 6 7
主族
周期
同周期主族元素:
从左到右原子半径依次减小
(除稀有气体)
B. 同主族元素:
从上到下原子半径逐渐变大
课堂达标1
CI、F、Br、I
Mg、Na 、CI、 S
比较下列粒子半径的大小
Na >Mg> S >CI
I>Br> CI >F
2.回顾碱金属元素和卤族元素的递变规律
碱金属
卤族元素
增大
增大
碱性增强
金属性增强
酸性减弱
非金属性减弱
稳定性减弱
放少许镁带于试管中,加2mL水,滴入2滴酚酞试液,观察现象;过一会加热至沸腾,再观察现象。
常温下,镁与水无明显反应。
加热时,有气泡产生,溶液变红。
Mg + 2H2O ==== Mg(OH)2 + H2↑
△
实验论证:第三周期元素性质的递变规律
金属性:钠>镁
通过钠、镁与水反应难易程度,对比金属性
与冷水反应剧烈产生H2
与沸水反应迅速产生H2
较剧烈
反应
较快反应
Na、Mg、Al从水或酸中置换氢气的能力减弱
。
与沸水无明显反应
剧烈反应
金属性:Na>Mg>Al
金属单质与水或酸的反应
NaOH
Mg(OH)2
Al(OH)3
中强碱
( )
( )
最高价氧化物的水化物的碱性
强碱
两性氢氧化物
Na、Mg、Al的最高价氧化物的水化物的碱性减弱。
金属性:Na>Mg>Al
同一周期,从左到右,
元素的金属性逐渐减弱。
(1)氢氧化铝的制备
AlCl3溶液 + 氨水
Al(OH)3沉淀不溶于氨水(弱碱)
实验2: 在试管里加入2mL 1mol/L AlCl3溶液 ,滴加氨水,生成白色胶状物质。继续滴加氨水,直到不再产生沉淀为止。
AlCl3+3NH3 H2O=Al(OH)3↓ +3NH4Cl
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
氢氧化铝属于两性氢氧化物。
氢氧化铝不溶于弱酸、弱碱,能溶解在强酸、强碱中。
与酸反应:Al(OH)3+3HCl=AlCl3+3H2O
与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
偏铝酸钠
2Al(OH)3 = Al2O3+3H2O
Δ
两性氢氧化物:既能跟酸反应生成盐和水,
又能跟碱反应生成盐和水的氢氧化物
硫酸铝钾的电离:
KAl(SO4)2 = K++ Al3+ + 2SO42-
溶液中有三种自由移动的离子,两种阳离子,一种阴离子(复盐)。
明矾易水解生成氢氧化铝胶体可吸附水中悬浮杂质,是常用的净水剂
硫酸铝钾 KAl(SO4)2 KAl(SO4)2·12H2O(明矾)
非金属性强弱的比较
性质
单质与H2 反应条件
最高价氧化物的水化物(含氧酸) 酸性
Si
P
S
Cl
高温
H2SiO3
弱酸
加热成磷蒸气
H3PO4
中强酸
加热
H2SO4
强酸
光照/点燃发生爆炸
HClO4
最强酸
+4
+5
+6
+7
非金属性:Si<P<S<Cl
高氯酸
归纳小结 14Si 15P 16S 17Cl
对应最高价氧化物
最高价氧化物的水化物
酸性强弱
单质与H2反应条件
气态氢化物及稳定性
SiO2
P2O5
SO3
Cl2O7
H2SiO3
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
最强酸
酸性逐渐增强
高温
加热
加热
点燃/光照
PH3
H2S
HCl
稳定性逐渐增强
+4
+5
+6
+7
非金属性 Si<P<S<Cl
同一周期,从左到右,
元素的非金属性逐渐增强。
结论: Na Mg Al Si P S Cl
同一周期元素,从左到右,
元素金属性逐渐减弱,非金属性逐渐增强。
同一周期元素
根据实验,可得出第三周期元素金属性、非金属性的递变规律:
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
用结构观点解释:
同周期元素从左到右,电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对最外层电子的吸引力逐渐增强,原子失电子能力逐渐减弱,得电子能力逐渐增强.
Li Be B C N O F
Na Mg Al Si P S Cl
K Ca Ga Ge As Se Br
Rb Sr In Sn Sb Te I
Cs Ba Tl Pb Bi Po At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
4.元素的金属性和非金属性递变小结
元素的性质随着原子序数
的递增而呈现周期性的变化规律。
元素周期律——
元 素 周 期 律
实质:原子的核外电子排布周期性的变化。
原子序数的递增
核外电子排布
呈周期性变化
元素性质呈
周期性变化
元素周期律
最外层电子数1→8
(K层电子数1→2)
同周期元素原子半径:大→小
化合价:+1→+7 -4→-1
决定了
归纳出
引起了
元素的性质随着原子序数的递增而呈现周期性的变化.
元素的金属性、非金属性、
最高价氧化物对应的水化物的酸碱性、非金属元素氢化物的稳定性
1.X、Y两元素是同周期的非金属主族元素,如果X原子半径比Y的大,下面说法正确的是( )
A.最高价氧化物对应水化物的酸性,X的比Y的强
B.X的非金属性比Y的强
C.X的阴离子比Y的阴离子还原性强
D.X的气态氢化物比Y的稳定
C
课堂达标1
2.下列递变情况不正确的是( )
A.Na、Mg、Al原子最外层电子数依次增多,其简单离子的氧化性依次增强
B.P、S、Cl最高正化合价依次升高,对应的气态氢化物的稳定性依次增强
C.C、N、O原子半径依次减小
D.P、S、Cl氧化物对应的水化物酸性依次增强
D
3.下表所列是七种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)
元素代号 A B C D E F G
原子半径 0.037 0.160 0.143 0.102 0.099 0.074 0.075
主要 化合价 +1 +2 +3 +6、-2 +7、 -1 -2 +5、
-3
(1)C元素在元素周期表中的位置是第____周期____族。
(2)B的原子结构示意图为_________。
(3)D、E气态氢化物的稳定性强弱顺序为_______(填化学式,下同)。(4)上述七种元素的最高价氧化物的水化物中酸性最强的是_______
三
ⅢA
HCl > H2S
HClO4
H
Mg
Al
S
Cl
O
N
3、2019年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为1-18号元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.原子半径:W
C.气态氢化物热稳定性:Z
D
4.短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数之和。下列说法不正确的是 ( )
A. 最简单的氢化物的稳定性:X>W
B. 元素的非金属性:Z>W>Y
C. 简单离子的半径大小:Y>W>Z
D. 氧化物对应水化物的酸性:Y
5、在水溶液中,RO3n-和S2-发生反应的离子方程式如下:
RO3n-+3S2-+6H+=R-+3S↓+3H2O
则RO3n-中R元素的化合价是 ,R元素的原子最外层电子数是 。
+5
7
