化学人教版(2019)必修第一册2.2.氯及其化合物(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.2.氯及其化合物(共22张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 19.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-30 17:51:50 | ||
图片预览





文档简介
(共22张PPT)
化学必修一 第2章 第2节氯及其化合物 (2课时)
第1课时 氯气的性质
一、物理性质
颜色、状态
气味
水溶性
毒性
密度
沸点
黄绿色气体
有刺激性气味
有毒
比空气大
能溶于水
沸点低
水溶液称为氯水
易液化,液态称为液氯
钢瓶
Cl2与Fe不反应吗
化学性质
与金属单质反应
Cu
现象
剧烈燃烧
棕黄色的烟
Na
白色的烟
2Na+Cl2 2NaCl
△
Fe
棕红色的烟
2Fe+3Cl2 2FeCl3
△
Cu+Cl2 CuCl2
△
化学性质
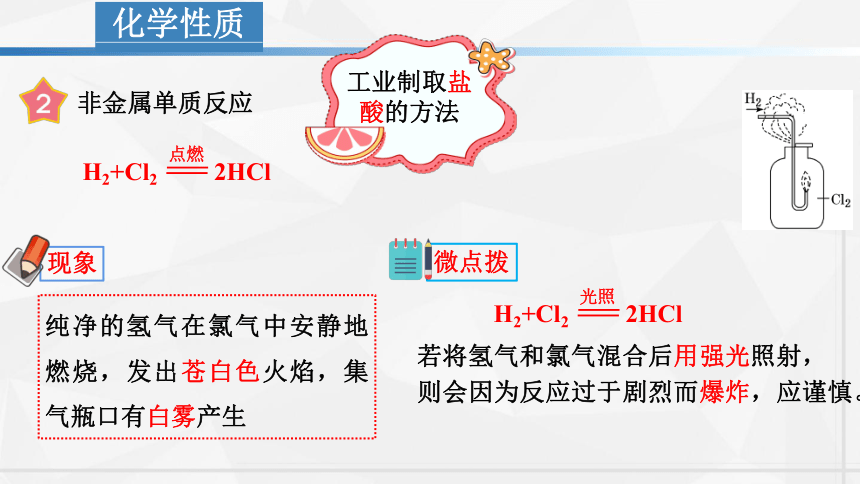
非金属单质反应
纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,集气瓶口有白雾产生
现象
微点拨
若将氢气和氯气混合后用强光照射,
则会因为反应过于剧烈而爆炸,应谨慎。
H2+Cl2 2HCl
点燃
H2+Cl2 2HCl
光照
工业制取盐酸的方法
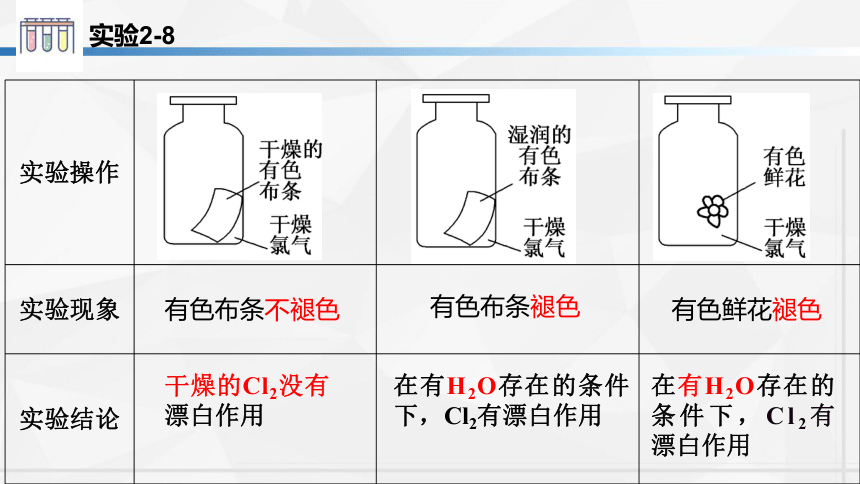
实验2-8
实验操作
实验现象
实验结论
有色布条不褪色
有色布条褪色
有色鲜花褪色
干燥的Cl2没有漂白作用
在有H2O存在的条件下,Cl2有漂白作用
在有H2O存在的条件下,Cl2有漂白作用
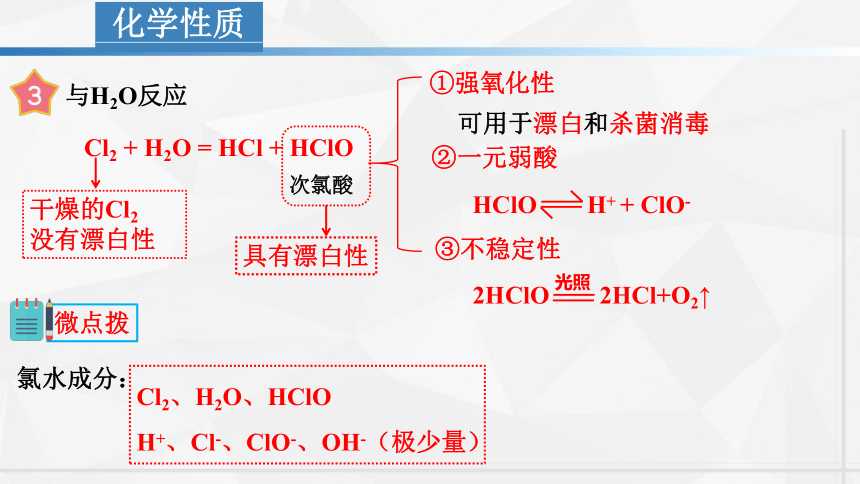
化学性质
与H2O反应
Cl2 + H2O = HCl + HClO
次氯酸
①强氧化性
可用于漂白和杀菌消毒
②一元弱酸
HClO H+ + ClO-
③不稳定性
2HClO 2HCl+O2↑
光照
微点拨
Cl2、H2O、HClO
H+、Cl-、ClO-、OH-(极少量)
氯水成分:
具有漂白性
干燥的Cl2
没有漂白性
化学性质
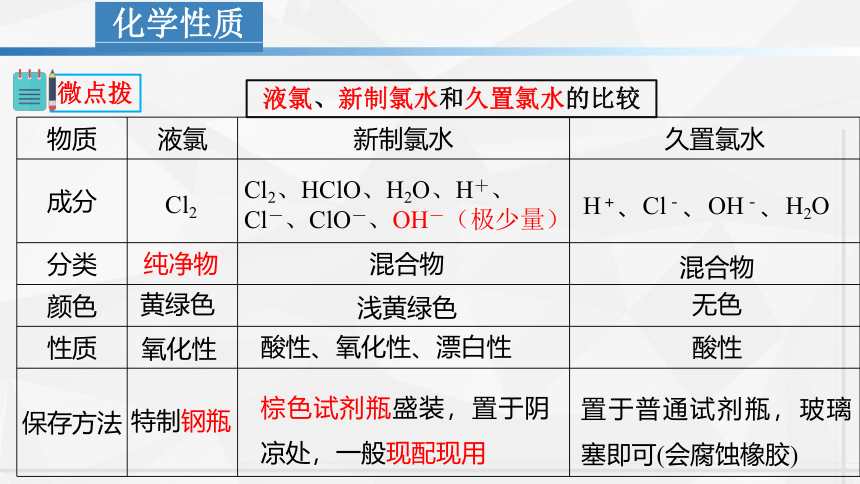
物质 液氯 新制氯水 久置氯水
成分
分类
颜色
性质
保存方法
液氯、新制氯水和久置氯水的比较
微点拨
Cl2
Cl2、HClO、H2O、H+、
Cl-、ClO-、OH-(极少量)
H+、Cl-、OH-、H2O
纯净物
混合物
混合物
黄绿色
浅黄绿色
无色
氧化性
酸性、氧化性、漂白性
酸性
特制钢瓶
棕色试剂瓶盛装,置于阴凉处,一般现配现用
置于普通试剂瓶,玻璃塞即可(会腐蚀橡胶)
化学性质
与碱反应
Cl2+2NaOH===NaCl+NaClO+H2O
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(工业上制取漂白液原理)
(工业上制取漂白粉原理)
(1)Cl2与NaOH溶液反应
(2)氯气通入冷的石灰乳
有效成分
有效成分
(工业上制取漂粉精原理)
充分反应
主要成分
化学性质
与碱反应
Cl2+2NaOH===NaCl+NaClO+H2O
(1)Cl2与NaOH溶液反应
Cl2+2OH- === Cl-+ClO-+H2O
Cl2的尾气处理
制漂白液
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(2)氯气通入冷的石灰乳
Cl2+Ca(OH)2===Ca2++Cl-+ClO-+H2O
制漂白粉和漂粉精
化学性质
Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO
(1)漂白粉的漂白原理
微点拨
(2)漂白粉的失效原理
Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO
2HClO 2HCl+O2↑
光照
化学性质
与还原性物质反应
I-
Br -
S2-
SO2
Fe2+
Cl2+2Br- === 2Cl-+Br2
Cl2+2Fe2+ === 2Cl-+2Fe3+
Cl2+2I- === 2Cl-+I2
Cl2+S2- === 2Cl-+S
Cl2+SO2+2H2O === 4H+ + 2Cl-+SO42-
存在与用途
在自然界中除了以 MgCl2 、 NaCl 、 CaCl2等形式
大量存在于海水中,还存在于陆地的盐湖和盐矿中。
1.存在
氯是一种重要的“成盐元素”
化学必修一 第2章 第2节氯及其化合物 (2课时)
2 氯气的实验室制备
氯气的实验室制法
1.原理
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
△
浓盐酸与二氧化锰加热制取氯气
MnO2+4H++2Cl- Cl2↑+Mn2++2H2O
△
氯气的实验室制法
2.装置
发生装置
除杂装置
收集装置
尾气处理装置
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
△
依据反应物的状态与反应条件选择
固液常温型
固固加热型
固液加热型
液液加热型
氯气的实验室制法
2.装置
发生装置
除杂装置
收集装置
尾气处理装置
依据生成物的密度和水溶性选择
排饱和食盐水
向上排空气法
向下排空气法
排水法
Cl2密度大于空气,可溶于水
氯气的实验室制法
2.装置
发生装置
除杂装置
收集装置
尾气处理装置
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
△
HCl、H2O(g)
除H2O(g)
除HCl
NaOH溶液
除去多余的Cl2
氯气的实验室制法
3.氯气的验满方法
湿润的蓝色石蕊试纸先变红后变褪色,则收集满
观察集气瓶口呈黄绿色,则收集满
湿润的淀粉-KI试纸在集气瓶口变蓝,则收集满
原理:Cl2 + 2KI === I2 + 2KCl,置换出的I2遇淀粉变蓝
氯气的实验室制法
4.注意事项
实验结束后,先使反应停止并排出装置中残留的Cl2,
再拆卸装置,避免污染空气。
必须用浓盐酸,浓盐酸中部分Cl-的化合价升高,被氧化,
MnO2与稀盐酸不反应
为了减少制得的Cl2中HCl的含量,加热温度不宜过高,
以减少HCl的挥发。
尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,吸收不完全
氯气的实验室制法
知识拓展
快速制Cl2的方法
用KMnO4、KClO3、Ca(ClO)2、K2Cr2O7等氧化剂代替MnO2制取氯气,反应不需加热且反应速率较快
①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
④K2Cr2O7+14HCl(浓)===2CrCl3+2KCl+3Cl2↑+7H2O
2MnO4-+16H++10Cl- ===2Mn2++5Cl2↑+8H2O
ClO3-+6H++5Cl-===3Cl2↑+3H2O
ClO-+2H++Cl-===Cl2↑+H2O
Cr2O72-+14H+ + 6Cl- ===2Cr3++3Cl2↑+7H2O
氯离子的检验
实验试剂 实验现象 反应原理
稀盐酸
NaCl溶液
Na2CO3溶液
产生白色沉淀,
沉淀不溶解
HCl+AgNO3=AgCl↓+HNO3
产生白色沉淀,
沉淀不溶解
NaCl+AgNO3=AgCl↓+NaNO3
产生白色沉淀,
后沉淀溶解,产生气泡
Ag2CO3+2HNO3=CO2↑+H2O+2AgNO3
Ag++Cl-===AgCl↓
Ag++Cl-===AgCl↓
Na2CO3+2AgNO3=Ag2CO3↓+2NaNO3
2Ag++CO32-===Ag2CO3↓
Ag2CO3+2H+===CO2↑+H2O
氯离子的检验
氯离子的检验
1.检验原理
Ag++Cl-===AgCl↓
2.检验步骤
取少量待测液于试管中,先加入稀硝酸酸化,再加入硝酸应溶液,若白色沉淀生成,说明溶液中含有Cl-。
或者硝酸酸化的硝酸银溶液
化学必修一 第2章 第2节氯及其化合物 (2课时)
第1课时 氯气的性质
一、物理性质
颜色、状态
气味
水溶性
毒性
密度
沸点
黄绿色气体
有刺激性气味
有毒
比空气大
能溶于水
沸点低
水溶液称为氯水
易液化,液态称为液氯
钢瓶
Cl2与Fe不反应吗
化学性质
与金属单质反应
Cu
现象
剧烈燃烧
棕黄色的烟
Na
白色的烟
2Na+Cl2 2NaCl
△
Fe
棕红色的烟
2Fe+3Cl2 2FeCl3
△
Cu+Cl2 CuCl2
△
化学性质
非金属单质反应
纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,集气瓶口有白雾产生
现象
微点拨
若将氢气和氯气混合后用强光照射,
则会因为反应过于剧烈而爆炸,应谨慎。
H2+Cl2 2HCl
点燃
H2+Cl2 2HCl
光照
工业制取盐酸的方法
实验2-8
实验操作
实验现象
实验结论
有色布条不褪色
有色布条褪色
有色鲜花褪色
干燥的Cl2没有漂白作用
在有H2O存在的条件下,Cl2有漂白作用
在有H2O存在的条件下,Cl2有漂白作用
化学性质
与H2O反应
Cl2 + H2O = HCl + HClO
次氯酸
①强氧化性
可用于漂白和杀菌消毒
②一元弱酸
HClO H+ + ClO-
③不稳定性
2HClO 2HCl+O2↑
光照
微点拨
Cl2、H2O、HClO
H+、Cl-、ClO-、OH-(极少量)
氯水成分:
具有漂白性
干燥的Cl2
没有漂白性
化学性质
物质 液氯 新制氯水 久置氯水
成分
分类
颜色
性质
保存方法
液氯、新制氯水和久置氯水的比较
微点拨
Cl2
Cl2、HClO、H2O、H+、
Cl-、ClO-、OH-(极少量)
H+、Cl-、OH-、H2O
纯净物
混合物
混合物
黄绿色
浅黄绿色
无色
氧化性
酸性、氧化性、漂白性
酸性
特制钢瓶
棕色试剂瓶盛装,置于阴凉处,一般现配现用
置于普通试剂瓶,玻璃塞即可(会腐蚀橡胶)
化学性质
与碱反应
Cl2+2NaOH===NaCl+NaClO+H2O
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(工业上制取漂白液原理)
(工业上制取漂白粉原理)
(1)Cl2与NaOH溶液反应
(2)氯气通入冷的石灰乳
有效成分
有效成分
(工业上制取漂粉精原理)
充分反应
主要成分
化学性质
与碱反应
Cl2+2NaOH===NaCl+NaClO+H2O
(1)Cl2与NaOH溶液反应
Cl2+2OH- === Cl-+ClO-+H2O
Cl2的尾气处理
制漂白液
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(2)氯气通入冷的石灰乳
Cl2+Ca(OH)2===Ca2++Cl-+ClO-+H2O
制漂白粉和漂粉精
化学性质
Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO
(1)漂白粉的漂白原理
微点拨
(2)漂白粉的失效原理
Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO
2HClO 2HCl+O2↑
光照
化学性质
与还原性物质反应
I-
Br -
S2-
SO2
Fe2+
Cl2+2Br- === 2Cl-+Br2
Cl2+2Fe2+ === 2Cl-+2Fe3+
Cl2+2I- === 2Cl-+I2
Cl2+S2- === 2Cl-+S
Cl2+SO2+2H2O === 4H+ + 2Cl-+SO42-
存在与用途
在自然界中除了以 MgCl2 、 NaCl 、 CaCl2等形式
大量存在于海水中,还存在于陆地的盐湖和盐矿中。
1.存在
氯是一种重要的“成盐元素”
化学必修一 第2章 第2节氯及其化合物 (2课时)
2 氯气的实验室制备
氯气的实验室制法
1.原理
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
△
浓盐酸与二氧化锰加热制取氯气
MnO2+4H++2Cl- Cl2↑+Mn2++2H2O
△
氯气的实验室制法
2.装置
发生装置
除杂装置
收集装置
尾气处理装置
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
△
依据反应物的状态与反应条件选择
固液常温型
固固加热型
固液加热型
液液加热型
氯气的实验室制法
2.装置
发生装置
除杂装置
收集装置
尾气处理装置
依据生成物的密度和水溶性选择
排饱和食盐水
向上排空气法
向下排空气法
排水法
Cl2密度大于空气,可溶于水
氯气的实验室制法
2.装置
发生装置
除杂装置
收集装置
尾气处理装置
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
△
HCl、H2O(g)
除H2O(g)
除HCl
NaOH溶液
除去多余的Cl2
氯气的实验室制法
3.氯气的验满方法
湿润的蓝色石蕊试纸先变红后变褪色,则收集满
观察集气瓶口呈黄绿色,则收集满
湿润的淀粉-KI试纸在集气瓶口变蓝,则收集满
原理:Cl2 + 2KI === I2 + 2KCl,置换出的I2遇淀粉变蓝
氯气的实验室制法
4.注意事项
实验结束后,先使反应停止并排出装置中残留的Cl2,
再拆卸装置,避免污染空气。
必须用浓盐酸,浓盐酸中部分Cl-的化合价升高,被氧化,
MnO2与稀盐酸不反应
为了减少制得的Cl2中HCl的含量,加热温度不宜过高,
以减少HCl的挥发。
尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,吸收不完全
氯气的实验室制法
知识拓展
快速制Cl2的方法
用KMnO4、KClO3、Ca(ClO)2、K2Cr2O7等氧化剂代替MnO2制取氯气,反应不需加热且反应速率较快
①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
④K2Cr2O7+14HCl(浓)===2CrCl3+2KCl+3Cl2↑+7H2O
2MnO4-+16H++10Cl- ===2Mn2++5Cl2↑+8H2O
ClO3-+6H++5Cl-===3Cl2↑+3H2O
ClO-+2H++Cl-===Cl2↑+H2O
Cr2O72-+14H+ + 6Cl- ===2Cr3++3Cl2↑+7H2O
氯离子的检验
实验试剂 实验现象 反应原理
稀盐酸
NaCl溶液
Na2CO3溶液
产生白色沉淀,
沉淀不溶解
HCl+AgNO3=AgCl↓+HNO3
产生白色沉淀,
沉淀不溶解
NaCl+AgNO3=AgCl↓+NaNO3
产生白色沉淀,
后沉淀溶解,产生气泡
Ag2CO3+2HNO3=CO2↑+H2O+2AgNO3
Ag++Cl-===AgCl↓
Ag++Cl-===AgCl↓
Na2CO3+2AgNO3=Ag2CO3↓+2NaNO3
2Ag++CO32-===Ag2CO3↓
Ag2CO3+2H+===CO2↑+H2O
氯离子的检验
氯离子的检验
1.检验原理
Ag++Cl-===AgCl↓
2.检验步骤
取少量待测液于试管中,先加入稀硝酸酸化,再加入硝酸应溶液,若白色沉淀生成,说明溶液中含有Cl-。
或者硝酸酸化的硝酸银溶液
