3.1.1弱电解质的电离平衡 课件(共20张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.1.1弱电解质的电离平衡 课件(共20张ppt)化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 55.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-31 22:40:33 | ||
图片预览








文档简介
(共20张PPT)
电离平衡
1
第三章 水溶液中的离子反应与平衡
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
第1课时 弱电解质的电离平衡
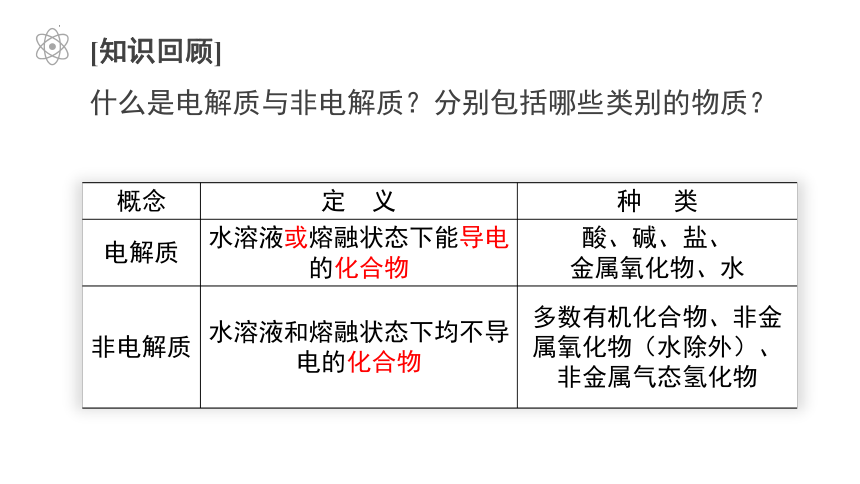
[知识回顾]
什么是电解质与非电解质?分别包括哪些类别的物质?
概念 定 义 种 类
电解质 水溶液或熔融状态下能导电的化合物 酸、碱、盐、
金属氧化物、水
非电解质 水溶液和熔融状态下均不导电的化合物 多数有机化合物、非金属氧化物(水除外)、非金属气态氢化物
[知识回顾]
什么是电解质与非电解质?分别包括哪些类别的物质?
注:①电解质、非电解质的前提必须为化合物;
②电解质与非电解质的本质区别是在水溶液或熔融状态下自身能否发生电离;
③电解质不一定导电,导电的不一定是电解质
④电解质的导电:条件:溶于水或熔融状态
本质:自由离子的定向移动
能力:与离子浓度、离子所带电荷数有关
[知识运用]
下列物质中:
①金属铜 ②固态NaCl ③O2 ④H2SO4 ⑤碳棒 ⑥酒精水溶液
⑦KOH溶液 ⑧熔融KNO3 ⑨葡萄糖 ⑩ 氨气 盐酸
NH3·H2O
电解质: ;
非电解质: ;
能导电: ;
①⑤⑦⑧
②④⑧
⑨⑩
【实验3-1】探究相同条件下不同电解质的电离程度
取体积相等、0.1 mol/L的盐酸和稀醋酸,试验其导电能力, 并分别与等量的镁条反应。观察,比较并记录现象,你能得出什么结论?
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
导电能力 强 弱
与镁条反应 速率较大 速率较小
取体积相等、0.1 mol/L的盐酸和稀醋酸,试验其导电能力, 并分别与等量的镁条反应。观察,比较并记录现象。
结论:等浓度的盐酸和醋酸中,离子浓度不同
【实验3-1】探究相同条件下不同电解质的电离程度
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
导电能力 强 弱
与镁条反应 速率较大 速率较小
pH=-lgc(H+) 1 3
取体积相等、0.1 mol/L的盐酸和稀醋酸,试验其导电能力, 并分别与等量的镁条反应。观察,比较并记录现象。
【实验3-1】探究相同条件下不同电解质的电离程度
根据0.1 mol/L的盐酸和稀醋酸的pH,估算两溶液中的氢离子浓度。
部分电离
全部电离
[结果分析]
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
主要微粒
微观探析
Cl- H3O+
HCl在水中电离示意图
H3O+ CH3COO- CH3COOH
完全电离
部分电离
CH3COOH在水中电离示意图
[小结]依据电解质电离程度的差异对电解质进行分类
电解质
强电解质
弱电解质
强酸→ HCl、H2SO4、HNO3、HI、HBr、HClO4等
强碱→ KOH、NaOH、Ca(OH)2、Ba(OH)2等
绝大多数盐→ NaCl、Na2SO4、BaSO4、NaHCO3等
弱酸→H2S、H2CO3、CH3COOH、H2SO3 、HClO等
弱碱→ NH3·H2O、Fe(OH)2、 Fe(OH)3等
极少数盐→ (CH3COOH)2Pb等
(全部电离)
(部分电离)
与溶解性无关
水
弱电解质是如何电离的(以CH3COOH的电离为例)
【实验设计】
可选试剂:0.1mol/L CH3COOH、CH3COONa溶液(碱性)、
CH3COONa(s)、CH3COONH4溶液(中性)、CH3COONH4(s),
可选仪器:pH传感器、烧杯、玻璃棒等。
猜想1:CH3COOH(部分) = H+ +CH3COO-
猜想2:CH3COOH H+ +CH3COO-
弱电解质是如何电离的(以CH3COOH电离为例)
【实验】向0.1 mol/L CH3COOH溶液中加入CH3COONH4固体,用pH传感器记录溶液pH变化。
(宏观现象)
溶液pH变大
(微观本质)
c(H+)减小
H+与CH3COO 能结合为CH3COOH
【思考】一定条件下,往一杯水中加进一定量的冰醋酸,溶液中溶质微粒得浓度会发生如何的变化?
弱电解质是如何电离的(以CH3COOH电离为例)
弱电解质的电离是可逆的!
弱电解质分子
离子
电离
结合
弱电解质是如何电离的(以CH3COOH电离为例)
CH3COOH CH3COO- + H+
电离平衡状态
强电解质和弱电解质电离过程的符号表达
1、强电解质:完全电离,符号用“=”。
H2SO4 = 2H+ +SO42- NaOH = Na+ + OH NaCl = Na+ + Cl
2、弱电解质:部分电离,符号选用“ ”。
(1)一元弱酸弱碱的电离:
NH3·H2O NH4+ + OH
CH3COOH CH3COO + H+
H2CO3 H+ + HCO3
HCO3 H+ + CO32
(2)多元弱酸的电离分步进行,以第一步电离为主。如:
强电解质和弱电解质电离过程的符号表达
2、弱电解质:部分电离,符号选用“ ”。
Cu(OH)2 Cu2+ + 2OH
(3)多元弱碱的电离分步进行,但是一般用一步电离表示。如:
(4)酸式盐的电离
强酸的酸式盐完全电离:
弱酸的酸式盐第一步完全电离:
NaHSO4 = Na+ + H+ + SO42-
[思考]结合所学知识,分析影响弱电解质电离平衡的因素有哪些?
(1) 内因:电解质自身性质决定了其电离程度的大小
(2) 外因:电离平衡是动态平衡,遵循勒夏特列原理。
影响电离平衡的条件有温度、浓度等。
影响弱电解质电离平衡的因素
条件改变 平衡移动方向 电离 程度 n(H+) c(H+) n(Ac-) c(Ac-) c(HAc) 溶液导电能力
升高温度
加水稀释
通入HCl气体
加少量冰醋酸
加少量NaOH(s)
加少量CH3COONa(s)
CH3COOH CH3COO + H+ H>0
[思考]一定温度下,冰醋酸稀释过程中溶液的导电能力如图所示,则:
(1)a、b、c三点对应溶液中,c(H+)由小到大的顺序为 。
(2)a、b、c三点对应溶液中,CH3COOH的电离程度最大的为 。
cc
电离平衡
1
第三章 水溶液中的离子反应与平衡
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
第1课时 弱电解质的电离平衡
[知识回顾]
什么是电解质与非电解质?分别包括哪些类别的物质?
概念 定 义 种 类
电解质 水溶液或熔融状态下能导电的化合物 酸、碱、盐、
金属氧化物、水
非电解质 水溶液和熔融状态下均不导电的化合物 多数有机化合物、非金属氧化物(水除外)、非金属气态氢化物
[知识回顾]
什么是电解质与非电解质?分别包括哪些类别的物质?
注:①电解质、非电解质的前提必须为化合物;
②电解质与非电解质的本质区别是在水溶液或熔融状态下自身能否发生电离;
③电解质不一定导电,导电的不一定是电解质
④电解质的导电:条件:溶于水或熔融状态
本质:自由离子的定向移动
能力:与离子浓度、离子所带电荷数有关
[知识运用]
下列物质中:
①金属铜 ②固态NaCl ③O2 ④H2SO4 ⑤碳棒 ⑥酒精水溶液
⑦KOH溶液 ⑧熔融KNO3 ⑨葡萄糖 ⑩ 氨气 盐酸
NH3·H2O
电解质: ;
非电解质: ;
能导电: ;
①⑤⑦⑧
②④⑧
⑨⑩
【实验3-1】探究相同条件下不同电解质的电离程度
取体积相等、0.1 mol/L的盐酸和稀醋酸,试验其导电能力, 并分别与等量的镁条反应。观察,比较并记录现象,你能得出什么结论?
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
导电能力 强 弱
与镁条反应 速率较大 速率较小
取体积相等、0.1 mol/L的盐酸和稀醋酸,试验其导电能力, 并分别与等量的镁条反应。观察,比较并记录现象。
结论:等浓度的盐酸和醋酸中,离子浓度不同
【实验3-1】探究相同条件下不同电解质的电离程度
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
导电能力 强 弱
与镁条反应 速率较大 速率较小
pH=-lgc(H+) 1 3
取体积相等、0.1 mol/L的盐酸和稀醋酸,试验其导电能力, 并分别与等量的镁条反应。观察,比较并记录现象。
【实验3-1】探究相同条件下不同电解质的电离程度
根据0.1 mol/L的盐酸和稀醋酸的pH,估算两溶液中的氢离子浓度。
部分电离
全部电离
[结果分析]
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
主要微粒
微观探析
Cl- H3O+
HCl在水中电离示意图
H3O+ CH3COO- CH3COOH
完全电离
部分电离
CH3COOH在水中电离示意图
[小结]依据电解质电离程度的差异对电解质进行分类
电解质
强电解质
弱电解质
强酸→ HCl、H2SO4、HNO3、HI、HBr、HClO4等
强碱→ KOH、NaOH、Ca(OH)2、Ba(OH)2等
绝大多数盐→ NaCl、Na2SO4、BaSO4、NaHCO3等
弱酸→H2S、H2CO3、CH3COOH、H2SO3 、HClO等
弱碱→ NH3·H2O、Fe(OH)2、 Fe(OH)3等
极少数盐→ (CH3COOH)2Pb等
(全部电离)
(部分电离)
与溶解性无关
水
弱电解质是如何电离的(以CH3COOH的电离为例)
【实验设计】
可选试剂:0.1mol/L CH3COOH、CH3COONa溶液(碱性)、
CH3COONa(s)、CH3COONH4溶液(中性)、CH3COONH4(s),
可选仪器:pH传感器、烧杯、玻璃棒等。
猜想1:CH3COOH(部分) = H+ +CH3COO-
猜想2:CH3COOH H+ +CH3COO-
弱电解质是如何电离的(以CH3COOH电离为例)
【实验】向0.1 mol/L CH3COOH溶液中加入CH3COONH4固体,用pH传感器记录溶液pH变化。
(宏观现象)
溶液pH变大
(微观本质)
c(H+)减小
H+与CH3COO 能结合为CH3COOH
【思考】一定条件下,往一杯水中加进一定量的冰醋酸,溶液中溶质微粒得浓度会发生如何的变化?
弱电解质是如何电离的(以CH3COOH电离为例)
弱电解质的电离是可逆的!
弱电解质分子
离子
电离
结合
弱电解质是如何电离的(以CH3COOH电离为例)
CH3COOH CH3COO- + H+
电离平衡状态
强电解质和弱电解质电离过程的符号表达
1、强电解质:完全电离,符号用“=”。
H2SO4 = 2H+ +SO42- NaOH = Na+ + OH NaCl = Na+ + Cl
2、弱电解质:部分电离,符号选用“ ”。
(1)一元弱酸弱碱的电离:
NH3·H2O NH4+ + OH
CH3COOH CH3COO + H+
H2CO3 H+ + HCO3
HCO3 H+ + CO32
(2)多元弱酸的电离分步进行,以第一步电离为主。如:
强电解质和弱电解质电离过程的符号表达
2、弱电解质:部分电离,符号选用“ ”。
Cu(OH)2 Cu2+ + 2OH
(3)多元弱碱的电离分步进行,但是一般用一步电离表示。如:
(4)酸式盐的电离
强酸的酸式盐完全电离:
弱酸的酸式盐第一步完全电离:
NaHSO4 = Na+ + H+ + SO42-
[思考]结合所学知识,分析影响弱电解质电离平衡的因素有哪些?
(1) 内因:电解质自身性质决定了其电离程度的大小
(2) 外因:电离平衡是动态平衡,遵循勒夏特列原理。
影响电离平衡的条件有温度、浓度等。
影响弱电解质电离平衡的因素
条件改变 平衡移动方向 电离 程度 n(H+) c(H+) n(Ac-) c(Ac-) c(HAc) 溶液导电能力
升高温度
加水稀释
通入HCl气体
加少量冰醋酸
加少量NaOH(s)
加少量CH3COONa(s)
CH3COOH CH3COO + H+ H>0
[思考]一定温度下,冰醋酸稀释过程中溶液的导电能力如图所示,则:
(1)a、b、c三点对应溶液中,c(H+)由小到大的顺序为 。
(2)a、b、c三点对应溶液中,CH3COOH的电离程度最大的为 。
c
