2.1.2钠的几种化合物 课件(共41张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1.2钠的几种化合物 课件(共41张ppt)化学人教版(2019)必修第一册 | 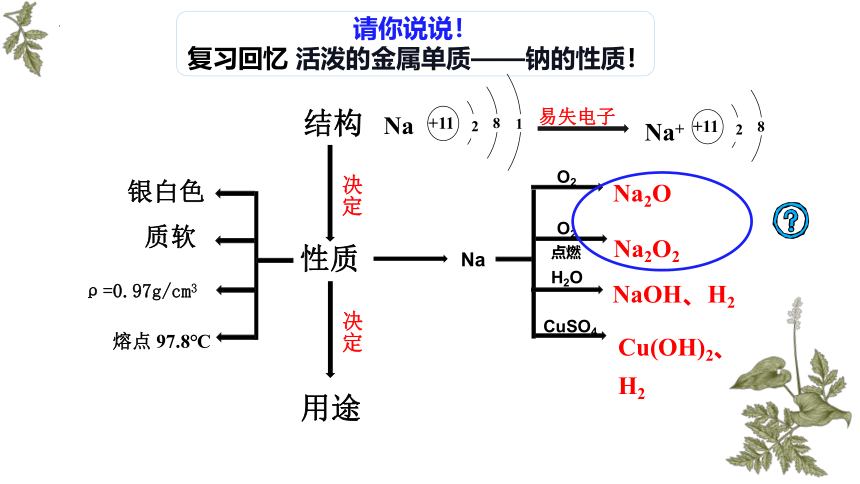 | |
| 格式 | pptx | ||
| 文件大小 | 40.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-31 23:07:21 | ||
图片预览








文档简介
(共41张PPT)
请你说说!
复习回忆 活泼的金属单质——钠的性质!
结构
性质
+11
2
8
1
易失电子
+11
2
8
Na
Na+
决定
Na
O2
Na2O
Na2O2
O2
点燃
H2O
NaOH、H2
CuSO4
决定
用途
银白色
ρ=0.97g/cm3
质软
熔点 97.8℃
Cu(OH)2、H2
第一节
钠及其化合物
第 2 课时 钠的几种化合物
第二章 海水中的重要元素——钠和氯
断面呈银白色
切面
片刻后
迅速变暗
不切割
淡黄色
Na
Na2O
Na2O2
01
氧化钠和过氧化钠
氧化钠 过氧化钠
颜色、状态 白色固体 淡黄色固体
思考与讨论
(1)回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。
(2)氧化钠与水的反应和氧化钙与水的反应类似,请写出氧化钠与水反应的化学方程式。
课本P34
钠及其化合物
依据类别共性
类比典型代表物
实验
验证
预测物质性质
确认物质性质
分析物质组成
确定物质类别
基于物质类别研究物质性质的认知模型
氧化钠和过氧化钠的性质如何?
CaO + H2O Ca(OH)2
碱性氧化物 + 水 → 碱
请你试试!
用类推的方法推测氧化钠和过氧化钠的性质!
CO2
酸性
氧化物
酸性氧化物 + 水 → 酸
酸性氧化物 + 碱 → 盐 + 水
CaO
Fe2O3
Fe2O3 + 6HCl 2FeCl3 + 3H2O
碱性氧化物 + 酸 → 盐 + 水
碱性
氧化物
酸性氧化物+碱性氧化物→盐
如何认识Na2O和Na2O2的性质?
基于物质类别研究物质性质
Na2O + H2O === 2NaOH
氧化钠与氧化钙一样都属于碱性氧化物,请你写出氧化钠与水、二氧化碳、盐酸反应的化学方程式。
Na2O + CO2 === Na2CO3
氧化钠的化学性质
Na2O + 2HCl === 2NaCl+H2O
1、与水反应
2、与二氧化碳反应
3、与盐酸反应
请你预测!
基于物质类别研究物质性质,Na2O2的性质如何?
组成元素一样
金属氧化物
Na2O
Na2O2
化学性质
Na2O + H2O === 2NaOH
Na2O + CO2 === Na2CO3
Na2O + 2HCl === 2NaCl+H2O
化学性质
与水反应
与CO2反应
与HCl反应
过氧化钠的化学性质
性质预测
设计方案
得出结论
实验探究
研究物质性质的一般程序
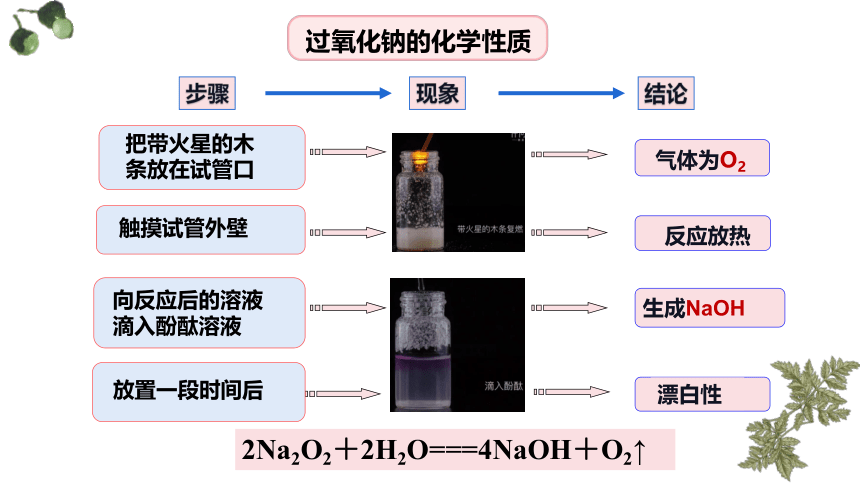
过氧化钠的化学性质
步骤
现象
结论
把带火星的木
条放在试管口
触摸试管外壁
向反应后的溶液
滴入酚酞溶液
气体为O2
反应放热
生成NaOH
放置一段时间后
漂白性
2Na2O2+2H2O===4NaOH+O2↑
-1 -2 0
化学方程式:
2Na2O2+2H2O == 4NaOH+O2↑
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
既是氧化剂又是还原剂
有漂白性
过氧化钠的化学性质
过氧化钠和水反应放热,生成氧气和氢氧化钠
过氧化钠有强氧化性和漂白性
氧化物
过氧化钠的化学性质
酸性氧化物
CO2
碱性氧化物
Na2O
过氧化物
Na2O2
Na2O + H2O === 2NaOH
氧元素化合价
阴阳离子个数比
-2
-1
O2-:Na+=1:2
:Na+=1:2
2Na2O2+2H2O===4NaOH+O2↑
你知道吗?
潜水艇中、呼吸面具的氧气怎么来的?
吹气生火
为什么脱脂棉会燃烧,燃烧的条件是什么?是什么在起作用?
脱脂棉
过氧化钠与CO2发
生反应放出热量
过氧化钠与CO2反应生成有氧气
2Na2O2+2CO2=2Na2CO3+O2
过氧化钠的化学性质
化学方程式:
2Na2O2+2CO2 = 2Na2CO3+O2
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
既是氧化剂又是还原剂
过氧化钠和二氧化碳反应放热,生成氧气和碳酸钠
Na2O2可作供氧剂,在呼吸面具和潜水艇中应用
你知道吗?
面粉发酵或制作油条,用到发酵粉和食用碱的成分是什么?
NaHCO3和Na2CO3
课本P38
02
碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠
观察碳酸钠、碳酸氢钠的外观并进行描述
[实验2-4]
在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
课本P38
盐 Na2CO3 NaHCO3
(1)观察Na2CO3和NaHCO3的外观并进行描述
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
(3)继续向(2)的试管中分别加入5mL水,用力振荡,有何现象
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
初步结论
碳酸钠和碳酸氢钠
课本P38-39
碳酸钠 碳酸氢钠
①观察碳酸钠、碳酸氢钠的外观并进行描述
②向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
③继续向②中的试管中分别加入5mL水,用力振荡,有何现象
④分别向③所得溶液中滴入1~2滴酚酞溶液,有何现象
初步结论 溶液变红(较深)
溶液变微红色
Na2CO3溶于水放出热量;Na2CO3比NaHCO3易溶于水;Na2CO3溶液碱性比NaHCO3溶液强。
振荡一段时间可溶解
固体并未完全溶解
温度计示数升高,溶解放热;
温度计示数降低,溶解吸热
白色粉末
白色细小晶体
加水结块成晶体Na2CO3·xH2O
碳酸钠与碳酸氢钠的热稳定性对比实验
[实验2-5]
如图所示,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
课本P39
碳酸钠与碳酸氢钠的热稳定性对比实验
实验操作 实验现象 化学方程式及结论
刚加热时,石灰水中有气泡,之后无气泡,澄清石灰水_____________
石灰水中有气泡,澄清石灰水 _____,试管口有 ____________
Na2CO3很稳定,受热不易发生分解
小液滴出现。
NaHCO3不稳定,受热容易分解,化学方程式为
碳酸钠与碳酸氢钠的热稳定性对比实验
课本P43
1. 除去Na,CO,粉末中混有的少量 NaHICO,的方法是__________________________________________ ,
所涉及的反应的化学方程式为__________________________________________
学以致用
加热
2NaHCO3==△===Na2CO3+H2O+CO2↑
6,某小组同学探究Na2CO3的性质,请你与他们一起完成,并回答问题。
(1)观察:描述Na2CO3的颜色、状态_________________________ ,
(2)预测:从物质的类别求看,Na2CO3______________类,可以与______________等类别的物质发生反应。
学以致用
课本P43
碳酸钠、碳酸氢钠与酸反应
在两支试管中分别加入等质量NaHCO3和Na2CO3,滴加等体积的稀盐酸,观察现象。
Na2CO3+HCl(少)=NaCl+NaHCO3
NaHCO3+HCl=NaCl+H2O+CO2 ↑
Na2CO3+2HCl(过)=2NaCl+H2O+CO2 ↑
Na2CO3现象:过一小段时间才产生气泡,速率较慢。
NaHCO3现象:立即产生气泡,速率较快。
深入了解
等质量的Na2CO3和NaHCO3与等浓度等体积酸反应
NaHCO3产生的CO2更多、更快。
现象对比与微观解析
Na2CO3 NaHCO3
较剧烈,一小段时间后才产生气泡,气球较小
很剧烈,立即产生气泡,气球较大
CO32-+H+=HCO3-
HCO3-+H+=H2O+CO2↑
HCO3-+H+=H2O+CO2↑
碳酸钠、碳酸氢钠与酸反应
碳酸钠、碳酸氢钠与碱反应
NaHCO3少量:__________________________________________
NaHCO3过量:__________________________________________
Na2CO3:
NaHCO3 :
Na2CO3:
NaHCO3 :不反应
Na2CO3 + Ca(OH)2 === CaCO3↓+ 2NaOH
Ca2++OH-+HCO3- ===CaCO3↓+H2O
Ca2++2OH-+2HCO3- ===CaCO3↓+2H2O+CO32-
Na2CO3 + CO2 + H2O === 2NaHCO3
Na2CO3:
NaHCO3 :不反应
Na2CO3 + BaCl2 === BaCO3↓+ 2NaCl
Ca(OH)2
CO2
BaCl2
学以致用
碳酸钠、碳酸氢钠鉴别
依据 方法
加热,有气体产生的是NaHCO3,无变化的是Na2CO3
有沉淀生成的是Na2CO3,无变化的是NaHCO3
生成气体剧烈的是NaHCO3相对不剧烈的是Na2CO3
立即产生气体的是NaHCO3,开始不产生气体,滴加一会才产生气体的是Na2CO3
热稳定性
CaCl2(BaCl2)
固体与盐酸反应的剧烈程度
溶液中逐滴滴加盐酸
小结
Na2CO3
NaHCO3
①CO2 + H2O
②NaOH
②HCl(少量)
①
Na2CO3和NaHCO3相互转化
类比推理
实验过程中,若通入二氧化碳时间较长,发现澄清的石灰水先变浑浊然后又变清,你知道为什么吗?
若将澄清石灰水换成饱和碳酸钠,会有什么现象呢?
现象:溶液变浑浊或有晶体析出
Na2CO3+CO2+H2O=2NaHCO3
CaCO3+CO2+H2O =Ca(HCO3)2
Ca(OH)2+CO2=CaCO3↓+H2O
NaHCO3溶解度比Na2CO3小,所以会析出碳酸氢钠晶体
侯氏制碱法
粗盐水
(含MgCl2、CaCl2)
沉 淀
过量Ca(OH)2
过量Na2CO3
操作a
流程Ⅰ
氨化
碳酸化
过滤
NH3
CO2
流程Ⅱ
煅烧碳酸氢钠
CO2和H2O
纯碱
Mg(OH)2、CaCO3
原理:
(1)NH3+H2O+CO2 +NaCl=NaHCO3↓ +NH4Cl
(2)2NaHCO3 == Na2CO3+H2O+CO2↑
你知道吗?
节日燃放的五彩缤纷的烟花是怎么来的吗?
03
焰色试验
焰色试验
把熔嵌在玻璃棒上的铂丝(或光洁无锈的铁丝)放在酒精灯(最好用煤气灯)外焰上灼烧,至与原来的火焰颜色相同为止。用铂丝(或铁丝)蘸取碳酸钠溶液,在外焰上灼烧,观察火焰的颜色。
课本P40
金属元素 Li Na K Ca Sr Ba Cu
焰色反应的颜色 紫红色 黄色 紫色 砖红色 洋红色 黄绿色 绿色
金属及化合物的焰色反应
1.每次试验完后,为什么都要用盐酸洗净铂,并灼烧至无色?
2.除金属的化合物之外,单质能不能有同样的现象呢?
因为金属氯化物灼烧时易气化而挥发,灼烧至无色后能除去能起焰色反应的少量杂质。
能,因为焰色反应是金属元素的性质,无论化合物还是单质,只要含有某种金属元素,这种物质就具有这种金属元素的焰色反应。
3.焰色反应的主要作用是什么?
由于一般钠盐、钾盐易溶于水,在溶液中又无颜色,无法通过其他反应进行检验“Na+”、“K+”,所以常常用焰色反应来检验。
学以致用
学以致用
4.焰色反应是物质的物理性质还是化学性质?
物理性质,属元素性质,与价态无关
5.进行钾及钾的化合物发生焰色反应实验时,为什么要透过蓝色钴玻璃去观察?
因钾及钾的化合物中可能混有钠元素,而钠的黄色火焰能掩盖钾的浅紫色火焰,而蓝色钴玻璃能滤去黄色的光,这样可以避免钾与钾的化合物中混有钠元素所造成的干扰。
金属及其化合物的研究思路
代表物
Na
Na2O和Na2O2
NaOH
Na2CO3和NaHCO3
物质类别
单质
氧化物
氢氧化物
盐
研究内容
物理性质
化学性质
制法
用途
……
研究视角
物质分类
元素化合价
反应规律
比较法
分类法
实验法
观察法
归纳法
小结
谢谢观看
请你说说!
复习回忆 活泼的金属单质——钠的性质!
结构
性质
+11
2
8
1
易失电子
+11
2
8
Na
Na+
决定
Na
O2
Na2O
Na2O2
O2
点燃
H2O
NaOH、H2
CuSO4
决定
用途
银白色
ρ=0.97g/cm3
质软
熔点 97.8℃
Cu(OH)2、H2
第一节
钠及其化合物
第 2 课时 钠的几种化合物
第二章 海水中的重要元素——钠和氯
断面呈银白色
切面
片刻后
迅速变暗
不切割
淡黄色
Na
Na2O
Na2O2
01
氧化钠和过氧化钠
氧化钠 过氧化钠
颜色、状态 白色固体 淡黄色固体
思考与讨论
(1)回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。
(2)氧化钠与水的反应和氧化钙与水的反应类似,请写出氧化钠与水反应的化学方程式。
课本P34
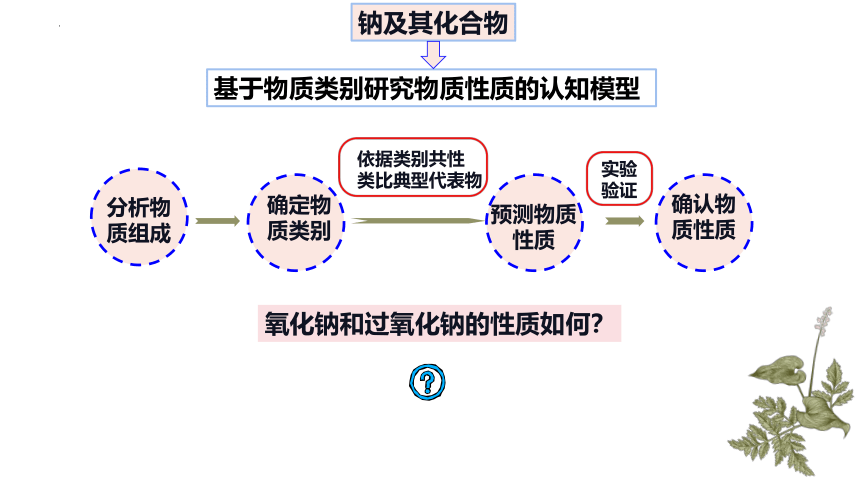
钠及其化合物
依据类别共性
类比典型代表物
实验
验证
预测物质性质
确认物质性质
分析物质组成
确定物质类别
基于物质类别研究物质性质的认知模型
氧化钠和过氧化钠的性质如何?
CaO + H2O Ca(OH)2
碱性氧化物 + 水 → 碱
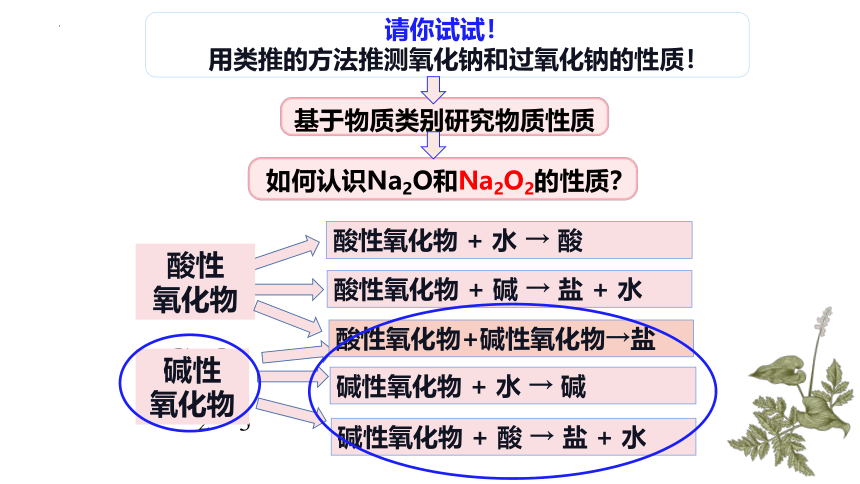
请你试试!
用类推的方法推测氧化钠和过氧化钠的性质!
CO2
酸性
氧化物
酸性氧化物 + 水 → 酸
酸性氧化物 + 碱 → 盐 + 水
CaO
Fe2O3
Fe2O3 + 6HCl 2FeCl3 + 3H2O
碱性氧化物 + 酸 → 盐 + 水
碱性
氧化物
酸性氧化物+碱性氧化物→盐
如何认识Na2O和Na2O2的性质?
基于物质类别研究物质性质
Na2O + H2O === 2NaOH
氧化钠与氧化钙一样都属于碱性氧化物,请你写出氧化钠与水、二氧化碳、盐酸反应的化学方程式。
Na2O + CO2 === Na2CO3
氧化钠的化学性质
Na2O + 2HCl === 2NaCl+H2O
1、与水反应
2、与二氧化碳反应
3、与盐酸反应
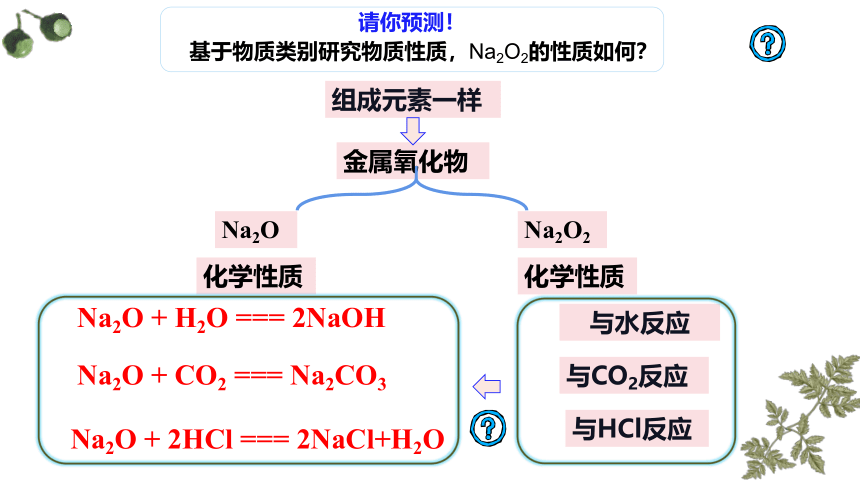
请你预测!
基于物质类别研究物质性质,Na2O2的性质如何?
组成元素一样
金属氧化物
Na2O
Na2O2
化学性质
Na2O + H2O === 2NaOH
Na2O + CO2 === Na2CO3
Na2O + 2HCl === 2NaCl+H2O
化学性质
与水反应
与CO2反应
与HCl反应
过氧化钠的化学性质
性质预测
设计方案
得出结论
实验探究
研究物质性质的一般程序
过氧化钠的化学性质
步骤
现象
结论
把带火星的木
条放在试管口
触摸试管外壁
向反应后的溶液
滴入酚酞溶液
气体为O2
反应放热
生成NaOH
放置一段时间后
漂白性
2Na2O2+2H2O===4NaOH+O2↑
-1 -2 0
化学方程式:
2Na2O2+2H2O == 4NaOH+O2↑
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
既是氧化剂又是还原剂
有漂白性
过氧化钠的化学性质
过氧化钠和水反应放热,生成氧气和氢氧化钠
过氧化钠有强氧化性和漂白性
氧化物
过氧化钠的化学性质
酸性氧化物
CO2
碱性氧化物
Na2O
过氧化物
Na2O2
Na2O + H2O === 2NaOH
氧元素化合价
阴阳离子个数比
-2
-1
O2-:Na+=1:2
:Na+=1:2
2Na2O2+2H2O===4NaOH+O2↑
你知道吗?
潜水艇中、呼吸面具的氧气怎么来的?
吹气生火
为什么脱脂棉会燃烧,燃烧的条件是什么?是什么在起作用?
脱脂棉
过氧化钠与CO2发
生反应放出热量
过氧化钠与CO2反应生成有氧气
2Na2O2+2CO2=2Na2CO3+O2
过氧化钠的化学性质
化学方程式:
2Na2O2+2CO2 = 2Na2CO3+O2
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
既是氧化剂又是还原剂
过氧化钠和二氧化碳反应放热,生成氧气和碳酸钠
Na2O2可作供氧剂,在呼吸面具和潜水艇中应用
你知道吗?
面粉发酵或制作油条,用到发酵粉和食用碱的成分是什么?
NaHCO3和Na2CO3
课本P38
02
碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠
观察碳酸钠、碳酸氢钠的外观并进行描述
[实验2-4]
在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
课本P38
盐 Na2CO3 NaHCO3
(1)观察Na2CO3和NaHCO3的外观并进行描述
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
(3)继续向(2)的试管中分别加入5mL水,用力振荡,有何现象
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
初步结论
碳酸钠和碳酸氢钠
课本P38-39
碳酸钠 碳酸氢钠
①观察碳酸钠、碳酸氢钠的外观并进行描述
②向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
③继续向②中的试管中分别加入5mL水,用力振荡,有何现象
④分别向③所得溶液中滴入1~2滴酚酞溶液,有何现象
初步结论 溶液变红(较深)
溶液变微红色
Na2CO3溶于水放出热量;Na2CO3比NaHCO3易溶于水;Na2CO3溶液碱性比NaHCO3溶液强。
振荡一段时间可溶解
固体并未完全溶解
温度计示数升高,溶解放热;
温度计示数降低,溶解吸热
白色粉末
白色细小晶体
加水结块成晶体Na2CO3·xH2O
碳酸钠与碳酸氢钠的热稳定性对比实验
[实验2-5]
如图所示,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
课本P39
碳酸钠与碳酸氢钠的热稳定性对比实验
实验操作 实验现象 化学方程式及结论
刚加热时,石灰水中有气泡,之后无气泡,澄清石灰水_____________
石灰水中有气泡,澄清石灰水 _____,试管口有 ____________
Na2CO3很稳定,受热不易发生分解
小液滴出现。
NaHCO3不稳定,受热容易分解,化学方程式为
碳酸钠与碳酸氢钠的热稳定性对比实验
课本P43
1. 除去Na,CO,粉末中混有的少量 NaHICO,的方法是__________________________________________ ,
所涉及的反应的化学方程式为__________________________________________
学以致用
加热
2NaHCO3==△===Na2CO3+H2O+CO2↑
6,某小组同学探究Na2CO3的性质,请你与他们一起完成,并回答问题。
(1)观察:描述Na2CO3的颜色、状态_________________________ ,
(2)预测:从物质的类别求看,Na2CO3______________类,可以与______________等类别的物质发生反应。
学以致用
课本P43
碳酸钠、碳酸氢钠与酸反应
在两支试管中分别加入等质量NaHCO3和Na2CO3,滴加等体积的稀盐酸,观察现象。
Na2CO3+HCl(少)=NaCl+NaHCO3
NaHCO3+HCl=NaCl+H2O+CO2 ↑
Na2CO3+2HCl(过)=2NaCl+H2O+CO2 ↑
Na2CO3现象:过一小段时间才产生气泡,速率较慢。
NaHCO3现象:立即产生气泡,速率较快。
深入了解
等质量的Na2CO3和NaHCO3与等浓度等体积酸反应
NaHCO3产生的CO2更多、更快。
现象对比与微观解析
Na2CO3 NaHCO3
较剧烈,一小段时间后才产生气泡,气球较小
很剧烈,立即产生气泡,气球较大
CO32-+H+=HCO3-
HCO3-+H+=H2O+CO2↑
HCO3-+H+=H2O+CO2↑
碳酸钠、碳酸氢钠与酸反应
碳酸钠、碳酸氢钠与碱反应
NaHCO3少量:__________________________________________
NaHCO3过量:__________________________________________
Na2CO3:
NaHCO3 :
Na2CO3:
NaHCO3 :不反应
Na2CO3 + Ca(OH)2 === CaCO3↓+ 2NaOH
Ca2++OH-+HCO3- ===CaCO3↓+H2O
Ca2++2OH-+2HCO3- ===CaCO3↓+2H2O+CO32-
Na2CO3 + CO2 + H2O === 2NaHCO3
Na2CO3:
NaHCO3 :不反应
Na2CO3 + BaCl2 === BaCO3↓+ 2NaCl
Ca(OH)2
CO2
BaCl2
学以致用
碳酸钠、碳酸氢钠鉴别
依据 方法
加热,有气体产生的是NaHCO3,无变化的是Na2CO3
有沉淀生成的是Na2CO3,无变化的是NaHCO3
生成气体剧烈的是NaHCO3相对不剧烈的是Na2CO3
立即产生气体的是NaHCO3,开始不产生气体,滴加一会才产生气体的是Na2CO3
热稳定性
CaCl2(BaCl2)
固体与盐酸反应的剧烈程度
溶液中逐滴滴加盐酸
小结
Na2CO3
NaHCO3
①CO2 + H2O
②NaOH
②HCl(少量)
①
Na2CO3和NaHCO3相互转化
类比推理
实验过程中,若通入二氧化碳时间较长,发现澄清的石灰水先变浑浊然后又变清,你知道为什么吗?
若将澄清石灰水换成饱和碳酸钠,会有什么现象呢?
现象:溶液变浑浊或有晶体析出
Na2CO3+CO2+H2O=2NaHCO3
CaCO3+CO2+H2O =Ca(HCO3)2
Ca(OH)2+CO2=CaCO3↓+H2O
NaHCO3溶解度比Na2CO3小,所以会析出碳酸氢钠晶体
侯氏制碱法
粗盐水
(含MgCl2、CaCl2)
沉 淀
过量Ca(OH)2
过量Na2CO3
操作a
流程Ⅰ
氨化
碳酸化
过滤
NH3
CO2
流程Ⅱ
煅烧碳酸氢钠
CO2和H2O
纯碱
Mg(OH)2、CaCO3
原理:
(1)NH3+H2O+CO2 +NaCl=NaHCO3↓ +NH4Cl
(2)2NaHCO3 == Na2CO3+H2O+CO2↑
你知道吗?
节日燃放的五彩缤纷的烟花是怎么来的吗?
03
焰色试验
焰色试验
把熔嵌在玻璃棒上的铂丝(或光洁无锈的铁丝)放在酒精灯(最好用煤气灯)外焰上灼烧,至与原来的火焰颜色相同为止。用铂丝(或铁丝)蘸取碳酸钠溶液,在外焰上灼烧,观察火焰的颜色。
课本P40
金属元素 Li Na K Ca Sr Ba Cu
焰色反应的颜色 紫红色 黄色 紫色 砖红色 洋红色 黄绿色 绿色
金属及化合物的焰色反应
1.每次试验完后,为什么都要用盐酸洗净铂,并灼烧至无色?
2.除金属的化合物之外,单质能不能有同样的现象呢?
因为金属氯化物灼烧时易气化而挥发,灼烧至无色后能除去能起焰色反应的少量杂质。
能,因为焰色反应是金属元素的性质,无论化合物还是单质,只要含有某种金属元素,这种物质就具有这种金属元素的焰色反应。
3.焰色反应的主要作用是什么?
由于一般钠盐、钾盐易溶于水,在溶液中又无颜色,无法通过其他反应进行检验“Na+”、“K+”,所以常常用焰色反应来检验。
学以致用
学以致用
4.焰色反应是物质的物理性质还是化学性质?
物理性质,属元素性质,与价态无关
5.进行钾及钾的化合物发生焰色反应实验时,为什么要透过蓝色钴玻璃去观察?
因钾及钾的化合物中可能混有钠元素,而钠的黄色火焰能掩盖钾的浅紫色火焰,而蓝色钴玻璃能滤去黄色的光,这样可以避免钾与钾的化合物中混有钠元素所造成的干扰。
金属及其化合物的研究思路
代表物
Na
Na2O和Na2O2
NaOH
Na2CO3和NaHCO3
物质类别
单质
氧化物
氢氧化物
盐
研究内容
物理性质
化学性质
制法
用途
……
研究视角
物质分类
元素化合价
反应规律
比较法
分类法
实验法
观察法
归纳法
小结
谢谢观看
