2.2.1化学平衡状态 课件(共19张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2.1化学平衡状态 课件(共19张ppt)化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-31 23:21:16 | ||
图片预览





文档简介
(共19张PPT)
第二章 化学反应速率与化学平衡
第1课时 化学平衡状态
第二节 化学平衡
CHEMICAL REACTION RATE AND CHEMICAL EQUILIBRIUM
第二章
合成氨是人类科学技术发展史上的一项重大成就,在农业、工业生产中具有及其重要的意义,满足了人类的需求。其原理如下:
如何提高生产效率呢?只要尽力提高化学反应速率生产效率就一定高吗?
2NH3
N2 + 3H2
催化剂
高温、高压
阅读思考
工业生产中的两个关键
①反应速率:快出产品
②化学平衡:多出产品
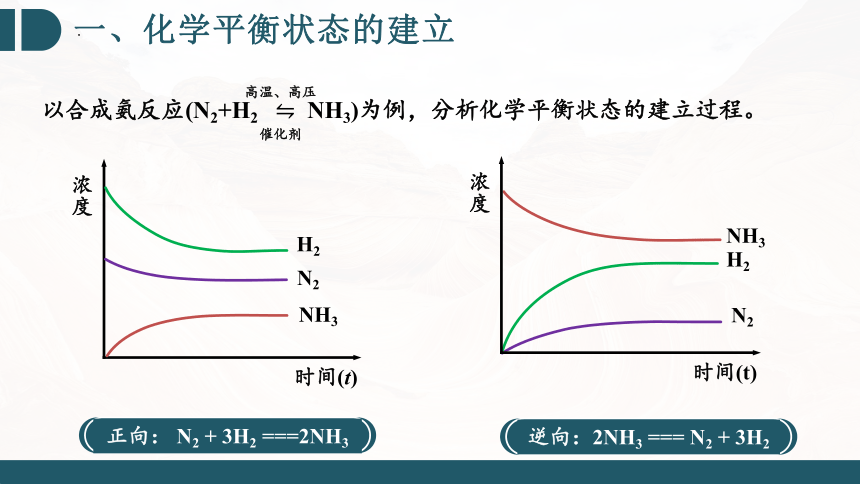
一、化学平衡状态的建立
浓度
时间(t)
NH3
N2
H2
正向: N2 + 3H2 ===2NH3
逆向:2NH3 === N2 + 3H2
NH3
N2
H2
浓度
时间(t)
以合成氨反应(N2+H2 NH3)为例,分析化学平衡状态的建立过程。
催化剂
高温、高压
一、化学平衡状态的建立
正向: N2 + 3H2 ===2NH3
逆向:2NH3 === N2 + 3H2
以合成氨反应(N2+H2 NH3)为例,分析化学平衡状态的建立过程。
催化剂
高温、高压
v(正)>v(逆)
v(正)
v(逆)
反应速率
时间(t)
反应处于平衡状态
t1
v(正)= v(逆)
v(逆)>v(正)
v(逆)
v(正)
反应速率
时间(t)
反应处于平衡状态
t1
v(正)= v(逆)
二、化学平衡状态
定义
在一定条件下,在可逆反应体系中,正反应速率与逆反应速率相等,反应物的浓度与生成物的浓度均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态我们称之为化学平衡状态,简称化学平衡。
即达到此条件下的最大转化率,反应的最大程度。
转化率(α)
=
转化的量
起始的量
×100%
量: 质量、物质的量、体积、物质的量浓度等
二、化学平衡状态
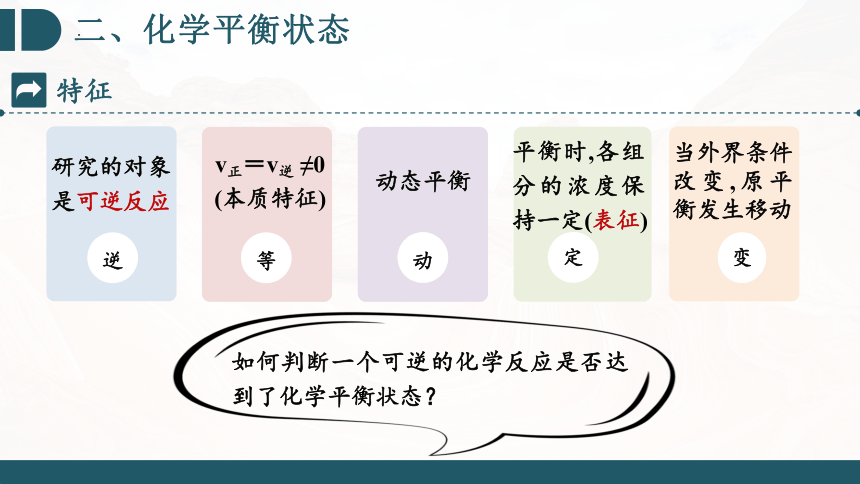
动态平衡
平衡时,各组分的浓度保持一定(表征)
当外界条件改变,原平衡发生移动
研究的对象是可逆反应
逆
v正=v逆 ≠0
(本质特征)
等
动
定
变
特征
如何判断一个可逆的化学反应是否达到了化学平衡状态?
三、化学平衡状态的判断
直接标志——v正=v逆 ≠0(正逆相等)
②速率之比化学方程式中相应的化学计量数之比。
①表示两个不同的方向。
必须符合两方面
a.同一物质的生成速率等于其消耗速率
c.在化学方程式两边的不同物质的生成(或消耗)速率之比等化学计量数之比
b. 在化学方程式同一边的不同物质,一种物质的生成速率与另一种物质的消耗速率之比等于化学计量数之比
典例精讲
3v(N2)=v(H2) ( )
状态01
2v正(N2) = v逆(NH3) ( )
状态02
消耗 1 mol N2的同时,生成2 mol NH3 ( )
状态03
1 mol H-H键断裂的同时,2molN-H键断裂 ( )
状态04
单位时间内消耗的N2量是NH3量的两倍 ( )
状态05
【例1】 ,请根据所学:判断下列描述的反应状态是否达到平衡。
N2 + 3H2 2NH3
三、化学平衡状态的判断
各组分的量不再变化时达到化学平衡状态
各组分的质量、物质的量、物质的量浓度不变
各组分的转化率或产率不变
各组分的百分含量(体积分数、质量分数)不变
各组分的量成一定比值时不一定达到平衡
只有生成物有气体时,体积分数始终不变,不是变量
间接标志——变量不变
三、化学平衡状态的判断
间接标志——变量不变
气体的p总、V总、n总(pV=nRT)
左=右:______
看两边气体
计量数之和
左≠右:______
例如:N2 + 3H2 2NH3
变量
定量
例如:反应2HI H2+I2
气体的n总不变时
恒温恒容 密闭容器,p总不变时
恒温恒压 密闭容器,V总不变时
A(g) + B(g) C(g)
A(s) + B(g) C(g)
气体平均相对分子质量M
三、化学平衡状态的判断
M=
m总
n总
看气体化学计量系数
看物质状态
①以mA(g)+nB(g) pC(g)+qD(g) 为例:
若各物质均为气体且m+n≠p+q
若各物质均为气体,且m+n=p+q
间接标志——变量不变
M不变时,即为平衡状态
M不变时,不一定为平衡状态
气体平均相对分子质量M
三、化学平衡状态的判断
M=
m总
n总
看气体化学计量系数
看物质状态
②有非气体参加的反应:
2A(g)+ B(s) 2C(g)
NH2COONH4(s) 2NH3(g) + CO2(g)
间接标志——变量不变
M不变时,即为平衡状态
M不变时,不一定为平衡状态
气体密度 ρ
三、化学平衡状态的判断
间接标志——变量不变
ρ=
m总
V
看气体化学计量系数
看物质状态
①以mA(g)+nB(g) pC(g)+qD(g) 为例:
恒容
恒压
若m+n≠p+q
若m+n=p+q
ρ不变时,不一定为平衡状态
ρ不变时,不一定为平衡状态
ρ不变时,即为平衡状态
气体密度 ρ
三、化学平衡状态的判断
间接标志——变量不变
ρ=
m总
V
看气体化学计量系数
看物质状态
②有非气体参加的反应:
Ni(s) + 4CO(g) Ni(CO)4(g)
ρ不变时,即为平衡状态
恒容
恒压
体系颜色或温度
三、化学平衡状态的判断
间接标志——变量不变
①对于有色物质参加反应,如果体系颜色不变,反应达到平衡。
②绝热条件下,对于吸热或放热反应,如果体系温度不变,反应达到平衡。
典例精讲
【例2】在一个绝热的固定容积的密闭容器中,发生可逆反应mA(g)+nB(g) pC(g)+qD(s),当m+n=p为任意整数时,一定可以作为反应达到平衡状态的标志是( )
①体系的压强不再改变
②体系的温度不再改变
③体系的密度不再变化
④各组分质量分数不再改变
A.①②③
B.①②③④
C.②③④
D.③④
B
演练—题组冲关
1.NO和O2混合后可发生反应:①2NO(g)+O2(g) === 2NO2(g)、②2NO2(g) N2O4(g),反应体系中含氮物质的物质的量浓度c随着时间t的变化曲线如图所示。下列说法正确的是
A.c为c(NO2)随t的变化曲线
B.t1时,c(NO)+c(NO2)+c(N2O4)=c0
C.t2时刻,NO2的消耗速率大于生成速率
D.t3时,反应①和②均达到化学平衡状态
C
2.在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)C(g)+D(g),下列描述中能表明反应已达到平衡状态的有几个
①容器内温度不变; ②混合气体的密度不变
③混合气体的压强不变; ④混合气体的平均相对分子质量不变
⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1
⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成nmolD,同时生成2nmolA
A.4 B.5 C.6 D.8
演练—题组冲关
C
课堂小结
CLASS SUMMARY
化学平衡状态
化学平衡状态的建立
化学平衡状态的判断
化学平衡状态
直接标志——
“正逆反应速率相等”
间接标志——“变量不变”
定义
特征:逆、等、动、定、变
第二章 化学反应速率与化学平衡
第1课时 化学平衡状态
第二节 化学平衡
CHEMICAL REACTION RATE AND CHEMICAL EQUILIBRIUM
第二章
合成氨是人类科学技术发展史上的一项重大成就,在农业、工业生产中具有及其重要的意义,满足了人类的需求。其原理如下:
如何提高生产效率呢?只要尽力提高化学反应速率生产效率就一定高吗?
2NH3
N2 + 3H2
催化剂
高温、高压
阅读思考
工业生产中的两个关键
①反应速率:快出产品
②化学平衡:多出产品
一、化学平衡状态的建立
浓度
时间(t)
NH3
N2
H2
正向: N2 + 3H2 ===2NH3
逆向:2NH3 === N2 + 3H2
NH3
N2
H2
浓度
时间(t)
以合成氨反应(N2+H2 NH3)为例,分析化学平衡状态的建立过程。
催化剂
高温、高压
一、化学平衡状态的建立
正向: N2 + 3H2 ===2NH3
逆向:2NH3 === N2 + 3H2
以合成氨反应(N2+H2 NH3)为例,分析化学平衡状态的建立过程。
催化剂
高温、高压
v(正)>v(逆)
v(正)
v(逆)
反应速率
时间(t)
反应处于平衡状态
t1
v(正)= v(逆)
v(逆)>v(正)
v(逆)
v(正)
反应速率
时间(t)
反应处于平衡状态
t1
v(正)= v(逆)
二、化学平衡状态
定义
在一定条件下,在可逆反应体系中,正反应速率与逆反应速率相等,反应物的浓度与生成物的浓度均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态我们称之为化学平衡状态,简称化学平衡。
即达到此条件下的最大转化率,反应的最大程度。
转化率(α)
=
转化的量
起始的量
×100%
量: 质量、物质的量、体积、物质的量浓度等
二、化学平衡状态
动态平衡
平衡时,各组分的浓度保持一定(表征)
当外界条件改变,原平衡发生移动
研究的对象是可逆反应
逆
v正=v逆 ≠0
(本质特征)
等
动
定
变
特征
如何判断一个可逆的化学反应是否达到了化学平衡状态?
三、化学平衡状态的判断
直接标志——v正=v逆 ≠0(正逆相等)
②速率之比化学方程式中相应的化学计量数之比。
①表示两个不同的方向。
必须符合两方面
a.同一物质的生成速率等于其消耗速率
c.在化学方程式两边的不同物质的生成(或消耗)速率之比等化学计量数之比
b. 在化学方程式同一边的不同物质,一种物质的生成速率与另一种物质的消耗速率之比等于化学计量数之比
典例精讲
3v(N2)=v(H2) ( )
状态01
2v正(N2) = v逆(NH3) ( )
状态02
消耗 1 mol N2的同时,生成2 mol NH3 ( )
状态03
1 mol H-H键断裂的同时,2molN-H键断裂 ( )
状态04
单位时间内消耗的N2量是NH3量的两倍 ( )
状态05
【例1】 ,请根据所学:判断下列描述的反应状态是否达到平衡。
N2 + 3H2 2NH3
三、化学平衡状态的判断
各组分的量不再变化时达到化学平衡状态
各组分的质量、物质的量、物质的量浓度不变
各组分的转化率或产率不变
各组分的百分含量(体积分数、质量分数)不变
各组分的量成一定比值时不一定达到平衡
只有生成物有气体时,体积分数始终不变,不是变量
间接标志——变量不变
三、化学平衡状态的判断
间接标志——变量不变
气体的p总、V总、n总(pV=nRT)
左=右:______
看两边气体
计量数之和
左≠右:______
例如:N2 + 3H2 2NH3
变量
定量
例如:反应2HI H2+I2
气体的n总不变时
恒温恒容 密闭容器,p总不变时
恒温恒压 密闭容器,V总不变时
A(g) + B(g) C(g)
A(s) + B(g) C(g)
气体平均相对分子质量M
三、化学平衡状态的判断
M=
m总
n总
看气体化学计量系数
看物质状态
①以mA(g)+nB(g) pC(g)+qD(g) 为例:
若各物质均为气体且m+n≠p+q
若各物质均为气体,且m+n=p+q
间接标志——变量不变
M不变时,即为平衡状态
M不变时,不一定为平衡状态
气体平均相对分子质量M
三、化学平衡状态的判断
M=
m总
n总
看气体化学计量系数
看物质状态
②有非气体参加的反应:
2A(g)+ B(s) 2C(g)
NH2COONH4(s) 2NH3(g) + CO2(g)
间接标志——变量不变
M不变时,即为平衡状态
M不变时,不一定为平衡状态
气体密度 ρ
三、化学平衡状态的判断
间接标志——变量不变
ρ=
m总
V
看气体化学计量系数
看物质状态
①以mA(g)+nB(g) pC(g)+qD(g) 为例:
恒容
恒压
若m+n≠p+q
若m+n=p+q
ρ不变时,不一定为平衡状态
ρ不变时,不一定为平衡状态
ρ不变时,即为平衡状态
气体密度 ρ
三、化学平衡状态的判断
间接标志——变量不变
ρ=
m总
V
看气体化学计量系数
看物质状态
②有非气体参加的反应:
Ni(s) + 4CO(g) Ni(CO)4(g)
ρ不变时,即为平衡状态
恒容
恒压
体系颜色或温度
三、化学平衡状态的判断
间接标志——变量不变
①对于有色物质参加反应,如果体系颜色不变,反应达到平衡。
②绝热条件下,对于吸热或放热反应,如果体系温度不变,反应达到平衡。
典例精讲
【例2】在一个绝热的固定容积的密闭容器中,发生可逆反应mA(g)+nB(g) pC(g)+qD(s),当m+n=p为任意整数时,一定可以作为反应达到平衡状态的标志是( )
①体系的压强不再改变
②体系的温度不再改变
③体系的密度不再变化
④各组分质量分数不再改变
A.①②③
B.①②③④
C.②③④
D.③④
B
演练—题组冲关
1.NO和O2混合后可发生反应:①2NO(g)+O2(g) === 2NO2(g)、②2NO2(g) N2O4(g),反应体系中含氮物质的物质的量浓度c随着时间t的变化曲线如图所示。下列说法正确的是
A.c为c(NO2)随t的变化曲线
B.t1时,c(NO)+c(NO2)+c(N2O4)=c0
C.t2时刻,NO2的消耗速率大于生成速率
D.t3时,反应①和②均达到化学平衡状态
C
2.在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)C(g)+D(g),下列描述中能表明反应已达到平衡状态的有几个
①容器内温度不变; ②混合气体的密度不变
③混合气体的压强不变; ④混合气体的平均相对分子质量不变
⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1
⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成nmolD,同时生成2nmolA
A.4 B.5 C.6 D.8
演练—题组冲关
C
课堂小结
CLASS SUMMARY
化学平衡状态
化学平衡状态的建立
化学平衡状态的判断
化学平衡状态
直接标志——
“正逆反应速率相等”
间接标志——“变量不变”
定义
特征:逆、等、动、定、变
