1.2反应热的计算 课件(共27张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.2反应热的计算 课件(共27张ppt)化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-31 23:39:51 | ||
图片预览







文档简介
(共27张PPT)
第二节
反应热的计算
第一章 化学反应的热效应
学习目标
1. 知道盖斯定律的内容,能用盖斯定律进行有关反应热的简单计算
2. 学会有关反应热计算的方法技巧,进一步提高化学计算的能力
许多反应热可以通过实验直接测定
有些反应热无法通过实验直接测定(难以控制反应的程度的反应)
C(s) + O2(g) = CO(g) ΔH =
新课导入
来自实验室的难题
C(s)+1/2O2(g) == CO(g) H3=?
3
C(s)+O2(g)==CO2(g) H1=–393.5 kJ/mol
1
CO(g)+ O2(g)==CO2(g) H2= – 283.0 kJ/mol
2
1
2
实验室可通过可燃物充分燃烧来测定反应热
氧气稍过量可让
可燃物的燃烧更
充分噢!
容易测定
这个有点难测定噢!同学们说说看,难在哪?
不易测定
一、盖斯定律
盖斯的简介
一. 盖斯定律
盖斯
G.H.
瑞士
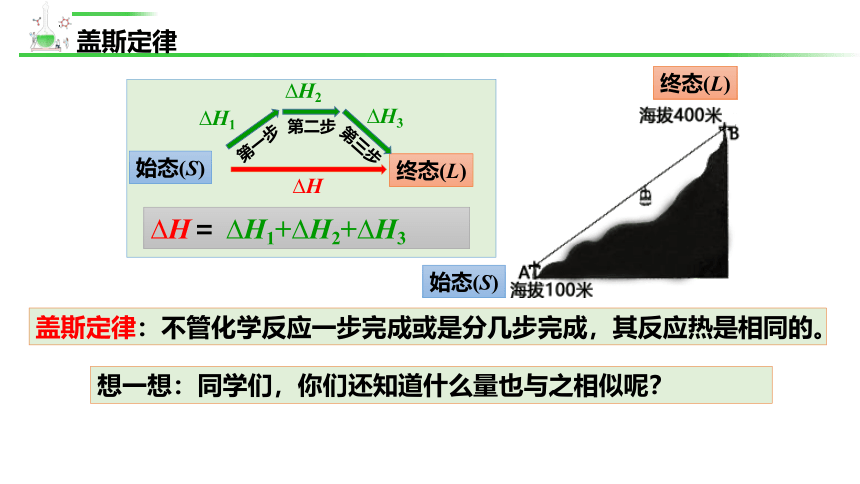
盖斯定律:不管化学反应一步完成或是分几步完成,其反应热是相同的。
始态(S)
终态(L)
H
H = H1+ H2+ H3
反应热只与反应体系
的始态和终态有关,
与反应途径无关
H2
第二步
H1
第一步
H3
第三步
一、盖斯定律
盖斯定律
盖斯定律:不管化学反应一步完成或是分几步完成,其反应热是相同的。
始态(S)
终态(L)
H1
H2
H3
H
H= H1+ H2+ H3
想一想:同学们,你们还知道什么量也与之相似呢?
始态(S)
终态(L)
第二步
第一步
第三步
C(s)+ O2(g)
CO2(g)
△H1
△H3
△H1= △H2 + △H3
CO(g) + O2(g)
1
2
△H2
△H3 =△H1 - △H2
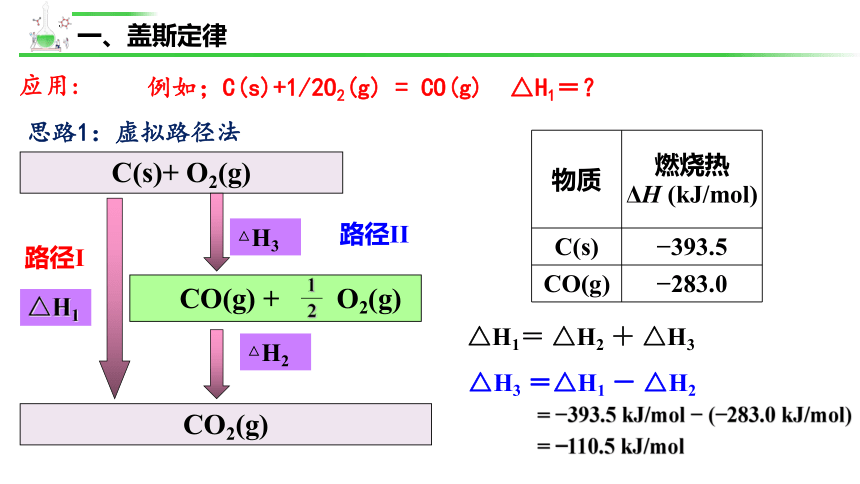
应用:
例如;C(s)+1/2O2(g) = CO(g) △H1=?
物质 燃烧热
ΔH (kJ/mol)
C(s) 393.5
CO(g) 283.0
思路1:虚拟路径法
路径I
路径II
= 393.5 kJ/mol ( 283.0 kJ/mol)
= 110.5 kJ/mol
一、盖斯定律
C(s) + O2(g) = CO(g) △H3=?
CO(g)+ O2(g) = CO2(g) △H2=-283.0 kJ/mol
C(s) + O2(g) = CO2(g) △H1=-393.5 kJ/mol
+)
△H3 =△H1 - △H2
= -393.5 kJ/mol -(-283.0 kJ/mol)= -110.5 kJ/mol
1
2
1
2
C(s) + O2(g) = CO(g) △H3= -110.5 kJ/mol
1
2
②加合法
即运用所给热化学方程式通过加减的方法得到所求热化学方程式。
思路2:代数运算法
一、盖斯定律
关键:目标方程式的“四则运算式”的导出(消元法)
方法:写出目标方程式确定“过渡物质” (要消去的物质)然后用消元法逐一消去“过渡物质”,导出“四则运算式”。
一、盖斯定律
图例说明
从反应途径角度:A→D:
ΔH=ΔH1+ΔH2+ΔH3
=-(ΔH4+ΔH5+ΔH6);
从能量守恒角度:
ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0。
一、盖斯定律
小结:利用盖斯定律计算反应热的一般步骤
总结
(1)确定待求反应的热化学方程式;
(2)找出待求热化学方程式中各物质出现在已知方程式中的位置(是同侧还是异侧);
(3)利用同侧相加、异侧相减进行处理;
(4)根据未知方程式中各物质的化学计量数通过乘除来调整已知反应的化学计量数,并消去中间产物;
(5)实施叠加并确定反应热的变化。
一、盖斯定律
例题1;已知 ① CO(g) + 1/2 O2(g) = CO2(g) ; ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) = H2O(l) ; ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l); ΔH3=-1370 kJ/mol
试计算: ④ 2CO(g)+ 4 H2(g) = H2O(l)+ C2H5OH (l) 的ΔH
【解】:①×2 + ②×4 - ③ = ④
ΔH=ΔH1×2 +ΔH2×4 -ΔH3
=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
一、盖斯定律
应用盖斯定律计算反应热时应注意的事项
1.热化学方程式中物质的化学计量数同乘以某一个数时,反应热数值也必须乘上该数。
2.热化学方程式相加减时,反应热也随之相加减。
3.将一个热化学方程式颠倒时,ΔH的“+”、“-”号必须随之改变。
4.若热化学方程式需相减,最好能先把被减方程式进行颠倒,然后相加,更不易出错。
一、盖斯定律
查燃烧热表知:
①C(石墨,s)+O2(g)= CO2(g) △H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)= CO2(g) △H2=-395.0kJ/mol
解:①- ②得:C(石墨,s)= C(金刚石,s) ; △H=+1.5kJ/mol
例题2:写出石墨变成金刚石的热化学方程式 (25℃,101kPa时)
一、盖斯定律
图例说明
从反应途径角度:A→D:
从能量守恒角度:
ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6)
ΔH=
对盖斯定律的理解
任务:C(s) + O2(g) = CO(g) ΔH =
CO(g) + O2(g)
ΔH2
ΔH3=
CO2(g)
C(s) + O2(g)
ΔH1
ΔH1 = ΔH2 + ΔH3
ΔH3 =ΔH1 ΔH2 = 393.5 kJ/mol ( 283.0 kJ/mol) = 110.5 kJ/mol
思路1:虚拟路径法
物质 燃烧热ΔH (kJ/mol)
C(s) 393.5
CO(g) 283.0
思考
思路2:加合法
ΔH3 = ΔH1 ΔH2= 110.5 kJ/mol
已知:
① C(s) + O2(g) = CO2(g) ΔH1= 393.5 kJ/mol
② CO(g) + O2(g) = CO2(g) ΔH2= 283.0 kJ/mol
任务:C(s) + O2(g) = CO(g) ΔH =
思考
C(s) + O2(g) = CO2(g) ΔH1 = 393.5 kJ/mol
-) CO(g) + O2(g) = CO2(g) ΔH2 = 283.0 kJ/mol
未知反应: C(s) + O2(g) = CO(g)
火箭发射时可以用肼(N2H4,液态)作燃料,NO2作氧化剂。
已知:① N2(g) + 2O2(g) = 2NO2(g) △H1= +66.4 kJ/mol
② N2H4(l) + O2(g) = N2(g) + 2H2O(g) △H2= -534 kJ/mol
试计算 2N2H4(l) + 2NO2(g) = 3N2(g) + 4H2O(g) 的△H。
②×2-①
△H= - 1134.4kJ/mol
已知 ①CO(g) + 1/2 O2(g) = CO2(g) ; ΔH1= -283.0 kJ/mol
②H2(g) + 1/2 O2(g) = H2O(l) ; ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l); ΔH3=-1370kJ/mol
试计算: ④2CO(g)+ 4 H2(g) = H2O(l)+ C2H5OH (l)的ΔH
【解】:①×2 + ②×4 - ③ = ④
ΔH=ΔH1×2 +ΔH2×4 -ΔH3
=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
2、根据热化学方程式、盖斯定律和燃烧热的数据进行反应热的计算
二. 反应热的计算
1、运用盖斯定律计算
3、依据物质的燃烧热ΔH: Q放=n可燃物×|ΔH|。
例2. 乙醇的燃烧热: ΔH=-1 366.8 kJ/mol,在25 ℃、101 kPa,1 kg乙醇充分燃烧放出多少热量?
二. 反应热的计算
ΔH=反应物总键能-生成物总键能=E吸-E放
物质 CO2 (C=O) CH4 (C-H) P4 (P-P) SiO2 (Si-O) 石墨 金刚石 S8 (S-S) Si
键数 2 4 6 4 1.5 2 8 2
常见物质中的化学键数目
4、利用键能来计算
二. 反应热的计算
【例题】白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P===O c kJ·mol-1、O===O d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
A
ΔH=生成物的总能量 - 反应物的总能量
图像
ΔH=(a-b)kJ·mol-1=-c kJ·mol-1
ΔH=(a-b)kJ·mol-1=+c kJ·mol-1
4、利用总能量来计算
1.ΔH是有符号“+”“-”的,比较时要带着符号比较。
(1)吸热反应的ΔH为“+”,所以吸热越多,ΔH越大。
(2)放热反应的ΔH 为“-”,所以放热越多,ΔH越小。
三、反应热(ΔH)的大小比较
2.同一反应,反应物或生成物的状态不同时
A(g)+B(g)=C(g) ΔH1<0
A(g)+B(g)=C(l) ΔH2<0
如S(g)+O2(g)=SO2(g) ΔH1=-a kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH2=-b kJ·mol-1
第二节
反应热的计算
第一章 化学反应的热效应
学习目标
1. 知道盖斯定律的内容,能用盖斯定律进行有关反应热的简单计算
2. 学会有关反应热计算的方法技巧,进一步提高化学计算的能力
许多反应热可以通过实验直接测定
有些反应热无法通过实验直接测定(难以控制反应的程度的反应)
C(s) + O2(g) = CO(g) ΔH =
新课导入
来自实验室的难题
C(s)+1/2O2(g) == CO(g) H3=?
3
C(s)+O2(g)==CO2(g) H1=–393.5 kJ/mol
1
CO(g)+ O2(g)==CO2(g) H2= – 283.0 kJ/mol
2
1
2
实验室可通过可燃物充分燃烧来测定反应热
氧气稍过量可让
可燃物的燃烧更
充分噢!
容易测定
这个有点难测定噢!同学们说说看,难在哪?
不易测定
一、盖斯定律
盖斯的简介
一. 盖斯定律
盖斯
G.H.
瑞士
盖斯定律:不管化学反应一步完成或是分几步完成,其反应热是相同的。
始态(S)
终态(L)
H
H = H1+ H2+ H3
反应热只与反应体系
的始态和终态有关,
与反应途径无关
H2
第二步
H1
第一步
H3
第三步
一、盖斯定律
盖斯定律
盖斯定律:不管化学反应一步完成或是分几步完成,其反应热是相同的。
始态(S)
终态(L)
H1
H2
H3
H
H= H1+ H2+ H3
想一想:同学们,你们还知道什么量也与之相似呢?
始态(S)
终态(L)
第二步
第一步
第三步
C(s)+ O2(g)
CO2(g)
△H1
△H3
△H1= △H2 + △H3
CO(g) + O2(g)
1
2
△H2
△H3 =△H1 - △H2
应用:
例如;C(s)+1/2O2(g) = CO(g) △H1=?
物质 燃烧热
ΔH (kJ/mol)
C(s) 393.5
CO(g) 283.0
思路1:虚拟路径法
路径I
路径II
= 393.5 kJ/mol ( 283.0 kJ/mol)
= 110.5 kJ/mol
一、盖斯定律
C(s) + O2(g) = CO(g) △H3=?
CO(g)+ O2(g) = CO2(g) △H2=-283.0 kJ/mol
C(s) + O2(g) = CO2(g) △H1=-393.5 kJ/mol
+)
△H3 =△H1 - △H2
= -393.5 kJ/mol -(-283.0 kJ/mol)= -110.5 kJ/mol
1
2
1
2
C(s) + O2(g) = CO(g) △H3= -110.5 kJ/mol
1
2
②加合法
即运用所给热化学方程式通过加减的方法得到所求热化学方程式。
思路2:代数运算法
一、盖斯定律
关键:目标方程式的“四则运算式”的导出(消元法)
方法:写出目标方程式确定“过渡物质” (要消去的物质)然后用消元法逐一消去“过渡物质”,导出“四则运算式”。
一、盖斯定律
图例说明
从反应途径角度:A→D:
ΔH=ΔH1+ΔH2+ΔH3
=-(ΔH4+ΔH5+ΔH6);
从能量守恒角度:
ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0。
一、盖斯定律
小结:利用盖斯定律计算反应热的一般步骤
总结
(1)确定待求反应的热化学方程式;
(2)找出待求热化学方程式中各物质出现在已知方程式中的位置(是同侧还是异侧);
(3)利用同侧相加、异侧相减进行处理;
(4)根据未知方程式中各物质的化学计量数通过乘除来调整已知反应的化学计量数,并消去中间产物;
(5)实施叠加并确定反应热的变化。
一、盖斯定律
例题1;已知 ① CO(g) + 1/2 O2(g) = CO2(g) ; ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) = H2O(l) ; ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l); ΔH3=-1370 kJ/mol
试计算: ④ 2CO(g)+ 4 H2(g) = H2O(l)+ C2H5OH (l) 的ΔH
【解】:①×2 + ②×4 - ③ = ④
ΔH=ΔH1×2 +ΔH2×4 -ΔH3
=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
一、盖斯定律
应用盖斯定律计算反应热时应注意的事项
1.热化学方程式中物质的化学计量数同乘以某一个数时,反应热数值也必须乘上该数。
2.热化学方程式相加减时,反应热也随之相加减。
3.将一个热化学方程式颠倒时,ΔH的“+”、“-”号必须随之改变。
4.若热化学方程式需相减,最好能先把被减方程式进行颠倒,然后相加,更不易出错。
一、盖斯定律
查燃烧热表知:
①C(石墨,s)+O2(g)= CO2(g) △H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)= CO2(g) △H2=-395.0kJ/mol
解:①- ②得:C(石墨,s)= C(金刚石,s) ; △H=+1.5kJ/mol
例题2:写出石墨变成金刚石的热化学方程式 (25℃,101kPa时)
一、盖斯定律
图例说明
从反应途径角度:A→D:
从能量守恒角度:
ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6)
ΔH=
对盖斯定律的理解
任务:C(s) + O2(g) = CO(g) ΔH =
CO(g) + O2(g)
ΔH2
ΔH3=
CO2(g)
C(s) + O2(g)
ΔH1
ΔH1 = ΔH2 + ΔH3
ΔH3 =ΔH1 ΔH2 = 393.5 kJ/mol ( 283.0 kJ/mol) = 110.5 kJ/mol
思路1:虚拟路径法
物质 燃烧热ΔH (kJ/mol)
C(s) 393.5
CO(g) 283.0
思考
思路2:加合法
ΔH3 = ΔH1 ΔH2= 110.5 kJ/mol
已知:
① C(s) + O2(g) = CO2(g) ΔH1= 393.5 kJ/mol
② CO(g) + O2(g) = CO2(g) ΔH2= 283.0 kJ/mol
任务:C(s) + O2(g) = CO(g) ΔH =
思考
C(s) + O2(g) = CO2(g) ΔH1 = 393.5 kJ/mol
-) CO(g) + O2(g) = CO2(g) ΔH2 = 283.0 kJ/mol
未知反应: C(s) + O2(g) = CO(g)
火箭发射时可以用肼(N2H4,液态)作燃料,NO2作氧化剂。
已知:① N2(g) + 2O2(g) = 2NO2(g) △H1= +66.4 kJ/mol
② N2H4(l) + O2(g) = N2(g) + 2H2O(g) △H2= -534 kJ/mol
试计算 2N2H4(l) + 2NO2(g) = 3N2(g) + 4H2O(g) 的△H。
②×2-①
△H= - 1134.4kJ/mol
已知 ①CO(g) + 1/2 O2(g) = CO2(g) ; ΔH1= -283.0 kJ/mol
②H2(g) + 1/2 O2(g) = H2O(l) ; ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l); ΔH3=-1370kJ/mol
试计算: ④2CO(g)+ 4 H2(g) = H2O(l)+ C2H5OH (l)的ΔH
【解】:①×2 + ②×4 - ③ = ④
ΔH=ΔH1×2 +ΔH2×4 -ΔH3
=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
2、根据热化学方程式、盖斯定律和燃烧热的数据进行反应热的计算
二. 反应热的计算
1、运用盖斯定律计算
3、依据物质的燃烧热ΔH: Q放=n可燃物×|ΔH|。
例2. 乙醇的燃烧热: ΔH=-1 366.8 kJ/mol,在25 ℃、101 kPa,1 kg乙醇充分燃烧放出多少热量?
二. 反应热的计算
ΔH=反应物总键能-生成物总键能=E吸-E放
物质 CO2 (C=O) CH4 (C-H) P4 (P-P) SiO2 (Si-O) 石墨 金刚石 S8 (S-S) Si
键数 2 4 6 4 1.5 2 8 2
常见物质中的化学键数目
4、利用键能来计算
二. 反应热的计算
【例题】白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P===O c kJ·mol-1、O===O d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
A
ΔH=生成物的总能量 - 反应物的总能量
图像
ΔH=(a-b)kJ·mol-1=-c kJ·mol-1
ΔH=(a-b)kJ·mol-1=+c kJ·mol-1
4、利用总能量来计算
1.ΔH是有符号“+”“-”的,比较时要带着符号比较。
(1)吸热反应的ΔH为“+”,所以吸热越多,ΔH越大。
(2)放热反应的ΔH 为“-”,所以放热越多,ΔH越小。
三、反应热(ΔH)的大小比较
2.同一反应,反应物或生成物的状态不同时
A(g)+B(g)=C(g) ΔH1<0
A(g)+B(g)=C(l) ΔH2<0
如S(g)+O2(g)=SO2(g) ΔH1=-a kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH2=-b kJ·mol-1
