京改版(2013) 练习题--第10章 金属(含解析)
文档属性
| 名称 | 京改版(2013) 练习题--第10章 金属(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 132.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-31 23:09:40 | ||
图片预览


文档简介
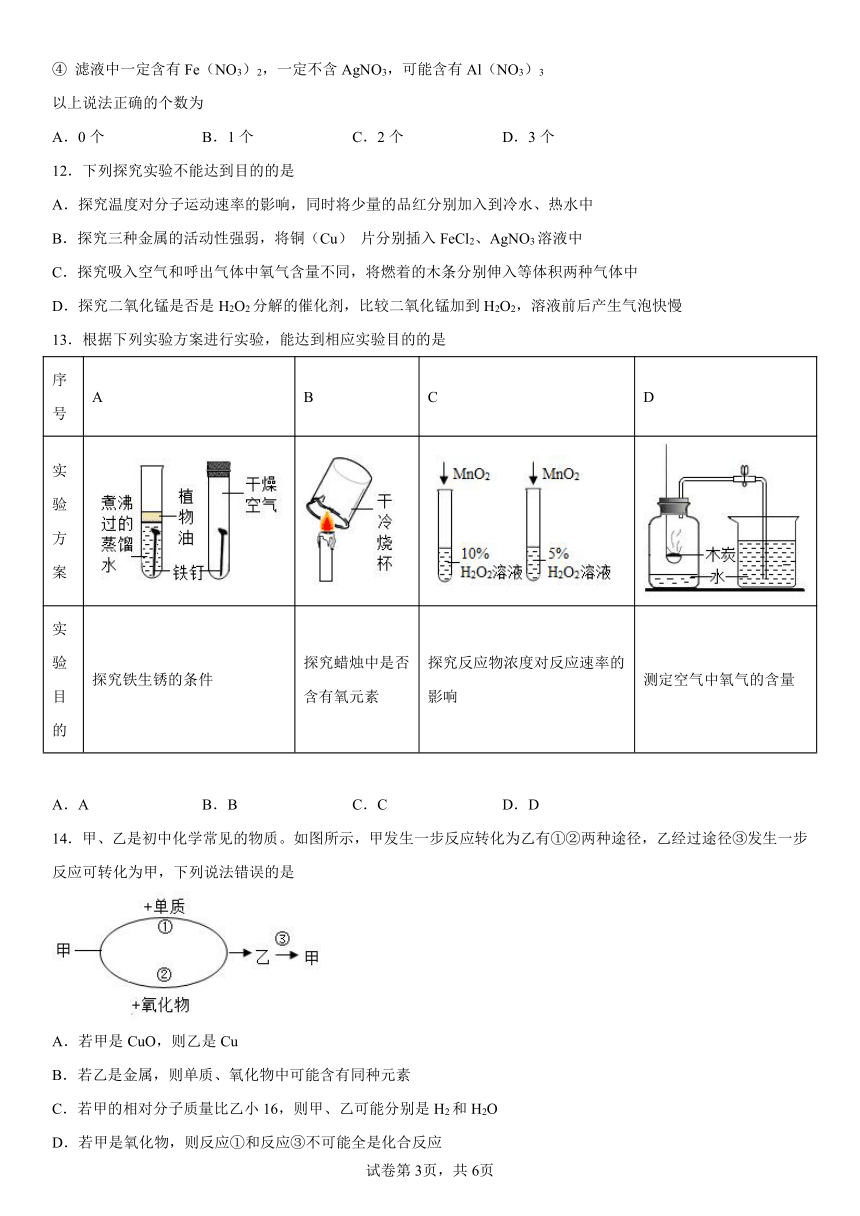
京改版(2013) 练习题--金属
一、单选题
1.下列有关说法正确的是( )
A.光亮的铜丝放入稀硫酸中,溶液变为蓝色,产生大量气泡
B.将打磨好的铜丝在酒精灯上加热,铜丝表面由黑色变红色
C.将铜片放入硝酸银溶液,溶液由无色变为蓝色
D.将铁钉加入到稀硫酸中,溶液由无色变为黄色
2.下列分类正确的是
A.黄铜、青铜、氧化铜都是合金
B.风能、太阳能、核能都属于可再生能源
C.煤气 、液化石油气、沼气都是纯净物
D.生石灰、干冰、二氧化硫都是氧化物
3.下列有关金属或合金的说法正确的是
A.合金属于单质 B.铁在潮湿的空气中不易生锈
C.铝的金属活动性强,在空气中易被腐蚀 D.铜的导电性好,常用于电线电缆
4.下列有关资源和能源叙述中正确的是
A.海洋中含有80多种物质
B.我国的金属矿藏比较丰富,其中铜、金、银等金属都以单质的形式存在
C.新能源的开发和利用很重要,所以我们应该大力开发氢能、电能等新能源
D.我们周围的空气在工农业生产中可以用于化肥,炼钢,石油加工等
5.现有锌片和铜片,要验证金属的活动性,提供的下列试剂不能达到实验目的的是
A.硫酸锌溶液 B.硝酸银溶液 C.稀盐酸 D.硫酸亚铁溶液
6.取甲、乙、丙三种金属粉末,分别投入同浓度的稀盐酸,只有甲能产生气体;再取少量乙投入丙的硝酸盐溶液中,乙的表面有丙析出。则甲、乙、丙的金属活动性顺序为
A.甲>乙>丙 B.乙>甲>丙 C.丙>乙>甲 D.乙>丙>甲
7.甲、乙两烧杯内盛有等质量、等质量分数的盐酸。把镁粉逐渐加入甲烧杯,把锌粉逐渐加入乙烧杯;测的加入金属质量(m)及相应的烧杯内物质的质量变化量(△M),将△M~m 作图像得到曲线 oac 和 obc(如图)。根据图示信息,判断下列说法错误的是
A.镁和锌的质量比 m1:m2=24:65
B.m1-△M1=m2-△M2
C.曲线 oac 表示的是甲烧杯中△M 和 m 的变化关系
D.当乙烧杯内加入锌质量为 m1时,溶液中溶质只有氯化锌
8.下列图像能正确反映对应变化关系的是
A B C D
加热一定量的高锰酸钾固体 两份完全相同的过氧化氢溶液分解 向一定量铁粉中加入硫酸铜溶液 加热一定量的饱和石灰水
A.A B.B C.C D.D
9.有X、Y、Z三种金属,X在常温下就能与氧气反应,Y、Z在常温下几乎不与氧气反应;如果把Y和Z分别放入稀硫酸中,Y溶解并产生氢气,Z不反应。根据以上实验事实判断,X、Y、Z三种金属的活动性由强至弱的顺序正确的是
A.X、Z、Y B.X、Y、Z C.Y、Z、X D.Z、Y、X
10.下列物质不具有导电性的是
A.石墨 B.铁 C.金刚石 D.铝
11.向AgNO3溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法:
① 向滤渣中加入稀盐酸,一定有气泡产生。
② 向滤液中加入稀盐酸,一定有沉淀产生。
③ 滤渣中一定含有Ag。
④ 滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Al(NO3)3
以上说法正确的个数为
A.0个 B.1个 C.2个 D.3个
12.下列探究实验不能达到目的的是
A.探究温度对分子运动速率的影响,同时将少量的品红分别加入到冷水、热水中
B.探究三种金属的活动性强弱,将铜(Cu) 片分别插入FeCl2、AgNO3溶液中
C.探究吸入空气和呼出气体中氧气含量不同,将燃着的木条分别伸入等体积两种气体中
D.探究二氧化锰是否是H2O2分解的催化剂,比较二氧化锰加到H2O2,溶液前后产生气泡快慢
13.根据下列实验方案进行实验,能达到相应实验目的的是
序号 A B C D
实验方案
实验目的 探究铁生锈的条件 探究蜡烛中是否含有氧元素 探究反应物浓度对反应速率的影响 测定空气中氧气的含量
A.A B.B C.C D.D
14.甲、乙是初中化学常见的物质。如图所示,甲发生一步反应转化为乙有①②两种途径,乙经过途径③发生一步反应可转化为甲,下列说法错误的是
A.若甲是CuO,则乙是Cu
B.若乙是金属,则单质、氧化物中可能含有同种元素
C.若甲的相对分子质量比乙小16,则甲、乙可能分别是H2和H2O
D.若甲是氧化物,则反应①和反应③不可能全是化合反应
二、填空题
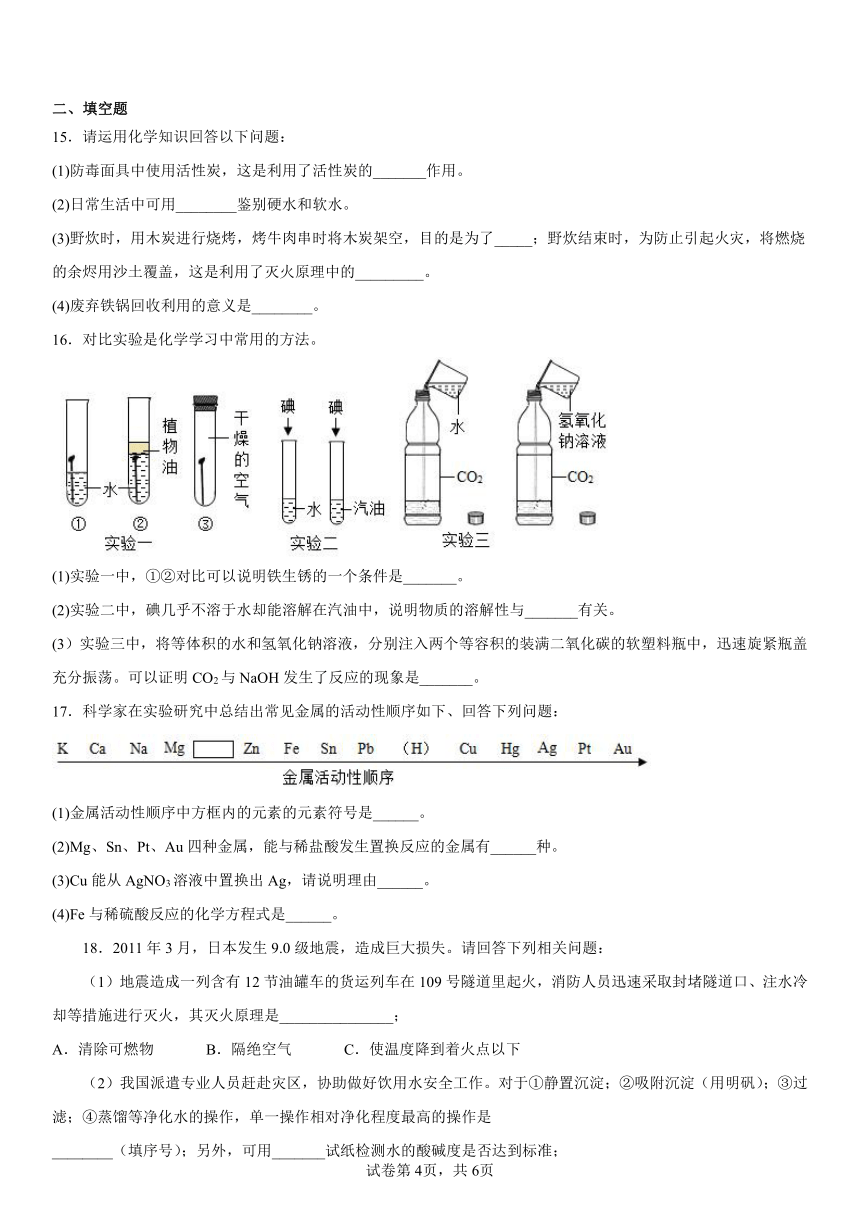
15.请运用化学知识回答以下问题:
(1)防毒面具中使用活性炭,这是利用了活性炭的_______作用。
(2)日常生活中可用________鉴别硬水和软水。
(3)野炊时,用木炭进行烧烤,烤牛肉串时将木炭架空,目的是为了_____;野炊结束时,为防止引起火灾,将燃烧的余烬用沙土覆盖,这是利用了灭火原理中的_________。
(4)废弃铁锅回收利用的意义是________。
16.对比实验是化学学习中常用的方法。
(1)实验一中,①②对比可以说明铁生锈的一个条件是_______。
(2)实验二中,碘几乎不溶于水却能溶解在汽油中,说明物质的溶解性与_______有关。
(3)实验三中,将等体积的水和氢氧化钠溶液,分别注入两个等容积的装满二氧化碳的软塑料瓶中,迅速旋紧瓶盖充分振荡。可以证明CO2与NaOH发生了反应的现象是_______。
17.科学家在实验研究中总结出常见金属的活动性顺序如下、回答下列问题:
(1)金属活动性顺序中方框内的元素的元素符号是______。
(2)Mg、Sn、Pt、Au四种金属,能与稀盐酸发生置换反应的金属有______种。
(3)Cu能从AgNO3溶液中置换出Ag,请说明理由______。
(4)Fe与稀硫酸反应的化学方程式是______。
18.2011年3月,日本发生9.0级地震,造成巨大损失。请回答下列相关问题:
(1)地震造成一列含有12节油罐车的货运列车在109号隧道里起火,消防人员迅速采取封堵隧道口、注水冷却等措施进行灭火,其灭火原理是_______________;
A.清除可燃物 B.隔绝空气 C.使温度降到着火点以下
(2)我国派遣专业人员赶赴灾区,协助做好饮用水安全工作。对于①静置沉淀;②吸附沉淀(用明矾);③过滤;④蒸馏等净化水的操作,单一操作相对净化程度最高的操作是
________(填序号);另外,可用_______试纸检测水的酸碱度是否达到标准;
(3)灾后重建,安置房用外层是钢板中间填充泡沫塑料的夹心板做墙体。为防止钢板生锈,延长夹心板的使用寿命,下列措施合理的是_________;
A.表面喷漆 B.经常酸洗 C.经常水洗
(4)药监局公布的抗震救灾急需药械目录中包括:一次性防护服、活性炭防护口罩、骨科内外固定材料等。其中防护口罩主要是利用活性炭的______性。
三、实验题
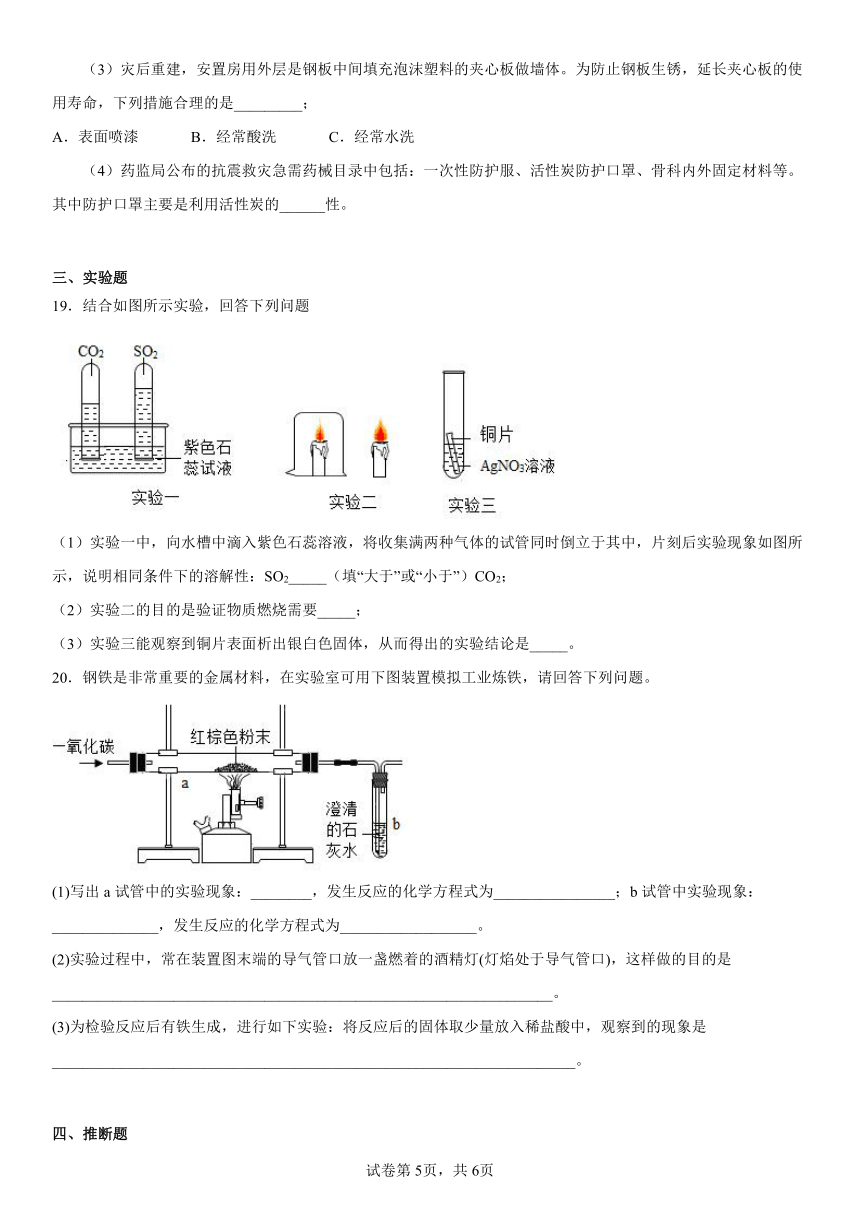
19.结合如图所示实验,回答下列问题
(1)实验一中,向水槽中滴入紫色石蕊溶液,将收集满两种气体的试管同时倒立于其中,片刻后实验现象如图所示,说明相同条件下的溶解性:SO2_____(填“大于”或“小于”)CO2;
(2)实验二的目的是验证物质燃烧需要_____;
(3)实验三能观察到铜片表面析出银白色固体,从而得出的实验结论是_____。
20.钢铁是非常重要的金属材料,在实验室可用下图装置模拟工业炼铁,请回答下列问题。
(1)写出a试管中的实验现象:________,发生反应的化学方程式为________________;b试管中实验现象:______________,发生反应的化学方程式为__________________。
(2)实验过程中,常在装置图末端的导气管口放一盏燃着的酒精灯(灯焰处于导气管口),这样做的目的是__________________________________________________________________。
(3)为检验反应后有铁生成,进行如下实验:将反应后的固体取少量放入稀盐酸中,观察到的现象是_____________________________________________________________________。
四、推断题
21.下图中A-J均为初中化学中的常见物质,其中仅C、H、I为单质。A为大理石的主要成分。J由两种元素组成,且其溶液为浅绿色(反应条件均已省略)。
(1)写出下列物质的化学式:C:__________;J:__________;
(2)写出下列反应的化学方程式:A+B→D+E+F:___________________________________;G+H→E:________________________________________。
22.已知A、B为两种黑色粉末,D为红色单质。A、B、C、D、E五种物质之间的转化关系如下图所示。请回答:
(1)C的化学式为_________;E的化学式为_________。
(2)A中金属元素的化合价是_________;
(3)反应①的化学方程式为_________;反应的基本类型是_________。反应②的化学方程式为_________。
五、计算题
23.某钢铁公司欲用200t含氧化铁80%的赤铁矿石炼铁,请你用两种不同的方法计算该公司所得到的生铁中最多含铁多少吨?
24.某100g稀盐酸恰好与6.5g锌完全反应,试计算:
(1)该反应产生氢气的质量为多少g
(2)求充分反应后,所得溶液的溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A、铜的金属活动性顺序排在H之后,不能和稀硫酸反应,故光亮的铜丝放入稀硫酸中,无明显现象,A错误;
B、将打磨好的铜丝在酒精灯上加热,,铜丝是红色的,氧化铜是黑色固体,故观察到铜丝表面由红色变黑色,B错误;
C、铜丝表面由黑色变红色,,硝酸银溶液是无色的,硝酸铜溶液为蓝色,故观察到溶液由无色变为蓝色,C正确;
D、将铁钉加入到稀硫酸中,,稀硫酸为无色,硫酸亚铁溶液为浅绿色,故溶液由无色变为浅绿色,D错误;
故选C。
【点睛】金属铁与稀盐酸、稀硫酸或其他金属的盐溶液发生反应时,通常生成亚铁盐溶液,溶液为浅绿色。
2.D
【详解】A、黄铜和青铜都是铜的合金,属于合金,氧化铜属于金属氧化物,不是合金,不符合题意;
B、风能、太阳能属于可再生能源,核能属于不可再生能源,不符合题意;
C、煤气的主要成分是一氧化碳,还含有其它物质,属于混合物,液化石油气主要成分为丙烷、丁烷等,属于混合物,沼气的主要成分是甲烷,还含有其它物质,属于混合物,不符合题意;
D、生石灰是氧化钙的俗称,是由Ca、O元素组成的化合物,属于氧化物,干冰是固体二氧化碳,是由C、O元素组成的化合物,属于氧化物;二氧化硫是由S、O两种元素组成的化合物,属于氧化物,符合题意。
故选D。
3.D
【详解】A、包含一种元素的纯净物是单质,合金包含多种元素,不属于单质,A错误;
B、铁在潮湿的空气中更容易生锈,B错误;
C、铝的金属活动性强,在空气中被氧化生成一层致密的氧化铝膜,可以防止继续被腐蚀,所以在空气中不易被腐蚀,C错误;
D、铜的导电性好,常用于电线电缆,D正确。
故选D。
4.D
【详解】A、海洋是地球上巨大的资源宝库,含有80多种元素,组成的物质不止80多种,故错误;
B、只有少量不活泼的金属(金、银、铂)以单质的形式存在,而铜还是以化合物的形式存在为主,故错误;
C、氢能属于新能源,电能不属于新能源,故错误;
D、空气是一种重要的自然资源,广泛的应用于生产化肥、炼钢、石油加工等,故正确。
故选D。
5.B
【详解】A、铜和硫酸锌不反应,说明锌的活动性大于铜,故A正确;
B、锌能和硝酸银反应,说明锌的活动性大于银,铜能和硝酸银反应,说明铜的活动性大于银,但无法比较锌、铜的活动性,故B错误;
C、锌能与稀盐酸反应,铜不能与稀盐酸反应,说明活动性:锌>氢>铜,故C正确;
D、锌能和硫酸亚铁反应,说明锌的活动性大于铁,铜不能和硫酸亚铁反应,说明铁的活动性大于铜,说明活动性:锌>铁>铜,故D正确。
故选B。
6.A
【详解】取甲、乙、丙三种金属粉末,分别投入同浓度的稀盐酸,只有甲能产生气体,说明在金属活动性顺序里,甲排在氢前,乙、丙排在氢后,再取少量乙投入丙的硝酸盐溶液中,乙的表面有丙析出。乙能将丙从其化合物中置换出来,说明乙比丙活泼,故三种金属的活动性顺序为:甲>乙>丙。
故选A。
7.D
【分析】本题考查金属和酸的反应图像。
【详解】A、分析反应可知,每24份质量的镁与盐酸反应能生产2份质量的氢气,分析反应可知,每65份质量的锌与盐酸反应能生产2份质量的氢气,分析图像可知,是足量的镁、锌与等质量、等质量分数的盐酸反应,产生的氢
气质量相等,则镁和锌的质量比m1:m2=24:65,故A不符合题意;;
B、足量的镁、锌与等质量、等质量分数的盐酸反应生成氢气的质量相等,m1-△M1为镁产生氢气的质量,m2-△M2为锌产生氢气的质量,则m1-△M1= m2-△M2,故B不符合题意;
C、分析曲线图可知,曲线oac表示的是甲烧杯中ΔM与m的变化关系,曲线obc表示的是乙烧杯中ΔM与m的变化,故C不符合题意;
D、分析曲线图可知,曲线obc表示的是乙烧杯中△M与m的变化关系,当乙烧杯内加入锌质量为m1时,盐酸还没反应完,则溶液中溶质为HCl、ZnCl2,故D符合题意;
故选D。
【点睛】本题难度较大,注意金属和酸反应中,要判断谁过量谁少量。
8.B
【详解】A、高锰酸钾加热生成锰酸钾、二氧化锰、氧气,剩余固体中含有氧元素,所以固体中氧元素的质量分数逐渐减少,最后是一定值,不能为零,故A错误;
B、催化剂只是改变反应速率,不影响生成物的质量,催化剂能加快过氧化氢的分解,故B正确;
C、向一定量铁粉中加入硫酸铜溶液,,根据化学方程式,生成金属的质量变大,故C错误;
D、加热一定量的饱和石灰水,溶解度变小,溶液质量变小,故D错误。
故选B。
9.B
【详解】X在常温下就能与氧气反应,Y、Z在常温下几乎不与氧气反应,说明三种金属中金属X活动性最强;把Y和Z分别放入稀硫酸中,Y溶解并产生氢气,Z不反应,说明金属Y在活动性顺序中位于H之前而Z位于H之后,金属Y活动性比Z强;综上所述,三种金属活动性由强到弱的顺序为X>Y>Z;
故选:B。
【点睛】金属活动性顺序中,位于H之前的金属能置换出酸中的H,位于H之后的金属不能置换酸中H。
10.C
【详解】石墨、铁、铝均具有导电性,金刚石不具有导电性,C选项符合题意。
故选C。
11.B
【详解】①由于没有提及具体的铝和铁的量,所以不能判断金属是否剩余,而银不能和酸反应,所以不能判断一定产生气泡,故①错;
②由于没有提及具体的铝和铁的量,所以不能判断是否将硝酸银全部置换出来,所以不能判断一定产生沉淀,故②错;
③由于铁和铝的活动性都比银强,所以在滤渣中一定含有银单质,故③对;
④由于溶液是浅绿色溶液,可以推断有硝酸亚铁,铝的比铁活泼,所以铝应该先反应完了,所以一定有硝酸铝。所以一定有硝酸亚铁和硝酸铝,可能有硝酸银。,故④错;
即题中所给的说法正确的只有③,即只有一种说法正确。
故选B。
【点睛】解答这类题目时,首先,要熟记和理解金属活动性顺序及其应用,以及与之相关的知识等;然后,根据所给问题情景结合所学的相关知识和技能,细致地阅读、分析题意等细心地进行探究、推理,最后,按照题目的要求,认真地进行选择或解答即可
12.D
【详解】A、同时将少量的品红分别加入到冷水、热水中,可以观察到品红在热水比在冷水中扩散更快,因此可以探究温度对分子运动速率的影响,不符合题意;
B、将铜(Cu) 片分别插入FeCl2、AgNO3溶液中,铜片与FeCl2不反应,铜片与硝酸银溶液反应生成硝酸铜和银,可以观察到铜表面有银白色固体生成,溶液由无色变为蓝色,因此可以得出三种金属的活动性强弱为:Fe> Cu> Ag,不符合题意;
C、燃着的木条在空气中正常燃烧,在呼出气体中很快熄灭,由此可以得出空气中氧气含量比呼出气体中的高,不符合题意;
D、该实验只能探究二氧化锰能加快过氧化氢分解速率,由于二氧化锰质量和化学性质在反应前后没有验证,所以不能探究二氧化锰作为反应的催化剂,符合题意。
故选D。
13.C
【详解】A、铁生锈是铁与氧气、水共同作用的结果,实验中左侧试管中铁钉没有与氧气接触不易生锈,右侧试管中铁钉没有与水接触不易生锈,故无法通过对比探究出铁生锈的条件,故A不能达到实验目的,不符合题意;
B、在蜡烛的上方放置干冷的烧杯,若烧杯中产生水雾,证明燃烧产生水,水是由H、O元素组成,反应物中有氧气参与反应,氧气中含有氧元素,则证明蜡烛中一定含有氢元素,可能含有氧元素,改实验不能用于探究蜡烛中是否含有氧元素,故B不能达到实验目的,不符合题意;
C、根据控制变量的原则,将二氧化锰分别加入到10%过氧化氢溶液和5%过氧化氢溶液中,通过观察产生气泡的速率,即可用来探究反应物浓度对反应速率的影响,故C能达到实验目的,符合题意;
D、木炭在空气中燃烧生成二氧化碳,虽然消耗了氧气,但是生成了二氧化碳气体,瓶内压强几乎不变,不能产生压强差,烧杯内的水不能进入集气瓶中,不能用来探究空气中氧气的含量,故D不能达到实验目的,不符合题意;
故选C。
14.D
【详解】A、若甲是CuO,则乙是Cu,在加热条件下氧化铜和氢气(或碳)反应生成铜和水(或二氧化碳),在加热条件下氧化铜和一氧化碳反应生成铜和二氧化碳;铜在氧气中加热生成氧化铜,正确;
B、由A中分析可知,乙是金属铜,单质可以是碳或氢气,氧化物可以是一氧化碳;碳和一氧化碳中都含有碳元素,正确;
C、若甲的相对分子质量比乙小16,则甲、乙可能分别是H2和H2O;氢气与氧气反应生成水,氢气与氧化铜反应生成铜和水,水通电生成氢气,正确;
D、若甲是氧化物,反应①可能是在一氧化碳和氧气点燃反应生成二氧化碳,属于化合反应;反应③是二氧化碳和碳高温下反应生成一氧化碳,属于化合反应;错误。
故选D。
15. 吸附 肥皂水 增大与氧气的接触面积 隔绝氧气 节约金属资源
【详解】(1)防毒面具中使用活性炭,这是利用了活性炭的吸附作用,可以吸附有毒物质。
(2)日常生活中可用肥皂鉴别硬水和软水,分别混合搅拌后,浮渣多、泡沫少的是硬水,反之是软水。
(3)野炊时,用木炭进行烧烤,烤牛肉串时将木炭架空,目的是为了增加空气浓度,增加木炭与氧气的接触面积,使木炭更加容易燃烧;野炊结束时,为防止引起火灾,将燃烧的余烬用沙土覆盖,这是利用了灭火原理中的:隔绝空气(助燃物);
(4)废弃铁锅回收利用的意义是:节约金属资源。
16. 有氧气 溶剂种类 右瓶变瘪的程度比左瓶大
【详解】(1)实验一中,②中只接触水,不接触氧气的铁钉不能生锈,①中同时接触氧气和水的铁钉生锈。因此①②对比可以说明铁生锈的一个条件是有氧气。故填:有氧气;
(2)实验二中碘几乎不溶于水却能溶解在汽油中,说明物质的溶解性与溶剂种类有关。故填:溶剂种类。
(3)分别向两个收集满CO2气体的软塑料瓶中加入等体积的水和氢氧化钠溶液,立即旋紧瓶盖,振荡,可以观察到右瓶变瘪的程度更大,是因为除了与左边瓶内相同体积的水吸收相同体积的二氧化碳外,氢氧化钠还和二氧化碳反应生成碳酸钠和水。故填:右瓶变瘪的程度比左瓶大。
17.(1)A1
(2)2
(3)铜的金属活动性强于银
(4)
【解析】(1)
根据金属活动性顺序钾钙钠镁铝,金属活动性顺序中方框内的元素的元素符号是Al;
(2)
由于在金属活动性顺序中金属Mg、Sn处在H之前,金属Pt、Au处在H之后,故Mg、Sn能与稀盐酸发生置换反应,Pt、Au不能,故能与稀盐酸发生置换反应的金属有2种;
(3)
活动性强的金属能把活动性弱的金属从其盐溶液中置换出来。在金属活动性顺序中,金属Cu处在金属Ag之前,则铜的金属活动性强于银,故Cu能从AgNO3溶液中置换出Ag;
(4)
Fe与稀硫酸反应生成硫酸亚铁和氢气,化学方程式是。
18. BC/CB ④ pH A 吸附
【详解】(1)灭火的原理包括:清除可燃物、隔绝空气、降低温度到着火点以下,题中所采取的措施中取封堵隧道口可以隔绝氧气,注水冷却可以降低温度到着火点以下。故选BC。
(2)我国派遣专业人员赶赴灾区,协助做好饮用水安全工作。①静置沉淀;②吸附沉淀(用明矾);③过滤;④蒸馏等净化水的操作,单一操作相对净化程度最高的操作是④蒸馏等净化水的操作。可用pH 试纸检测水的酸碱度是否达到标准。
(3)根据铁生锈的条件可知,要保证铁制品表面的干燥,所以不能经常水洗,同时铁会与酸发生化学反应,所以也不能经常酸洗,酸会加快铁制品的腐蚀,正确的方法是涂保护膜,表面喷漆。故选A。
(4)药监局公布的抗震救灾急需药械目录中包括:一次性防护服、活性炭防护口罩、骨科内外固定材料等。其中防护口罩主要是利用活性炭的吸附性,能吸附色素和异味。
【点睛】本题主要考查灭火原理,水的净化,防锈等知识,难度不大。
19. 大于 氧气 铜比银活泼
【详解】(1)盛有二氧化硫的试管液面上升比二氧化碳高,说明相同条件下的溶解性:SO2大于CO2。
故填:大于。
(2)实验二中,烧杯中的蜡烛燃烧一段时间后熄灭,是因为氧气完全反应,烧杯外的蜡烛持续燃烧,因此目的是验证物质燃烧需要氧气。
故填:氧气。
(3)实验三能观察到铜片表面析出银白色固体,是因为铜和硝酸银反应生成硝酸铜和银,从而得出的实验结论是铜比银活泼。
故填:铜比银活泼。
20. 红棕色粉末变黑 Fe2O3+3CO2Fe+3CO2 澄清石灰水变浑浊 CO2+Ca(OH)2=CaCO3↓+H2O 除去尾气中的CO(或防止CO使人中毒;防止CO污染空气;将CO转化为没有毒性的CO2等合理答案均可) 有气泡产生,溶液由无色变为浅绿色
【详解】(1) 一氧化碳可把三氧化二铁还原为铁,并生成二氧化碳气体,a中的实验现象为:红棕色粉末变黑,发生反应的化学方程式为Fe2O3+3CO2Fe+3CO2;氢氧化钙能与二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
(2) 通入的CO可能过量,进入大气会污染空气,所以要在装置图末端的导气管口放一盏燃着的酒精灯(灯焰处于导气管口),除去尾气中的CO;
(3) 铁和盐酸反应生成氯化亚铁和氢气,观察到的现象是:有气泡产生,溶液由无色变为浅绿色。
21. Fe FeCl2 CaCO3+2HCl=CaCl2+H2O+CO2↑ 2CO+ O22CO2或 C + O2CO2
【详解】本题是框图式推断题。要根据题给条件和物质的化学特性找准突破口,然后顺藤摸瓜完成解答,最后放到整道题目的环境去验证。
依据A为大理石的主要成分,可知A是碳酸钙,J由两种元素组成,且其溶液为浅绿色,所以J是氯化亚铁,C、H、I为单质,可以猜想C是铁,I是氢气,则B是盐酸,因此可知DEF是水、二氧化碳和氯化钙中的一种,由于F能生成氢气,所以F是水,水分解可生成氢气和氧气,所以H为氧气,则G是一氧化碳或碳,E是二氧化碳,则可知D是氯化钙。将假设代入框图,假设成立。综上所述:
(1) C是铁,化学式是:Fe;J是氯化亚铁,化学式是FeCl2;
(2) A+B→D+E+F是碳酸钙与盐酸反应生成氯化钙和水和二氧化碳反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑;G+H→E是一氧化碳在氧气燃烧生成二氧化碳,或碳在氧气中燃烧生成二氧化碳,反应的化学方程式:分别是, C + O2点燃CO2。
22. CO2 CaCO3 +2 置换反应
【分析】C和澄清石灰水反应生成沉淀E,所以C是二氧化碳,E是碳酸钙,A、B为两种黑色粉末,A、B高温生成二氧化碳和D,D为红色单质,所以D是铜,A、B是氧化铜、碳中的一种,经过验证,推断正确。
【详解】(1)由分析可知,C是二氧化碳,化学式为:CO2;E是碳酸钙,化学式为:CaCO3;
(2)氧化铜中氧元素为-2价,铜元素为+2价;
(3)反应①是氧化铜和碳在高温的条件下生成铜和二氧化碳,化学方程式为:,该反应是单质与化合物生成单质与化合物的反应,属于置换反应;反应②是二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:。
23.①
②解:设生铁中最多含铁的质量是x
x=112t
答:所得到的生铁中最多含铁112t。
【详解】见答案。
24.(1)解:设生成氢气的质量为x,生成氯化锌的质量为y
解得:x=0. 2g,y=13. 6g
答:生成氢气的质量为0. 2g
(2)反应后所得氯化锌溶液的溶质质量分数为:
答:反应后所得溶液中溶质的质量分数为12. 8%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关说法正确的是( )
A.光亮的铜丝放入稀硫酸中,溶液变为蓝色,产生大量气泡
B.将打磨好的铜丝在酒精灯上加热,铜丝表面由黑色变红色
C.将铜片放入硝酸银溶液,溶液由无色变为蓝色
D.将铁钉加入到稀硫酸中,溶液由无色变为黄色
2.下列分类正确的是
A.黄铜、青铜、氧化铜都是合金
B.风能、太阳能、核能都属于可再生能源
C.煤气 、液化石油气、沼气都是纯净物
D.生石灰、干冰、二氧化硫都是氧化物
3.下列有关金属或合金的说法正确的是
A.合金属于单质 B.铁在潮湿的空气中不易生锈
C.铝的金属活动性强,在空气中易被腐蚀 D.铜的导电性好,常用于电线电缆
4.下列有关资源和能源叙述中正确的是
A.海洋中含有80多种物质
B.我国的金属矿藏比较丰富,其中铜、金、银等金属都以单质的形式存在
C.新能源的开发和利用很重要,所以我们应该大力开发氢能、电能等新能源
D.我们周围的空气在工农业生产中可以用于化肥,炼钢,石油加工等
5.现有锌片和铜片,要验证金属的活动性,提供的下列试剂不能达到实验目的的是
A.硫酸锌溶液 B.硝酸银溶液 C.稀盐酸 D.硫酸亚铁溶液
6.取甲、乙、丙三种金属粉末,分别投入同浓度的稀盐酸,只有甲能产生气体;再取少量乙投入丙的硝酸盐溶液中,乙的表面有丙析出。则甲、乙、丙的金属活动性顺序为
A.甲>乙>丙 B.乙>甲>丙 C.丙>乙>甲 D.乙>丙>甲
7.甲、乙两烧杯内盛有等质量、等质量分数的盐酸。把镁粉逐渐加入甲烧杯,把锌粉逐渐加入乙烧杯;测的加入金属质量(m)及相应的烧杯内物质的质量变化量(△M),将△M~m 作图像得到曲线 oac 和 obc(如图)。根据图示信息,判断下列说法错误的是
A.镁和锌的质量比 m1:m2=24:65
B.m1-△M1=m2-△M2
C.曲线 oac 表示的是甲烧杯中△M 和 m 的变化关系
D.当乙烧杯内加入锌质量为 m1时,溶液中溶质只有氯化锌
8.下列图像能正确反映对应变化关系的是
A B C D
加热一定量的高锰酸钾固体 两份完全相同的过氧化氢溶液分解 向一定量铁粉中加入硫酸铜溶液 加热一定量的饱和石灰水
A.A B.B C.C D.D
9.有X、Y、Z三种金属,X在常温下就能与氧气反应,Y、Z在常温下几乎不与氧气反应;如果把Y和Z分别放入稀硫酸中,Y溶解并产生氢气,Z不反应。根据以上实验事实判断,X、Y、Z三种金属的活动性由强至弱的顺序正确的是
A.X、Z、Y B.X、Y、Z C.Y、Z、X D.Z、Y、X
10.下列物质不具有导电性的是
A.石墨 B.铁 C.金刚石 D.铝
11.向AgNO3溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法:
① 向滤渣中加入稀盐酸,一定有气泡产生。
② 向滤液中加入稀盐酸,一定有沉淀产生。
③ 滤渣中一定含有Ag。
④ 滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Al(NO3)3
以上说法正确的个数为
A.0个 B.1个 C.2个 D.3个
12.下列探究实验不能达到目的的是
A.探究温度对分子运动速率的影响,同时将少量的品红分别加入到冷水、热水中
B.探究三种金属的活动性强弱,将铜(Cu) 片分别插入FeCl2、AgNO3溶液中
C.探究吸入空气和呼出气体中氧气含量不同,将燃着的木条分别伸入等体积两种气体中
D.探究二氧化锰是否是H2O2分解的催化剂,比较二氧化锰加到H2O2,溶液前后产生气泡快慢
13.根据下列实验方案进行实验,能达到相应实验目的的是
序号 A B C D
实验方案
实验目的 探究铁生锈的条件 探究蜡烛中是否含有氧元素 探究反应物浓度对反应速率的影响 测定空气中氧气的含量
A.A B.B C.C D.D
14.甲、乙是初中化学常见的物质。如图所示,甲发生一步反应转化为乙有①②两种途径,乙经过途径③发生一步反应可转化为甲,下列说法错误的是
A.若甲是CuO,则乙是Cu
B.若乙是金属,则单质、氧化物中可能含有同种元素
C.若甲的相对分子质量比乙小16,则甲、乙可能分别是H2和H2O
D.若甲是氧化物,则反应①和反应③不可能全是化合反应
二、填空题
15.请运用化学知识回答以下问题:
(1)防毒面具中使用活性炭,这是利用了活性炭的_______作用。
(2)日常生活中可用________鉴别硬水和软水。
(3)野炊时,用木炭进行烧烤,烤牛肉串时将木炭架空,目的是为了_____;野炊结束时,为防止引起火灾,将燃烧的余烬用沙土覆盖,这是利用了灭火原理中的_________。
(4)废弃铁锅回收利用的意义是________。
16.对比实验是化学学习中常用的方法。
(1)实验一中,①②对比可以说明铁生锈的一个条件是_______。
(2)实验二中,碘几乎不溶于水却能溶解在汽油中,说明物质的溶解性与_______有关。
(3)实验三中,将等体积的水和氢氧化钠溶液,分别注入两个等容积的装满二氧化碳的软塑料瓶中,迅速旋紧瓶盖充分振荡。可以证明CO2与NaOH发生了反应的现象是_______。
17.科学家在实验研究中总结出常见金属的活动性顺序如下、回答下列问题:
(1)金属活动性顺序中方框内的元素的元素符号是______。
(2)Mg、Sn、Pt、Au四种金属,能与稀盐酸发生置换反应的金属有______种。
(3)Cu能从AgNO3溶液中置换出Ag,请说明理由______。
(4)Fe与稀硫酸反应的化学方程式是______。
18.2011年3月,日本发生9.0级地震,造成巨大损失。请回答下列相关问题:
(1)地震造成一列含有12节油罐车的货运列车在109号隧道里起火,消防人员迅速采取封堵隧道口、注水冷却等措施进行灭火,其灭火原理是_______________;
A.清除可燃物 B.隔绝空气 C.使温度降到着火点以下
(2)我国派遣专业人员赶赴灾区,协助做好饮用水安全工作。对于①静置沉淀;②吸附沉淀(用明矾);③过滤;④蒸馏等净化水的操作,单一操作相对净化程度最高的操作是
________(填序号);另外,可用_______试纸检测水的酸碱度是否达到标准;
(3)灾后重建,安置房用外层是钢板中间填充泡沫塑料的夹心板做墙体。为防止钢板生锈,延长夹心板的使用寿命,下列措施合理的是_________;
A.表面喷漆 B.经常酸洗 C.经常水洗
(4)药监局公布的抗震救灾急需药械目录中包括:一次性防护服、活性炭防护口罩、骨科内外固定材料等。其中防护口罩主要是利用活性炭的______性。
三、实验题
19.结合如图所示实验,回答下列问题
(1)实验一中,向水槽中滴入紫色石蕊溶液,将收集满两种气体的试管同时倒立于其中,片刻后实验现象如图所示,说明相同条件下的溶解性:SO2_____(填“大于”或“小于”)CO2;
(2)实验二的目的是验证物质燃烧需要_____;
(3)实验三能观察到铜片表面析出银白色固体,从而得出的实验结论是_____。
20.钢铁是非常重要的金属材料,在实验室可用下图装置模拟工业炼铁,请回答下列问题。
(1)写出a试管中的实验现象:________,发生反应的化学方程式为________________;b试管中实验现象:______________,发生反应的化学方程式为__________________。
(2)实验过程中,常在装置图末端的导气管口放一盏燃着的酒精灯(灯焰处于导气管口),这样做的目的是__________________________________________________________________。
(3)为检验反应后有铁生成,进行如下实验:将反应后的固体取少量放入稀盐酸中,观察到的现象是_____________________________________________________________________。
四、推断题
21.下图中A-J均为初中化学中的常见物质,其中仅C、H、I为单质。A为大理石的主要成分。J由两种元素组成,且其溶液为浅绿色(反应条件均已省略)。
(1)写出下列物质的化学式:C:__________;J:__________;
(2)写出下列反应的化学方程式:A+B→D+E+F:___________________________________;G+H→E:________________________________________。
22.已知A、B为两种黑色粉末,D为红色单质。A、B、C、D、E五种物质之间的转化关系如下图所示。请回答:
(1)C的化学式为_________;E的化学式为_________。
(2)A中金属元素的化合价是_________;
(3)反应①的化学方程式为_________;反应的基本类型是_________。反应②的化学方程式为_________。
五、计算题
23.某钢铁公司欲用200t含氧化铁80%的赤铁矿石炼铁,请你用两种不同的方法计算该公司所得到的生铁中最多含铁多少吨?
24.某100g稀盐酸恰好与6.5g锌完全反应,试计算:
(1)该反应产生氢气的质量为多少g
(2)求充分反应后,所得溶液的溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A、铜的金属活动性顺序排在H之后,不能和稀硫酸反应,故光亮的铜丝放入稀硫酸中,无明显现象,A错误;
B、将打磨好的铜丝在酒精灯上加热,,铜丝是红色的,氧化铜是黑色固体,故观察到铜丝表面由红色变黑色,B错误;
C、铜丝表面由黑色变红色,,硝酸银溶液是无色的,硝酸铜溶液为蓝色,故观察到溶液由无色变为蓝色,C正确;
D、将铁钉加入到稀硫酸中,,稀硫酸为无色,硫酸亚铁溶液为浅绿色,故溶液由无色变为浅绿色,D错误;
故选C。
【点睛】金属铁与稀盐酸、稀硫酸或其他金属的盐溶液发生反应时,通常生成亚铁盐溶液,溶液为浅绿色。
2.D
【详解】A、黄铜和青铜都是铜的合金,属于合金,氧化铜属于金属氧化物,不是合金,不符合题意;
B、风能、太阳能属于可再生能源,核能属于不可再生能源,不符合题意;
C、煤气的主要成分是一氧化碳,还含有其它物质,属于混合物,液化石油气主要成分为丙烷、丁烷等,属于混合物,沼气的主要成分是甲烷,还含有其它物质,属于混合物,不符合题意;
D、生石灰是氧化钙的俗称,是由Ca、O元素组成的化合物,属于氧化物,干冰是固体二氧化碳,是由C、O元素组成的化合物,属于氧化物;二氧化硫是由S、O两种元素组成的化合物,属于氧化物,符合题意。
故选D。
3.D
【详解】A、包含一种元素的纯净物是单质,合金包含多种元素,不属于单质,A错误;
B、铁在潮湿的空气中更容易生锈,B错误;
C、铝的金属活动性强,在空气中被氧化生成一层致密的氧化铝膜,可以防止继续被腐蚀,所以在空气中不易被腐蚀,C错误;
D、铜的导电性好,常用于电线电缆,D正确。
故选D。
4.D
【详解】A、海洋是地球上巨大的资源宝库,含有80多种元素,组成的物质不止80多种,故错误;
B、只有少量不活泼的金属(金、银、铂)以单质的形式存在,而铜还是以化合物的形式存在为主,故错误;
C、氢能属于新能源,电能不属于新能源,故错误;
D、空气是一种重要的自然资源,广泛的应用于生产化肥、炼钢、石油加工等,故正确。
故选D。
5.B
【详解】A、铜和硫酸锌不反应,说明锌的活动性大于铜,故A正确;
B、锌能和硝酸银反应,说明锌的活动性大于银,铜能和硝酸银反应,说明铜的活动性大于银,但无法比较锌、铜的活动性,故B错误;
C、锌能与稀盐酸反应,铜不能与稀盐酸反应,说明活动性:锌>氢>铜,故C正确;
D、锌能和硫酸亚铁反应,说明锌的活动性大于铁,铜不能和硫酸亚铁反应,说明铁的活动性大于铜,说明活动性:锌>铁>铜,故D正确。
故选B。
6.A
【详解】取甲、乙、丙三种金属粉末,分别投入同浓度的稀盐酸,只有甲能产生气体,说明在金属活动性顺序里,甲排在氢前,乙、丙排在氢后,再取少量乙投入丙的硝酸盐溶液中,乙的表面有丙析出。乙能将丙从其化合物中置换出来,说明乙比丙活泼,故三种金属的活动性顺序为:甲>乙>丙。
故选A。
7.D
【分析】本题考查金属和酸的反应图像。
【详解】A、分析反应可知,每24份质量的镁与盐酸反应能生产2份质量的氢气,分析反应可知,每65份质量的锌与盐酸反应能生产2份质量的氢气,分析图像可知,是足量的镁、锌与等质量、等质量分数的盐酸反应,产生的氢
气质量相等,则镁和锌的质量比m1:m2=24:65,故A不符合题意;;
B、足量的镁、锌与等质量、等质量分数的盐酸反应生成氢气的质量相等,m1-△M1为镁产生氢气的质量,m2-△M2为锌产生氢气的质量,则m1-△M1= m2-△M2,故B不符合题意;
C、分析曲线图可知,曲线oac表示的是甲烧杯中ΔM与m的变化关系,曲线obc表示的是乙烧杯中ΔM与m的变化,故C不符合题意;
D、分析曲线图可知,曲线obc表示的是乙烧杯中△M与m的变化关系,当乙烧杯内加入锌质量为m1时,盐酸还没反应完,则溶液中溶质为HCl、ZnCl2,故D符合题意;
故选D。
【点睛】本题难度较大,注意金属和酸反应中,要判断谁过量谁少量。
8.B
【详解】A、高锰酸钾加热生成锰酸钾、二氧化锰、氧气,剩余固体中含有氧元素,所以固体中氧元素的质量分数逐渐减少,最后是一定值,不能为零,故A错误;
B、催化剂只是改变反应速率,不影响生成物的质量,催化剂能加快过氧化氢的分解,故B正确;
C、向一定量铁粉中加入硫酸铜溶液,,根据化学方程式,生成金属的质量变大,故C错误;
D、加热一定量的饱和石灰水,溶解度变小,溶液质量变小,故D错误。
故选B。
9.B
【详解】X在常温下就能与氧气反应,Y、Z在常温下几乎不与氧气反应,说明三种金属中金属X活动性最强;把Y和Z分别放入稀硫酸中,Y溶解并产生氢气,Z不反应,说明金属Y在活动性顺序中位于H之前而Z位于H之后,金属Y活动性比Z强;综上所述,三种金属活动性由强到弱的顺序为X>Y>Z;
故选:B。
【点睛】金属活动性顺序中,位于H之前的金属能置换出酸中的H,位于H之后的金属不能置换酸中H。
10.C
【详解】石墨、铁、铝均具有导电性,金刚石不具有导电性,C选项符合题意。
故选C。
11.B
【详解】①由于没有提及具体的铝和铁的量,所以不能判断金属是否剩余,而银不能和酸反应,所以不能判断一定产生气泡,故①错;
②由于没有提及具体的铝和铁的量,所以不能判断是否将硝酸银全部置换出来,所以不能判断一定产生沉淀,故②错;
③由于铁和铝的活动性都比银强,所以在滤渣中一定含有银单质,故③对;
④由于溶液是浅绿色溶液,可以推断有硝酸亚铁,铝的比铁活泼,所以铝应该先反应完了,所以一定有硝酸铝。所以一定有硝酸亚铁和硝酸铝,可能有硝酸银。,故④错;
即题中所给的说法正确的只有③,即只有一种说法正确。
故选B。
【点睛】解答这类题目时,首先,要熟记和理解金属活动性顺序及其应用,以及与之相关的知识等;然后,根据所给问题情景结合所学的相关知识和技能,细致地阅读、分析题意等细心地进行探究、推理,最后,按照题目的要求,认真地进行选择或解答即可
12.D
【详解】A、同时将少量的品红分别加入到冷水、热水中,可以观察到品红在热水比在冷水中扩散更快,因此可以探究温度对分子运动速率的影响,不符合题意;
B、将铜(Cu) 片分别插入FeCl2、AgNO3溶液中,铜片与FeCl2不反应,铜片与硝酸银溶液反应生成硝酸铜和银,可以观察到铜表面有银白色固体生成,溶液由无色变为蓝色,因此可以得出三种金属的活动性强弱为:Fe> Cu> Ag,不符合题意;
C、燃着的木条在空气中正常燃烧,在呼出气体中很快熄灭,由此可以得出空气中氧气含量比呼出气体中的高,不符合题意;
D、该实验只能探究二氧化锰能加快过氧化氢分解速率,由于二氧化锰质量和化学性质在反应前后没有验证,所以不能探究二氧化锰作为反应的催化剂,符合题意。
故选D。
13.C
【详解】A、铁生锈是铁与氧气、水共同作用的结果,实验中左侧试管中铁钉没有与氧气接触不易生锈,右侧试管中铁钉没有与水接触不易生锈,故无法通过对比探究出铁生锈的条件,故A不能达到实验目的,不符合题意;
B、在蜡烛的上方放置干冷的烧杯,若烧杯中产生水雾,证明燃烧产生水,水是由H、O元素组成,反应物中有氧气参与反应,氧气中含有氧元素,则证明蜡烛中一定含有氢元素,可能含有氧元素,改实验不能用于探究蜡烛中是否含有氧元素,故B不能达到实验目的,不符合题意;
C、根据控制变量的原则,将二氧化锰分别加入到10%过氧化氢溶液和5%过氧化氢溶液中,通过观察产生气泡的速率,即可用来探究反应物浓度对反应速率的影响,故C能达到实验目的,符合题意;
D、木炭在空气中燃烧生成二氧化碳,虽然消耗了氧气,但是生成了二氧化碳气体,瓶内压强几乎不变,不能产生压强差,烧杯内的水不能进入集气瓶中,不能用来探究空气中氧气的含量,故D不能达到实验目的,不符合题意;
故选C。
14.D
【详解】A、若甲是CuO,则乙是Cu,在加热条件下氧化铜和氢气(或碳)反应生成铜和水(或二氧化碳),在加热条件下氧化铜和一氧化碳反应生成铜和二氧化碳;铜在氧气中加热生成氧化铜,正确;
B、由A中分析可知,乙是金属铜,单质可以是碳或氢气,氧化物可以是一氧化碳;碳和一氧化碳中都含有碳元素,正确;
C、若甲的相对分子质量比乙小16,则甲、乙可能分别是H2和H2O;氢气与氧气反应生成水,氢气与氧化铜反应生成铜和水,水通电生成氢气,正确;
D、若甲是氧化物,反应①可能是在一氧化碳和氧气点燃反应生成二氧化碳,属于化合反应;反应③是二氧化碳和碳高温下反应生成一氧化碳,属于化合反应;错误。
故选D。
15. 吸附 肥皂水 增大与氧气的接触面积 隔绝氧气 节约金属资源
【详解】(1)防毒面具中使用活性炭,这是利用了活性炭的吸附作用,可以吸附有毒物质。
(2)日常生活中可用肥皂鉴别硬水和软水,分别混合搅拌后,浮渣多、泡沫少的是硬水,反之是软水。
(3)野炊时,用木炭进行烧烤,烤牛肉串时将木炭架空,目的是为了增加空气浓度,增加木炭与氧气的接触面积,使木炭更加容易燃烧;野炊结束时,为防止引起火灾,将燃烧的余烬用沙土覆盖,这是利用了灭火原理中的:隔绝空气(助燃物);
(4)废弃铁锅回收利用的意义是:节约金属资源。
16. 有氧气 溶剂种类 右瓶变瘪的程度比左瓶大
【详解】(1)实验一中,②中只接触水,不接触氧气的铁钉不能生锈,①中同时接触氧气和水的铁钉生锈。因此①②对比可以说明铁生锈的一个条件是有氧气。故填:有氧气;
(2)实验二中碘几乎不溶于水却能溶解在汽油中,说明物质的溶解性与溶剂种类有关。故填:溶剂种类。
(3)分别向两个收集满CO2气体的软塑料瓶中加入等体积的水和氢氧化钠溶液,立即旋紧瓶盖,振荡,可以观察到右瓶变瘪的程度更大,是因为除了与左边瓶内相同体积的水吸收相同体积的二氧化碳外,氢氧化钠还和二氧化碳反应生成碳酸钠和水。故填:右瓶变瘪的程度比左瓶大。
17.(1)A1
(2)2
(3)铜的金属活动性强于银
(4)
【解析】(1)
根据金属活动性顺序钾钙钠镁铝,金属活动性顺序中方框内的元素的元素符号是Al;
(2)
由于在金属活动性顺序中金属Mg、Sn处在H之前,金属Pt、Au处在H之后,故Mg、Sn能与稀盐酸发生置换反应,Pt、Au不能,故能与稀盐酸发生置换反应的金属有2种;
(3)
活动性强的金属能把活动性弱的金属从其盐溶液中置换出来。在金属活动性顺序中,金属Cu处在金属Ag之前,则铜的金属活动性强于银,故Cu能从AgNO3溶液中置换出Ag;
(4)
Fe与稀硫酸反应生成硫酸亚铁和氢气,化学方程式是。
18. BC/CB ④ pH A 吸附
【详解】(1)灭火的原理包括:清除可燃物、隔绝空气、降低温度到着火点以下,题中所采取的措施中取封堵隧道口可以隔绝氧气,注水冷却可以降低温度到着火点以下。故选BC。
(2)我国派遣专业人员赶赴灾区,协助做好饮用水安全工作。①静置沉淀;②吸附沉淀(用明矾);③过滤;④蒸馏等净化水的操作,单一操作相对净化程度最高的操作是④蒸馏等净化水的操作。可用pH 试纸检测水的酸碱度是否达到标准。
(3)根据铁生锈的条件可知,要保证铁制品表面的干燥,所以不能经常水洗,同时铁会与酸发生化学反应,所以也不能经常酸洗,酸会加快铁制品的腐蚀,正确的方法是涂保护膜,表面喷漆。故选A。
(4)药监局公布的抗震救灾急需药械目录中包括:一次性防护服、活性炭防护口罩、骨科内外固定材料等。其中防护口罩主要是利用活性炭的吸附性,能吸附色素和异味。
【点睛】本题主要考查灭火原理,水的净化,防锈等知识,难度不大。
19. 大于 氧气 铜比银活泼
【详解】(1)盛有二氧化硫的试管液面上升比二氧化碳高,说明相同条件下的溶解性:SO2大于CO2。
故填:大于。
(2)实验二中,烧杯中的蜡烛燃烧一段时间后熄灭,是因为氧气完全反应,烧杯外的蜡烛持续燃烧,因此目的是验证物质燃烧需要氧气。
故填:氧气。
(3)实验三能观察到铜片表面析出银白色固体,是因为铜和硝酸银反应生成硝酸铜和银,从而得出的实验结论是铜比银活泼。
故填:铜比银活泼。
20. 红棕色粉末变黑 Fe2O3+3CO2Fe+3CO2 澄清石灰水变浑浊 CO2+Ca(OH)2=CaCO3↓+H2O 除去尾气中的CO(或防止CO使人中毒;防止CO污染空气;将CO转化为没有毒性的CO2等合理答案均可) 有气泡产生,溶液由无色变为浅绿色
【详解】(1) 一氧化碳可把三氧化二铁还原为铁,并生成二氧化碳气体,a中的实验现象为:红棕色粉末变黑,发生反应的化学方程式为Fe2O3+3CO2Fe+3CO2;氢氧化钙能与二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
(2) 通入的CO可能过量,进入大气会污染空气,所以要在装置图末端的导气管口放一盏燃着的酒精灯(灯焰处于导气管口),除去尾气中的CO;
(3) 铁和盐酸反应生成氯化亚铁和氢气,观察到的现象是:有气泡产生,溶液由无色变为浅绿色。
21. Fe FeCl2 CaCO3+2HCl=CaCl2+H2O+CO2↑ 2CO+ O22CO2或 C + O2CO2
【详解】本题是框图式推断题。要根据题给条件和物质的化学特性找准突破口,然后顺藤摸瓜完成解答,最后放到整道题目的环境去验证。
依据A为大理石的主要成分,可知A是碳酸钙,J由两种元素组成,且其溶液为浅绿色,所以J是氯化亚铁,C、H、I为单质,可以猜想C是铁,I是氢气,则B是盐酸,因此可知DEF是水、二氧化碳和氯化钙中的一种,由于F能生成氢气,所以F是水,水分解可生成氢气和氧气,所以H为氧气,则G是一氧化碳或碳,E是二氧化碳,则可知D是氯化钙。将假设代入框图,假设成立。综上所述:
(1) C是铁,化学式是:Fe;J是氯化亚铁,化学式是FeCl2;
(2) A+B→D+E+F是碳酸钙与盐酸反应生成氯化钙和水和二氧化碳反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑;G+H→E是一氧化碳在氧气燃烧生成二氧化碳,或碳在氧气中燃烧生成二氧化碳,反应的化学方程式:分别是, C + O2点燃CO2。
22. CO2 CaCO3 +2 置换反应
【分析】C和澄清石灰水反应生成沉淀E,所以C是二氧化碳,E是碳酸钙,A、B为两种黑色粉末,A、B高温生成二氧化碳和D,D为红色单质,所以D是铜,A、B是氧化铜、碳中的一种,经过验证,推断正确。
【详解】(1)由分析可知,C是二氧化碳,化学式为:CO2;E是碳酸钙,化学式为:CaCO3;
(2)氧化铜中氧元素为-2价,铜元素为+2价;
(3)反应①是氧化铜和碳在高温的条件下生成铜和二氧化碳,化学方程式为:,该反应是单质与化合物生成单质与化合物的反应,属于置换反应;反应②是二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:。
23.①
②解:设生铁中最多含铁的质量是x
x=112t
答:所得到的生铁中最多含铁112t。
【详解】见答案。
24.(1)解:设生成氢气的质量为x,生成氯化锌的质量为y
解得:x=0. 2g,y=13. 6g
答:生成氢气的质量为0. 2g
(2)反应后所得氯化锌溶液的溶质质量分数为:
答:反应后所得溶液中溶质的质量分数为12. 8%。
答案第1页,共2页
答案第1页,共2页
