京改版(2013) 练习题-第12章盐(含解析)
文档属性
| 名称 | 京改版(2013) 练习题-第12章盐(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 135.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-31 23:06:12 | ||
图片预览



文档简介
京改版(2013) 练习题-盐
一、单选题
1.下列有关实验现象的描述,错误的是
A.红磷在氧气中燃烧,产生大量白烟
B.铁丝在空气中剧烈燃烧,火星四射
C.木炭在氧气中燃烧发出白光,同时放出热量
D.硫酸铜溶液和氢氧化钠溶液反应有蓝色沉淀生成
2.下列实验方法不能达到实验目的的是
选项 实验目的 实验操作
A 除去二氧化碳中混有的一氧化碳 通过灼热的氧化铜
B 鉴别氯化钠和硝酸铵 加水,感受温度不同
C 鉴别NH4C1和(NH4)2SO4 加入熟石灰研磨,闻气味
D 除去KCl固体中混有的少量MnO2 加水溶解,过滤,蒸发
A.A B.B C.C D.D
3.下列涉及学科观点的有关说法不正确的是
A.微粒观:水分子是由氢分子和氧分子构成的
B.结构观:氢氧化钠与氢氧化钙的溶液中都含有OH-,其化学性质相似
C.转化观:在一定条件下,氢氧化钾和碳酸钾可以相互转化
D.守恒观:某物质在氧气中燃烧生成二氧化碳和水,该物质中一定含碳、氢两种元素
4.下列物质的名称、俗称、化学式一致的是( )
A.二氧化碳 冰 CO2
B.氧化钙 石灰石 CaO
C.汞 水银 Hg
D.碳酸氢钠 苏打 Na2CO3
5.归纳与比较是学习化学的重要方法,下列有关FeCl2和FeCl3的归纳与比较不正确的是( )
A.组成:都是由铁元素和氯元素组成的
B.性质:都能与氢氧化钠溶液反应生成沉淀
C.制取:都可以用铁和稀盐酸反应来制取
D.分类:都属于盐类
6.下列化学反应与图像对应关系正确的是
A.高温煅烧石灰石 B.红磷在密闭容器中燃烧
C.完全分解等量等浓度的过氧化氢溶液 D.将水通电电解一段时间
7.下列物质的性质与用途具有对应关系的是
A.碳酸钙难溶于水,可用作补钙剂
B.浓硫酸有腐蚀性,实验室可用作干燥剂
C.活性炭有吸附性,可除去水中色素和异味
D.二氧化碳能与水反应,可作制冷剂用于人工降雨
8.向 100g 质量分数为 4%的氢氧化钠溶液中逐滴加入氯化镁溶液,相关量的变化如下图。下列说法错误的是
A.a点的值为2.9
B.b 点对应的溶液能使无色酚酞溶液变红
C.c 点时两者恰好完全反应
D.d 点对应的溶液含有三种溶质
9.下列实验操作不能达到实验目的的是
选项 物质 目的 主要实验操作
A NaOH和NH4NO3固体 鉴别 取样,分别加适量水,测定所得溶液温度
B 空气中NaOH变质程度 检验 加入足量BaCl2溶液,过滤,向滤液中滴加酚酞
C CO2中混有少量SO2气体 除杂 先通过KMnO4溶液、浓硫酸洗气
D Fe粉含少量CuSO4粉末 分离 溶解、过滤,洗涤固体并烘干,蒸发滤液
A.A B.B C.C D.D
10.下列物质鉴别方法可行的是
A.用燃着的木条鉴别一氧化碳与甲烷 B.用酚酞试液鉴别氯化钠溶液与盐酸
C.用品尝的方法鉴别葡萄糖与亚硝酸钠 D.用肥皂水鉴别硬水与软水
11.如表给出了氯化钠和碳酸钠在不同温度时的溶解度,根据此表推断合理的是( )
温度/℃ 10 20 30 40
溶解度/g 氯化钠 35.8 36.0 36.3 36.6
碳酸钠 12.2 21.8 39.7 49.6
A.20℃时,将100g水加入30g碳酸钠中,充分搅拌后得到不饱和溶液
B.20℃时,将100g水加入30g氯化钠中,充分搅拌后所得溶液中溶质质量分数为30%
C.两物质均属于易溶物质
D.可以采用降温结晶的方法从二者的混合物中提纯氯化钠
12.下列图像表示的对应关系,正确的是
A.煅烧石灰石 B.向NaOH溶液中加入稀盐酸
C.③向盐酸中加水 D.等质量的金属与足量盐酸反应
二、填空题
13.在①食盐,②烧碱;③熟石灰;④氢氧化铝;⑤浓硝酸
(1)能够用于治疗胃酸过多的是___________(填化学式)。
(2)能够用于制备氯气的是___________(填序号)。
(3)用于制造化学纤维、生产橡胶的是___________(填化学式)。
(4)用于生产化肥、炸药、化工等领域的是___________(填序号)。
14.化肥在提高粮食产量,解决人类吃饭问题上发挥重要作用.
(1)下列均为常见的化学肥料:①碳酸氢铵(NH4HCO3);②尿素[CO(NH2)2] ;③硝酸钾KNO3 ;④磷酸二氢钙[Ca(H2PO4)2]。上述四种化肥中属于复合肥的是___________(填序号);①和②两种化肥相比较,N元素质量分数较低的是_________(填序号).
(2)资料表明,在高温高压下以CO2和NH3为原料合成尿素[CO(NH2)2],同时有物质X生成,反应方程式可表示为:CO2+2NH3CO(NH2)2+X; X物质的化学式为_________;在尿素中碳、氧、氮、氢元素的质量比为_________.
15.完成下列化学反应方程式
(1)二氧化碳使紫色石蕊溶液变红。_______。
(2)某物质在纯氧中燃烧生成黑色固体_______。
(3)水通电_______。
(4)工业上用磁铁矿炼铁_______。
(5)自制灭火器的灭火原理_______。
16.请从下列物质中选择合适的物质,用相应的序号填空。
①淀粉 ②肥皂水 ③氯化钠 ④碳酸 ⑤氢氧化钠
(1)汽水中含有的酸:_______;
(2)食盐的主要成分:_______;
(3)大米中富含的营养素是:_______;
(4)可用于区分硬水和软水的是:_______;
(5)固体溶于水有显著放热现象的化合物:_______。
三、实验题
17.小红在探究碱的化学性质时,将稀盐酸滴入到氢氧化钠溶液中,意外地发现有气泡产生,她认为氢氧化钠溶液已经变质。氢氧化钠溶液变质的原因是___________ (用化学方程式表示)。
【提出问题】变质后的氢氧化钠溶液中的溶质是什么
【猜想假设】小红对变质后的氢氧化钠溶液中的溶质成分做出了两种猜想:
猜想一:____________ 猜想二:________________
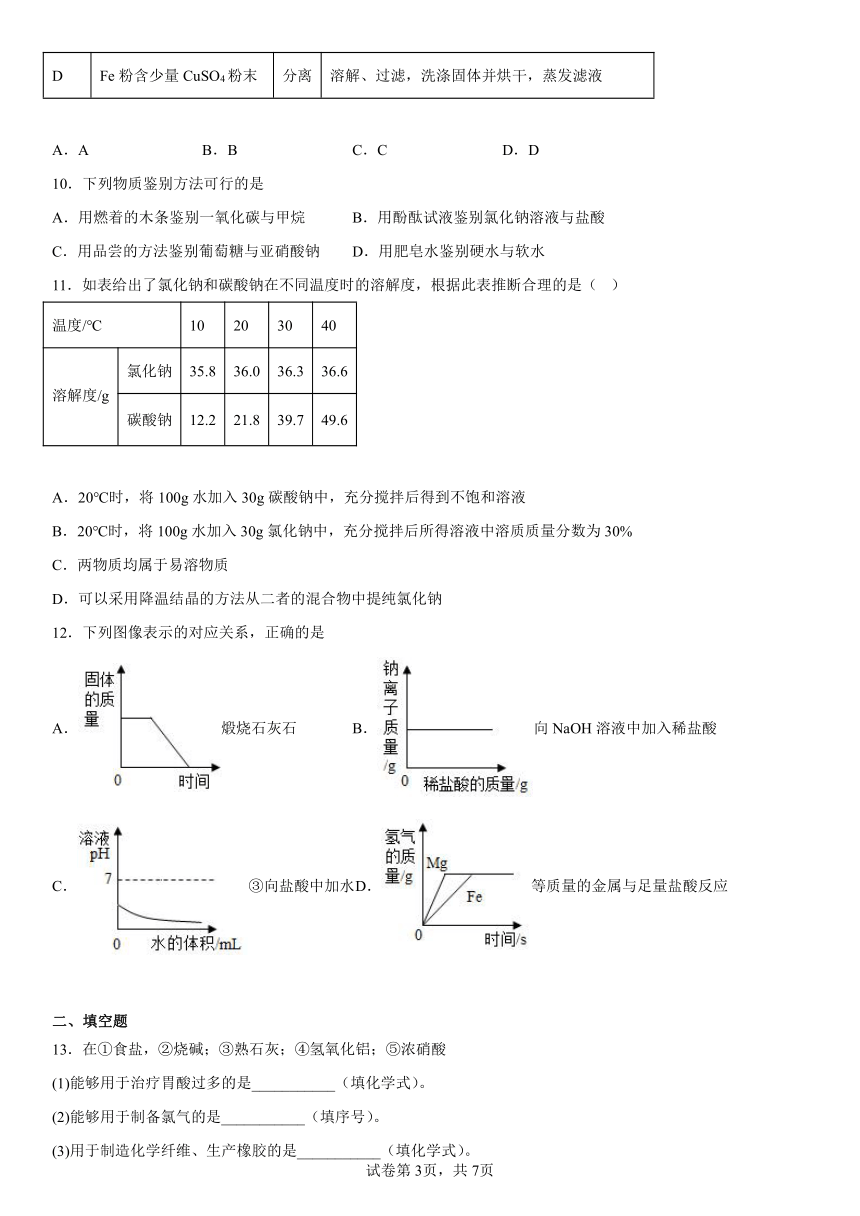
【实验设计】为了验证上述猜想哪个正确,小红设计了如下方案:取少量氢氧化钠溶液样品于试管中,滴加几滴无色酚酞溶液,观察溶液颜色的变化,可以得出结论。小敏认为小红的实验方案不合理,理由是_____________。
【实验与结论】小敏另外设计实验方案并进行了探究,请你帮她完成下面的实验报告:
实验步骤 实验现象 结论
步骤1:取少量氢氧化钠溶液样品于试管中,向其中滴加过量的氯化钙溶液并振荡 有白色沉淀产生 猜想一正确
步骤2:______________ ________________
步骤1反应的化学方程式是_____________。
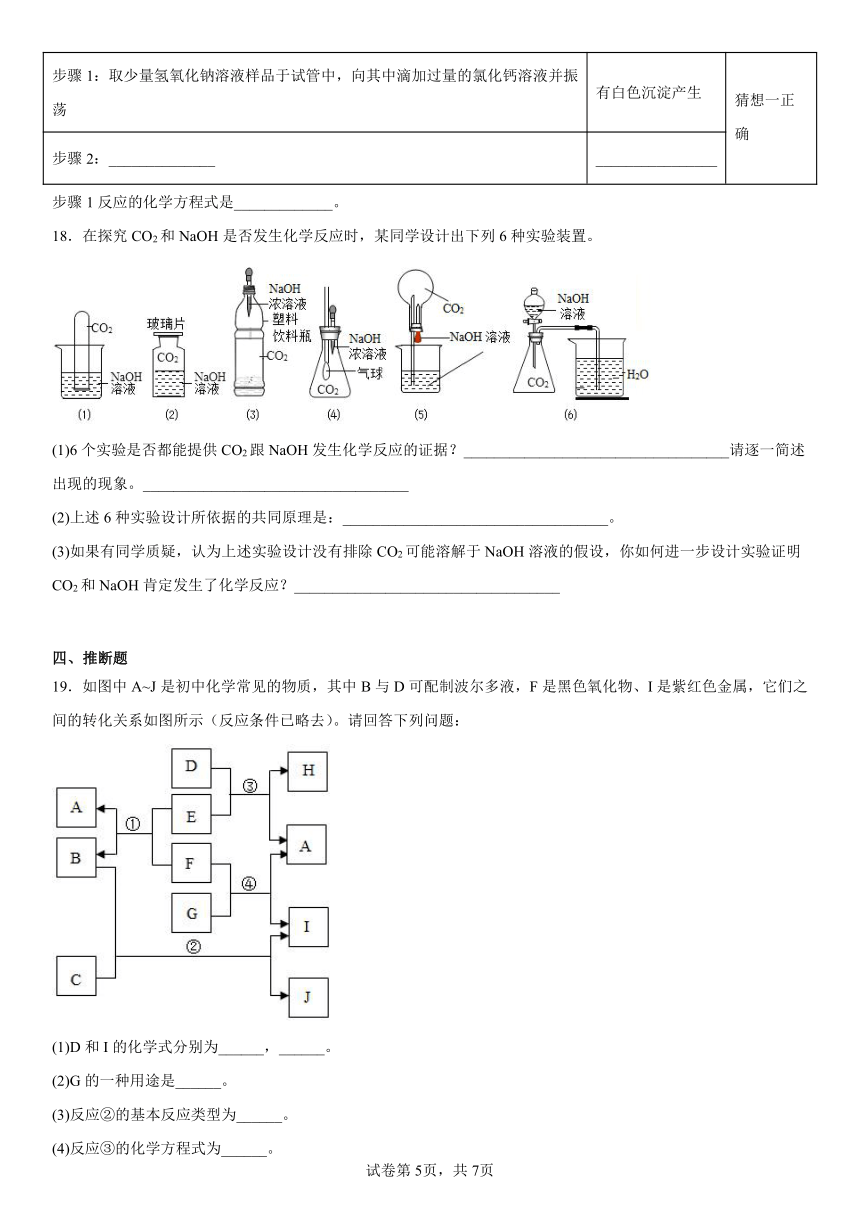
18.在探究CO2和NaOH是否发生化学反应时,某同学设计出下列6种实验装置。
(1)6个实验是否都能提供CO2跟NaOH发生化学反应的证据?___________________________________请逐一简述出现的现象。___________________________________
(2)上述6种实验设计所依据的共同原理是:___________________________________。
(3)如果有同学质疑,认为上述实验设计没有排除CO2可能溶解于NaOH溶液的假设,你如何进一步设计实验证明CO2和NaOH肯定发生了化学反应?___________________________________
四、推断题
19.如图中A~J是初中化学常见的物质,其中B与D可配制波尔多液,F是黑色氧化物、I是紫红色金属,它们之间的转化关系如图所示(反应条件已略去)。请回答下列问题:
(1)D和I的化学式分别为______,______。
(2)G的一种用途是______。
(3)反应②的基本反应类型为______。
(4)反应③的化学方程式为______。
20.一包固体粉末可能含有铁粉、碳粉、氧化铜、氢氧化钾中的一种或几种。为探究该固体粉末的组成,某化学兴趣小组进行了如图所示实验:
(1)图中气泡所含物质为_____。
(2)滤渣乙中一定含有的物质为_____。
(3)该固体粉末中一定含有的物质为_____。
五、计算题
21.同学们在实验室发现了一瓶没有塞子的氢氧化钠固体,为了探究瓶中固体的成分,同学们展开了探究。
(1)小明同学取了14.6g样品,加入足量的水充分溶解,再滴入足量的氯化钡溶液,过滤得到白色沉淀19.7g,求所取样品中氢氧化钠的质量,请写出计算过程。
(2)求14.6g样品中所含钠元素的质量为 ;
(3)小李同学也取14.6g样品,逐渐滴入7.3%的稀盐酸200g,观察到的现象为 ;若碳酸钠与稀盐酸的反应分为两步进行:第一步:Na2CO3+HCl= NaHCO3+ NaCl第二步:NaHCO3+ HCl= NaCl+H2O+CO2↑下图横轴为稀盐酸的质量,纵轴为生成气体的质量,请画图。
22.为了确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后,分别滴加相同浓度盐酸溶液100克,充分反应,产生CO2的体积(不考虑CO2在水中的溶解)如下表:
实验序号 1 2 3 4
盐酸质量(g) 100 100 100 100
样品质量(g) 2.96 3.70 5.18 6.66
CO2的体积(mL) 672 840 896 896
(1)四次实验中,盐酸过量的有______(填实验序号)。
(2)若加入的Na2CO3和NaHCO3混合物质量为2.22克,产生CO2的体积为______mL。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A、红磷在氧气中燃烧,产生大量白烟,放出热量,不符合题意;
B、铁丝在空气中不能燃烧,只能烧至红热,铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体,符合题意;
C、木炭在氧气中燃烧,发出白光,放出热量,生成能使澄清石灰水变浑浊的气体,不符合题意;
D、硫酸铜和氢氧化钠反应生成氢氧化铜和硫酸钠,产生蓝色沉淀,不符合题意。
故选B。
2.C
【详解】A、氧化铜和一氧化碳反应生成铜和二氧化碳,所以可用灼热的氧化铜,除去二氧化碳中混有的一氧化碳,该选项能够达到实验目的;
B、氯化钠溶于水温度无明显变化,硝酸铵溶于水吸热,温度降低,该选项能够达到实验目的;
C、氯化铵和氢氧化钙反应生成氯化钙、水和氨气,硫酸铵和氢氧化钙反应生成硫酸钙、水和氨气,氨气有刺激性气味,无法鉴别,该选项不能够达到实验目的;
D、过滤能够除去二氧化锰,蒸发得到氯化钾,该选项能够达到实验目的。
故选C。
3.A
【详解】A、分子是由原子构成的,水分子是由氢原子和氧原子构成的,故A选项叙述错误;
B、氢氧化钠和氢氧化钙都属于碱,在溶液中都含有OH-,其化学性质相似,故B选项叙述正确;
C、氢氧化钾能和二氧化碳反应生成碳酸钾和水,碳酸钾能和氢氧化钙反应生成碳酸钙和氢氧化钾,在一定条件下,氢氧化钾和碳酸钾可以相互转化,故C选项叙述正确;
D、根据化学反应前后元素的种类不变,生成物二氧化碳和水共含有碳、氢、氧三种元素,所以反应前的物质也只含有碳、氢、氧三种元素,而氧气只含氧元素,则该物质一定含碳、氢元素两种元素,故D选项叙述正确。
故选A。
【点睛】掌本题考查物质的微粒构成,物质的性质及质量守恒定律的应用,此题属于基础知识题,难度较小。
4.C
【详解】A、固体二氧化碳,俗称干冰,化学式为:CO2,不符合题意;
B、氧化钙俗称生石灰,化学式为:CaO,不符合题意;
C、汞俗称水银,化学式为:Hg,符合题意;
D、碳酸氢钠俗称小苏打,化学式为:NaHCO3,不符合题意。
故选C。
5.C
【详解】A、氯化铁和氯化亚铁都是由铁元素和氯元素组成的,A正确。
B、氯化铁和氢氧化钠生成氯化钠和氢氧化铁沉淀,氯化亚铁和氢氧化钠反应生成氯化钠和氢氧化亚铁沉淀,故B正确。
C、氯化亚铁可以由铁和稀盐酸制取,氯化铁不可以,C错。
D、氯化铁和氯化亚铁都是金属阳离子和酸根阴离子构成的化合物,属于盐,D正确。
故选:C。
6.B
【详解】A、高温煅烧石灰石,石灰石的主要成分碳酸钙高温煅烧生成氧化钙和二氧化碳,固体的质量逐渐减小,但是不会减少至零,不符合题意;
B、红磷在密闭容器中燃烧生成五氧化二磷,根据质量守恒定律,化学反应前后,物质的总质量不变,符合题意;
C、完全分解等量等浓度的过氧化氢溶液,有催化剂的反应速率快,但是最后生成氧气的质量相同,不符合题意;
D、在电解水实验中,“正氧负氢”,生成氢气和氧气的体积比约为2:1,生成氢气和氧气的质量比为:2:16=1:8,不符合题意。
故选B。
7.C
【详解】A、碳酸钙中含有钙元素,可用作补钙剂,不具有对应关系,不符合题意;
B、浓硫酸有吸水性,实验室可用作干燥剂,不具有对应关系,不符合题意;
C、活性炭有吸附性,故可除去水中色素和异味,具有对应关系,符合题意;
D、固体二氧化碳生华吸热,可作制冷剂用于人工降雨,不具有对应关系,不符合题意。
故选:C。
8.D
【详解】A、a点对应的值是恰好完全反应后生成的氢氧化镁的质量,设该质量为x
,
生成氢氧化镁的质量为2.9g,此选项表述正确;
B、b 点对应的溶液是氢氧化钠还未反应完,故溶液能使无色酚酞溶液变红,此选项表述正确;
C、c 点时继续滴加氯化镁,生成沉淀的质量不再增加,说明两者恰好完全反应,此选项表述正确;
D、d 点对应的溶液是氢氧化钠已完全反应,且滴加的氯化镁过量,故此时溶液中含有氯化钠和氯化镁两种溶质,此选项表述不正确。
故选D。
9.D
【详解】A、氢氧化钠固体溶于水,放出大量的热,溶液温度升高,硝酸铵溶于水吸热,溶液温度降低,现象不同,可以区分,不符合题意;
B、氢氧化钠能与空气中的二氧化碳反应生成碳酸钠和水,加入足量氯化钡溶液,氯化钡能与碳酸钠反应生成碳酸钡和氯化钠,产生白色沉淀,说明氢氧化钠已经变质,且足量的氯化钡溶液能将碳酸钠除尽,过滤,向滤液中加入无色酚酞试液,溶液变红,说明含氢氧化钠,则溶液部分变质,溶液不变色,说明溶液完全变质,不符合题意;
C、先通过高锰酸钾溶液,二氧化硫能与高锰酸钾溶液反应,可除去二氧化硫,浓硫酸具有吸水性,且与二氧化碳不反应,可用于干燥二氧化碳,可除去杂质,不符合题意;
D、溶解,铁能与硫酸铜反应生成硫酸亚铁和铜,达不到分离的目的,符合题意。
故选D。
10.D
【详解】A、一氧化碳和甲烷都具有可燃性,都会被点燃,燃烧发出蓝色火焰,现象相同,不能鉴别,不符合题意;
B、酚酞遇碱变红,遇酸性和中性不变色,仍为无色,氯化钠显中性,盐酸显酸性,都不能使无色酚酞试液变色,不能鉴别,不符合题意;
C、亚硝酸钠具有毒性,过量使用易产生危险,不能用品尝的方法鉴别葡萄糖与亚硝酸钠,不符合题意;
D、通常用肥皂水来区分硬水和软水,肥皂水在硬水中易起浮渣,在软水中泡沫较多,可以鉴别,符合题意。
故选D。
11.C
【详解】A、20℃时,碳酸钠的溶解度为21.8g,将100g水加入30g碳酸钠中将会有部分碳酸钠不能溶解,得到的是饱和溶液,推断错误;
B、20℃时,氯化钠的溶解度为36g,将100g水加入30g氯化钠中,充分搅拌后所得溶液中溶质质量分数为:,推断错误;
C、20℃时氯化钠和碳酸钠溶解度分别为36.0g、21.8g,两物质均属于易溶物质,推断正确;
D、不可以采用降温结晶的方法从二者的混合物中提纯氯化钠,推断错误;
故选:C。
12.B
【详解】A、碳酸钙煅烧固体的质量减少,碳酸钙反应后生成了氧化钙和二氧化碳,故固体的质量不可能减少为0,错误;
B、向氢氧化钠溶液中加入稀盐酸,溶液中钠离子始终存在于溶液中,故钠离子的质量保持不变,正确;
C、稀释盐酸时,溶液的酸性减弱,pH增加,故错误;
D、等质量的金属镁和铁与足量的酸反应镁比铁生成的氢气的质量大,故错误。故选B。
13.(1)Al(OH)3
(2)①
(3)NaOH
(4)⑤
【解析】(1)
氢氧化铝能与胃酸中的盐酸反应生成氯化铝和水,因此氢氧化铝能治疗胃酸过多,故填:Al(OH)3;
(2)
食盐水通电可以生成氢氧化钠、氯气和氢气,故能够用于制备氯气的是食盐,故填:①;
(3)
烧碱是氢氧化钠的俗称,氢氧化钠广泛应用于造纸、印染、炼油、制造化学纤维和生产橡胶等,故填:NaOH;
(4)
浓硝酸用于生产化肥、炸药、染料、医药、橡胶、塑料及冶金等领域,故填:⑤。
14.(1) ③ ①
(2) H2O 3:4:7:1
【解析】(1)
化肥种类:氮肥、磷肥、钾肥、复合肥(含有两种及两种以上的化肥);所以属于复合肥的是:硝酸钾。碳酸氢铵和尿素中N元素质量分数分别为:,
故填:③;①
(2)
根据质量守恒定律:化学反应前后原子种类及个数不变:反应前碳原子1个;氧原子2个;氮原子2个;氢原子6个;反应后碳原子1个;氧原子1个;氮原子2个;氢原子4个。所以反应后少2个氢原子和1和氧原子,X的化学式为H2O。尿素中碳、氧、氮、氢元素的质量比为
故填:H2O;3:4:7:1
15. CO2+H2O=H2CO3 Na2CO3+2HCl=2NaCl+H2O+CO2↑ ·
【详解】(1)二氧化碳使紫色石蕊溶液变红,是二氧化碳与石蕊试液中的水反应生成了碳酸,碳酸显酸性,能使紫色石蕊试液变化,反应的化学方程式为:CO2+H2O=H2CO3
(2)某物质在纯氧中燃烧生成黑色固体,是铁丝在氧气中燃烧生成了四氧化三铁,反应的化学方程式为:
(3)水通电生成氢气和氧气,反应的化学方程式为:。
(4)磁铁矿主要成分是四氧化三铁,工业上用磁铁矿炼铁的化学方程式为:。
(5)自制灭火器用的药品是碳酸钠和稀盐酸,它们之间发生反应生成氯化钠、水、二氧化碳,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑
16.(1)④
(2)③
(3)①
(4)②
(5)⑤
【解析】(1)
汽水里主要是碳酸,所以叫碳酸饮料,碳酸很不稳定,受热会迅速分解为水和二氧化碳。故填④;
(2)
食盐的主要成分氯化钠。故填③;
(3)
大米中富含的营养素是蛋白质、淀粉等。故填①;
(4)
鉴别硬水和软水使用的是肥皂水:硬水与肥皂水混合有浮渣产生,而软水与肥皂水混合有泡沫产生。故填②;
(5)
溶于水放热的常见物质有:浓硫酸、氢氧化钠固体、氧化钙等。故填⑤。
17. 2NaOH+CO2=Na2CO3+H2O 猜想一为碳酸钠或者猜想一为氢氧化钠和碳酸钠 猜想二为氢氧化钠和碳酸钠或者猜想二为碳酸钠 氢氧化钠和碳酸钠的水溶液都呈碱性 将步骤1中的混合溶液进行过滤,取滤液滴加酚酞试液,观察溶液颜色是否变红 猜想一填写碳酸钠的,实验现象为溶液仍为无色;猜想一填写碳酸钠和氢氧化钠的,实验现象为溶液变红。 Na2CO3+CaCl2=CaCO3↓+2NaCl
【详解】(1)稀盐酸滴入到氢氧化钠溶液中,意外地发现有气泡产生,可知氢氧化钠中混有碳酸盐,原因是氢氧化钠与空气中二氧化碳反应生成碳酸钠和水,化学方程式为2NaOH+CO2=Na2CO3+H2O;
(2)猜想假设:氢氧化钠可能部分变质,故溶液溶质为氢氧化钠和碳酸钠,氢氧化钠也可能全部变质,故溶液溶质为碳酸钠。故猜想为碳酸钠或者氢氧化钠和碳酸钠,顺序没有要求。
(3)实验设计:无论氢氧化钠是否变质,氢氧化钠和碳酸钠的水溶液都呈碱性,故酚酞试液都会变成红色,故小红的实验方案不合理。
(4)实验与结论:氢氧化钠变质是否完全,需要检验溶液中是否仍有剩余氢氧化钠,故需要先将变质后的碳酸根除去,检验剩余溶液中是否存在氢氧根离子即可,故步骤2可将步骤1中的混合溶液进行过滤,取滤液滴加酚酞试液,观察溶液颜色是否变红,若变红,则氢氧化钠部分变质。根据表格中结论为猜想一正确,故若猜想一填写碳酸钠,则实验现象为溶液仍为无色,若猜想一填写碳酸钠和氢氧化钠,则实验现象为溶液变红;步骤1滴加过量的氯化钙溶液,氯化钙和碳酸钠反应生成碳酸钙白色沉淀和氯化钠,故反应的化学方程式为Na2CO3+CaCl2=CaCO3↓+2NaCl,不要丢掉沉淀符号,配平化学计量数。
18. 6个实验都可以证明CO2和NaOH反应 分别出现的现象是:实验(1),反应后,试管内液面上升;
实验(2),反应后,倒置可发现玻璃片被吸住;
实验(3),反应后,塑料饮料瓶被压瘪;
实验(4),反应后,气球会充气鼓起来;
实验(5),反应后,烧瓶中有“喷泉”出现
实验(6),反应后,烧杯中的水被吸到锥形瓶中。 反应后,盛有CO2的容器内压强减小,同外界大气压产生压强差。 取少量反应后的溶液于试管中,滴入稀盐酸,如果出现气泡,则说明CO2确实同NaOH发生了化学反应
【详解】(1)实验(1)中二氧化碳和氢氧化钠反应后,气体减少,压强减小,试管内液面上升;实验(2)中二氧化碳和氢氧化钠反应,气体减少,压强减小,在大气压的作用下,玻璃片被吸住,故现象为倒置可发现玻璃片被吸住;实验(3)中反应后,由于气体减小,压强减小,软塑料瓶变瘪;实验(4)中反应后,由于压强减小,气球胀大;实验(5)中反应后,由于压强减小,烧瓶中有“喷泉”出现;实验(6)中反应后,由于压强减小,烧杯中的水被吸到锥形瓶中,故均能提供二氧化碳和氢氧化钠发生化学反应的证据;
(2)上述6种实验设计所依据的共同原理是:二氧化碳和氢氧化钠溶液反应后,气体减小,压强减小,同外界大气压产生压强差;
(3)二氧化碳与氢氧化钠反应生成了碳酸钠,碳酸钠能与酸反应生成二氧化碳,故可设计实验:取少量反应后的溶液于试管中,滴入过量稀盐酸,如果出现气泡,则说明CO2确实同NaOH发生了化学反应。
19.(1) Ca(OH)2 Cu
(2)清洁燃料(或冶炼金属)
(3)置换反应
(4)
【分析】I是紫红色金属,故I是铜;F和G生成A和I,F为黑色氧化物,所以F为氧化铜,该反应为氢气、一氧化碳或碳还原氧化铜;且B 能配制波尔多液,且氧化铜F和E反应可生成B和A,所以B为硫酸铜,E为硫酸,A为水; F与G反应生成A和I,即为氢气还原氧化铜,G为氢气;D也可用于配制波尔多液,所以D为氢氧化钙;D氢氧化钙和E硫酸反应生成水和硫酸钙,所以H为硫酸钙;B硫酸铜和C反应生成I(铜)和J,该反应应是活泼金属置换出硫酸铜中的铜,C可能为铁等活动性比铜强的金属,J为相应的金属盐,如硫酸亚铁,代入验证,推断合理。
(1)
由分析可知,D为氢氧化钙,I为铜,其化学式为分别为Ca(OH)2、Cu,故填:Ca(OH)2;Cu;
(2)
G为氢气,具有可燃性、还原性,可作清洁燃料或冶炼金属,故填:清洁燃料(或冶炼金属);
(3)
反应②,即铁和硫酸铜反应生成硫酸亚铁和铜,该反应符合“一种单质与一种化合物反应,生成另一种单质和另一种化合物”的特点,属于置换反应,故填:置换反应;
(4)
反应③,即氢氧化钙与硫酸反应生成硫酸钙和水,反应的化学方程式为,故填:。
20.(1)氢气
(2)铜
(3)铁粉、氧化铜
【分析】固体样品加水得到的滤液A中加入氯化铜溶液无明显现象,说明A中不含有氢氧化钾;滤渣甲加入过量的稀硫酸产生气体,说明含有铁,得到的滤液B中含有硫酸亚铁和硫酸;得到的滤渣乙在空气中充分灼烧,有固体残留物,说明滤渣乙中含有铜,故原固体中含有氧化铜,不能确定是否含有碳,氧化铜与硫酸反应生成硫酸铜,铁可以和硫酸铜反应生成硫酸亚铁和铜,由于乙中含有铜,故滤液B中不一定含有硫酸铜,代入验证,推理正确。
(1)
由分析可知:滤渣甲加入过量的稀硫酸产生气体,说明含有铁,所以生成的气泡是氢气;
(2)
由分析可知:滤渣乙中一定含有铜;
(3)
由分析可知:该固体粉末中一定含有的物质为铁粉、氧化铜。
21.4g;6.9g;一段时间后才开始产生气泡;
【详解】(1)设样品中的碳酸钠的质量为x,
x=10.6g,
则样品中氢氧化钠的质量=14.6g-10.6g=4g;
(2)样品中钠元素的质量=4g××100%+10.6g××100%=6.9g;
(3)取14.6g样品,逐渐滴入7.3%的稀盐酸200g,氢氧化钠先与盐酸反应生成氯化钠和水,没有气泡产生;当氢氧化钠完全反应后,碳酸钠先与盐酸反应生成碳酸氢钠和氯化钠,而后碳酸氢钠再与盐酸反应氯化钠、水和二氧化碳,有气泡产生;
设与4g氢氧化钠反应需要7.3%的稀盐酸的质量为y,则:
y=50g;
设在反应Na2CO3+HCl=NaHCO3+NaCl中,10.6g碳酸钠消耗7.3%的稀盐酸的质量为z,生成碳酸氢钠的质量为m,则:
z=50g,
m=8.4g,
也就是开始滴加稀盐酸时没有气泡产生,当滴加到(50g+50g)=100g稀盐酸时才开始产生气泡;设8.4g碳酸氢钠消耗7.3%的稀盐酸的质量为n,生成二氧化碳的质量为w,则:
n=50g,
w=4.4g,
则图象为:。
22.(1)1、2
(2)504
【详解】(1)对比实验1、2、3可知,加入盐酸的质量相同,随着样品的质量增加,生成二氧化碳的体积逐渐增大,故实验1、2中盐酸一定过量;
(2)解:设产生二氧化碳的体积为x
则 x=504mL
答:产生二氧化碳的体积为504mL。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关实验现象的描述,错误的是
A.红磷在氧气中燃烧,产生大量白烟
B.铁丝在空气中剧烈燃烧,火星四射
C.木炭在氧气中燃烧发出白光,同时放出热量
D.硫酸铜溶液和氢氧化钠溶液反应有蓝色沉淀生成
2.下列实验方法不能达到实验目的的是
选项 实验目的 实验操作
A 除去二氧化碳中混有的一氧化碳 通过灼热的氧化铜
B 鉴别氯化钠和硝酸铵 加水,感受温度不同
C 鉴别NH4C1和(NH4)2SO4 加入熟石灰研磨,闻气味
D 除去KCl固体中混有的少量MnO2 加水溶解,过滤,蒸发
A.A B.B C.C D.D
3.下列涉及学科观点的有关说法不正确的是
A.微粒观:水分子是由氢分子和氧分子构成的
B.结构观:氢氧化钠与氢氧化钙的溶液中都含有OH-,其化学性质相似
C.转化观:在一定条件下,氢氧化钾和碳酸钾可以相互转化
D.守恒观:某物质在氧气中燃烧生成二氧化碳和水,该物质中一定含碳、氢两种元素
4.下列物质的名称、俗称、化学式一致的是( )
A.二氧化碳 冰 CO2
B.氧化钙 石灰石 CaO
C.汞 水银 Hg
D.碳酸氢钠 苏打 Na2CO3
5.归纳与比较是学习化学的重要方法,下列有关FeCl2和FeCl3的归纳与比较不正确的是( )
A.组成:都是由铁元素和氯元素组成的
B.性质:都能与氢氧化钠溶液反应生成沉淀
C.制取:都可以用铁和稀盐酸反应来制取
D.分类:都属于盐类
6.下列化学反应与图像对应关系正确的是
A.高温煅烧石灰石 B.红磷在密闭容器中燃烧
C.完全分解等量等浓度的过氧化氢溶液 D.将水通电电解一段时间
7.下列物质的性质与用途具有对应关系的是
A.碳酸钙难溶于水,可用作补钙剂
B.浓硫酸有腐蚀性,实验室可用作干燥剂
C.活性炭有吸附性,可除去水中色素和异味
D.二氧化碳能与水反应,可作制冷剂用于人工降雨
8.向 100g 质量分数为 4%的氢氧化钠溶液中逐滴加入氯化镁溶液,相关量的变化如下图。下列说法错误的是
A.a点的值为2.9
B.b 点对应的溶液能使无色酚酞溶液变红
C.c 点时两者恰好完全反应
D.d 点对应的溶液含有三种溶质
9.下列实验操作不能达到实验目的的是
选项 物质 目的 主要实验操作
A NaOH和NH4NO3固体 鉴别 取样,分别加适量水,测定所得溶液温度
B 空气中NaOH变质程度 检验 加入足量BaCl2溶液,过滤,向滤液中滴加酚酞
C CO2中混有少量SO2气体 除杂 先通过KMnO4溶液、浓硫酸洗气
D Fe粉含少量CuSO4粉末 分离 溶解、过滤,洗涤固体并烘干,蒸发滤液
A.A B.B C.C D.D
10.下列物质鉴别方法可行的是
A.用燃着的木条鉴别一氧化碳与甲烷 B.用酚酞试液鉴别氯化钠溶液与盐酸
C.用品尝的方法鉴别葡萄糖与亚硝酸钠 D.用肥皂水鉴别硬水与软水
11.如表给出了氯化钠和碳酸钠在不同温度时的溶解度,根据此表推断合理的是( )
温度/℃ 10 20 30 40
溶解度/g 氯化钠 35.8 36.0 36.3 36.6
碳酸钠 12.2 21.8 39.7 49.6
A.20℃时,将100g水加入30g碳酸钠中,充分搅拌后得到不饱和溶液
B.20℃时,将100g水加入30g氯化钠中,充分搅拌后所得溶液中溶质质量分数为30%
C.两物质均属于易溶物质
D.可以采用降温结晶的方法从二者的混合物中提纯氯化钠
12.下列图像表示的对应关系,正确的是
A.煅烧石灰石 B.向NaOH溶液中加入稀盐酸
C.③向盐酸中加水 D.等质量的金属与足量盐酸反应
二、填空题
13.在①食盐,②烧碱;③熟石灰;④氢氧化铝;⑤浓硝酸
(1)能够用于治疗胃酸过多的是___________(填化学式)。
(2)能够用于制备氯气的是___________(填序号)。
(3)用于制造化学纤维、生产橡胶的是___________(填化学式)。
(4)用于生产化肥、炸药、化工等领域的是___________(填序号)。
14.化肥在提高粮食产量,解决人类吃饭问题上发挥重要作用.
(1)下列均为常见的化学肥料:①碳酸氢铵(NH4HCO3);②尿素[CO(NH2)2] ;③硝酸钾KNO3 ;④磷酸二氢钙[Ca(H2PO4)2]。上述四种化肥中属于复合肥的是___________(填序号);①和②两种化肥相比较,N元素质量分数较低的是_________(填序号).
(2)资料表明,在高温高压下以CO2和NH3为原料合成尿素[CO(NH2)2],同时有物质X生成,反应方程式可表示为:CO2+2NH3CO(NH2)2+X; X物质的化学式为_________;在尿素中碳、氧、氮、氢元素的质量比为_________.
15.完成下列化学反应方程式
(1)二氧化碳使紫色石蕊溶液变红。_______。
(2)某物质在纯氧中燃烧生成黑色固体_______。
(3)水通电_______。
(4)工业上用磁铁矿炼铁_______。
(5)自制灭火器的灭火原理_______。
16.请从下列物质中选择合适的物质,用相应的序号填空。
①淀粉 ②肥皂水 ③氯化钠 ④碳酸 ⑤氢氧化钠
(1)汽水中含有的酸:_______;
(2)食盐的主要成分:_______;
(3)大米中富含的营养素是:_______;
(4)可用于区分硬水和软水的是:_______;
(5)固体溶于水有显著放热现象的化合物:_______。
三、实验题
17.小红在探究碱的化学性质时,将稀盐酸滴入到氢氧化钠溶液中,意外地发现有气泡产生,她认为氢氧化钠溶液已经变质。氢氧化钠溶液变质的原因是___________ (用化学方程式表示)。
【提出问题】变质后的氢氧化钠溶液中的溶质是什么
【猜想假设】小红对变质后的氢氧化钠溶液中的溶质成分做出了两种猜想:
猜想一:____________ 猜想二:________________
【实验设计】为了验证上述猜想哪个正确,小红设计了如下方案:取少量氢氧化钠溶液样品于试管中,滴加几滴无色酚酞溶液,观察溶液颜色的变化,可以得出结论。小敏认为小红的实验方案不合理,理由是_____________。
【实验与结论】小敏另外设计实验方案并进行了探究,请你帮她完成下面的实验报告:
实验步骤 实验现象 结论
步骤1:取少量氢氧化钠溶液样品于试管中,向其中滴加过量的氯化钙溶液并振荡 有白色沉淀产生 猜想一正确
步骤2:______________ ________________
步骤1反应的化学方程式是_____________。
18.在探究CO2和NaOH是否发生化学反应时,某同学设计出下列6种实验装置。
(1)6个实验是否都能提供CO2跟NaOH发生化学反应的证据?___________________________________请逐一简述出现的现象。___________________________________
(2)上述6种实验设计所依据的共同原理是:___________________________________。
(3)如果有同学质疑,认为上述实验设计没有排除CO2可能溶解于NaOH溶液的假设,你如何进一步设计实验证明CO2和NaOH肯定发生了化学反应?___________________________________
四、推断题
19.如图中A~J是初中化学常见的物质,其中B与D可配制波尔多液,F是黑色氧化物、I是紫红色金属,它们之间的转化关系如图所示(反应条件已略去)。请回答下列问题:
(1)D和I的化学式分别为______,______。
(2)G的一种用途是______。
(3)反应②的基本反应类型为______。
(4)反应③的化学方程式为______。
20.一包固体粉末可能含有铁粉、碳粉、氧化铜、氢氧化钾中的一种或几种。为探究该固体粉末的组成,某化学兴趣小组进行了如图所示实验:
(1)图中气泡所含物质为_____。
(2)滤渣乙中一定含有的物质为_____。
(3)该固体粉末中一定含有的物质为_____。
五、计算题
21.同学们在实验室发现了一瓶没有塞子的氢氧化钠固体,为了探究瓶中固体的成分,同学们展开了探究。
(1)小明同学取了14.6g样品,加入足量的水充分溶解,再滴入足量的氯化钡溶液,过滤得到白色沉淀19.7g,求所取样品中氢氧化钠的质量,请写出计算过程。
(2)求14.6g样品中所含钠元素的质量为 ;
(3)小李同学也取14.6g样品,逐渐滴入7.3%的稀盐酸200g,观察到的现象为 ;若碳酸钠与稀盐酸的反应分为两步进行:第一步:Na2CO3+HCl= NaHCO3+ NaCl第二步:NaHCO3+ HCl= NaCl+H2O+CO2↑下图横轴为稀盐酸的质量,纵轴为生成气体的质量,请画图。
22.为了确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后,分别滴加相同浓度盐酸溶液100克,充分反应,产生CO2的体积(不考虑CO2在水中的溶解)如下表:
实验序号 1 2 3 4
盐酸质量(g) 100 100 100 100
样品质量(g) 2.96 3.70 5.18 6.66
CO2的体积(mL) 672 840 896 896
(1)四次实验中,盐酸过量的有______(填实验序号)。
(2)若加入的Na2CO3和NaHCO3混合物质量为2.22克,产生CO2的体积为______mL。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A、红磷在氧气中燃烧,产生大量白烟,放出热量,不符合题意;
B、铁丝在空气中不能燃烧,只能烧至红热,铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体,符合题意;
C、木炭在氧气中燃烧,发出白光,放出热量,生成能使澄清石灰水变浑浊的气体,不符合题意;
D、硫酸铜和氢氧化钠反应生成氢氧化铜和硫酸钠,产生蓝色沉淀,不符合题意。
故选B。
2.C
【详解】A、氧化铜和一氧化碳反应生成铜和二氧化碳,所以可用灼热的氧化铜,除去二氧化碳中混有的一氧化碳,该选项能够达到实验目的;
B、氯化钠溶于水温度无明显变化,硝酸铵溶于水吸热,温度降低,该选项能够达到实验目的;
C、氯化铵和氢氧化钙反应生成氯化钙、水和氨气,硫酸铵和氢氧化钙反应生成硫酸钙、水和氨气,氨气有刺激性气味,无法鉴别,该选项不能够达到实验目的;
D、过滤能够除去二氧化锰,蒸发得到氯化钾,该选项能够达到实验目的。
故选C。
3.A
【详解】A、分子是由原子构成的,水分子是由氢原子和氧原子构成的,故A选项叙述错误;
B、氢氧化钠和氢氧化钙都属于碱,在溶液中都含有OH-,其化学性质相似,故B选项叙述正确;
C、氢氧化钾能和二氧化碳反应生成碳酸钾和水,碳酸钾能和氢氧化钙反应生成碳酸钙和氢氧化钾,在一定条件下,氢氧化钾和碳酸钾可以相互转化,故C选项叙述正确;
D、根据化学反应前后元素的种类不变,生成物二氧化碳和水共含有碳、氢、氧三种元素,所以反应前的物质也只含有碳、氢、氧三种元素,而氧气只含氧元素,则该物质一定含碳、氢元素两种元素,故D选项叙述正确。
故选A。
【点睛】掌本题考查物质的微粒构成,物质的性质及质量守恒定律的应用,此题属于基础知识题,难度较小。
4.C
【详解】A、固体二氧化碳,俗称干冰,化学式为:CO2,不符合题意;
B、氧化钙俗称生石灰,化学式为:CaO,不符合题意;
C、汞俗称水银,化学式为:Hg,符合题意;
D、碳酸氢钠俗称小苏打,化学式为:NaHCO3,不符合题意。
故选C。
5.C
【详解】A、氯化铁和氯化亚铁都是由铁元素和氯元素组成的,A正确。
B、氯化铁和氢氧化钠生成氯化钠和氢氧化铁沉淀,氯化亚铁和氢氧化钠反应生成氯化钠和氢氧化亚铁沉淀,故B正确。
C、氯化亚铁可以由铁和稀盐酸制取,氯化铁不可以,C错。
D、氯化铁和氯化亚铁都是金属阳离子和酸根阴离子构成的化合物,属于盐,D正确。
故选:C。
6.B
【详解】A、高温煅烧石灰石,石灰石的主要成分碳酸钙高温煅烧生成氧化钙和二氧化碳,固体的质量逐渐减小,但是不会减少至零,不符合题意;
B、红磷在密闭容器中燃烧生成五氧化二磷,根据质量守恒定律,化学反应前后,物质的总质量不变,符合题意;
C、完全分解等量等浓度的过氧化氢溶液,有催化剂的反应速率快,但是最后生成氧气的质量相同,不符合题意;
D、在电解水实验中,“正氧负氢”,生成氢气和氧气的体积比约为2:1,生成氢气和氧气的质量比为:2:16=1:8,不符合题意。
故选B。
7.C
【详解】A、碳酸钙中含有钙元素,可用作补钙剂,不具有对应关系,不符合题意;
B、浓硫酸有吸水性,实验室可用作干燥剂,不具有对应关系,不符合题意;
C、活性炭有吸附性,故可除去水中色素和异味,具有对应关系,符合题意;
D、固体二氧化碳生华吸热,可作制冷剂用于人工降雨,不具有对应关系,不符合题意。
故选:C。
8.D
【详解】A、a点对应的值是恰好完全反应后生成的氢氧化镁的质量,设该质量为x
,
生成氢氧化镁的质量为2.9g,此选项表述正确;
B、b 点对应的溶液是氢氧化钠还未反应完,故溶液能使无色酚酞溶液变红,此选项表述正确;
C、c 点时继续滴加氯化镁,生成沉淀的质量不再增加,说明两者恰好完全反应,此选项表述正确;
D、d 点对应的溶液是氢氧化钠已完全反应,且滴加的氯化镁过量,故此时溶液中含有氯化钠和氯化镁两种溶质,此选项表述不正确。
故选D。
9.D
【详解】A、氢氧化钠固体溶于水,放出大量的热,溶液温度升高,硝酸铵溶于水吸热,溶液温度降低,现象不同,可以区分,不符合题意;
B、氢氧化钠能与空气中的二氧化碳反应生成碳酸钠和水,加入足量氯化钡溶液,氯化钡能与碳酸钠反应生成碳酸钡和氯化钠,产生白色沉淀,说明氢氧化钠已经变质,且足量的氯化钡溶液能将碳酸钠除尽,过滤,向滤液中加入无色酚酞试液,溶液变红,说明含氢氧化钠,则溶液部分变质,溶液不变色,说明溶液完全变质,不符合题意;
C、先通过高锰酸钾溶液,二氧化硫能与高锰酸钾溶液反应,可除去二氧化硫,浓硫酸具有吸水性,且与二氧化碳不反应,可用于干燥二氧化碳,可除去杂质,不符合题意;
D、溶解,铁能与硫酸铜反应生成硫酸亚铁和铜,达不到分离的目的,符合题意。
故选D。
10.D
【详解】A、一氧化碳和甲烷都具有可燃性,都会被点燃,燃烧发出蓝色火焰,现象相同,不能鉴别,不符合题意;
B、酚酞遇碱变红,遇酸性和中性不变色,仍为无色,氯化钠显中性,盐酸显酸性,都不能使无色酚酞试液变色,不能鉴别,不符合题意;
C、亚硝酸钠具有毒性,过量使用易产生危险,不能用品尝的方法鉴别葡萄糖与亚硝酸钠,不符合题意;
D、通常用肥皂水来区分硬水和软水,肥皂水在硬水中易起浮渣,在软水中泡沫较多,可以鉴别,符合题意。
故选D。
11.C
【详解】A、20℃时,碳酸钠的溶解度为21.8g,将100g水加入30g碳酸钠中将会有部分碳酸钠不能溶解,得到的是饱和溶液,推断错误;
B、20℃时,氯化钠的溶解度为36g,将100g水加入30g氯化钠中,充分搅拌后所得溶液中溶质质量分数为:,推断错误;
C、20℃时氯化钠和碳酸钠溶解度分别为36.0g、21.8g,两物质均属于易溶物质,推断正确;
D、不可以采用降温结晶的方法从二者的混合物中提纯氯化钠,推断错误;
故选:C。
12.B
【详解】A、碳酸钙煅烧固体的质量减少,碳酸钙反应后生成了氧化钙和二氧化碳,故固体的质量不可能减少为0,错误;
B、向氢氧化钠溶液中加入稀盐酸,溶液中钠离子始终存在于溶液中,故钠离子的质量保持不变,正确;
C、稀释盐酸时,溶液的酸性减弱,pH增加,故错误;
D、等质量的金属镁和铁与足量的酸反应镁比铁生成的氢气的质量大,故错误。故选B。
13.(1)Al(OH)3
(2)①
(3)NaOH
(4)⑤
【解析】(1)
氢氧化铝能与胃酸中的盐酸反应生成氯化铝和水,因此氢氧化铝能治疗胃酸过多,故填:Al(OH)3;
(2)
食盐水通电可以生成氢氧化钠、氯气和氢气,故能够用于制备氯气的是食盐,故填:①;
(3)
烧碱是氢氧化钠的俗称,氢氧化钠广泛应用于造纸、印染、炼油、制造化学纤维和生产橡胶等,故填:NaOH;
(4)
浓硝酸用于生产化肥、炸药、染料、医药、橡胶、塑料及冶金等领域,故填:⑤。
14.(1) ③ ①
(2) H2O 3:4:7:1
【解析】(1)
化肥种类:氮肥、磷肥、钾肥、复合肥(含有两种及两种以上的化肥);所以属于复合肥的是:硝酸钾。碳酸氢铵和尿素中N元素质量分数分别为:,
故填:③;①
(2)
根据质量守恒定律:化学反应前后原子种类及个数不变:反应前碳原子1个;氧原子2个;氮原子2个;氢原子6个;反应后碳原子1个;氧原子1个;氮原子2个;氢原子4个。所以反应后少2个氢原子和1和氧原子,X的化学式为H2O。尿素中碳、氧、氮、氢元素的质量比为
故填:H2O;3:4:7:1
15. CO2+H2O=H2CO3 Na2CO3+2HCl=2NaCl+H2O+CO2↑ ·
【详解】(1)二氧化碳使紫色石蕊溶液变红,是二氧化碳与石蕊试液中的水反应生成了碳酸,碳酸显酸性,能使紫色石蕊试液变化,反应的化学方程式为:CO2+H2O=H2CO3
(2)某物质在纯氧中燃烧生成黑色固体,是铁丝在氧气中燃烧生成了四氧化三铁,反应的化学方程式为:
(3)水通电生成氢气和氧气,反应的化学方程式为:。
(4)磁铁矿主要成分是四氧化三铁,工业上用磁铁矿炼铁的化学方程式为:。
(5)自制灭火器用的药品是碳酸钠和稀盐酸,它们之间发生反应生成氯化钠、水、二氧化碳,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑
16.(1)④
(2)③
(3)①
(4)②
(5)⑤
【解析】(1)
汽水里主要是碳酸,所以叫碳酸饮料,碳酸很不稳定,受热会迅速分解为水和二氧化碳。故填④;
(2)
食盐的主要成分氯化钠。故填③;
(3)
大米中富含的营养素是蛋白质、淀粉等。故填①;
(4)
鉴别硬水和软水使用的是肥皂水:硬水与肥皂水混合有浮渣产生,而软水与肥皂水混合有泡沫产生。故填②;
(5)
溶于水放热的常见物质有:浓硫酸、氢氧化钠固体、氧化钙等。故填⑤。
17. 2NaOH+CO2=Na2CO3+H2O 猜想一为碳酸钠或者猜想一为氢氧化钠和碳酸钠 猜想二为氢氧化钠和碳酸钠或者猜想二为碳酸钠 氢氧化钠和碳酸钠的水溶液都呈碱性 将步骤1中的混合溶液进行过滤,取滤液滴加酚酞试液,观察溶液颜色是否变红 猜想一填写碳酸钠的,实验现象为溶液仍为无色;猜想一填写碳酸钠和氢氧化钠的,实验现象为溶液变红。 Na2CO3+CaCl2=CaCO3↓+2NaCl
【详解】(1)稀盐酸滴入到氢氧化钠溶液中,意外地发现有气泡产生,可知氢氧化钠中混有碳酸盐,原因是氢氧化钠与空气中二氧化碳反应生成碳酸钠和水,化学方程式为2NaOH+CO2=Na2CO3+H2O;
(2)猜想假设:氢氧化钠可能部分变质,故溶液溶质为氢氧化钠和碳酸钠,氢氧化钠也可能全部变质,故溶液溶质为碳酸钠。故猜想为碳酸钠或者氢氧化钠和碳酸钠,顺序没有要求。
(3)实验设计:无论氢氧化钠是否变质,氢氧化钠和碳酸钠的水溶液都呈碱性,故酚酞试液都会变成红色,故小红的实验方案不合理。
(4)实验与结论:氢氧化钠变质是否完全,需要检验溶液中是否仍有剩余氢氧化钠,故需要先将变质后的碳酸根除去,检验剩余溶液中是否存在氢氧根离子即可,故步骤2可将步骤1中的混合溶液进行过滤,取滤液滴加酚酞试液,观察溶液颜色是否变红,若变红,则氢氧化钠部分变质。根据表格中结论为猜想一正确,故若猜想一填写碳酸钠,则实验现象为溶液仍为无色,若猜想一填写碳酸钠和氢氧化钠,则实验现象为溶液变红;步骤1滴加过量的氯化钙溶液,氯化钙和碳酸钠反应生成碳酸钙白色沉淀和氯化钠,故反应的化学方程式为Na2CO3+CaCl2=CaCO3↓+2NaCl,不要丢掉沉淀符号,配平化学计量数。
18. 6个实验都可以证明CO2和NaOH反应 分别出现的现象是:实验(1),反应后,试管内液面上升;
实验(2),反应后,倒置可发现玻璃片被吸住;
实验(3),反应后,塑料饮料瓶被压瘪;
实验(4),反应后,气球会充气鼓起来;
实验(5),反应后,烧瓶中有“喷泉”出现
实验(6),反应后,烧杯中的水被吸到锥形瓶中。 反应后,盛有CO2的容器内压强减小,同外界大气压产生压强差。 取少量反应后的溶液于试管中,滴入稀盐酸,如果出现气泡,则说明CO2确实同NaOH发生了化学反应
【详解】(1)实验(1)中二氧化碳和氢氧化钠反应后,气体减少,压强减小,试管内液面上升;实验(2)中二氧化碳和氢氧化钠反应,气体减少,压强减小,在大气压的作用下,玻璃片被吸住,故现象为倒置可发现玻璃片被吸住;实验(3)中反应后,由于气体减小,压强减小,软塑料瓶变瘪;实验(4)中反应后,由于压强减小,气球胀大;实验(5)中反应后,由于压强减小,烧瓶中有“喷泉”出现;实验(6)中反应后,由于压强减小,烧杯中的水被吸到锥形瓶中,故均能提供二氧化碳和氢氧化钠发生化学反应的证据;
(2)上述6种实验设计所依据的共同原理是:二氧化碳和氢氧化钠溶液反应后,气体减小,压强减小,同外界大气压产生压强差;
(3)二氧化碳与氢氧化钠反应生成了碳酸钠,碳酸钠能与酸反应生成二氧化碳,故可设计实验:取少量反应后的溶液于试管中,滴入过量稀盐酸,如果出现气泡,则说明CO2确实同NaOH发生了化学反应。
19.(1) Ca(OH)2 Cu
(2)清洁燃料(或冶炼金属)
(3)置换反应
(4)
【分析】I是紫红色金属,故I是铜;F和G生成A和I,F为黑色氧化物,所以F为氧化铜,该反应为氢气、一氧化碳或碳还原氧化铜;且B 能配制波尔多液,且氧化铜F和E反应可生成B和A,所以B为硫酸铜,E为硫酸,A为水; F与G反应生成A和I,即为氢气还原氧化铜,G为氢气;D也可用于配制波尔多液,所以D为氢氧化钙;D氢氧化钙和E硫酸反应生成水和硫酸钙,所以H为硫酸钙;B硫酸铜和C反应生成I(铜)和J,该反应应是活泼金属置换出硫酸铜中的铜,C可能为铁等活动性比铜强的金属,J为相应的金属盐,如硫酸亚铁,代入验证,推断合理。
(1)
由分析可知,D为氢氧化钙,I为铜,其化学式为分别为Ca(OH)2、Cu,故填:Ca(OH)2;Cu;
(2)
G为氢气,具有可燃性、还原性,可作清洁燃料或冶炼金属,故填:清洁燃料(或冶炼金属);
(3)
反应②,即铁和硫酸铜反应生成硫酸亚铁和铜,该反应符合“一种单质与一种化合物反应,生成另一种单质和另一种化合物”的特点,属于置换反应,故填:置换反应;
(4)
反应③,即氢氧化钙与硫酸反应生成硫酸钙和水,反应的化学方程式为,故填:。
20.(1)氢气
(2)铜
(3)铁粉、氧化铜
【分析】固体样品加水得到的滤液A中加入氯化铜溶液无明显现象,说明A中不含有氢氧化钾;滤渣甲加入过量的稀硫酸产生气体,说明含有铁,得到的滤液B中含有硫酸亚铁和硫酸;得到的滤渣乙在空气中充分灼烧,有固体残留物,说明滤渣乙中含有铜,故原固体中含有氧化铜,不能确定是否含有碳,氧化铜与硫酸反应生成硫酸铜,铁可以和硫酸铜反应生成硫酸亚铁和铜,由于乙中含有铜,故滤液B中不一定含有硫酸铜,代入验证,推理正确。
(1)
由分析可知:滤渣甲加入过量的稀硫酸产生气体,说明含有铁,所以生成的气泡是氢气;
(2)
由分析可知:滤渣乙中一定含有铜;
(3)
由分析可知:该固体粉末中一定含有的物质为铁粉、氧化铜。
21.4g;6.9g;一段时间后才开始产生气泡;
【详解】(1)设样品中的碳酸钠的质量为x,
x=10.6g,
则样品中氢氧化钠的质量=14.6g-10.6g=4g;
(2)样品中钠元素的质量=4g××100%+10.6g××100%=6.9g;
(3)取14.6g样品,逐渐滴入7.3%的稀盐酸200g,氢氧化钠先与盐酸反应生成氯化钠和水,没有气泡产生;当氢氧化钠完全反应后,碳酸钠先与盐酸反应生成碳酸氢钠和氯化钠,而后碳酸氢钠再与盐酸反应氯化钠、水和二氧化碳,有气泡产生;
设与4g氢氧化钠反应需要7.3%的稀盐酸的质量为y,则:
y=50g;
设在反应Na2CO3+HCl=NaHCO3+NaCl中,10.6g碳酸钠消耗7.3%的稀盐酸的质量为z,生成碳酸氢钠的质量为m,则:
z=50g,
m=8.4g,
也就是开始滴加稀盐酸时没有气泡产生,当滴加到(50g+50g)=100g稀盐酸时才开始产生气泡;设8.4g碳酸氢钠消耗7.3%的稀盐酸的质量为n,生成二氧化碳的质量为w,则:
n=50g,
w=4.4g,
则图象为:。
22.(1)1、2
(2)504
【详解】(1)对比实验1、2、3可知,加入盐酸的质量相同,随着样品的质量增加,生成二氧化碳的体积逐渐增大,故实验1、2中盐酸一定过量;
(2)解:设产生二氧化碳的体积为x
则 x=504mL
答:产生二氧化碳的体积为504mL。
答案第1页,共2页
答案第1页,共2页
