化学人教版九年级上册导学课件:4.4化学式与化合价(第2、3课时)(共28张PPT)
文档属性
| 名称 | 化学人教版九年级上册导学课件:4.4化学式与化合价(第2、3课时)(共28张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-01 10:58:19 | ||
图片预览



文档简介
(共28张PPT)
课题4 化学式与化合价
(第二课时)
人教版九年级化学上册 第四单元 自然界的水
1、知道常见元素的化合价
2、熟记常见原子团及其化合价
3、 能利用化合价推求化学式
NaCl
MgCl2
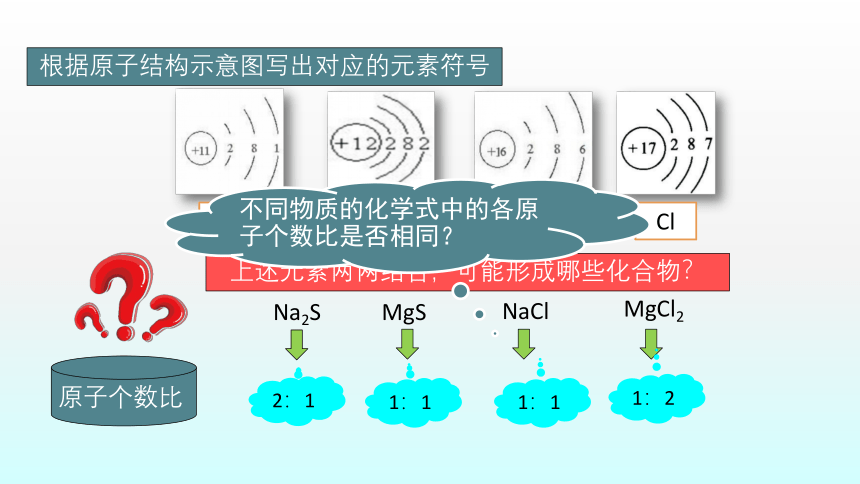
根据原子结构示意图写出对应的元素符号
Na
Mg
S
Cl
上述元素两两结合,可能形成哪些化合物?
MgS
Na2S
原子个数比
2:1
1:1
1:1
1:2
不同物质的化学式中的各原子个数比是否相同?
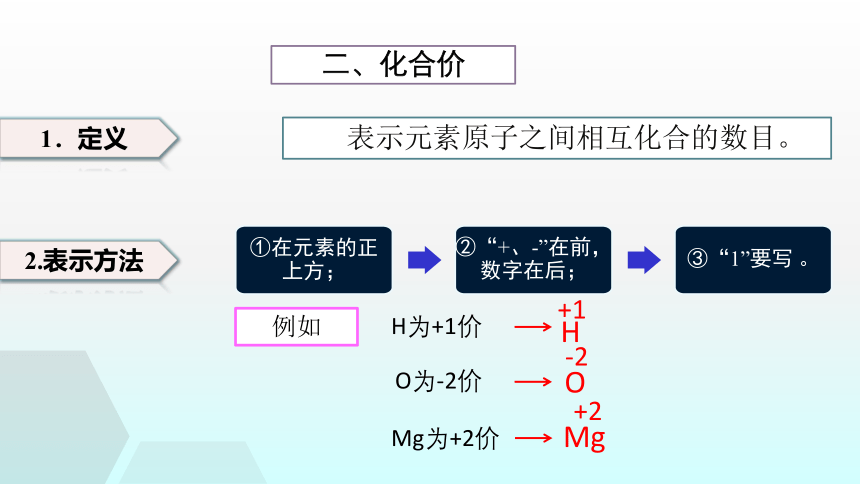
二、化合价
1.定义
表示元素原子之间相互化合的数目。
2.表示方法
①在元素的正上方;
②“+、-”在前,数字在后;
③“1”要写 。
H为+1价
H
+1
O为-2价
Mg为+2价
O
-2
Mg
+2
例如
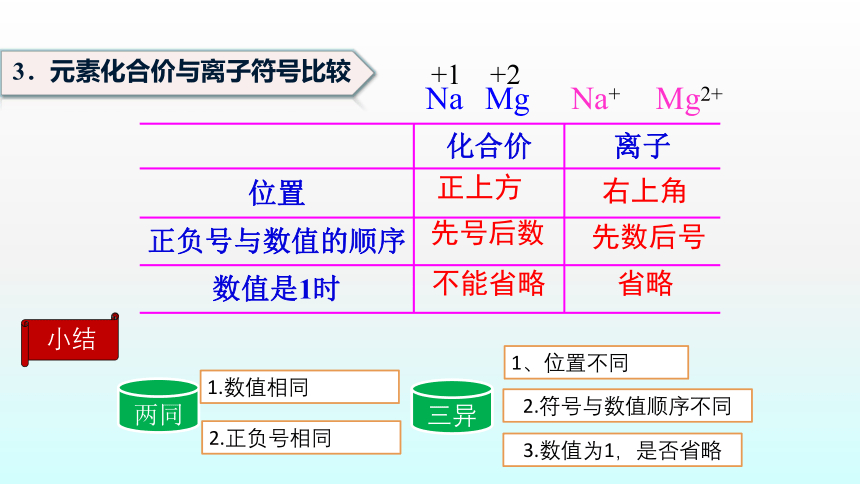
3.元素化合价与离子符号比较
化合价 离子
位置
正负号与数值的顺序
数值是1时
正上方
右上角
先号后数
先数后号
省略
不能省略
Na
+1
Mg
+2
Na+
Mg2+
小结
三异
两同
1、位置不同
2.正负号相同
1.数值相同
2.符号与数值顺序不同
3.数值为1,是否省略
Ca(OH)2 CaCO3
氢氧根
碳酸根
4. 原子团
+2
-1
+2
-2
常作为整体参加反应的原子集团,叫原子团,又叫做根。不是一种物质,同时也不能独立存在。
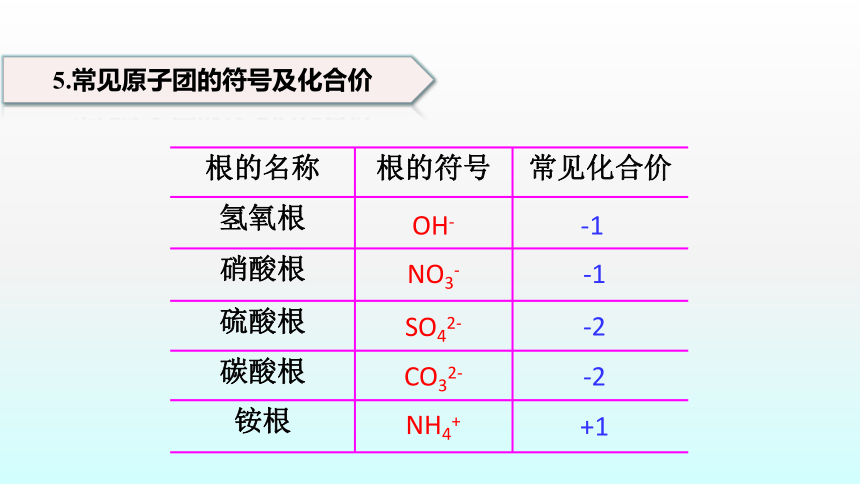
根的名称 根的符号 常见化合价
氢氧根
硝酸根
硫酸根
碳酸根
铵根
5.常见原子团的符号及化合价
OH-
NO3-
SO42-
CO32-
NH4+
-1
-1
-2
-2
+1
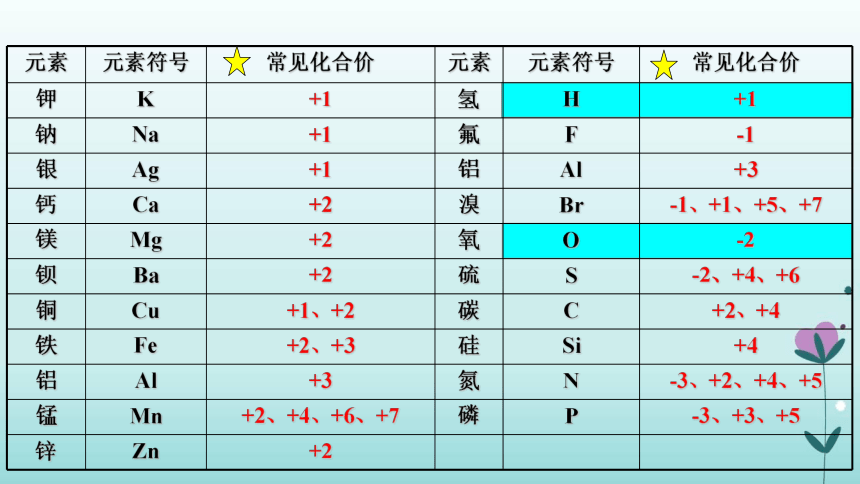
元素 元素符号 常见化合价 元素 元素符号 常见化合价
钾 K +1 氢 H +1
钠 Na +1 氟 F -1
银 Ag +1 铝 Al +3
钙 Ca +2 溴 Br -1、+1、+5、+7
镁 Mg +2 氧 O -2
钡 Ba +2 硫 S -2、+4、+6
铜 Cu +1、+2 碳 C +2、+4
铁 Fe +2、+3 硅 Si +4
铝 Al +3 氮 N -3、+2、+4、+5
锰 Mn +2、+4、+6、+7 磷 P -3、+3、+5
锌 Zn +2
(6)规定:单质中元素化合价为0。
6.化合价规律:
(1)化合物中,正负化合价代数和为0。
H2O
HCl
(2)在化合物中规定,氧元素显-2价,氢元素显+1价。
(3)金属与非金属元素组成的化合物中,通常金属元素显正价,非金属元素显负价。
(4)一些元素在不同的物质中可显不同的化合价。
+1
-2
-1
+1
NaCl
KClO3
NH4NO3
MgO
+1
+2
-1
-2
+5
(5)同一种元素在同一化合物中可显不同的化合价。
-3
+5
H2
0
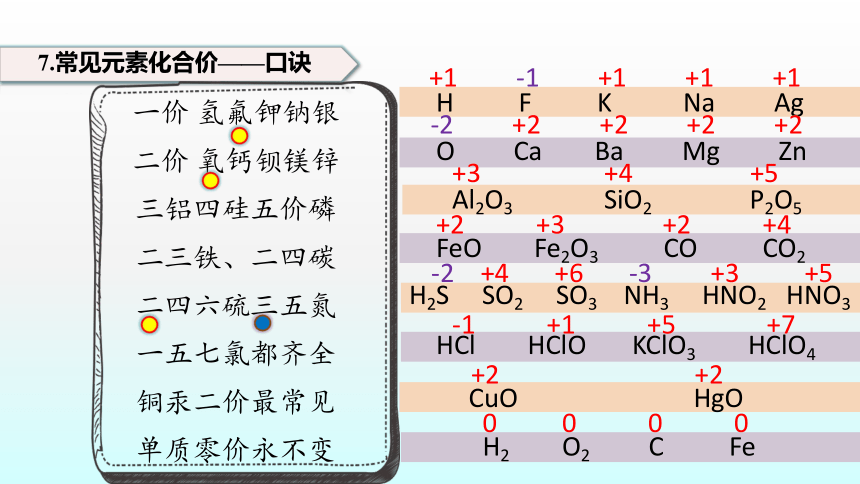
7.常见元素化合价——口诀
一价 氢氟钾钠银
二价 氧钙钡镁锌
三铝四硅五价磷
二三铁、二四碳
二四六硫三五氮
一五七氯都齐全
铜汞二价最常见
单质零价永不变
H F K Na Ag
O Ca Ba Mg Zn
Al2O3 SiO2 P2O5
FeO Fe2O3 CO CO2
H2S SO2 SO3 NH3 HNO2 HNO3
HCl HClO KClO3 HClO4
CuO HgO
H2 O2 C Fe
+1 -1 +1 +1 +1
-2 +2 +2 +2 +2
+3 +4 +5
+2 +3 +2 +4
-2 +4 +6 -3 +3 +5
-1 +1 +5 +7
+2 +2
0 0 0 0
7.常见原子团的化合价——口诀
负一氢氧、硝酸根。
负二碳酸、硫酸根。
负三记住 磷酸根。
正一价的 是铵根。
OH-
NO3-
CO32-
SO42-
PO43-
NH4+
8.根据化学式求某一元素化合价
原则:化合物里正负化合价的代数和为零。
例题:求氯酸钾(KMnO4)中锰元素的化合价。
解:设锰元素的化合价为x,则
(+1)+ x +(-2)x 4=0
x = +7
答:在高锰酸钾中,锰元素的化合价为+7价。
化合价绝对值交叉
03
标化合价
02
约简
04
01
排序写符号
检查
05
9.根据化合价求化学式
放置元素符号右下角
Mn
O
Mn
O
+4
-2
Mn
O
+4
-2
4
2
Mn
O
2
1
Mn
O
2
一排顺序二标价;
去掉正负再交叉;
最后一环要检查。
01
化合价的表示方法
03
常见元素化合价
05
根据化学式求化合价
02
化合价的一般规律
04
常见原子团化合价
06
根据化合价求化学式
课
堂
小
结
课题4 化学式与化合价
(第三课时)
人教版九年级化学上册 第四单元 自然界的水
1、相对分之质量的计算
2、计算元素质量比
3、计算某物质中元素质量分数
3、计算某物质中元素质量分数
O2
NaCl
Fe(OH)3
C2H5OH
CaCO3
1.计算相对分子质量:
16× 2 = 32
23 + 35.5 = 58.5
56 + (16+1) × 2 = 117
40 + 12 + 16 × 3= 100
12× 2+ 1 ×6 + 16 = 46
Mg(OH)2
P2O5
(NH4)2CO3
CuSO4
CnH2nO2
2. 计算组成元素的质量比
24 : (16×2) : (1×2) = 12:16:1
(31×2) : (16×5) = 31 : 40
(14×2) : (1×8) : 12 : (16× 3) = 7:2:3:12
(12×n) + (1×2n) + (16×2)= 6n:n:16
64 : 32 : (16×4) = 2:1:2
3.计算物质中某元素的质量分数:
计算氮肥NH4NO3中氮元素的质量分数。
NH4NO3的相对分子质量=14+1×4+14+16×3=80
再计算氮元素的质量分数:
答:氮肥NH4NO3中氮元素的质量分数为35%。
解:
4.计算物质中某元素的质量:
60千克NH4NO3中含氮元素多少千克?
答:60千克NH4NO3中含氮元素21千克。
解:
01
计算相对分子质量。
02
计算组成元素的质量比。
04
计算物质中某元素的质量。
课
堂
小
结
02
计算物质中某元素的质量分数。
B
1.下列符号中能正确表示+3价铁元素的是( )
A.Fe3+ B. C.3Fe D.
课堂练习
Fe
+3
Fe
3+
2.下列化学式中,书写错误的是 ( )
A
课堂练习
A.氧化镁(OMg)
B.氧化铜(CuO)
C.二氧化碳 (CO2)
D.五氧化二磷(P2O5)
3.化学式Al2O3的读法是(可多选) ( )
C、E
课堂练习
A.铝二氧三 B.二铝化三氧
C.三氧化二铝 D.二氧化二铝
E.氧化铝
4.Cu(NO3)2相对分子质量的计算式为 ( )
D
课堂练习
A. 64+14+16×3
B. 64×(14+16)×3
C.64×16+14×2
D.64+(14+16)×3
5. 6H2O相对分子质量的计算式为 ( )
C
课堂练习
A.6+1×2+16
B. 6×1×2×16
C. 6 ×(1×2+16)
D. 6×1×2+16
6.KMnO4的相对分子质量为____,在H2SO4
中钾、锰、氧三种元素的质量比是 __________ 。
钾、锰、氧三种元素的原子个数比是 __________。
158
39:55:64
1:1:4
课堂练习
7.用数字和化学式表示出:
5H2O2
2H2SO4
3N2
9Na+
课堂练习
(1)五个过氧化氢分子
(2)2个硫酸分子
(3)3个氮气分子
(4)9个钠离子
8.下列化学符号表示两个氢原子的是 ( )
A
课堂练习
A.2H
B.H2
C.2H2
D.H2O
课题4 化学式与化合价
(第二课时)
人教版九年级化学上册 第四单元 自然界的水
1、知道常见元素的化合价
2、熟记常见原子团及其化合价
3、 能利用化合价推求化学式
NaCl
MgCl2
根据原子结构示意图写出对应的元素符号
Na
Mg
S
Cl
上述元素两两结合,可能形成哪些化合物?
MgS
Na2S
原子个数比
2:1
1:1
1:1
1:2
不同物质的化学式中的各原子个数比是否相同?
二、化合价
1.定义
表示元素原子之间相互化合的数目。
2.表示方法
①在元素的正上方;
②“+、-”在前,数字在后;
③“1”要写 。
H为+1价
H
+1
O为-2价
Mg为+2价
O
-2
Mg
+2
例如
3.元素化合价与离子符号比较
化合价 离子
位置
正负号与数值的顺序
数值是1时
正上方
右上角
先号后数
先数后号
省略
不能省略
Na
+1
Mg
+2
Na+
Mg2+
小结
三异
两同
1、位置不同
2.正负号相同
1.数值相同
2.符号与数值顺序不同
3.数值为1,是否省略
Ca(OH)2 CaCO3
氢氧根
碳酸根
4. 原子团
+2
-1
+2
-2
常作为整体参加反应的原子集团,叫原子团,又叫做根。不是一种物质,同时也不能独立存在。
根的名称 根的符号 常见化合价
氢氧根
硝酸根
硫酸根
碳酸根
铵根
5.常见原子团的符号及化合价
OH-
NO3-
SO42-
CO32-
NH4+
-1
-1
-2
-2
+1
元素 元素符号 常见化合价 元素 元素符号 常见化合价
钾 K +1 氢 H +1
钠 Na +1 氟 F -1
银 Ag +1 铝 Al +3
钙 Ca +2 溴 Br -1、+1、+5、+7
镁 Mg +2 氧 O -2
钡 Ba +2 硫 S -2、+4、+6
铜 Cu +1、+2 碳 C +2、+4
铁 Fe +2、+3 硅 Si +4
铝 Al +3 氮 N -3、+2、+4、+5
锰 Mn +2、+4、+6、+7 磷 P -3、+3、+5
锌 Zn +2
(6)规定:单质中元素化合价为0。
6.化合价规律:
(1)化合物中,正负化合价代数和为0。
H2O
HCl
(2)在化合物中规定,氧元素显-2价,氢元素显+1价。
(3)金属与非金属元素组成的化合物中,通常金属元素显正价,非金属元素显负价。
(4)一些元素在不同的物质中可显不同的化合价。
+1
-2
-1
+1
NaCl
KClO3
NH4NO3
MgO
+1
+2
-1
-2
+5
(5)同一种元素在同一化合物中可显不同的化合价。
-3
+5
H2
0
7.常见元素化合价——口诀
一价 氢氟钾钠银
二价 氧钙钡镁锌
三铝四硅五价磷
二三铁、二四碳
二四六硫三五氮
一五七氯都齐全
铜汞二价最常见
单质零价永不变
H F K Na Ag
O Ca Ba Mg Zn
Al2O3 SiO2 P2O5
FeO Fe2O3 CO CO2
H2S SO2 SO3 NH3 HNO2 HNO3
HCl HClO KClO3 HClO4
CuO HgO
H2 O2 C Fe
+1 -1 +1 +1 +1
-2 +2 +2 +2 +2
+3 +4 +5
+2 +3 +2 +4
-2 +4 +6 -3 +3 +5
-1 +1 +5 +7
+2 +2
0 0 0 0
7.常见原子团的化合价——口诀
负一氢氧、硝酸根。
负二碳酸、硫酸根。
负三记住 磷酸根。
正一价的 是铵根。
OH-
NO3-
CO32-
SO42-
PO43-
NH4+
8.根据化学式求某一元素化合价
原则:化合物里正负化合价的代数和为零。
例题:求氯酸钾(KMnO4)中锰元素的化合价。
解:设锰元素的化合价为x,则
(+1)+ x +(-2)x 4=0
x = +7
答:在高锰酸钾中,锰元素的化合价为+7价。
化合价绝对值交叉
03
标化合价
02
约简
04
01
排序写符号
检查
05
9.根据化合价求化学式
放置元素符号右下角
Mn
O
Mn
O
+4
-2
Mn
O
+4
-2
4
2
Mn
O
2
1
Mn
O
2
一排顺序二标价;
去掉正负再交叉;
最后一环要检查。
01
化合价的表示方法
03
常见元素化合价
05
根据化学式求化合价
02
化合价的一般规律
04
常见原子团化合价
06
根据化合价求化学式
课
堂
小
结
课题4 化学式与化合价
(第三课时)
人教版九年级化学上册 第四单元 自然界的水
1、相对分之质量的计算
2、计算元素质量比
3、计算某物质中元素质量分数
3、计算某物质中元素质量分数
O2
NaCl
Fe(OH)3
C2H5OH
CaCO3
1.计算相对分子质量:
16× 2 = 32
23 + 35.5 = 58.5
56 + (16+1) × 2 = 117
40 + 12 + 16 × 3= 100
12× 2+ 1 ×6 + 16 = 46
Mg(OH)2
P2O5
(NH4)2CO3
CuSO4
CnH2nO2
2. 计算组成元素的质量比
24 : (16×2) : (1×2) = 12:16:1
(31×2) : (16×5) = 31 : 40
(14×2) : (1×8) : 12 : (16× 3) = 7:2:3:12
(12×n) + (1×2n) + (16×2)= 6n:n:16
64 : 32 : (16×4) = 2:1:2
3.计算物质中某元素的质量分数:
计算氮肥NH4NO3中氮元素的质量分数。
NH4NO3的相对分子质量=14+1×4+14+16×3=80
再计算氮元素的质量分数:
答:氮肥NH4NO3中氮元素的质量分数为35%。
解:
4.计算物质中某元素的质量:
60千克NH4NO3中含氮元素多少千克?
答:60千克NH4NO3中含氮元素21千克。
解:
01
计算相对分子质量。
02
计算组成元素的质量比。
04
计算物质中某元素的质量。
课
堂
小
结
02
计算物质中某元素的质量分数。
B
1.下列符号中能正确表示+3价铁元素的是( )
A.Fe3+ B. C.3Fe D.
课堂练习
Fe
+3
Fe
3+
2.下列化学式中,书写错误的是 ( )
A
课堂练习
A.氧化镁(OMg)
B.氧化铜(CuO)
C.二氧化碳 (CO2)
D.五氧化二磷(P2O5)
3.化学式Al2O3的读法是(可多选) ( )
C、E
课堂练习
A.铝二氧三 B.二铝化三氧
C.三氧化二铝 D.二氧化二铝
E.氧化铝
4.Cu(NO3)2相对分子质量的计算式为 ( )
D
课堂练习
A. 64+14+16×3
B. 64×(14+16)×3
C.64×16+14×2
D.64+(14+16)×3
5. 6H2O相对分子质量的计算式为 ( )
C
课堂练习
A.6+1×2+16
B. 6×1×2×16
C. 6 ×(1×2+16)
D. 6×1×2+16
6.KMnO4的相对分子质量为____,在H2SO4
中钾、锰、氧三种元素的质量比是 __________ 。
钾、锰、氧三种元素的原子个数比是 __________。
158
39:55:64
1:1:4
课堂练习
7.用数字和化学式表示出:
5H2O2
2H2SO4
3N2
9Na+
课堂练习
(1)五个过氧化氢分子
(2)2个硫酸分子
(3)3个氮气分子
(4)9个钠离子
8.下列化学符号表示两个氢原子的是 ( )
A
课堂练习
A.2H
B.H2
C.2H2
D.H2O
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
