2.1.1活泼的金属单质——钠 课件(共39张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1.1活泼的金属单质——钠 课件(共39张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 74.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-01 00:00:00 | ||
图片预览







文档简介
(共39张PPT)
请你说说!
日常生活生产中离不开的NaCl从哪来?
地球表面总面积约5.1亿平方千米,其中陆地面积1.49亿平方千米,海洋面积3.61亿平方千米,海洋占大部分。海洋占地球表面积的71%,陆地占地球表面积的29%.
浩瀚的大海美丽而且富饶。海洋是一个巨大的化学资源宝库,含有80多种元素,钠元素和氯元素是海水中含量较高的元素,也是典型的金属元素和非金属元素。
海水制盐
NaCl
Na
Cl
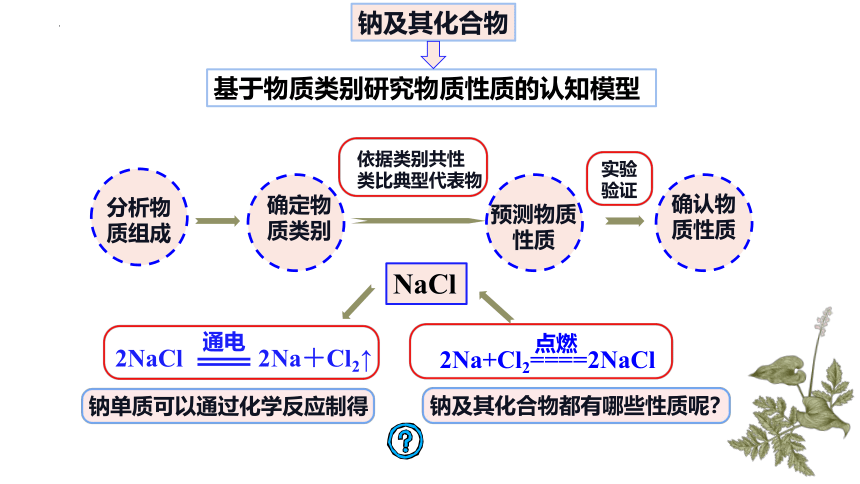
钠及其化合物
氯及其化合物
第一节
钠及其化合物
第 1 课时 活泼的金属单质——钠
第二章 海水中的重要元素——钠和氯
钠及其化合物
依据类别共性
类比典型代表物
实验
验证
预测物质性质
确认物质性质
分析物质组成
确定物质类别
基于物质类别研究物质性质的认知模型
NaCl
2NaCl
通电
2Na+Cl2↑
2Na+Cl2====2NaCl
点燃
钠单质可以通过化学反应制得
钠及其化合物都有哪些性质呢?
请你说说!
你对钠的性质,用途等相关知识了解多少?
图为特斯拉Model S 底部的电池组 ,车主还为它装上了4各轮子,超过7000颗18650锂电池组成,近900公斤。电池组附近有加强筋和框架保护。
锂矿枯竭
将金属锂回收利用
开发新的金属电池
如何解决供需矛盾?
研制钠电池
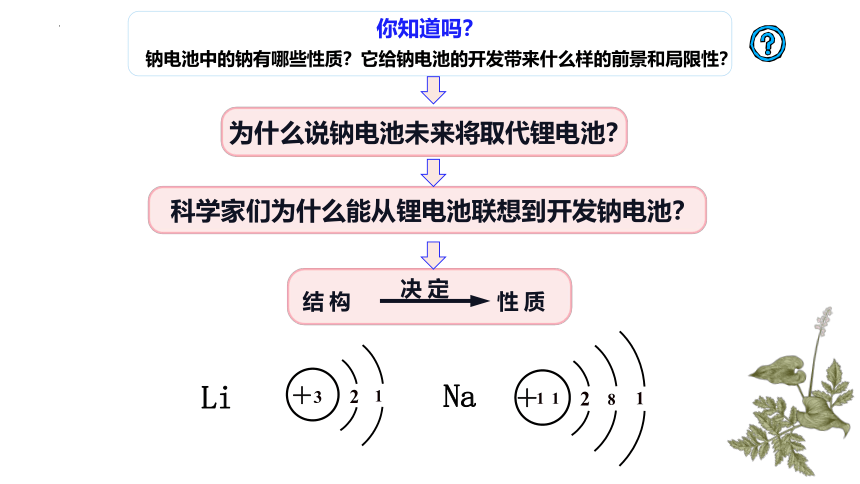
你知道吗?
钠电池中的钠有哪些性质?它给钠电池的开发带来什么样的前景和局限性?
科学家们为什么能从锂电池联想到开发钠电池?
为什么说钠电池未来将取代锂电池?
结构
性质
决定
Li
Na
活泼的金属单质——钠
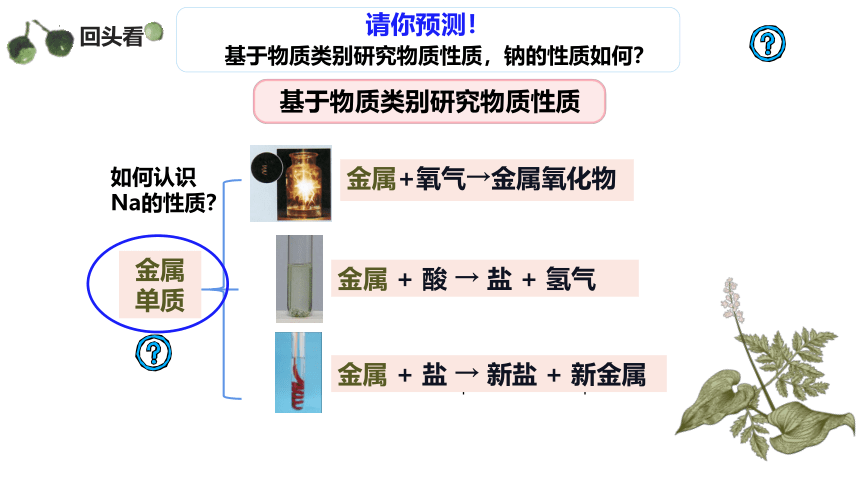
Fe
Fe+CuSO4 FeSO4+Cu
Fe+2HCl FeCl2+H2↑
3Fe+2O2 Fe3O4
点燃
金属
单质
金属+氧气→金属氧化物
金属 + 酸 → 盐 + 氢气
金属 + 盐 → 新盐 + 新金属
如何认识Na的性质?
请你预测!
基于物质类别研究物质性质,钠的性质如何?
回头看
基于物质类别研究物质性质
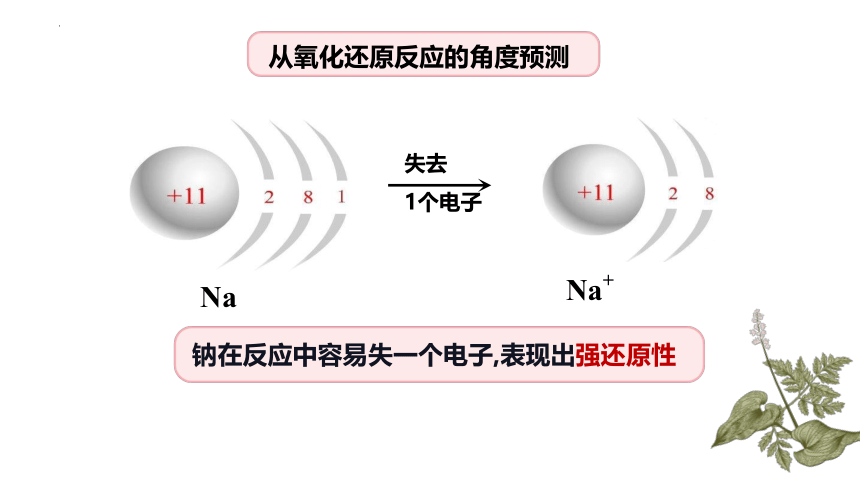
从氧化还原反应的角度预测
失去
1个电子
Na
Na+
钠在反应中容易失一个电子,表现出强还原性
请你预测!
基于物质类别研究物质性质,钠的性质如何?
遇湿易燃物品
钠电池的开发应用离不开钠的包装。工业金属钠产品采用双层包装,外包装采用铁桶,内包装采用双层聚乙烯塑料袋。包装时将袋内空气排净后扎紧袋口,包装桶上有“遇湿易燃物品”标志。为什么钠的包装如此特殊?
空气排净
预测一
钠能与氧气发生反应
预测二
钠能与水发生反应
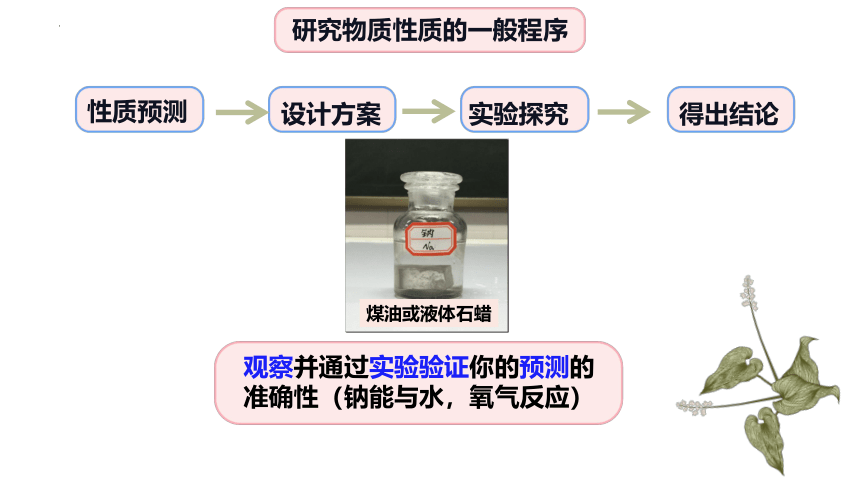
研究物质性质的一般程序
性质预测
设计方案
得出结论
实验探究
观察并通过实验验证你的预测的准确性(钠能与水,氧气反应)
煤油或液体石蜡
请你观察!
从以下实验,了解到金属钠的哪些物理和化学性质?
01
钠的物理性质
[实验2-1]
用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
钠的物理性质
课本P34
你有没有注意到,切割后,钠的表面有什么变化?
钠的物理性质
断面呈银白色
露置空气中的钠切面的颜色变化
切割
切面
片刻后
迅速变暗
深入了解
钠的物理性质
颜色 状态 银白色固体 有金属光泽
密度 比煤油大ρ=0.97g/cm3 比水小
硬度 较软(可用刀切开)
熔点 沸点 97.8°C 882.9°C 较低
导电 导热性 良好 (金属的通性)
银白色金属光泽很快变暗
请你解释!
为什么新切开的钠在空气中会变暗?
4Na+O2=2Na2O
化学性质
02
钠的化学性质
深入了解
化学性质
[实验2-2]
将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
化学性质
课本P34
钠受热后先熔化,然后与氧气剧烈反应,发出黄色火焰,生成一种淡黄色固体
实验现象
Na2O2
化学性质
钠与氧气反应
常温下
4Na + O2 == 2Na2O
(白色)
0
0
+1
-2
失去4e-,化合价升高,被氧化
得到4e-,化合价降低,被还原
不稳定
加热下
0
0
+1
-1
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
稳定
△
2Na +O2 == Na2O2 (淡黄色)
2Na2O +O2 == 2Na2O2
△
反应条件不同,现象不同,产物也不同
学以致用
写出钠分别与下列物质发生反应的化学方程式
失去
1个电子
Na
Na+
钠在反应中容易失一个电子,表现出强还原性
2、 S (加热)
1、 Cl2 (加热)
3、 H2 (加热)
请你预测!
基于物质类别研究物质性质,钠的性质如何?
遇湿易燃物品
钠电池的开发应用离不开钠的包装。工业金属钠产品采用双层包装,外包装采用铁桶,内包装采用双层聚乙烯塑料袋。包装时将袋内空气排净后扎紧袋口,包装桶上有“遇湿易燃物品”标志。为什么钠的包装如此特殊?
空气排净
预测一
钠能与氧气发生反应
预测二
钠能与水发生反应
化学性质
请你推测,钠与水反应的产物,并写出化学方程式
活泼金属
Mg
物质分类
性质相似
物质分类
Na
物质组成角度
类比推理
氧化还原反应角度
Na
类比推理
Mg
化合价升高,失2e-
化合价降低,得2e-
MgCl2 + H2↑
Mg + 2HCl
+1
0
Na
Na+
Na+H2O →
0
Na
+1
+1
-2
H2
0
OH-
化合价降低
化合价升高
发生氧化还原反应后的氧元素以什么形式存在呢?
反应物元素有:Na、 H、 O
生成物元素有:Na、 H、 O
2Na + H2O
化合价升高
化合价降低
H2↑
2NaOH +
质量守恒定律角度
元素守恒
原子守恒
预测的反应产物为:NaOH和H2
实验验证 预测的钠与水反应
深入了解
钠与水的反应
课本P36
浮
熔
游
响
红
实验现象
讨 论
浮
现 象
熔
红
响
游
小于水的密度,0.97g/cm3
反应放热 ,熔点低,97.8℃
有气体(H2)产生
有气体(H2)产生且剧烈
有碱生成,NaOH
2Na + 2H2O == 2NaOH + H2
钠与水的反应
深入了解
NaOH、H2
预测的反应产物为:NaOH和H2
钠与水反应的生成物是 。与你的猜测是否一致?
2Na + 2H2O == 2NaOH + H2↑
失去2e-
得到2e-
+1
0
0
+1
2Na+2H2O==2Na++2OH-+H2 ↑
钠与水的反应
学以致用
2Na + 2H2O == 2NaOH + H2
假如钠起火,能否用水灭火呢?
不能
干沙
Fe
Fe+CuSO4 FeSO4+Cu
Fe+2HCl FeCl2+H2↑
3Fe+2O2 Fe3O4
点燃
金属
单质
金属+氧气→金属氧化物
金属 + 酸 → 盐 + 氢气
金属 + 盐 → 新盐 + 新金属
如何认识Na的性质?
回头看
基于物质类别研究物质性质
Na
金属钠与硫酸铜溶液反应结果如何呢?
预测钠与硫酸铜溶液反应的结果
CuSO4
H2O
钠与硫酸铜溶液反应的生成物是 。
Cu(OH)2、H2
2Na+2H2O=2NaOH+H2↑
2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑
2NaOH+CuSO4=Na2SO4+Cu(OH)2 ↓
钠与硫酸铜溶液反应
Fe+CuSO4 FeSO4+Cu
金属 + 盐 → 新盐 + 新金属
Na
×
学以致用
1,下列关于钠的叙述中,不正确的是( )
A、钠燃烧时生成氧化钠
B、钠燃烧时发出黄色的火焰
C、钠有很强的还原性
D、钠原子的最外层上只有1个电子
A
学以致用
2,向一小烧杯中加入等体积的水和煤油,片刻后再向该烧杯中轻缓的加入一绿豆大小的金属钠,可能观察到的现象是( )
A
学以致用
3,将适量金属钠投入下列溶液中,有气体放出,但无沉淀生成的是( )
注意对比分析钠与水反应和钠与酸、碱、盐溶液反应现象的相似和差异。
A.盐酸 B.饱和氢氧化钠溶液
C.FeCl3溶液 D.CuSO4溶液
A
谢谢观看
请你说说!
日常生活生产中离不开的NaCl从哪来?
地球表面总面积约5.1亿平方千米,其中陆地面积1.49亿平方千米,海洋面积3.61亿平方千米,海洋占大部分。海洋占地球表面积的71%,陆地占地球表面积的29%.
浩瀚的大海美丽而且富饶。海洋是一个巨大的化学资源宝库,含有80多种元素,钠元素和氯元素是海水中含量较高的元素,也是典型的金属元素和非金属元素。
海水制盐
NaCl
Na
Cl
钠及其化合物
氯及其化合物
第一节
钠及其化合物
第 1 课时 活泼的金属单质——钠
第二章 海水中的重要元素——钠和氯
钠及其化合物
依据类别共性
类比典型代表物
实验
验证
预测物质性质
确认物质性质
分析物质组成
确定物质类别
基于物质类别研究物质性质的认知模型
NaCl
2NaCl
通电
2Na+Cl2↑
2Na+Cl2====2NaCl
点燃
钠单质可以通过化学反应制得
钠及其化合物都有哪些性质呢?
请你说说!
你对钠的性质,用途等相关知识了解多少?
图为特斯拉Model S 底部的电池组 ,车主还为它装上了4各轮子,超过7000颗18650锂电池组成,近900公斤。电池组附近有加强筋和框架保护。
锂矿枯竭
将金属锂回收利用
开发新的金属电池
如何解决供需矛盾?
研制钠电池
你知道吗?
钠电池中的钠有哪些性质?它给钠电池的开发带来什么样的前景和局限性?
科学家们为什么能从锂电池联想到开发钠电池?
为什么说钠电池未来将取代锂电池?
结构
性质
决定
Li
Na
活泼的金属单质——钠
Fe
Fe+CuSO4 FeSO4+Cu
Fe+2HCl FeCl2+H2↑
3Fe+2O2 Fe3O4
点燃
金属
单质
金属+氧气→金属氧化物
金属 + 酸 → 盐 + 氢气
金属 + 盐 → 新盐 + 新金属
如何认识Na的性质?
请你预测!
基于物质类别研究物质性质,钠的性质如何?
回头看
基于物质类别研究物质性质
从氧化还原反应的角度预测
失去
1个电子
Na
Na+
钠在反应中容易失一个电子,表现出强还原性
请你预测!
基于物质类别研究物质性质,钠的性质如何?
遇湿易燃物品
钠电池的开发应用离不开钠的包装。工业金属钠产品采用双层包装,外包装采用铁桶,内包装采用双层聚乙烯塑料袋。包装时将袋内空气排净后扎紧袋口,包装桶上有“遇湿易燃物品”标志。为什么钠的包装如此特殊?
空气排净
预测一
钠能与氧气发生反应
预测二
钠能与水发生反应
研究物质性质的一般程序
性质预测
设计方案
得出结论
实验探究
观察并通过实验验证你的预测的准确性(钠能与水,氧气反应)
煤油或液体石蜡
请你观察!
从以下实验,了解到金属钠的哪些物理和化学性质?
01
钠的物理性质
[实验2-1]
用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
钠的物理性质
课本P34
你有没有注意到,切割后,钠的表面有什么变化?
钠的物理性质
断面呈银白色
露置空气中的钠切面的颜色变化
切割
切面
片刻后
迅速变暗
深入了解
钠的物理性质
颜色 状态 银白色固体 有金属光泽
密度 比煤油大ρ=0.97g/cm3 比水小
硬度 较软(可用刀切开)
熔点 沸点 97.8°C 882.9°C 较低
导电 导热性 良好 (金属的通性)
银白色金属光泽很快变暗
请你解释!
为什么新切开的钠在空气中会变暗?
4Na+O2=2Na2O
化学性质
02
钠的化学性质
深入了解
化学性质
[实验2-2]
将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
化学性质
课本P34
钠受热后先熔化,然后与氧气剧烈反应,发出黄色火焰,生成一种淡黄色固体
实验现象
Na2O2
化学性质
钠与氧气反应
常温下
4Na + O2 == 2Na2O
(白色)
0
0
+1
-2
失去4e-,化合价升高,被氧化
得到4e-,化合价降低,被还原
不稳定
加热下
0
0
+1
-1
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
稳定
△
2Na +O2 == Na2O2 (淡黄色)
2Na2O +O2 == 2Na2O2
△
反应条件不同,现象不同,产物也不同
学以致用
写出钠分别与下列物质发生反应的化学方程式
失去
1个电子
Na
Na+
钠在反应中容易失一个电子,表现出强还原性
2、 S (加热)
1、 Cl2 (加热)
3、 H2 (加热)
请你预测!
基于物质类别研究物质性质,钠的性质如何?
遇湿易燃物品
钠电池的开发应用离不开钠的包装。工业金属钠产品采用双层包装,外包装采用铁桶,内包装采用双层聚乙烯塑料袋。包装时将袋内空气排净后扎紧袋口,包装桶上有“遇湿易燃物品”标志。为什么钠的包装如此特殊?
空气排净
预测一
钠能与氧气发生反应
预测二
钠能与水发生反应
化学性质
请你推测,钠与水反应的产物,并写出化学方程式
活泼金属
Mg
物质分类
性质相似
物质分类
Na
物质组成角度
类比推理
氧化还原反应角度
Na
类比推理
Mg
化合价升高,失2e-
化合价降低,得2e-
MgCl2 + H2↑
Mg + 2HCl
+1
0
Na
Na+
Na+H2O →
0
Na
+1
+1
-2
H2
0
OH-
化合价降低
化合价升高
发生氧化还原反应后的氧元素以什么形式存在呢?
反应物元素有:Na、 H、 O
生成物元素有:Na、 H、 O
2Na + H2O
化合价升高
化合价降低
H2↑
2NaOH +
质量守恒定律角度
元素守恒
原子守恒
预测的反应产物为:NaOH和H2
实验验证 预测的钠与水反应
深入了解
钠与水的反应
课本P36
浮
熔
游
响
红
实验现象
讨 论
浮
现 象
熔
红
响
游
小于水的密度,0.97g/cm3
反应放热 ,熔点低,97.8℃
有气体(H2)产生
有气体(H2)产生且剧烈
有碱生成,NaOH
2Na + 2H2O == 2NaOH + H2
钠与水的反应
深入了解
NaOH、H2
预测的反应产物为:NaOH和H2
钠与水反应的生成物是 。与你的猜测是否一致?
2Na + 2H2O == 2NaOH + H2↑
失去2e-
得到2e-
+1
0
0
+1
2Na+2H2O==2Na++2OH-+H2 ↑
钠与水的反应
学以致用
2Na + 2H2O == 2NaOH + H2
假如钠起火,能否用水灭火呢?
不能
干沙
Fe
Fe+CuSO4 FeSO4+Cu
Fe+2HCl FeCl2+H2↑
3Fe+2O2 Fe3O4
点燃
金属
单质
金属+氧气→金属氧化物
金属 + 酸 → 盐 + 氢气
金属 + 盐 → 新盐 + 新金属
如何认识Na的性质?
回头看
基于物质类别研究物质性质
Na
金属钠与硫酸铜溶液反应结果如何呢?
预测钠与硫酸铜溶液反应的结果
CuSO4
H2O
钠与硫酸铜溶液反应的生成物是 。
Cu(OH)2、H2
2Na+2H2O=2NaOH+H2↑
2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑
2NaOH+CuSO4=Na2SO4+Cu(OH)2 ↓
钠与硫酸铜溶液反应
Fe+CuSO4 FeSO4+Cu
金属 + 盐 → 新盐 + 新金属
Na
×
学以致用
1,下列关于钠的叙述中,不正确的是( )
A、钠燃烧时生成氧化钠
B、钠燃烧时发出黄色的火焰
C、钠有很强的还原性
D、钠原子的最外层上只有1个电子
A
学以致用
2,向一小烧杯中加入等体积的水和煤油,片刻后再向该烧杯中轻缓的加入一绿豆大小的金属钠,可能观察到的现象是( )
A
学以致用
3,将适量金属钠投入下列溶液中,有气体放出,但无沉淀生成的是( )
注意对比分析钠与水反应和钠与酸、碱、盐溶液反应现象的相似和差异。
A.盐酸 B.饱和氢氧化钠溶液
C.FeCl3溶液 D.CuSO4溶液
A
谢谢观看
