2.1.1 活泼的金属单质——钠 课件(共21张PPT) 2023-2024学年高一化学高(人教版2019必修第一册)
文档属性
| 名称 | 2.1.1 活泼的金属单质——钠 课件(共21张PPT) 2023-2024学年高一化学高(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 25.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-01 23:41:22 | ||
图片预览








文档简介
(共21张PPT)
2023-2024学年
必修第一册(人教版2019)
第二章 海水中的重要元素——钠和氯
第一节 钠及其化合物
第1课时 活泼的金属单质——钠
海洋是一个巨大的化学资源宝库,含有80多种元素,钠和氯既是其中含量较高的元素,也是典型的金属元素和典型的非金属元素。钠的单质可以通过化学反应制得,那么,钠有什么性质呢?
图1 海水中溶解的盐分含量分布图
目录
钠的物理性质
01
钠的化学性质
02
习
学
目
标
1.结合真实情境或实验,了解钠的主要性质,培养“科学探究与创新意识,宏观辨识与微观探析”的核心素养。
2.结合实际应用,了解钠的应用,培养“社会责任”的核心素养。
NO.1
钠的物理性质
【实验2-1】用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
讨论:从以上实验,我们了解到金属钠的哪些物理和化学性质?
图2 钠保存在煤油中
现象:切口处可观察到银白色的金属光泽,在空气中很快变暗。
钠的物理性质(小结)
1.颜色 状态:
银白色固体 有金属光泽
2.密度:
比煤油大ρ=0.97g/cm3 比水小
3.硬度:
较软(可用刀切开)
4.熔点 沸点:
97.8°C 882.9°C 较低
5.导电 导热性:
良好 (金属的通性)
NO.1
钠的化学性质
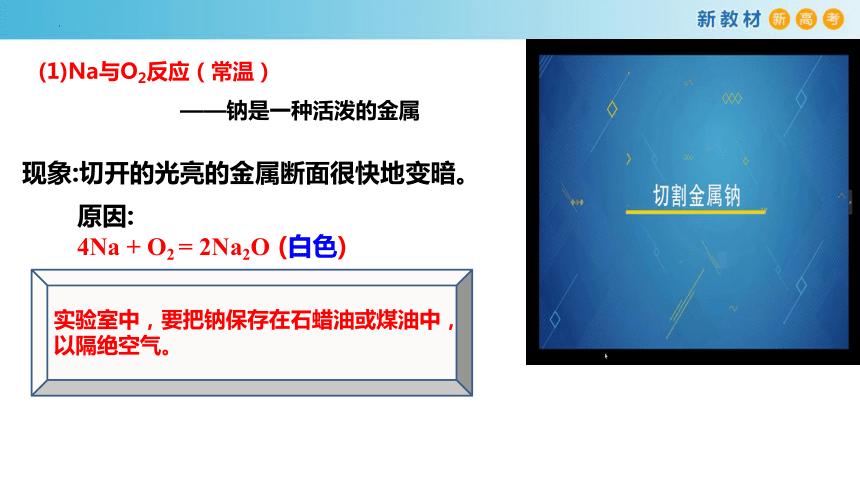
现象:切开的光亮的金属断面很快地变暗。
原因:
4Na + O2 = 2Na2O (白色)
(1)Na与O2反应(常温)
——钠是一种活泼的金属
实验室中,要把钠保存在石蜡油或煤油中,
以隔绝空气。
钠受热
先熔化
与氧气
剧烈反应
发出
黄色火焰
生成
淡黄色固体
Na在加热条件下与O2反应
【实验2-2】将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中,继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
空气中加热
2Na + O2 ==Na2O2 (过氧化钠)
燃烧
常温下
条件不同
产物不同
点燃或加热
钠的化学性质
1、 和氧气反应
(灰白色)
-2
(淡黄色)
-1
燃烧
(1)钠与硫混合研磨生成Na2S:2Na+S===Na2S (研磨时容易爆炸)
(2)在氯气中燃烧:2Na+Cl2 2NaCl (产生黄色火焰,生成白烟)
(3)与氢气反应生成NaH:2Na+H2 NaH(金属氢化物中,氢为-1价)
(4)与氮气反应生成Na3N:6Na+N2 2Na3N
资料卡片——钠与其他非金属单质的反应
原子结构及存在
失1个电子
还原
化合物
NaCl
微观探析,原理探究
【实验2-3】
在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大的钠放入水中,观察现象。
仔细观察钠与水的反应现象,填写下表:
实验现象 分析结论
浮于水面上
钠的密度小于水
0.971g·cm-3
熔成一个小球
反应放热,钠的熔点低
四处游动
生成气体
发出嘶嘶的响声
反应放热,热的钠使水蒸发
溶液变为红色
生成碱性物质
2Na + 2H2O = 2NaOH + H2↑
2Na + 2H2O = 2Na+ + 2OH- + H2↑
97.8℃
浮
熔
游
响
红
【注意】金属钠着火时不能用水,
也不能用泡沫灭火器,应用沙土盖灭。
【实验2-4】
钠和盐溶液的反应
在烧杯中加入一些硫酸铜溶液,然后把一块绿豆大的钠放入溶液中,观察现象。
现象:
有气泡放出, 产生蓝色沉淀
方程式:
2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
总反应:2Na+2H2O+CuSO4 = Cu(OH)2↓+Na2SO4+H2↑
钠与盐溶液:
钠先与水反应,生成的NaOH再与盐反应
反思总结
1. 钠在各种水溶液中反应时,有酸氢为先,无酸水为先;
2. K、Ca、Na等活泼金属不能从盐溶液中置换出其他金属。
若盐为熔融状态,钠可以置换出较不活泼的金属,如:
4Na+TiCl4(熔融)=4NaCl+Ti。
遇酸酸优先,遇盐水在前;
遇碱消耗水,遇氧看条件。
【实验2-5】
钠和酸的反应
在烧杯中加入一些稀盐酸,然后把一块绿豆大的钠放入溶液中,立即用玻璃片盖住烧杯,观察现象。
【实验现象】
钠与盐酸反应比与水反应更加剧烈,有轻微爆炸,生成的氢气可直接燃烧。
2Na+ 2HCl= 2NaCl+ H2↑
银白色金属钠
(Na)
表面变暗
(生成Na2O)
出现白色固体
(生成NaOH)
表面变成溶液 (NaOH潮解)
白色粉末状物质
(生成Na2CO3)
白色块状物
(生成Na2CO3·10H2O)
O2
风化
CO2
H2O
H2O
思考:Na长时间暴露空气,最后生成什么物质?
①
⑤
④
③
②
完成上述各变化过程中的化学反应方程式
1、钠易与空气中的氧气、以及水反应,实验室中应如何保存钠?
2、当在火灾现场有大量钠存在时,应怎样灭火?
保存在盛有煤油的试剂瓶中。
干燥的沙土灭火
思考
与
交流
钠的用途
金属冶炼
金属冶炼是把金属从化合态变为游离态的过程。利用钠将其置换出来。
高压钠灯
高压钠灯使用时发出金白色光,具有发光效率高、耗电少、寿命长、透雾能力强和不锈蚀等优点。
钾钠合金
钠钾合金可作为冷却剂应用于实验室的快中子反应器中。
[课堂小结]
物理性质
化学性质
银白色固体
硬度小
熔点低
密度比水小
导电性和导热性
钠
与氧气反应
与水反应
与熔融态盐反应
……
2023-2024学年
必修第一册(人教版2019)
第二章 海水中的重要元素——钠和氯
第一节 钠及其化合物
第1课时 活泼的金属单质——钠
海洋是一个巨大的化学资源宝库,含有80多种元素,钠和氯既是其中含量较高的元素,也是典型的金属元素和典型的非金属元素。钠的单质可以通过化学反应制得,那么,钠有什么性质呢?
图1 海水中溶解的盐分含量分布图
目录
钠的物理性质
01
钠的化学性质
02
习
学
目
标
1.结合真实情境或实验,了解钠的主要性质,培养“科学探究与创新意识,宏观辨识与微观探析”的核心素养。
2.结合实际应用,了解钠的应用,培养“社会责任”的核心素养。
NO.1
钠的物理性质
【实验2-1】用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
讨论:从以上实验,我们了解到金属钠的哪些物理和化学性质?
图2 钠保存在煤油中
现象:切口处可观察到银白色的金属光泽,在空气中很快变暗。
钠的物理性质(小结)
1.颜色 状态:
银白色固体 有金属光泽
2.密度:
比煤油大ρ=0.97g/cm3 比水小
3.硬度:
较软(可用刀切开)
4.熔点 沸点:
97.8°C 882.9°C 较低
5.导电 导热性:
良好 (金属的通性)
NO.1
钠的化学性质
现象:切开的光亮的金属断面很快地变暗。
原因:
4Na + O2 = 2Na2O (白色)
(1)Na与O2反应(常温)
——钠是一种活泼的金属
实验室中,要把钠保存在石蜡油或煤油中,
以隔绝空气。
钠受热
先熔化
与氧气
剧烈反应
发出
黄色火焰
生成
淡黄色固体
Na在加热条件下与O2反应
【实验2-2】将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中,继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
空气中加热
2Na + O2 ==Na2O2 (过氧化钠)
燃烧
常温下
条件不同
产物不同
点燃或加热
钠的化学性质
1、 和氧气反应
(灰白色)
-2
(淡黄色)
-1
燃烧
(1)钠与硫混合研磨生成Na2S:2Na+S===Na2S (研磨时容易爆炸)
(2)在氯气中燃烧:2Na+Cl2 2NaCl (产生黄色火焰,生成白烟)
(3)与氢气反应生成NaH:2Na+H2 NaH(金属氢化物中,氢为-1价)
(4)与氮气反应生成Na3N:6Na+N2 2Na3N
资料卡片——钠与其他非金属单质的反应
原子结构及存在
失1个电子
还原
化合物
NaCl
微观探析,原理探究
【实验2-3】
在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大的钠放入水中,观察现象。
仔细观察钠与水的反应现象,填写下表:
实验现象 分析结论
浮于水面上
钠的密度小于水
0.971g·cm-3
熔成一个小球
反应放热,钠的熔点低
四处游动
生成气体
发出嘶嘶的响声
反应放热,热的钠使水蒸发
溶液变为红色
生成碱性物质
2Na + 2H2O = 2NaOH + H2↑
2Na + 2H2O = 2Na+ + 2OH- + H2↑
97.8℃
浮
熔
游
响
红
【注意】金属钠着火时不能用水,
也不能用泡沫灭火器,应用沙土盖灭。
【实验2-4】
钠和盐溶液的反应
在烧杯中加入一些硫酸铜溶液,然后把一块绿豆大的钠放入溶液中,观察现象。
现象:
有气泡放出, 产生蓝色沉淀
方程式:
2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
总反应:2Na+2H2O+CuSO4 = Cu(OH)2↓+Na2SO4+H2↑
钠与盐溶液:
钠先与水反应,生成的NaOH再与盐反应
反思总结
1. 钠在各种水溶液中反应时,有酸氢为先,无酸水为先;
2. K、Ca、Na等活泼金属不能从盐溶液中置换出其他金属。
若盐为熔融状态,钠可以置换出较不活泼的金属,如:
4Na+TiCl4(熔融)=4NaCl+Ti。
遇酸酸优先,遇盐水在前;
遇碱消耗水,遇氧看条件。
【实验2-5】
钠和酸的反应
在烧杯中加入一些稀盐酸,然后把一块绿豆大的钠放入溶液中,立即用玻璃片盖住烧杯,观察现象。
【实验现象】
钠与盐酸反应比与水反应更加剧烈,有轻微爆炸,生成的氢气可直接燃烧。
2Na+ 2HCl= 2NaCl+ H2↑
银白色金属钠
(Na)
表面变暗
(生成Na2O)
出现白色固体
(生成NaOH)
表面变成溶液 (NaOH潮解)
白色粉末状物质
(生成Na2CO3)
白色块状物
(生成Na2CO3·10H2O)
O2
风化
CO2
H2O
H2O
思考:Na长时间暴露空气,最后生成什么物质?
①
⑤
④
③
②
完成上述各变化过程中的化学反应方程式
1、钠易与空气中的氧气、以及水反应,实验室中应如何保存钠?
2、当在火灾现场有大量钠存在时,应怎样灭火?
保存在盛有煤油的试剂瓶中。
干燥的沙土灭火
思考
与
交流
钠的用途
金属冶炼
金属冶炼是把金属从化合态变为游离态的过程。利用钠将其置换出来。
高压钠灯
高压钠灯使用时发出金白色光,具有发光效率高、耗电少、寿命长、透雾能力强和不锈蚀等优点。
钾钠合金
钠钾合金可作为冷却剂应用于实验室的快中子反应器中。
[课堂小结]
物理性质
化学性质
银白色固体
硬度小
熔点低
密度比水小
导电性和导热性
钠
与氧气反应
与水反应
与熔融态盐反应
……
