化学人教版(2019)选择性必修1 2.4化学反应的调控(共39张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.4化学反应的调控(共39张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-03 00:00:00 | ||
图片预览











文档简介
(共39张PPT)
新
教
材
第二章 化学反应速率与化学平衡
化学反应的调控
第四节
合成氨条件的选择
——化学反应速率和化学平衡的应用
工业生产硫酸中反应条件的控制
1.知道如何应用化学反应速率和化学平衡原理,选择合成氨的适宜条件。
2.初步掌握应用化学原理选择化工生产条件的思想和方法。
学习目标
合成氨的发展
我国合成氨工业的发展是在20 世纪30 年代开始的,经过几十年的不懈奋斗和发展,我国已经拥有了许多不同流程、不同规模的合成氨工厂。我国目前拥有了一支能够进行合成氨生产的科研等方面的研究技术团队,让我国已成为世界上最大的合成氨生产国,产量约占世界总产量的1/3。
合成氨工业是关系我国国民经济的重要行业,是我国化肥工业的基础,也是传统煤化工的重要组成部分。氨是重要的化工原料,主要用于制造氮肥、硝酸、丁腈橡胶等;氨在冶金、机械加工、电子、造纸等行业用途广泛。
合成氨的应用
制尿素
制硝酸
制冷剂
合成氨的反应历程
N2 +3H2 2NH3
化工生产过程中的基本问题?
综合经济效益
环境保护
工艺流程
设备结构
能源消耗
原料选择
化学反应原理
问题一:工业上合成氨,主要要考虑哪些因素?
1.速度要快,原料的利用率要高,单位时间的产量要高.
经济效益和社会效益
化学反应速率的问题
化学平衡问题
2.还要考虑生产中的消耗能源,原料,设备条件等因素。
一、合成氨的适宜条件的选择
(1)原理分析
根据合成氨反应的特点,应如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中按的含量?请填入下表
对合成氨反应的影响 影 响 因 素 浓度 温度 压强 催化剂
增大合成氨的反应速率
提高平衡混合物中氨的含量
增大反应物浓度
增大反应物浓度
升高温度
降低温度
增大压强
增大压强
使用催化剂
无影响
思考与讨论P44
N2+3H2 2NH3 H<0
→综合上述两个方面、分析增大合成氨的反应速率与提高平衡混合物中氨的含量所应采取的措施是否一致。
1、压强怎么选?
分析:①合成氨反应是体积缩小的气体反应,增大压强既可以增大反应速率,又能提高平衡混合物中氨的含量,所以理论上压强越大越好。
N2+3H2 2NH3 H<0
②但是压强越大,对设备的要求高、压缩H2和N2所需要的动力也大。
因此应该适当高压
综合以上两点,实际生产中压强一般选择在10~30MPa之间。
压强的选择----成本与效益的博弈
1、压强怎么选?
分析:①合成氨反应是体积缩小的气体反应,增大压强既可以增大反应速率,又能提高平衡混合物中氨的含量,所以理论上压强越大越好。
N2+3H2 2NH3 H<0
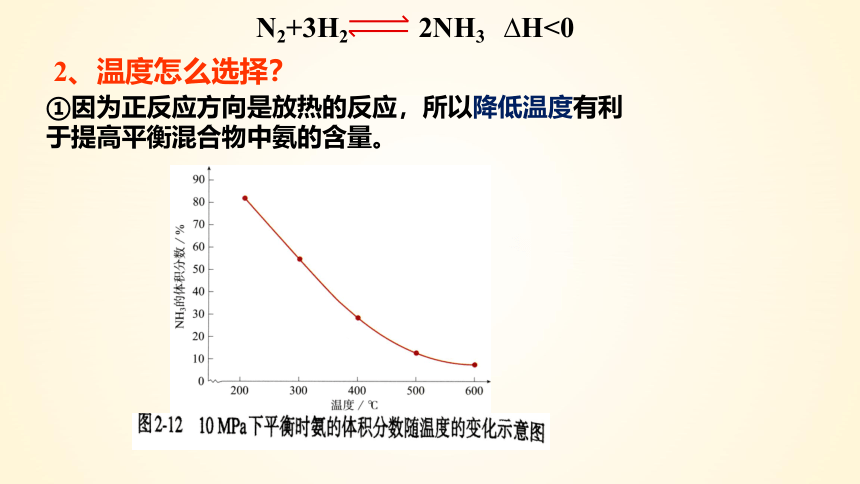
2、温度怎么选择?
①因为正反应方向是放热的反应,所以降低温度有利于提高平衡混合物中氨的含量。
N2+3H2 2NH3 H<0
②可是温度越低,反应速率越小,达到平衡所需要的时间越长
因此温度也不宜太低。
③催化剂要在一定温度下效果最好。
综合以上因素,实际生产中温度一般选择在400~500℃左右
判断:选择400~500℃作为合成氨的温度可用勒夏特烈原理解释
Ⅹ
温度的选择----快与少、慢与多的权衡
2、温度怎么选择?
①因为正反应方向是放热的反应,所以降低温度有利于提高平衡混合物中氨的含量。
N2+3H2 2NH3 H<0
3、用不用催化剂?
使用催化剂能否提高合成氨的转化率?
使用催化剂对反应速率有何影响?
实际生产中选用铁为主体的多成分催化剂(铁触媒),它在500℃时活性较高。
∴ 要使用合适的催化剂
不能
能加快反应速率,提高生产效率
判断:选择铁触媒作为合成氨的催化剂可用勒夏特烈原理解释
Ⅹ
N2+3H2 2NH3 H<0
4、浓度怎么定?H2和N2的比例怎么定?
因此,可以用保持一定的N2、H2浓度,减少NH3的浓度的方法,提高合成氨的效率和产量。
实际生产中的处理方法:
增大反应物的浓度可以增大反应速率,促进平衡正向移动
减小生成物的浓度可以使平衡正向移动
及时将气态氨冷却液化而分离出去;
及时补充氮气和氢气并循环利用,使其保持一定的浓度。
[n(N2)∶n(H2)=1∶2.8]
N2+3H2 2NH3 H<0
N2+3H2 2NH3
归纳总结:工业合成氨的最佳条件
1)浓度:
2)温度:
3)压强:
4)催化剂:
使用过量的N2或及时分离平衡混合气中的氨。
400-500℃左右 (温度低,有利于增大平衡混合气中的含量,但反应速率太慢。 500℃,催化剂活性最大)
铁触媒 (能加快化学反应速率,对平衡无影响)
10~30MPa(压强过高,对设备材质和生产条件提出了更高的要求)
500℃
铁触媒
10-30Mpa
值得说明的是:在上述条件下,合成氨的产率仍然不高。
P45
合成氨的工艺流程
流程分析
⒈原料气干燥、净化:除去原料气中的水蒸气及其他气体杂质,
防止与催化剂接触时,导致催化剂“中毒”而降低或丧失催化活性。
⒉压缩机加压:增大压强
合成氨的工艺流程
流程分析
⒊热交换:合成氨反应为放热反应,反应体系温度逐渐升高,
为原料气反应提供热量,故热交换可充分利用能源,提高经济效益。
合成氨的工艺流程
流程分析
⒋冷却:生成物NH3的液化需较低温度采取迅速冷却的方法,可使气态氨变成液氨后及时从平衡混合物中分离出来,以促使平衡向生成NH3的方向移动。
合成氨的工艺流程
流程分析
⒌循环使用原料气:
将NH3分离后的原料气循环利用,并及时补充N2和H2,使反应物保持一定的浓度,以利于合成氨反应,提高经济效益。
合成氨的工艺流程
流程分析
合成氨的工业流程简图:
1.在合成氨工业中,为增加氨气的日产量,在实现此目的的过程中与平衡移动有关的是
( A)不断将氨分离出来
(B) 使用催化剂
(C) 采用500℃的高温
(D)采用10-30Mpa的压强
√
√
2、有平衡体系CO (g) + 2H2 (g) CH3OH (g) △H<0 ,
为了增加CH3OH的产量,应该采取的措施是 ( )。
A、高温、高压
B、适宜的温度、高压、催化剂
C、低温、低压
D、高温、高压、催化剂
B
B
3.关于氨的合成工业的下列说法正确的是 ( )
A. 从合成塔出来的气体,其中氨一般占15%,所以生产氨的工业的效率都很低
B. 由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高
C. 合成氨工业的反应温度控制在500℃左右,目的是使平衡向正反应方向进行
D. 合成氨工业采用10-30MPa ,是因该条件下催化剂的活性最好
(一)硫酸工业生产的原理
S或FeS2 → SO2
→ SO3
→ H2SO4
① ② ③
S + O2 === SO2
点燃
4FeS2+11O2===2Fe2O3+8SO2
高温
2SO2 + O2 2SO3
催化剂
加 热
SO3 + H2O H2SO4
第一步:
第二步:
第三步:
(造气)
(催化氧化)
(吸收)
生产过程
②硫酸生产中的第二步为可逆反应,是生产硫酸的关键。
①三步反应均为放热反应,可设法利用反应热。
注意:
二、工业生产硫酸中反应条件的控制
③工业上是用98.3%的浓硫酸来吸收SO3的,而不是直接用水作吸收剂,原因是用后者吸收时容易形成酸雾,吸收速率慢。
使用催化剂
低温
高压
反应条件:
理论需要:
压强
温度
催化剂
讨论:根据平衡移动原理,该反应是在什么条件下进行更有利于SO2的转化?
;△H=-196.6KJ/mol
2SO2(g) + O2(g) 2SO3(g)
催化剂
△
(二)、生产中反应条件的控制
注:这是一个气体总体积缩小的、放热的可逆反应
理论上:低温、高压、催化剂有利于SO2的转化。
浓度
①增大c(O2)
②减小c(SO3)
思考与交流2:
分析下列表格,思考:温度较低时 ,SO2的转化率_____;
越高
不同温度下SO2的平衡转化率
温度 400 450 475 500 525 550 575 600 650 1000
转化率 99.2 97.5 95.8 93.5 90.5 85.6 79.9 73.7 58.5 5.0
→那么是否温度越低越好呢?
虽然温度较低对提高SO2的转化率有利,
但温度较低时:①催化剂活性不高;②反应速率低。
不是.
;△H=-196.6KJ/mol
2SO2(g) + O2(g) 2SO3(g)
催化剂
△
(二)、生产中反应条件的控制
应选择温度:
400~5000C
注意:工业生产中,反应温度的选择,往往还要考虑该温度下催化剂的活性。
思考与交流2:
分析下列表格,思考:温度较低时 ,SO2的转化率_____;
越高
→那么是否温度越低越好呢?
虽然温度较低对提高SO2的转化率有利,
但温度较低时:①催化剂活性不高;②反应速率低。
不是.
;△H=-196.6KJ/mol
2SO2(g) + O2(g) 2SO3(g)
催化剂
△
(二)、生产中反应条件的控制
分析下表1-2,思考压强的增大,SO2的转化率_____;
越高
那么是否压强越高越好呢?
表1-2 压强对SO2平衡转化率的影响
0.1MPa=1×105Pa
=1个大气压 (即: 1atm)
不是.
1atm
5atm
10atm
100atm
思考与交流2:
;△H=-196.6KJ/mol
2SO2(g) + O2(g) 2SO3(g)
催化剂
△
(二)、生产中反应条件的控制
根据平衡移动原理,加压对提高SO2的转化率有利,
但在400~500℃时,常压下SO2的转化率已经很高,
加压对设备的要求高,会增大投资和能量消耗。
应选择压强:
常压(1atm )
注意:工业生产中,压强的选择,往往还要考虑成本和能量消耗等问题
分析下表1-2,思考压强的增大,SO2的转化率_____;
越高
那么是否压强越高越好呢?
不是.
思考与交流2:
;△H=-196.6KJ/mol
2SO2(g) + O2(g) 2SO3(g)
催化剂
△
(二)、生产中反应条件的控制
实际应用:
400℃∽500℃
常压
使用V2O5作催化剂
增大压强对SO2的转化率提高不多而对设备的要求高,会增大投资和能量消耗
①催化剂活性好
②反应速率高
(同上)
;△H=-196.6KJ/mol
2SO2(g) + O2(g) 2SO3(g)
催化剂
△
(二)、生产中反应条件的控制
使用催化剂
低温
高压
反应条件:
理论需要:
压强
温度
催化剂
①增大c(O2)
②减小c(SO3)
浓度
硫酸工业生产的三个主要设备
SO2
O2
“接触法制硫酸”
沸腾炉
接触室
吸收塔
因反应物在催化剂表面接触时发生氧化反应,所以称之为
【小结】
工业上利用某可逆反应生产产品:
① 一般要使用催化剂:这样可以大大加快化学反应速率,提高生产效率,也提高了经济效益;
②选择合适的温度:该温度是催化剂活性最大的温度;
③选择合适的压强:既要考虑化学反应速率和化学平衡,还要考虑动力、材料、设备等。
最后,选择适宜的生产条件还要考虑环境保护及社会效益等方面的规定和要求。
1.有一处于平衡状态的反应:X(g)+3Y(g) 2Z(g) ΔH<0。
为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( )
①高温 ②低温 ③高压
④低压 ⑤加催化剂 ⑥除去Z
A.①④⑥ B.②③⑤ C.①③⑥ D.②③⑥
D
√
√
√
2、氯化铜溶液为淡蓝色,当加入浓盐酸后,溶液就会变成黄绿色,这种颜色变化是由下列可逆反应引起的:
[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O
下列方法能使溶液变成淡蓝色的是( )
A、加蒸馏水 B、加AgNO3溶液
C、加NaCl溶液 D、加盐酸
A B
3.(双选)2018年是合成氨工业先驱哈伯(P·Haber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:N2(g)+3H2(g) 2NH3(g) ΔH(298K)=-46.2kJ/mol。关于合成氨工艺的下列理解正确的是
A.合成氨反应在不同温度下的ΔH和ΔS都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
AD
K Na KCl NaCl
熔点℃ 63.6 97.8 770 801
沸点℃ 774 883 1500 1413
制备K的适宜温度是 。
801 ℃—883 ℃
4.工业上利用Na和KCl制备K。发生反应为:
Na+KCl(熔融) K+NaCl(熔融)
下面是四种物质的熔沸点:
>
>
>
<
5、合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气中的CO,其反应是:[Cu(NH3)2Ac]+CO+NH3 [Cu(NH3)3]Ac·CO △H<0
(1)必须除去原料气中CO的原因是 。
(2)醋酸二氨合铜(I)吸收CO的生产适宜条件应是 。
(3)吸收CO后的醋酸铜氨溶液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用。醋酸铜氨溶液再生的生产适宜条件应是 。
防止合成塔中的催化剂中毒
低温、高压
高温、低压
新
教
材
第二章 化学反应速率与化学平衡
化学反应的调控
第四节
合成氨条件的选择
——化学反应速率和化学平衡的应用
工业生产硫酸中反应条件的控制
1.知道如何应用化学反应速率和化学平衡原理,选择合成氨的适宜条件。
2.初步掌握应用化学原理选择化工生产条件的思想和方法。
学习目标
合成氨的发展
我国合成氨工业的发展是在20 世纪30 年代开始的,经过几十年的不懈奋斗和发展,我国已经拥有了许多不同流程、不同规模的合成氨工厂。我国目前拥有了一支能够进行合成氨生产的科研等方面的研究技术团队,让我国已成为世界上最大的合成氨生产国,产量约占世界总产量的1/3。
合成氨工业是关系我国国民经济的重要行业,是我国化肥工业的基础,也是传统煤化工的重要组成部分。氨是重要的化工原料,主要用于制造氮肥、硝酸、丁腈橡胶等;氨在冶金、机械加工、电子、造纸等行业用途广泛。
合成氨的应用
制尿素
制硝酸
制冷剂
合成氨的反应历程
N2 +3H2 2NH3
化工生产过程中的基本问题?
综合经济效益
环境保护
工艺流程
设备结构
能源消耗
原料选择
化学反应原理
问题一:工业上合成氨,主要要考虑哪些因素?
1.速度要快,原料的利用率要高,单位时间的产量要高.
经济效益和社会效益
化学反应速率的问题
化学平衡问题
2.还要考虑生产中的消耗能源,原料,设备条件等因素。
一、合成氨的适宜条件的选择
(1)原理分析
根据合成氨反应的特点,应如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中按的含量?请填入下表
对合成氨反应的影响 影 响 因 素 浓度 温度 压强 催化剂
增大合成氨的反应速率
提高平衡混合物中氨的含量
增大反应物浓度
增大反应物浓度
升高温度
降低温度
增大压强
增大压强
使用催化剂
无影响
思考与讨论P44
N2+3H2 2NH3 H<0
→综合上述两个方面、分析增大合成氨的反应速率与提高平衡混合物中氨的含量所应采取的措施是否一致。
1、压强怎么选?
分析:①合成氨反应是体积缩小的气体反应,增大压强既可以增大反应速率,又能提高平衡混合物中氨的含量,所以理论上压强越大越好。
N2+3H2 2NH3 H<0
②但是压强越大,对设备的要求高、压缩H2和N2所需要的动力也大。
因此应该适当高压
综合以上两点,实际生产中压强一般选择在10~30MPa之间。
压强的选择----成本与效益的博弈
1、压强怎么选?
分析:①合成氨反应是体积缩小的气体反应,增大压强既可以增大反应速率,又能提高平衡混合物中氨的含量,所以理论上压强越大越好。
N2+3H2 2NH3 H<0
2、温度怎么选择?
①因为正反应方向是放热的反应,所以降低温度有利于提高平衡混合物中氨的含量。
N2+3H2 2NH3 H<0
②可是温度越低,反应速率越小,达到平衡所需要的时间越长
因此温度也不宜太低。
③催化剂要在一定温度下效果最好。
综合以上因素,实际生产中温度一般选择在400~500℃左右
判断:选择400~500℃作为合成氨的温度可用勒夏特烈原理解释
Ⅹ
温度的选择----快与少、慢与多的权衡
2、温度怎么选择?
①因为正反应方向是放热的反应,所以降低温度有利于提高平衡混合物中氨的含量。
N2+3H2 2NH3 H<0
3、用不用催化剂?
使用催化剂能否提高合成氨的转化率?
使用催化剂对反应速率有何影响?
实际生产中选用铁为主体的多成分催化剂(铁触媒),它在500℃时活性较高。
∴ 要使用合适的催化剂
不能
能加快反应速率,提高生产效率
判断:选择铁触媒作为合成氨的催化剂可用勒夏特烈原理解释
Ⅹ
N2+3H2 2NH3 H<0
4、浓度怎么定?H2和N2的比例怎么定?
因此,可以用保持一定的N2、H2浓度,减少NH3的浓度的方法,提高合成氨的效率和产量。
实际生产中的处理方法:
增大反应物的浓度可以增大反应速率,促进平衡正向移动
减小生成物的浓度可以使平衡正向移动
及时将气态氨冷却液化而分离出去;
及时补充氮气和氢气并循环利用,使其保持一定的浓度。
[n(N2)∶n(H2)=1∶2.8]
N2+3H2 2NH3 H<0
N2+3H2 2NH3
归纳总结:工业合成氨的最佳条件
1)浓度:
2)温度:
3)压强:
4)催化剂:
使用过量的N2或及时分离平衡混合气中的氨。
400-500℃左右 (温度低,有利于增大平衡混合气中的含量,但反应速率太慢。 500℃,催化剂活性最大)
铁触媒 (能加快化学反应速率,对平衡无影响)
10~30MPa(压强过高,对设备材质和生产条件提出了更高的要求)
500℃
铁触媒
10-30Mpa
值得说明的是:在上述条件下,合成氨的产率仍然不高。
P45
合成氨的工艺流程
流程分析
⒈原料气干燥、净化:除去原料气中的水蒸气及其他气体杂质,
防止与催化剂接触时,导致催化剂“中毒”而降低或丧失催化活性。
⒉压缩机加压:增大压强
合成氨的工艺流程
流程分析
⒊热交换:合成氨反应为放热反应,反应体系温度逐渐升高,
为原料气反应提供热量,故热交换可充分利用能源,提高经济效益。
合成氨的工艺流程
流程分析
⒋冷却:生成物NH3的液化需较低温度采取迅速冷却的方法,可使气态氨变成液氨后及时从平衡混合物中分离出来,以促使平衡向生成NH3的方向移动。
合成氨的工艺流程
流程分析
⒌循环使用原料气:
将NH3分离后的原料气循环利用,并及时补充N2和H2,使反应物保持一定的浓度,以利于合成氨反应,提高经济效益。
合成氨的工艺流程
流程分析
合成氨的工业流程简图:
1.在合成氨工业中,为增加氨气的日产量,在实现此目的的过程中与平衡移动有关的是
( A)不断将氨分离出来
(B) 使用催化剂
(C) 采用500℃的高温
(D)采用10-30Mpa的压强
√
√
2、有平衡体系CO (g) + 2H2 (g) CH3OH (g) △H<0 ,
为了增加CH3OH的产量,应该采取的措施是 ( )。
A、高温、高压
B、适宜的温度、高压、催化剂
C、低温、低压
D、高温、高压、催化剂
B
B
3.关于氨的合成工业的下列说法正确的是 ( )
A. 从合成塔出来的气体,其中氨一般占15%,所以生产氨的工业的效率都很低
B. 由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高
C. 合成氨工业的反应温度控制在500℃左右,目的是使平衡向正反应方向进行
D. 合成氨工业采用10-30MPa ,是因该条件下催化剂的活性最好
(一)硫酸工业生产的原理
S或FeS2 → SO2
→ SO3
→ H2SO4
① ② ③
S + O2 === SO2
点燃
4FeS2+11O2===2Fe2O3+8SO2
高温
2SO2 + O2 2SO3
催化剂
加 热
SO3 + H2O H2SO4
第一步:
第二步:
第三步:
(造气)
(催化氧化)
(吸收)
生产过程
②硫酸生产中的第二步为可逆反应,是生产硫酸的关键。
①三步反应均为放热反应,可设法利用反应热。
注意:
二、工业生产硫酸中反应条件的控制
③工业上是用98.3%的浓硫酸来吸收SO3的,而不是直接用水作吸收剂,原因是用后者吸收时容易形成酸雾,吸收速率慢。
使用催化剂
低温
高压
反应条件:
理论需要:
压强
温度
催化剂
讨论:根据平衡移动原理,该反应是在什么条件下进行更有利于SO2的转化?
;△H=-196.6KJ/mol
2SO2(g) + O2(g) 2SO3(g)
催化剂
△
(二)、生产中反应条件的控制
注:这是一个气体总体积缩小的、放热的可逆反应
理论上:低温、高压、催化剂有利于SO2的转化。
浓度
①增大c(O2)
②减小c(SO3)
思考与交流2:
分析下列表格,思考:温度较低时 ,SO2的转化率_____;
越高
不同温度下SO2的平衡转化率
温度 400 450 475 500 525 550 575 600 650 1000
转化率 99.2 97.5 95.8 93.5 90.5 85.6 79.9 73.7 58.5 5.0
→那么是否温度越低越好呢?
虽然温度较低对提高SO2的转化率有利,
但温度较低时:①催化剂活性不高;②反应速率低。
不是.
;△H=-196.6KJ/mol
2SO2(g) + O2(g) 2SO3(g)
催化剂
△
(二)、生产中反应条件的控制
应选择温度:
400~5000C
注意:工业生产中,反应温度的选择,往往还要考虑该温度下催化剂的活性。
思考与交流2:
分析下列表格,思考:温度较低时 ,SO2的转化率_____;
越高
→那么是否温度越低越好呢?
虽然温度较低对提高SO2的转化率有利,
但温度较低时:①催化剂活性不高;②反应速率低。
不是.
;△H=-196.6KJ/mol
2SO2(g) + O2(g) 2SO3(g)
催化剂
△
(二)、生产中反应条件的控制
分析下表1-2,思考压强的增大,SO2的转化率_____;
越高
那么是否压强越高越好呢?
表1-2 压强对SO2平衡转化率的影响
0.1MPa=1×105Pa
=1个大气压 (即: 1atm)
不是.
1atm
5atm
10atm
100atm
思考与交流2:
;△H=-196.6KJ/mol
2SO2(g) + O2(g) 2SO3(g)
催化剂
△
(二)、生产中反应条件的控制
根据平衡移动原理,加压对提高SO2的转化率有利,
但在400~500℃时,常压下SO2的转化率已经很高,
加压对设备的要求高,会增大投资和能量消耗。
应选择压强:
常压(1atm )
注意:工业生产中,压强的选择,往往还要考虑成本和能量消耗等问题
分析下表1-2,思考压强的增大,SO2的转化率_____;
越高
那么是否压强越高越好呢?
不是.
思考与交流2:
;△H=-196.6KJ/mol
2SO2(g) + O2(g) 2SO3(g)
催化剂
△
(二)、生产中反应条件的控制
实际应用:
400℃∽500℃
常压
使用V2O5作催化剂
增大压强对SO2的转化率提高不多而对设备的要求高,会增大投资和能量消耗
①催化剂活性好
②反应速率高
(同上)
;△H=-196.6KJ/mol
2SO2(g) + O2(g) 2SO3(g)
催化剂
△
(二)、生产中反应条件的控制
使用催化剂
低温
高压
反应条件:
理论需要:
压强
温度
催化剂
①增大c(O2)
②减小c(SO3)
浓度
硫酸工业生产的三个主要设备
SO2
O2
“接触法制硫酸”
沸腾炉
接触室
吸收塔
因反应物在催化剂表面接触时发生氧化反应,所以称之为
【小结】
工业上利用某可逆反应生产产品:
① 一般要使用催化剂:这样可以大大加快化学反应速率,提高生产效率,也提高了经济效益;
②选择合适的温度:该温度是催化剂活性最大的温度;
③选择合适的压强:既要考虑化学反应速率和化学平衡,还要考虑动力、材料、设备等。
最后,选择适宜的生产条件还要考虑环境保护及社会效益等方面的规定和要求。
1.有一处于平衡状态的反应:X(g)+3Y(g) 2Z(g) ΔH<0。
为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( )
①高温 ②低温 ③高压
④低压 ⑤加催化剂 ⑥除去Z
A.①④⑥ B.②③⑤ C.①③⑥ D.②③⑥
D
√
√
√
2、氯化铜溶液为淡蓝色,当加入浓盐酸后,溶液就会变成黄绿色,这种颜色变化是由下列可逆反应引起的:
[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O
下列方法能使溶液变成淡蓝色的是( )
A、加蒸馏水 B、加AgNO3溶液
C、加NaCl溶液 D、加盐酸
A B
3.(双选)2018年是合成氨工业先驱哈伯(P·Haber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:N2(g)+3H2(g) 2NH3(g) ΔH(298K)=-46.2kJ/mol。关于合成氨工艺的下列理解正确的是
A.合成氨反应在不同温度下的ΔH和ΔS都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
AD
K Na KCl NaCl
熔点℃ 63.6 97.8 770 801
沸点℃ 774 883 1500 1413
制备K的适宜温度是 。
801 ℃—883 ℃
4.工业上利用Na和KCl制备K。发生反应为:
Na+KCl(熔融) K+NaCl(熔融)
下面是四种物质的熔沸点:
>
>
>
<
5、合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气中的CO,其反应是:[Cu(NH3)2Ac]+CO+NH3 [Cu(NH3)3]Ac·CO △H<0
(1)必须除去原料气中CO的原因是 。
(2)醋酸二氨合铜(I)吸收CO的生产适宜条件应是 。
(3)吸收CO后的醋酸铜氨溶液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用。醋酸铜氨溶液再生的生产适宜条件应是 。
防止合成塔中的催化剂中毒
低温、高压
高温、低压
