2.3.1物质的量单位——摩尔 课件(共27张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3.1物质的量单位——摩尔 课件(共27张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-03 23:38:57 | ||
图片预览






文档简介
(共27张PPT)
第二章 海水中的重要元素——钠和氯
第3节 物质的量
第一课时 物质的量单位——摩尔
1.理解物质的量、摩尔质量的含义,建立宏观与微观之间的联系,感受从物质的量层次定量研究化学问题的意义。
2.能基于物质的量认识物质组成及其化学变化,运用物质的量和摩尔质量之间的关系进行简单计算。
3.了解生产、生活的多种计量方法,初步学会从实际需求的角度审视化学问题。
学习目标
本节重难点
物质的量的概念;
以物质的量为中心的转化关系;
本节重点
本节难点
物质的量的概念;
以物质的量为中心的转化关系;
宏观与微观结合的思想。
1个
1箱
1盒
1堆
情境导入
Part 1 认识计量微观粒子的物理量
硅原子(微观粒子)
如何计量微观粒子的数目呢?
科学家引入“物质的量”这一基本物理量,来描述微观粒子集体数目的多少。
物质的量及其单位
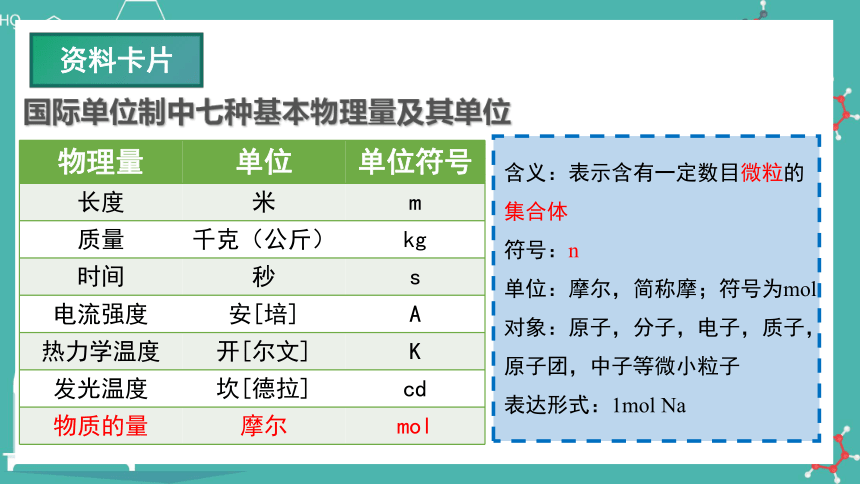
国际单位制中七种基本物理量及其单位
资料卡片
物理量 单位 单位符号
长度 米 m
质量 千克(公斤) kg
时间 秒 s
电流强度 安[培] A
热力学温度 开[尔文] K
发光温度 坎[德拉] cd
物质的量 摩尔 mol
含义:表示含有一定数目微粒的集合体
符号:n
单位:摩尔,简称摩;符号为mol
对象:原子,分子,电子,质子,原子团,中子等微小粒子
表达形式:1mol Na
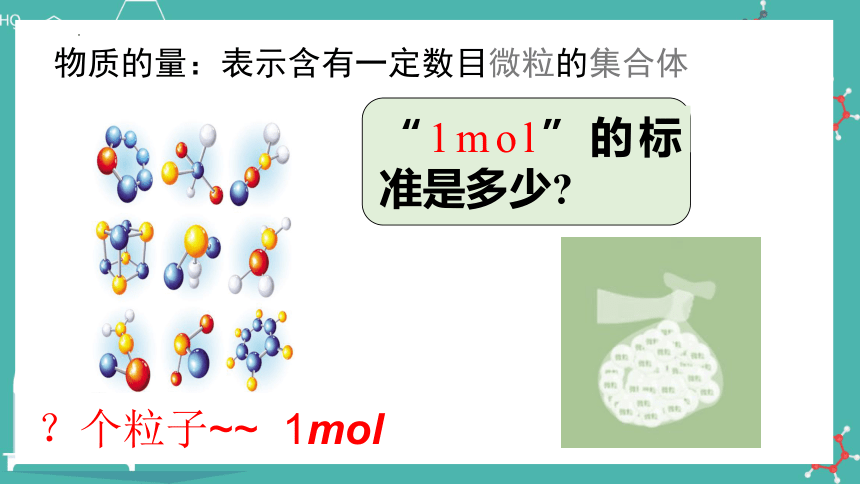
1mol 粒子集合体所含的粒子数是多少呢?
?个粒子~~ 1mol
“1mol”的标准是多少
物质的量:表示含有一定数目微粒的集合体
阿伏伽德罗常数
阿伏加德罗
让·巴蒂斯特·佩兰
(Jean Baptiste Perrin)
1870-1942
第26届国际计量大会
2018年人为规定阿伏伽德罗常数为6.02214076×10
用N 表示,数值以“0.012kg包含的原子的数量”为标准
实验测出“2克原子氢”所含的分子数为5-8×10 ,为了纪念阿伏伽德罗,将其命名为“阿伏伽德罗常数”
科学史话
归纳小结
物质的量
表示含有一定数目粒子的集合体
符号为n
七大基本物理量之一
摩尔
标准
1摩尔粒子集合体所含的粒子数为6.02×1023,符号为n
计量对象
分子、原子、离子、电子、质子等所有微观粒子
阿伏伽德罗常数
1 mol 任何粒子的粒子数
符号为NA
Part 2 建立以物质的量为中心的计算关系
3
4. 1.204×1024个NO 相当于 mol NO 。
3
1. 1 mol H2O中约含有 个水分子;
2. 0.5 mol NaOH中约含有 个Na+;
6.02×1023
3.01×1023
知识巩固
3. 6.02×1023个H2相当于 mol H2 ;
1
2
物质的量
n (mol)
粒子数
N(个)
2.物质的量与粒子数之间的关系:
n =
NA
N
× NA (mol-1)
÷ NA (mol-1)
H2O ~ 2 H ~ O
1 mol 2 mol 1 mol
1×6.02×1023 2×6.02×1023 1×6.02×1023
练习应用
练习应用
分别在0.5mol、1mol O2中含有的氧分子数目是多少?
N1 = n1 × NA
= 0.5 mol× 6.02 ×1023 mol-1
N2 = n2 × NA
= 1 mol × 6.02 ×1023 mol-1
有什么规律?
粒子的物质的量之比=物质的粒子数之比
n1︰n2 = N1︰N2
H2O ~ 2 H ~ O
1 mol 2 mol 1 mol
1×6.02×1023 2×6.02×1023 1×6.02×1023
有什么规律?
粒子数之比 = 物质的量之比
=
N2
N1
n2
n1
物质的量为1 mol的几种物质
资料卡片
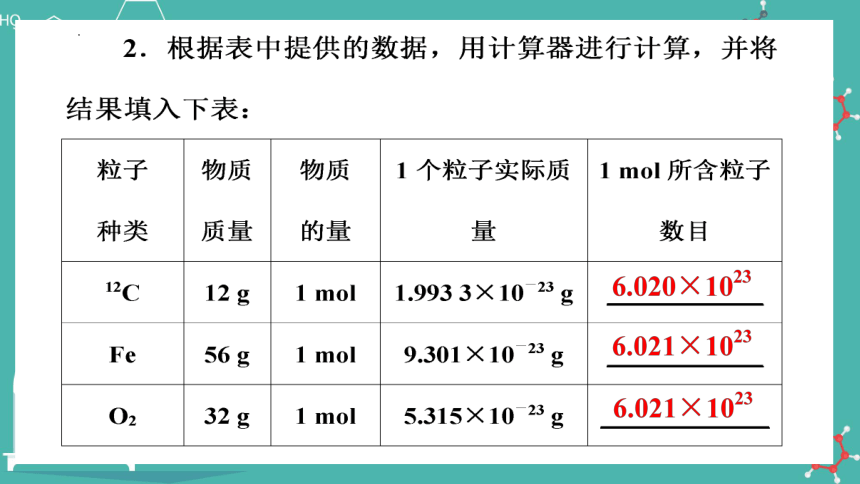
序号 物质 相对原子(分子)质量 质量 物质的量
1 Fe 56 g 1 mol
2 Cu 64 g 1 mol
3 Al 27 g 1 mol
4 Zn 65 g 1 mol
5 S 32 g 1 mol
6 NaCl 58.5 g 1 mol
7 H2O 18 g 1 mol
8 蔗糖 342 g 1 mol
56
64
27
65
32
58.5
18
342
资料卡片
M =
m
n
3. 摩尔质量
——单位物质的量的物质所具有的质量
单位: g/mol 或 g·mol-1
符号: M
表达式:
摩尔质量数值 = 相对原子(分子)质量
4. 物质的量与质量之间的关系:
物质的量
n(mol)
质量
m(g)
(g/mol)
n =
M
m
×M
÷M
(g/mol)
摩尔质量 相对分子质量
H2O 18
18 g/mol
1mol H2的摩尔质量为_____
2mol H2的摩尔质量为_____
2g/mol
1mol O2的摩尔质量为_____
2mol O2的摩尔质量为_____
32g/mol
2g/mol
32g/mol
巩固训练
电子的质量非常小,所以离子的摩尔质量以g/mol为单位时,其数值近似等于该粒子数的相对原子质量,如Na和Na+的摩尔质量都是23g/mol
巩固训练
2mol氧气分子 2mol水分子
微粒数目N 2NA 2NA
相对分子质量
摩尔质量M
微粒质量m
32g/mol
18g/mol
32g/mol×2mol
18g/mol×2mol
32
18
64g
36g
n =
M
m
n =
NA
N
(2)3molNa2CO3·10H2O含有 NA氢原子、含有 个钠离子和 个碳酸根离子
(1)1mol H2SO4中约含有 个硫酸分子, ________________个氧原子。
6.02×1023
4 6.02×1023
60
6NA
0.25
3NA
(3)含3.01×1023个Na+的 Na2SO4中约含SO42- mol
巩固训练
质量m
物质的量n
微粒数目N
×
摩尔质量M
÷
摩尔质量M
×
÷
NA
NA
宏观层面
微观层面
桥梁
(2)
(3)
归纳小结
课堂小练
C
B
3. 已知1个氧原子的质量约为2.657×10-23 g,请计算O2的摩尔质量为多少 与O2的相对分子质量的关系是什么
课堂小练
提示:M(O2)=2.657×10-23 g×6.02×1023 mol-1
×2=15.995 g·mol-1×2=31.99 g·mol-1,氧气摩尔质量以g·mol-1为单位,数值上与氧气相对分子质量相等。
A
课堂小练
4. 下列关于0.5 mol O2的说法不正确的是( )。
A. 含有0.5个氧分子
B. 摩尔质量是32 g/mol
C. 含有3.01×1023个氧分子
D. 质量是16 g
第二章 海水中的重要元素——钠和氯
第3节 物质的量
第一课时 物质的量单位——摩尔
1.理解物质的量、摩尔质量的含义,建立宏观与微观之间的联系,感受从物质的量层次定量研究化学问题的意义。
2.能基于物质的量认识物质组成及其化学变化,运用物质的量和摩尔质量之间的关系进行简单计算。
3.了解生产、生活的多种计量方法,初步学会从实际需求的角度审视化学问题。
学习目标
本节重难点
物质的量的概念;
以物质的量为中心的转化关系;
本节重点
本节难点
物质的量的概念;
以物质的量为中心的转化关系;
宏观与微观结合的思想。
1个
1箱
1盒
1堆
情境导入
Part 1 认识计量微观粒子的物理量
硅原子(微观粒子)
如何计量微观粒子的数目呢?
科学家引入“物质的量”这一基本物理量,来描述微观粒子集体数目的多少。
物质的量及其单位
国际单位制中七种基本物理量及其单位
资料卡片
物理量 单位 单位符号
长度 米 m
质量 千克(公斤) kg
时间 秒 s
电流强度 安[培] A
热力学温度 开[尔文] K
发光温度 坎[德拉] cd
物质的量 摩尔 mol
含义:表示含有一定数目微粒的集合体
符号:n
单位:摩尔,简称摩;符号为mol
对象:原子,分子,电子,质子,原子团,中子等微小粒子
表达形式:1mol Na
1mol 粒子集合体所含的粒子数是多少呢?
?个粒子~~ 1mol
“1mol”的标准是多少
物质的量:表示含有一定数目微粒的集合体
阿伏伽德罗常数
阿伏加德罗
让·巴蒂斯特·佩兰
(Jean Baptiste Perrin)
1870-1942
第26届国际计量大会
2018年人为规定阿伏伽德罗常数为6.02214076×10
用N 表示,数值以“0.012kg包含的原子的数量”为标准
实验测出“2克原子氢”所含的分子数为5-8×10 ,为了纪念阿伏伽德罗,将其命名为“阿伏伽德罗常数”
科学史话
归纳小结
物质的量
表示含有一定数目粒子的集合体
符号为n
七大基本物理量之一
摩尔
标准
1摩尔粒子集合体所含的粒子数为6.02×1023,符号为n
计量对象
分子、原子、离子、电子、质子等所有微观粒子
阿伏伽德罗常数
1 mol 任何粒子的粒子数
符号为NA
Part 2 建立以物质的量为中心的计算关系
3
4. 1.204×1024个NO 相当于 mol NO 。
3
1. 1 mol H2O中约含有 个水分子;
2. 0.5 mol NaOH中约含有 个Na+;
6.02×1023
3.01×1023
知识巩固
3. 6.02×1023个H2相当于 mol H2 ;
1
2
物质的量
n (mol)
粒子数
N(个)
2.物质的量与粒子数之间的关系:
n =
NA
N
× NA (mol-1)
÷ NA (mol-1)
H2O ~ 2 H ~ O
1 mol 2 mol 1 mol
1×6.02×1023 2×6.02×1023 1×6.02×1023
练习应用
练习应用
分别在0.5mol、1mol O2中含有的氧分子数目是多少?
N1 = n1 × NA
= 0.5 mol× 6.02 ×1023 mol-1
N2 = n2 × NA
= 1 mol × 6.02 ×1023 mol-1
有什么规律?
粒子的物质的量之比=物质的粒子数之比
n1︰n2 = N1︰N2
H2O ~ 2 H ~ O
1 mol 2 mol 1 mol
1×6.02×1023 2×6.02×1023 1×6.02×1023
有什么规律?
粒子数之比 = 物质的量之比
=
N2
N1
n2
n1
物质的量为1 mol的几种物质
资料卡片
序号 物质 相对原子(分子)质量 质量 物质的量
1 Fe 56 g 1 mol
2 Cu 64 g 1 mol
3 Al 27 g 1 mol
4 Zn 65 g 1 mol
5 S 32 g 1 mol
6 NaCl 58.5 g 1 mol
7 H2O 18 g 1 mol
8 蔗糖 342 g 1 mol
56
64
27
65
32
58.5
18
342
资料卡片
M =
m
n
3. 摩尔质量
——单位物质的量的物质所具有的质量
单位: g/mol 或 g·mol-1
符号: M
表达式:
摩尔质量数值 = 相对原子(分子)质量
4. 物质的量与质量之间的关系:
物质的量
n(mol)
质量
m(g)
(g/mol)
n =
M
m
×M
÷M
(g/mol)
摩尔质量 相对分子质量
H2O 18
18 g/mol
1mol H2的摩尔质量为_____
2mol H2的摩尔质量为_____
2g/mol
1mol O2的摩尔质量为_____
2mol O2的摩尔质量为_____
32g/mol
2g/mol
32g/mol
巩固训练
电子的质量非常小,所以离子的摩尔质量以g/mol为单位时,其数值近似等于该粒子数的相对原子质量,如Na和Na+的摩尔质量都是23g/mol
巩固训练
2mol氧气分子 2mol水分子
微粒数目N 2NA 2NA
相对分子质量
摩尔质量M
微粒质量m
32g/mol
18g/mol
32g/mol×2mol
18g/mol×2mol
32
18
64g
36g
n =
M
m
n =
NA
N
(2)3molNa2CO3·10H2O含有 NA氢原子、含有 个钠离子和 个碳酸根离子
(1)1mol H2SO4中约含有 个硫酸分子, ________________个氧原子。
6.02×1023
4 6.02×1023
60
6NA
0.25
3NA
(3)含3.01×1023个Na+的 Na2SO4中约含SO42- mol
巩固训练
质量m
物质的量n
微粒数目N
×
摩尔质量M
÷
摩尔质量M
×
÷
NA
NA
宏观层面
微观层面
桥梁
(2)
(3)
归纳小结
课堂小练
C
B
3. 已知1个氧原子的质量约为2.657×10-23 g,请计算O2的摩尔质量为多少 与O2的相对分子质量的关系是什么
课堂小练
提示:M(O2)=2.657×10-23 g×6.02×1023 mol-1
×2=15.995 g·mol-1×2=31.99 g·mol-1,氧气摩尔质量以g·mol-1为单位,数值上与氧气相对分子质量相等。
A
课堂小练
4. 下列关于0.5 mol O2的说法不正确的是( )。
A. 含有0.5个氧分子
B. 摩尔质量是32 g/mol
C. 含有3.01×1023个氧分子
D. 质量是16 g
