2.3.1物质的量 摩尔质量 课件(共50张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3.1物质的量 摩尔质量 课件(共50张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 941.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-03 23:57:01 | ||
图片预览









文档简介
(共50张PPT)
新
教
材
第二章
物质的量
第三节
第1课时 物质的量 摩尔质量
【学习目标】
1.理解阿伏加德罗常数概念建立的依据。
2.了解物质的量及其单位---摩尔。
3.了解阿伏加德罗常数,并能运用NA进行计算。
4.了解摩尔质量的含义。
5.能够进行物质的量、微粒数、摩尔质量之间的换算。
谁能介绍几种生活中相似的例子
古时有一个勇敢的小伙子想娶国王美丽的公主,国王出题刁难,
其中一个问题是:10kg小米是多少粒?同学们你们能不能帮帮他?
对于微小物质,扩大倍数形成一定量,更方便计量
称一两小米,数其数目,再推算
数50或100粒小米,称其质量,再推算
生活经验告诉我们:
买材料纸:500张/刀
买啤酒:12瓶/箱 ……
买火柴:一盒一盒买
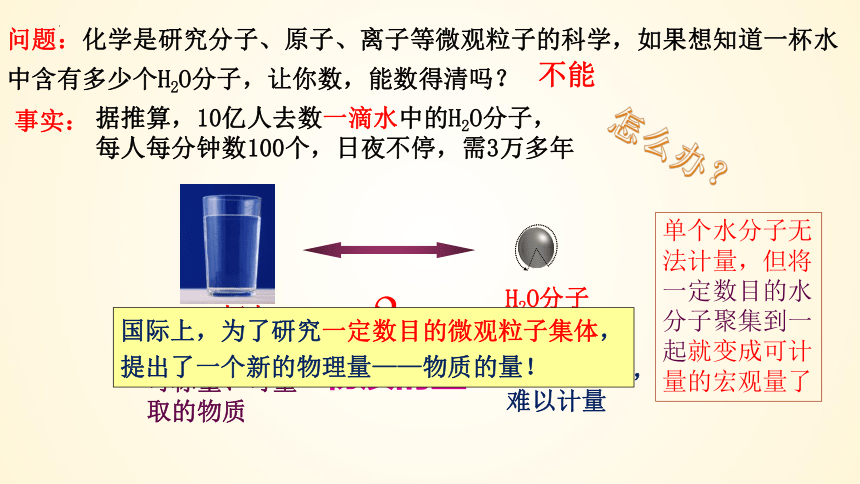
问题:化学是研究分子、原子、离子等微观粒子的科学,如果想知道一杯水中含有多少个H2O分子,让你数,能数得清吗?
不能
事实:
据推算,10亿人去数一滴水中的H2O分子,
每人每分钟数100个,日夜不停,需3万多年
怎么办?
一杯水
H2O分子
宏观物质
微观粒子
物质的量
肉眼看不见,难以计量
可称量、可量取的物质
?
国际上,为了研究一定数目的微观粒子集体,提出了一个新的物理量——物质的量!
单个水分子无法计量,但将一定数目的水分子聚集到一起就变成可计量的宏观量了
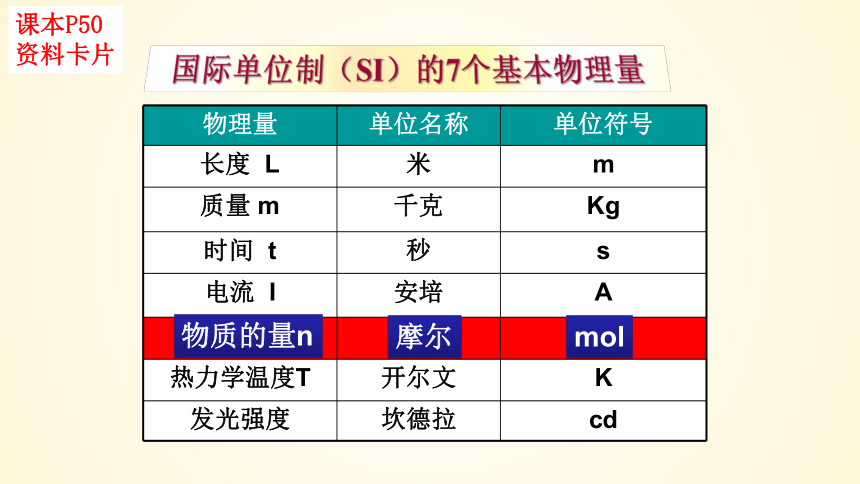
物理量 单位名称 单位符号
长度 L 米 m
质量 m 千克 Kg
时间 t 秒 s
电流 I 安培 A
热力学温度T 开尔文 K
发光强度 坎德拉 cd
物质的量n
摩尔
mol
课本P50
资料卡片
③“物质的量” 是物理量,专用名词,不可拆分,更不可理解为物质的质量或物质的数量等
1.含义:表示含有一定数目粒子集体的物理量。
{
分子、原子、离子、原子团、质子、中子、电子等
一、物质的量
①适用于微观粒子:
⑤“物质的量”的单位: 摩尔 简称摩
(符号为 mol )
②描述的对象:
微观粒子的集合体
④“物质的量”的符号:
n
n(H)
:表示氢原子的物质的量
n(H2)
:表示氢分子的物质的量
n(H+)呢?
n(H2O)
n(Fe)
类比:
质量:符号m,单位:Kg
m(Fe) = 28 Kg
:表示Fe的质量为28千克
n(Fe) = 1 mol
:表示Fe原子的物质的量为1 mol
n(H+) = 2 mol
:表示氢离子的物质的量为2 mol
n(H2O) = 0.5 mol
:表示水分子的物质的量为0.5 mol
2.符号:n,单位:mol
一、物质的量
1.含义:表示含有一定数目粒子集体的物理量。
判断正误,并说明理由。
1)摩尔是国际七个基本物理量之一。
物质的量是一个基本物理量,而摩尔是它的单位
×
2)摩尔是物质的质量单位。
摩尔是物质的量的单位
×
3) 1mol芝麻
×
物质的量仅适用于微观粒子,对宏观物质毫无意义
4)3mol氢
没有指明是氢分子、氢原子或氢离子等
×
必须指明粒子的种类,如原子、分子、离子等。
5)2.6 molCO2
常用化学符号表示组成物质的微观粒子
应用“物质的量”时应注意的问题
(4)物质的量的规范表示方法:
(1)“物质的量”是一个整体,不可拆开。
(2)物质的量仅用于计量微观粒子,不适用于宏观物质。
(3)使用物质的量时一般用化学式表示,若用中文,则必须指明微粒的种类。
(5)物质的量的数值可以是整数,也可以是小数。
如:3molH、1.5molCO2 、 1mol钠离子或1molNa+等。
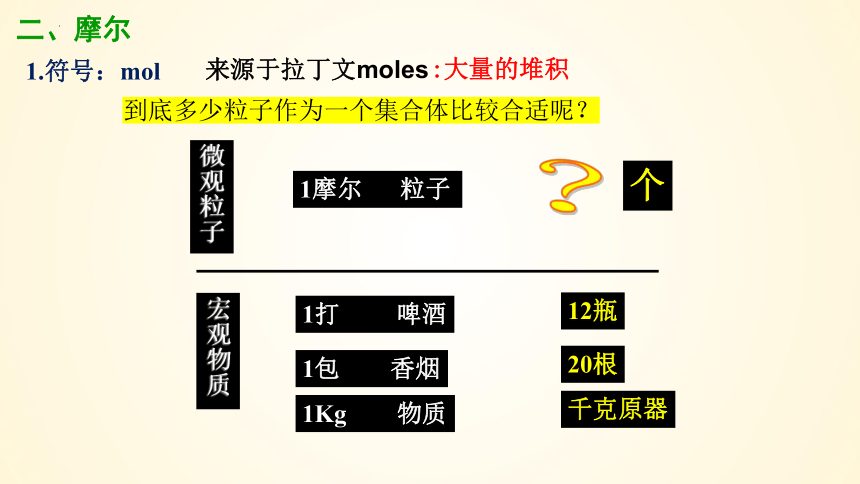
1.符号:mol
1打 啤酒
12瓶
1包 香烟
20根
宏观物质
二、摩尔
微观粒子
1摩尔 粒子
个
?
来源于拉丁文moles
:大量的堆积
到底多少粒子作为一个集合体比较合适呢?
1Kg 物质
千克原器
2.摩尔的标准:
以0.012kg 12C中所含的碳原子数为标准
12C
——含6个质子、6个中子的碳原子
12C与相对原子/分子质量有关
一个原子的真实质量
1
12
一个12C原子质量
×
相对原子质量
1mol任何粒子所含的粒子数
即,
=
0.012kg 12C中所含的碳原子数
指同一粒子
(例如:1molH2O所含的H2O分子数)
1.符号:mol
二、摩尔
来源于拉丁文moles
:大量的堆积
?
0.012kg 12C
碳原子
已知:一个碳原子的质量为 1.993 × 10-23g
求: 0.012kg 12C 中所含的碳原子数?
【思考】
解:
≈ 6.02×1023
12g
1.993 × 10-23g
碳原子数=
国际上规定:
1mol任何粒子所含的粒子数
0.012kg 12C中所含的碳原子数
1mol任何粒子的粒子数
0.012Kg12C 所含的碳原子数
小 结
【指明】0.012Kg12C 所含的碳原子数是一个客观存在且十分精确的数值,但目前还没测得其真实的数据,不同的方法测得的数据略有不同,但均接近6.02×1023
约为6.02×1023
阿伏加德罗常数
意大利物理学家
其数值约为 ,单位为 。
6.02×1023
mol-1
三. 阿伏加德罗常数
1)含义:
例如: 1molH2O所含有的H2O数为阿伏加德罗常数(NA)个
2)数值:
1mol任何粒子所含有的粒子数。
即:
NA
≈
6.02×1023 mol-1
说明:
NA有一个真实的值,现阶段常取6.02×1023 mol-1作为计算。
有如: 与 3.14的区别
NA
6.02×1023
与
科学上规定
(符号:NA)
[指出]当进行有关概念表述时,用阿伏加德罗常数表示粒子个数,
当进行计算时,可用6.02×1023 mol-1代入计算。
例如:1molO2中含有 个O2,约为 个O2
NA
6.02×1023
2molO2中含有 个O2,约为 个O2
2NA
1.204×1024
1、喜欢下国际象棋的同学可能听说过舍罕王重赏国际象棋发现者达依尔的故事:
“陛下,请您在这张棋盘的第一个小格内,赏给我一粒麦粒;在第二个小格内给两粒;第三格内给四粒,照这样下去,后一小格都比前一小格加一倍,然后把摆在棋盘上所有64格的麦粒都赏给您的仆人吧!”
感受阿伏加德罗常数
6.02×1023 mol-1
麦粒的总数= 1 + 2 + 4 + 8 + … + 263
= 264 – 1
=1.845 × 1019
这竟是全世界在2000年内所生产的全部小麦!
3.如果把 6.02×1023 粒米给全球70亿人吃,
每人每天吃一斤,要吃12万年。
2、如果把6.02×1023个直径为2.5cm的硬币排成一行,
可以来回于地球与太阳之间240.8亿次
感受阿伏加德罗常数
6.02×1023 mol-1
1mol任何粒子的粒子数
0.012Kg12C中所含原子数
阿伏加德罗常数
6.02 × 1023
约为
约为
约为
‖
‖
=
不能认为1 mol粒子 = 6.02 × 1023 个
也不能认为6.02×1023就是阿伏加德罗常数
【归纳总结】
3×NA个H
3mol H
议一议
物质的量(n)、阿伏加德罗常数(NA)、微粒数(N )之间的关系
n(物质的量)
N(粒子总数)
1mol H
NA个H
2mol H
N = n×NA
规律:
2×NA个H
……
n×NA个H
……
n mol H
物质的量(n)、阿伏加德罗常数(NA)、微粒数(N )
N(X)
n(X)
NA
=
N(X)
NA
n(X)
=
规律: 任何粒子的物质的量与其粒子数成正比
或者:
X粒子的物质的量
X粒子的粒子数
NA
≈
6.02×1023 mol-1
换算关系
[或者说] 物质的量之比等于其粒子数之比
N(X)
N(Y)
n(X)
n(Y)
1、1.204×1024个H2O 的物质的量是多少?
N(H2O )
NA
n(H2O )
=
解: H2O 的物质的量为
1.204×1024
6.02 ×1023mol-1
=
=
2 mol
答:H2O的物质的量为2 mol。
2:在0.5mol O2中含有的氧分子(O2)数目是多少?
解:O2的分子数为
N(O2)= n(O2) × NA
= 0.5 mol× 6.02 ×1023mol-1
= 3.01 × 1023
答:O2的分子数为3.01 × 1023个。
3:在0.5mol O2中含有的氧原子(O)数目是多少?
解:O2的氧原子数为
N(O)
=0.5 mol×2× 6.02 ×1023mol-1
= 6.02 × 1023
答:O2的氧原子数为6.02 × 1023个。
= n(O) × NA
= n(O2)×2 × NA
1个水分子中有2个氢原子和1个氧原子
2NA
NA
NA
1mol
n1︰n2 = N1︰N2
2mol
1mol
同一物质中,不同粒子的物质的量之比等于其粒子数之比
1 2 1
粒子数之比:
物质的量之比:
扩大NA倍
: :
: :
H2O —— 2 H —— O
规律:
一
微观: 1个碳原子 1个氧分子 1个二氧化碳分子
C + O2 CO2
点燃
6.02×1023个 6.02×1023个 6.02×1023个
1摩尔 1摩尔 1摩尔
物质的量:
二
扩大NA倍
规律:化学方程式中,各物质的化学计量数之比等于各物质的物质的量之比
系数
1)1molC中约含有 个碳原子
2) 0.3 mol H2SO4约含有 个硫酸分子
3)1molNa2CO3中约含有___molNa+、____molCO32-离子,共含有离子的个数为______________个。
6.02 × 1023
0.3× 6.02 × 1023
2
1
3×6.02×1023
3 NA
0.3NA
4) 0.1molNH4+中含有 个N,
含有 mol H,含有 个H
含有 个电子。
0.1NA
0.4
0.4NA
NA
6.02 × 1022
2.408 × 1023
知识链接
1.原子结构知识:
2. 注意描述的微粒和所求微粒之间的数量关系。
如:Al2(SO4)3~2Al3+~3SO42-
1 2 3
1
如:H2O~2H~O~原子~质子~电子~中子
2
1
3
10
10
8
质子数 电子数 中子数
H2O
NH3
Na+
F-
OH-
10 10 8
10 10 7
11 10 12
11 10 7
9 10 10
9 10 8
30 32 30
微粒间的数量关系
判断下列说法是否正确 。
1mol小麦约含有6.02×1023个麦粒 。( )
0.5molH2约含有3.01×1023 个氢原子。( )
3molNH3 中含有3molN原子,9molH原子。( )
×
×
√
2.1molCO2分子中有 molC, molO,共有 mol原子.
3.0.3 mol H2SO4含有 个硫酸分子, molO,
molS molH
4.1mol CO2与 molO2所含原子数相等。
1
2
1.5
1.806×1023
1.2
0.3
0.6
3
则1mol12C的质量是 克?
你能推算出1molO原子的质量吗?
1.已知:0.012kg 12C中所含的碳原子数为1mol,
12
一个原子的真实质量
1
12
一个12C原子质量
×
相对原子质量
2.已知:
=
推算:
(扩大NA倍)
=
=
16g
换成1mol S 呢
1mol Fe
1mol H2O
32g
56g
18g
1个O原子的质量
Ar
Ar(O)
1
12
一个12C原子质量
×
×
1molO原子的质量
Ar(O)
1
12
1mol12C原子质量
×
×
16
1
12
12 g
×
×
=
1mol Na+
23g
16g
【思考与交流】
18克水
27克铝
6.02×1023个水分子
1mol
6.02×1023个铝原子
1mol
课 本 P50
图2-19
1mol几种物质的质量
课 本 P51
归纳总结:分析以上推算结果及图示,可得出什么规律?
①1mol任何原子的质量(以g为单位)在数值上等于这种原子的相对原子质量。
②1mol任何分子的质量(以g为单位)在数值上等于这种分子的相对分子质量。
③1mol任何离子的质量(以g为单位)在数值上等于这种离子的式量。
结论:1mol任何粒子或物质的质量,当以g为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
摩尔质量
四.摩尔质量
①定义:单位物质的量的物质所具有的质量叫做该物质的摩尔质量
(符号:M )
②单位:g·mol-1或Kg/mol
③数值: 以g/mol为单位,数值上等于该物质的相对原子(分子)质量
(即1mol)
1molO质量是16克,则氧原子的摩尔质量为
即,M(O)=16g/mol
1molH2O质量是18克,则水分子的摩尔质量为
即,M(H2O)=18g/mol
M(H)=
1g/mol
M(H+)=
1g/mol
M(SO42-)=
96g/mol
16g/mol
18g/mol
Kg或g
→O2的相对分子质量是( )
→1mol O2的质量是( )
→O2的摩尔质量是( )
→Mg的相对原子质量是( )
→1mol Mg 的质量是( )
→2molMg的摩尔质量是( )
32 g
24 g/mol
24 g
32
32 g/mol
24
注意单位
!
1
2
1.下列说法错误的是( )
A.0.5molNaCl的摩尔质量是58.5 g/mol
B.1 mol OH-的质量是17 g/mol
C.1 molN的质量是14 g
D.1 molCO2的摩尔质量是44 g
BD
2.下列物质中,摩尔质量最大的是( )
A.10 mL H2O B.0.8 mol H2SO4
C.54 g Al D.1 g CaCO3
D
18 g/mol
98 g/mol
27g/mol
100 g/mol
g
g/mol
议一议
物质的量(n)、物质的质量(m)、摩尔质量(M )之间的关系
1mol O的质量为16g
2mol O的质量为 g
2mol×16g/mol=32g
32
3mol O的质量为 g
3mol×16g/mol=48g
48
n mol O的质量为 g
n mol×16g/mol=16n g
16n
换算公式 :
m
或 n =
M =
= n×M
m
M
m
n
(1)0.1molOH-的质量是 克?
(2)24.5g H2SO4的物质的量是 mol?
(3) 71g Na2SO4中含有Na+和SO42-的物质的量各是多少?
0.25
1mol
0.5mol
1.7
0.5molO2的质量是 克?
16
2 molH2O的质量是 克?
36
m
= n×M
5.4g H2O的物质的量是 mol?
0.3
88g CO2的物质的量是 mol?
2
n =
m
M
0.5mol
练一练
(4) 0.02摩尔某物质A,其质量为2.12克,
则A的相对质量为 ,摩尔质量为 。
106
106g/mol
M =
n
m
练一练
两个换算关系:
1.物质的量(n)、阿伏加德罗常数(NA)、微粒数(N )
N(X)
NA
n(X)
=
2.物质的量(n)、物质的质量(m)、摩尔质量(M )
n(X) =
m(X)
M (X)
规律: 任何粒子的物质的量与其粒子数成正比
规律: 对于具体的某一物质,物质的量与其质量成正比
(1) 49g H2SO4中含有多少个H2SO4分子?
分析:
已知:
m(H2SO4)
求算:
N(H2SO4)
找“物质的量”做中介
宏观
微观
解:
n(H2SO4) =
m(H2SO4)
M (H2SO4)
=
49g
98g· mol-1
0.5mol
=
N(H2SO4)
= n(H2SO4) × NA
=0.5mol×6.02 ×1023mol-1
= 3.01× 1023
答: 49g H2SO4中含有3.01× 1023个H2SO4分子?
(2)含有约1.204× 1023个H2O分子的质量是多少?
已知:
N(H2O)
求算:
m(H2O)
找“物质的量”做中介
解:
n(H2O) =
N(H2O)
NA
=
1.204×1023
6.02 ×1023mol-1
0.2mol
=
m(H2O)
= n(H2O) × M (H2O)
=0.2mol × 18g·mol-1
= 3.6g
答:含有约1.204× 1023个H2O分子的质量是3.6g 。
粒子数N
物质的量n
质量m
÷NA
×M
×NA
÷M
联系微观和宏观物质的桥梁
物质的量是联系宏观和微观的桥梁。
归纳总结:
化学计算的中心思想:
“见量化摩,求啥先求摩”
n (X)
微观粒子
可称量
宏观物质
N(X)
NA
=
m(X)
M (X)
=
1.正误判断,正确的划“√”,错误的划“×”
(1)1 mol NaCl和1 mol HCl含有相同的粒子数目 ( )
(2)1 mol任何物质都含有6.02×1023个分子 ( )
(3)1 mol水中含有2 mol氢和1 mol氧 ( )
(4)NaOH的摩尔质量为40 g ( )
(5)1 molO2的质量与它的相对分子质量相等 ( )
×
×
×
×
×
NaCl组成微粒是Na+和Cl-,而HCl组成微粒是HCl分子。
解析:有的物质不是由分子构成,如NaCl
解析:1mol水分子中含有2mol氢原子和1mol氧原子
g·mol-1
数值上相等,意义不同
32 g
32
(6)1 mol OH-的质量为17 g·mol-1( )
(7)氖气的摩尔质量(单位g·mol-1)在数值上等于它的相对原子质量
(8)2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍( )
(9)1 mol H3PO4与1 mol H2SO4的质量相同( )
×
√
×
g
解析: 氖为单原子分子
解析: 物质的摩尔质量与物质的多少无关。
√
均为98g
2、在NaCl、MgCl2、MgSO4三种盐配制的混合液中,Na+为0.1 mol,Mg2+为0.25 mol, Cl-为0.2 mol,则SO42-( )
A、0.5 mol B、0.15 mol
C、0.25 mol D、0.2 mol
“电荷守恒”
D
3.某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
①该氯原子的相对原子质量为
②m g该氯原子的物质的量为 mol
③该氯原子的摩尔质量是aNA g
④a g该氯原子所含的电子数为17 mol
A.①③ B.②④ C.①② D.②③
C
√
×
√
×
17个
g·mol-1
M = m(物质) / n
M = m(一个粒子的质量)× NA
总结归纳:有关摩尔质量的计算方法:
①
②
4、45gKCl中所含的Cl-数与 克CaCl2中所含的Cl-个数相等?
5.55
5、质量相等的SO2与SO3,物质的量之比为 ,其中所含S原子个数比为 ,O原子个数比为 。
5:4
5:4
5:6
6、① 4.4g CO2 ② 约含1.204× 1023个H2O分子
③ 12.8g O2 ④ 4.9g H2SO4
这4种物质分子数由多到少顺序为
这4种物质原子数由多到少顺序为
③②①④
③②④①
8、一定条件下,16gA和22gB恰好反应生成C和4.5gD,在相同条件下8gA和15gB反应可生成D和0.125molC,则C的式量是多少?
7、含有1.5×1022个分子的物质,其质量为0.7g,求该物质的相对分子质量。
28
0.025mol
134
(式量:相对分子质量)
9.已知0.4 mol的CO和CO2的混合气体共14.4 g,则
②混合气体的平均摩尔质量为 。
①CO的质量为 ;
解:设混合气体中CO的物质的量为x mol,CO2的物质的量为y mol
28 x +44 y =14.4
x +y =0.4
解得x=0.2,y=0.2
则①m(CO)=0.2 mol×28 g·mol-1=5.6 g
②混合气体的平均摩尔质量为:
14.4g
0.4 mol
=36 g·mol-1
M
m(总质量)
n(总物质的量)
=
=
5.6 g
36 g·mol-1
平均摩尔质量
:单位物质的量的混合物所具有的质量
(或1mol混合物所具有的质量)
新
教
材
第二章
物质的量
第三节
第1课时 物质的量 摩尔质量
【学习目标】
1.理解阿伏加德罗常数概念建立的依据。
2.了解物质的量及其单位---摩尔。
3.了解阿伏加德罗常数,并能运用NA进行计算。
4.了解摩尔质量的含义。
5.能够进行物质的量、微粒数、摩尔质量之间的换算。
谁能介绍几种生活中相似的例子
古时有一个勇敢的小伙子想娶国王美丽的公主,国王出题刁难,
其中一个问题是:10kg小米是多少粒?同学们你们能不能帮帮他?
对于微小物质,扩大倍数形成一定量,更方便计量
称一两小米,数其数目,再推算
数50或100粒小米,称其质量,再推算
生活经验告诉我们:
买材料纸:500张/刀
买啤酒:12瓶/箱 ……
买火柴:一盒一盒买
问题:化学是研究分子、原子、离子等微观粒子的科学,如果想知道一杯水中含有多少个H2O分子,让你数,能数得清吗?
不能
事实:
据推算,10亿人去数一滴水中的H2O分子,
每人每分钟数100个,日夜不停,需3万多年
怎么办?
一杯水
H2O分子
宏观物质
微观粒子
物质的量
肉眼看不见,难以计量
可称量、可量取的物质
?
国际上,为了研究一定数目的微观粒子集体,提出了一个新的物理量——物质的量!
单个水分子无法计量,但将一定数目的水分子聚集到一起就变成可计量的宏观量了
物理量 单位名称 单位符号
长度 L 米 m
质量 m 千克 Kg
时间 t 秒 s
电流 I 安培 A
热力学温度T 开尔文 K
发光强度 坎德拉 cd
物质的量n
摩尔
mol
课本P50
资料卡片
③“物质的量” 是物理量,专用名词,不可拆分,更不可理解为物质的质量或物质的数量等
1.含义:表示含有一定数目粒子集体的物理量。
{
分子、原子、离子、原子团、质子、中子、电子等
一、物质的量
①适用于微观粒子:
⑤“物质的量”的单位: 摩尔 简称摩
(符号为 mol )
②描述的对象:
微观粒子的集合体
④“物质的量”的符号:
n
n(H)
:表示氢原子的物质的量
n(H2)
:表示氢分子的物质的量
n(H+)呢?
n(H2O)
n(Fe)
类比:
质量:符号m,单位:Kg
m(Fe) = 28 Kg
:表示Fe的质量为28千克
n(Fe) = 1 mol
:表示Fe原子的物质的量为1 mol
n(H+) = 2 mol
:表示氢离子的物质的量为2 mol
n(H2O) = 0.5 mol
:表示水分子的物质的量为0.5 mol
2.符号:n,单位:mol
一、物质的量
1.含义:表示含有一定数目粒子集体的物理量。
判断正误,并说明理由。
1)摩尔是国际七个基本物理量之一。
物质的量是一个基本物理量,而摩尔是它的单位
×
2)摩尔是物质的质量单位。
摩尔是物质的量的单位
×
3) 1mol芝麻
×
物质的量仅适用于微观粒子,对宏观物质毫无意义
4)3mol氢
没有指明是氢分子、氢原子或氢离子等
×
必须指明粒子的种类,如原子、分子、离子等。
5)2.6 molCO2
常用化学符号表示组成物质的微观粒子
应用“物质的量”时应注意的问题
(4)物质的量的规范表示方法:
(1)“物质的量”是一个整体,不可拆开。
(2)物质的量仅用于计量微观粒子,不适用于宏观物质。
(3)使用物质的量时一般用化学式表示,若用中文,则必须指明微粒的种类。
(5)物质的量的数值可以是整数,也可以是小数。
如:3molH、1.5molCO2 、 1mol钠离子或1molNa+等。
1.符号:mol
1打 啤酒
12瓶
1包 香烟
20根
宏观物质
二、摩尔
微观粒子
1摩尔 粒子
个
?
来源于拉丁文moles
:大量的堆积
到底多少粒子作为一个集合体比较合适呢?
1Kg 物质
千克原器
2.摩尔的标准:
以0.012kg 12C中所含的碳原子数为标准
12C
——含6个质子、6个中子的碳原子
12C与相对原子/分子质量有关
一个原子的真实质量
1
12
一个12C原子质量
×
相对原子质量
1mol任何粒子所含的粒子数
即,
=
0.012kg 12C中所含的碳原子数
指同一粒子
(例如:1molH2O所含的H2O分子数)
1.符号:mol
二、摩尔
来源于拉丁文moles
:大量的堆积
?
0.012kg 12C
碳原子
已知:一个碳原子的质量为 1.993 × 10-23g
求: 0.012kg 12C 中所含的碳原子数?
【思考】
解:
≈ 6.02×1023
12g
1.993 × 10-23g
碳原子数=
国际上规定:
1mol任何粒子所含的粒子数
0.012kg 12C中所含的碳原子数
1mol任何粒子的粒子数
0.012Kg12C 所含的碳原子数
小 结
【指明】0.012Kg12C 所含的碳原子数是一个客观存在且十分精确的数值,但目前还没测得其真实的数据,不同的方法测得的数据略有不同,但均接近6.02×1023
约为6.02×1023
阿伏加德罗常数
意大利物理学家
其数值约为 ,单位为 。
6.02×1023
mol-1
三. 阿伏加德罗常数
1)含义:
例如: 1molH2O所含有的H2O数为阿伏加德罗常数(NA)个
2)数值:
1mol任何粒子所含有的粒子数。
即:
NA
≈
6.02×1023 mol-1
说明:
NA有一个真实的值,现阶段常取6.02×1023 mol-1作为计算。
有如: 与 3.14的区别
NA
6.02×1023
与
科学上规定
(符号:NA)
[指出]当进行有关概念表述时,用阿伏加德罗常数表示粒子个数,
当进行计算时,可用6.02×1023 mol-1代入计算。
例如:1molO2中含有 个O2,约为 个O2
NA
6.02×1023
2molO2中含有 个O2,约为 个O2
2NA
1.204×1024
1、喜欢下国际象棋的同学可能听说过舍罕王重赏国际象棋发现者达依尔的故事:
“陛下,请您在这张棋盘的第一个小格内,赏给我一粒麦粒;在第二个小格内给两粒;第三格内给四粒,照这样下去,后一小格都比前一小格加一倍,然后把摆在棋盘上所有64格的麦粒都赏给您的仆人吧!”
感受阿伏加德罗常数
6.02×1023 mol-1
麦粒的总数= 1 + 2 + 4 + 8 + … + 263
= 264 – 1
=1.845 × 1019
这竟是全世界在2000年内所生产的全部小麦!
3.如果把 6.02×1023 粒米给全球70亿人吃,
每人每天吃一斤,要吃12万年。
2、如果把6.02×1023个直径为2.5cm的硬币排成一行,
可以来回于地球与太阳之间240.8亿次
感受阿伏加德罗常数
6.02×1023 mol-1
1mol任何粒子的粒子数
0.012Kg12C中所含原子数
阿伏加德罗常数
6.02 × 1023
约为
约为
约为
‖
‖
=
不能认为1 mol粒子 = 6.02 × 1023 个
也不能认为6.02×1023就是阿伏加德罗常数
【归纳总结】
3×NA个H
3mol H
议一议
物质的量(n)、阿伏加德罗常数(NA)、微粒数(N )之间的关系
n(物质的量)
N(粒子总数)
1mol H
NA个H
2mol H
N = n×NA
规律:
2×NA个H
……
n×NA个H
……
n mol H
物质的量(n)、阿伏加德罗常数(NA)、微粒数(N )
N(X)
n(X)
NA
=
N(X)
NA
n(X)
=
规律: 任何粒子的物质的量与其粒子数成正比
或者:
X粒子的物质的量
X粒子的粒子数
NA
≈
6.02×1023 mol-1
换算关系
[或者说] 物质的量之比等于其粒子数之比
N(X)
N(Y)
n(X)
n(Y)
1、1.204×1024个H2O 的物质的量是多少?
N(H2O )
NA
n(H2O )
=
解: H2O 的物质的量为
1.204×1024
6.02 ×1023mol-1
=
=
2 mol
答:H2O的物质的量为2 mol。
2:在0.5mol O2中含有的氧分子(O2)数目是多少?
解:O2的分子数为
N(O2)= n(O2) × NA
= 0.5 mol× 6.02 ×1023mol-1
= 3.01 × 1023
答:O2的分子数为3.01 × 1023个。
3:在0.5mol O2中含有的氧原子(O)数目是多少?
解:O2的氧原子数为
N(O)
=0.5 mol×2× 6.02 ×1023mol-1
= 6.02 × 1023
答:O2的氧原子数为6.02 × 1023个。
= n(O) × NA
= n(O2)×2 × NA
1个水分子中有2个氢原子和1个氧原子
2NA
NA
NA
1mol
n1︰n2 = N1︰N2
2mol
1mol
同一物质中,不同粒子的物质的量之比等于其粒子数之比
1 2 1
粒子数之比:
物质的量之比:
扩大NA倍
: :
: :
H2O —— 2 H —— O
规律:
一
微观: 1个碳原子 1个氧分子 1个二氧化碳分子
C + O2 CO2
点燃
6.02×1023个 6.02×1023个 6.02×1023个
1摩尔 1摩尔 1摩尔
物质的量:
二
扩大NA倍
规律:化学方程式中,各物质的化学计量数之比等于各物质的物质的量之比
系数
1)1molC中约含有 个碳原子
2) 0.3 mol H2SO4约含有 个硫酸分子
3)1molNa2CO3中约含有___molNa+、____molCO32-离子,共含有离子的个数为______________个。
6.02 × 1023
0.3× 6.02 × 1023
2
1
3×6.02×1023
3 NA
0.3NA
4) 0.1molNH4+中含有 个N,
含有 mol H,含有 个H
含有 个电子。
0.1NA
0.4
0.4NA
NA
6.02 × 1022
2.408 × 1023
知识链接
1.原子结构知识:
2. 注意描述的微粒和所求微粒之间的数量关系。
如:Al2(SO4)3~2Al3+~3SO42-
1 2 3
1
如:H2O~2H~O~原子~质子~电子~中子
2
1
3
10
10
8
质子数 电子数 中子数
H2O
NH3
Na+
F-
OH-
10 10 8
10 10 7
11 10 12
11 10 7
9 10 10
9 10 8
30 32 30
微粒间的数量关系
判断下列说法是否正确 。
1mol小麦约含有6.02×1023个麦粒 。( )
0.5molH2约含有3.01×1023 个氢原子。( )
3molNH3 中含有3molN原子,9molH原子。( )
×
×
√
2.1molCO2分子中有 molC, molO,共有 mol原子.
3.0.3 mol H2SO4含有 个硫酸分子, molO,
molS molH
4.1mol CO2与 molO2所含原子数相等。
1
2
1.5
1.806×1023
1.2
0.3
0.6
3
则1mol12C的质量是 克?
你能推算出1molO原子的质量吗?
1.已知:0.012kg 12C中所含的碳原子数为1mol,
12
一个原子的真实质量
1
12
一个12C原子质量
×
相对原子质量
2.已知:
=
推算:
(扩大NA倍)
=
=
16g
换成1mol S 呢
1mol Fe
1mol H2O
32g
56g
18g
1个O原子的质量
Ar
Ar(O)
1
12
一个12C原子质量
×
×
1molO原子的质量
Ar(O)
1
12
1mol12C原子质量
×
×
16
1
12
12 g
×
×
=
1mol Na+
23g
16g
【思考与交流】
18克水
27克铝
6.02×1023个水分子
1mol
6.02×1023个铝原子
1mol
课 本 P50
图2-19
1mol几种物质的质量
课 本 P51
归纳总结:分析以上推算结果及图示,可得出什么规律?
①1mol任何原子的质量(以g为单位)在数值上等于这种原子的相对原子质量。
②1mol任何分子的质量(以g为单位)在数值上等于这种分子的相对分子质量。
③1mol任何离子的质量(以g为单位)在数值上等于这种离子的式量。
结论:1mol任何粒子或物质的质量,当以g为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
摩尔质量
四.摩尔质量
①定义:单位物质的量的物质所具有的质量叫做该物质的摩尔质量
(符号:M )
②单位:g·mol-1或Kg/mol
③数值: 以g/mol为单位,数值上等于该物质的相对原子(分子)质量
(即1mol)
1molO质量是16克,则氧原子的摩尔质量为
即,M(O)=16g/mol
1molH2O质量是18克,则水分子的摩尔质量为
即,M(H2O)=18g/mol
M(H)=
1g/mol
M(H+)=
1g/mol
M(SO42-)=
96g/mol
16g/mol
18g/mol
Kg或g
→O2的相对分子质量是( )
→1mol O2的质量是( )
→O2的摩尔质量是( )
→Mg的相对原子质量是( )
→1mol Mg 的质量是( )
→2molMg的摩尔质量是( )
32 g
24 g/mol
24 g
32
32 g/mol
24
注意单位
!
1
2
1.下列说法错误的是( )
A.0.5molNaCl的摩尔质量是58.5 g/mol
B.1 mol OH-的质量是17 g/mol
C.1 molN的质量是14 g
D.1 molCO2的摩尔质量是44 g
BD
2.下列物质中,摩尔质量最大的是( )
A.10 mL H2O B.0.8 mol H2SO4
C.54 g Al D.1 g CaCO3
D
18 g/mol
98 g/mol
27g/mol
100 g/mol
g
g/mol
议一议
物质的量(n)、物质的质量(m)、摩尔质量(M )之间的关系
1mol O的质量为16g
2mol O的质量为 g
2mol×16g/mol=32g
32
3mol O的质量为 g
3mol×16g/mol=48g
48
n mol O的质量为 g
n mol×16g/mol=16n g
16n
换算公式 :
m
或 n =
M =
= n×M
m
M
m
n
(1)0.1molOH-的质量是 克?
(2)24.5g H2SO4的物质的量是 mol?
(3) 71g Na2SO4中含有Na+和SO42-的物质的量各是多少?
0.25
1mol
0.5mol
1.7
0.5molO2的质量是 克?
16
2 molH2O的质量是 克?
36
m
= n×M
5.4g H2O的物质的量是 mol?
0.3
88g CO2的物质的量是 mol?
2
n =
m
M
0.5mol
练一练
(4) 0.02摩尔某物质A,其质量为2.12克,
则A的相对质量为 ,摩尔质量为 。
106
106g/mol
M =
n
m
练一练
两个换算关系:
1.物质的量(n)、阿伏加德罗常数(NA)、微粒数(N )
N(X)
NA
n(X)
=
2.物质的量(n)、物质的质量(m)、摩尔质量(M )
n(X) =
m(X)
M (X)
规律: 任何粒子的物质的量与其粒子数成正比
规律: 对于具体的某一物质,物质的量与其质量成正比
(1) 49g H2SO4中含有多少个H2SO4分子?
分析:
已知:
m(H2SO4)
求算:
N(H2SO4)
找“物质的量”做中介
宏观
微观
解:
n(H2SO4) =
m(H2SO4)
M (H2SO4)
=
49g
98g· mol-1
0.5mol
=
N(H2SO4)
= n(H2SO4) × NA
=0.5mol×6.02 ×1023mol-1
= 3.01× 1023
答: 49g H2SO4中含有3.01× 1023个H2SO4分子?
(2)含有约1.204× 1023个H2O分子的质量是多少?
已知:
N(H2O)
求算:
m(H2O)
找“物质的量”做中介
解:
n(H2O) =
N(H2O)
NA
=
1.204×1023
6.02 ×1023mol-1
0.2mol
=
m(H2O)
= n(H2O) × M (H2O)
=0.2mol × 18g·mol-1
= 3.6g
答:含有约1.204× 1023个H2O分子的质量是3.6g 。
粒子数N
物质的量n
质量m
÷NA
×M
×NA
÷M
联系微观和宏观物质的桥梁
物质的量是联系宏观和微观的桥梁。
归纳总结:
化学计算的中心思想:
“见量化摩,求啥先求摩”
n (X)
微观粒子
可称量
宏观物质
N(X)
NA
=
m(X)
M (X)
=
1.正误判断,正确的划“√”,错误的划“×”
(1)1 mol NaCl和1 mol HCl含有相同的粒子数目 ( )
(2)1 mol任何物质都含有6.02×1023个分子 ( )
(3)1 mol水中含有2 mol氢和1 mol氧 ( )
(4)NaOH的摩尔质量为40 g ( )
(5)1 molO2的质量与它的相对分子质量相等 ( )
×
×
×
×
×
NaCl组成微粒是Na+和Cl-,而HCl组成微粒是HCl分子。
解析:有的物质不是由分子构成,如NaCl
解析:1mol水分子中含有2mol氢原子和1mol氧原子
g·mol-1
数值上相等,意义不同
32 g
32
(6)1 mol OH-的质量为17 g·mol-1( )
(7)氖气的摩尔质量(单位g·mol-1)在数值上等于它的相对原子质量
(8)2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍( )
(9)1 mol H3PO4与1 mol H2SO4的质量相同( )
×
√
×
g
解析: 氖为单原子分子
解析: 物质的摩尔质量与物质的多少无关。
√
均为98g
2、在NaCl、MgCl2、MgSO4三种盐配制的混合液中,Na+为0.1 mol,Mg2+为0.25 mol, Cl-为0.2 mol,则SO42-( )
A、0.5 mol B、0.15 mol
C、0.25 mol D、0.2 mol
“电荷守恒”
D
3.某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
①该氯原子的相对原子质量为
②m g该氯原子的物质的量为 mol
③该氯原子的摩尔质量是aNA g
④a g该氯原子所含的电子数为17 mol
A.①③ B.②④ C.①② D.②③
C
√
×
√
×
17个
g·mol-1
M = m(物质) / n
M = m(一个粒子的质量)× NA
总结归纳:有关摩尔质量的计算方法:
①
②
4、45gKCl中所含的Cl-数与 克CaCl2中所含的Cl-个数相等?
5.55
5、质量相等的SO2与SO3,物质的量之比为 ,其中所含S原子个数比为 ,O原子个数比为 。
5:4
5:4
5:6
6、① 4.4g CO2 ② 约含1.204× 1023个H2O分子
③ 12.8g O2 ④ 4.9g H2SO4
这4种物质分子数由多到少顺序为
这4种物质原子数由多到少顺序为
③②①④
③②④①
8、一定条件下,16gA和22gB恰好反应生成C和4.5gD,在相同条件下8gA和15gB反应可生成D和0.125molC,则C的式量是多少?
7、含有1.5×1022个分子的物质,其质量为0.7g,求该物质的相对分子质量。
28
0.025mol
134
(式量:相对分子质量)
9.已知0.4 mol的CO和CO2的混合气体共14.4 g,则
②混合气体的平均摩尔质量为 。
①CO的质量为 ;
解:设混合气体中CO的物质的量为x mol,CO2的物质的量为y mol
28 x +44 y =14.4
x +y =0.4
解得x=0.2,y=0.2
则①m(CO)=0.2 mol×28 g·mol-1=5.6 g
②混合气体的平均摩尔质量为:
14.4g
0.4 mol
=36 g·mol-1
M
m(总质量)
n(总物质的量)
=
=
5.6 g
36 g·mol-1
平均摩尔质量
:单位物质的量的混合物所具有的质量
(或1mol混合物所具有的质量)
