2.2.2化学平衡常数 课件(共20张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2.2化学平衡常数 课件(共20张ppt)化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-03 23:59:52 | ||
图片预览






文档简介
(共20张PPT)
第二章 化学反应速率与化学平衡
第2课时 化学平衡常数
第二节 化学平衡
CHEMICAL REACTION RATE AND CHEMICAL EQUILIBRIUM
第二章
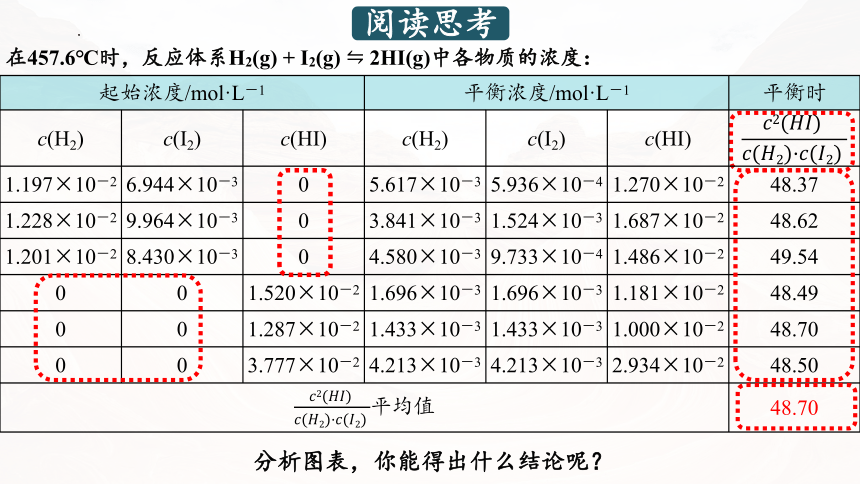
阅读思考
分析图表,你能得出什么结论呢?
起始浓度/mol·L-1 平衡浓度/mol·L-1 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI)
1.197×10-2 6.944×10-3 0 5.617×10-3 5.936×10-4 1.270×10-2 48.37
1.228×10-2 9.964×10-3 0 3.841×10-3 1.524×10-3 1.687×10-2 48.62
1.201×10-2 8.430×10-3 0 4.580×10-3 9.733×10-4 1.486×10-2 49.54
0 0 1.520×10-2 1.696×10-3 1.696×10-3 1.181×10-2 48.49
0 0 1.287×10-2 1.433×10-3 1.433×10-3 1.000×10-2 48.70
0 0 3.777×10-2 4.213×10-3 4.213×10-3 2.934×10-2 48.50
平均值 48.70
在457.6℃时,反应体系H2(g) + I2(g) 2HI(g)中各物质的浓度:
结论
结论2:与反应物的起始浓度大小无关。
结论1: 为常数。
c2(HI)
c(H2) · c(I2)
H2(g) + I2(g) 2HI(g)
化学平衡常数
结论3:与正向建立还是逆向建立平衡无关,即与平衡建立的过程无关。
一、化学平衡常数概念及表达式
概念
在一定温度下,当一个可逆反应达到化学平衡时,体系内生成物浓度幂(以其化学计量数为幂)之积与反应物浓度幂之积的比值是一个常数,叫做该反应的化学平衡常数(简称平衡常数),用符号K表示。
表达式
K
=
生成物浓度幂之积
反应物浓度幂之积
=
cp(C)·cq(D)
cm(A)·cn(B)
m A(g) + n B(g) p C(g) + q D(g)
其中c为各组分的平衡时浓度
固体或液体纯物质
不列入平衡常数表达式中
典例精讲
反应01
反应02
反应03
反应04
【例1】写出下列可逆反应的平衡常数表达式。
N2(g) + 3H2(g) 2NH3(g)
2NH3(g) N2(g) + 3H2(g)
N2(g) + H2(g) NH3(g)
1
2
3
2
Fe3O4(s) + 4H2(g) 3Fe(s) + 4H2O(g)
高温
反应05
C2H5OH+CH3COOH CH3COOC2H5+H2O
一、化学平衡常数概念及表达式
平衡常数与化学方程式的关系
(1)对于同一可逆反应,正反应和逆反应的平衡常数互为倒数;
(2)若化学方程式中各物质的化学计量数都扩大或缩小至原来的n倍,则化学平衡常数变为原来的n次幂或次幂。
(3)若干方程式相加,则总反应的平衡常数等于分步平衡常数之乘积;若干方程式相减,则总反应的平衡常数等于分步平衡常数之商。(多重平衡规则)
① C (s) + H2O (g) CO (g) + H2 (g) K1=
② CO (g) +H2O (g) CO2 (g) + H2 (g) K2=
③ C (s) + CO2(g) 2CO(g) K3=
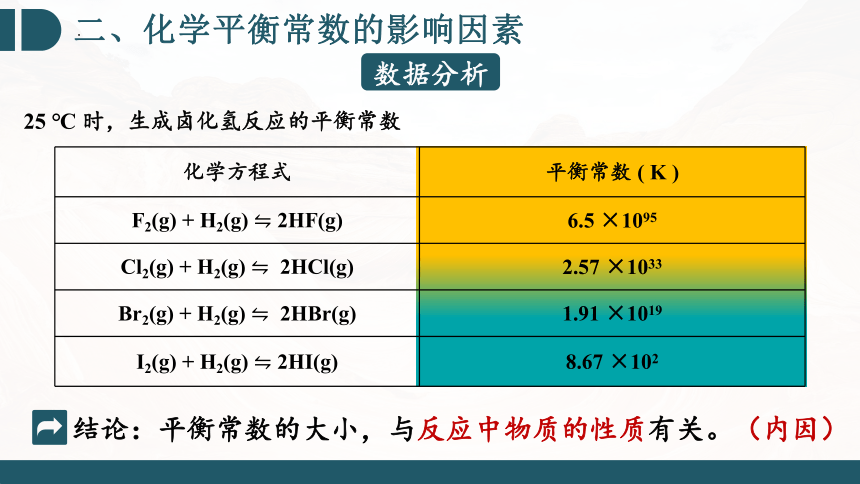
化学方程式 平衡常数 ( K )
F2(g) + H2(g) 2HF(g) 6.5 ×1095
Cl2(g) + H2(g) 2HCl(g) 2.57 ×1033
Br2(g) + H2(g) 2HBr(g) 1.91 ×1019
I2(g) + H2(g) 2HI(g) 8.67 ×102
二、化学平衡常数的影响因素
数据分析
结论:平衡常数的大小,与反应中物质的性质有关。(内因)
25 ℃ 时,生成卤化氢反应的平衡常数
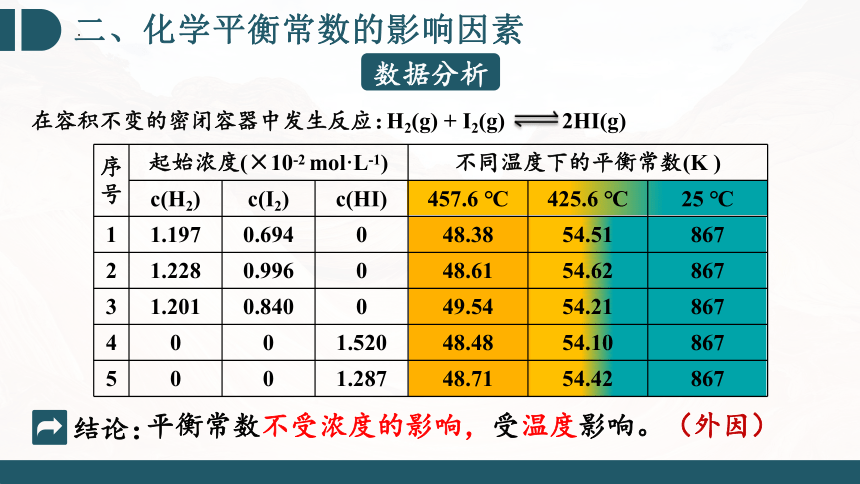
序号 起始浓度(×10-2 mol·L-1) 不同温度下的平衡常数(K ) c(H2) c(I2) c(HI) 457.6 ℃ 425.6 ℃ 25 ℃
1 1.197 0.694 0 48.38 54.51 867
2 1.228 0.996 0 48.61 54.62 867
3 1.201 0.840 0 49.54 54.21 867
4 0 0 1.520 48.48 54.10 867
5 0 0 1.287 48.71 54.42 867
二、化学平衡常数的影响因素
数据分析
H2(g) + I2(g) 2HI(g)
在容积不变的密闭容器中发生反应:
结论:
平衡常数不受浓度的影响,受温度影响。(外因)
二、化学平衡常数的影响因素
数据分析
结论:
平衡常数不受浓度的影响,受温度影响。(外因)
体系压强改变会影响平衡常数吗?
压强改变可能会影响体系中物质的浓度,而浓度的改变不影响平衡常数。因此压强不影响平衡常数的大小。
二、化学平衡常数的影响因素
小结
(1)内因:同一温度下,不同的反应化学平衡常数不同
(2)外因:在化学方程式一定的情况下,K只受温度影响。与压强、起始浓度、起始反方向均无关。
升高温度,吸热反应的平衡常数增大,放热反应的平衡常数减小
降低温度,吸热反应的平衡常数减小,放热反应的平衡常数增大
三、化学平衡常数的意义
化学平衡常数的大小反映了化学反应进行的程度
K值越大,表示反应进行得越完全,平衡时反应物的转化率越大。一般来说,对于同类型的化学反应,K≥105时可认为该反应进行得基本完全了。
K值越小,表示反应进行得越不完全,平衡时反应物的转化率越小。同样地,K ≤10-5则认为这个反应很难进行。
化学平衡常数的大小反映的是反应进行的程度大小,并不涉及反应时间和化学反应速率。也就是说,某个化学反应的平衡常数很大,可能化学反应速率却很小。
四、化学平衡常数的应用
判断可逆反应的进行方向
浓度商
定义:对于一般的可逆反应:mA(g)+nB(g) pC(g)+qD(g), 在任意时刻的 ,称为浓度商,常用Q表示,即 Q= 。
cp(C)·cq(D)
cm(A)·cn(B)
cp(C)·cq(D)
cm(A)·cn(B)
Q<K ,反应向正方向进行
Q=K ,反应处于平衡状态
Q>K ,反应向逆方向进行
指任意时刻的浓度
典例精讲
【例2】高炉炼铁中发生的基本反应如下: FeO(s)+CO(g) Fe(s)+CO2(g) (条件省略)
已知1100℃,K=0.263,某时刻测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1 在这种情况下:
(1)该反应是否处于平衡状态_____(填“是”或“否”);
(2)此时反应会向______进行?(填“正向”或“逆向”);
(3)此时化学反应速率是ν正 _____ν逆(填“大于”、“小于”或“等于”)。
否
正向
大于
四、化学平衡常数的应用
判断可逆反应的热效应
在化学方程式一定的情况下,K只受温度影响。与压强、起始浓度、起始反方向均无关。
若升高温度,K增大,正反应是吸热反应;
若升高温度,K减小,正反应是放热反应。
【例3】不同温度时,反应:H2(g)+I2(g)2HI(g),的平衡常数与温度的关系如表所示,可以判断该可逆反应的正方向是______反应。
温度 623K 698K 763K
平衡常数 66 .9 54.4 45.9
放热
四、化学平衡常数的应用
用“三段式”法计算化学平衡常数与平衡时转化率
mX(g) + nY(g)pZ(g)
始(mol/L)
变(mol/L)
平(mol/L)
c1 c2 c3
mx nx px
c1-mx c2-nx c3-px
K=
α=100%=
已知平衡时各物质或某物质平衡时物质的量浓度,求K;
已知起始浓度C0和平衡常数K,求平衡时物质的浓度或转化率;
已知起始浓度C0和平衡时转化率,求平衡常数K。
典例精讲
【例3】一定温度下,将0.050 mol SO2(g)和0.030 mol O2(g)注入体积为1.0 L的密闭反应器,发生反应2SO2(g)+O2(g) 2SO3(g),达到平衡后,测得SO3的平衡浓度为0.044 mol·L-1。该温度下的平衡常数K为 。
【例4】某温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=0.25,若在此温度下,在10 L的密闭容器中充入0.2 mol HI气体,达到平衡时,HI的分解率为______。
【例5】在830 K时,在密闭容器中发生可逆反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。试回答下列问题:
若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,4 s后达到平衡,此时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____。
80%
1
课堂小结
CLASS SUMMARY
化学平衡常数
化学平衡常数
化学平衡常数的应用
概念及表达式
判断可逆反应进行的方向
意义
影响因素
判断可逆反应热效应
计算
1.某温度下气体反应体系达到化学平衡,平衡常数K= ,下列说法正确的是
A.该反应的化学方程式为2E(g)+F(g) A(g)+2B(g)
B.降低温度,正反应速率增大
C.该温度时,v(F)=v(A)则反应达到平衡状态
D.增大c(A)、c(B),K增大
演练—题组冲关
A
2.对于下列反应,其反应过程的能量变化示意图如下:
演练—题组冲关
编号 反应 平衡常数 反应热
反应① A(g) B(g)+C(g) K1 ΔH1
反应② B(g)+C(g) D(g) K2 ΔH2
反应③ A(g) D(g) K3 ΔH3
下列说法正确的是( )
A.K3=K1+K2
B.ΔH3=ΔH1+ΔH2
C.加催化剂,反应①的反应热降低,反应速率加快
D.增大压强,K1减小,K2增大,K3不变
B
3.五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g) PCl5(g)△H=-93.0kJ/mol。某温度下,在2.0L密闭容器中充入1.0molPCl3和0.5molCl2,一段时间后反应达平衡状态,实验数据如下表所示,下列说法不正确的是
A.0~150s内,PCl3的反应速率为0.0012mol/(L s)
B.反应至250s,该反应放出的热量为37.2kJ
C.该温度下,此反应的化学平衡常数数值为40/3
D.在此温度下,该密闭容器中若初始充入1.0molPCl3、1molCl2、2.0molPCl5,则应向逆反应方向进行
演练—题组冲关
t/s 0 50 150 250 350
n(PCl5)/mol 0 0.21 0.36 0.40 0.40
D
第二章 化学反应速率与化学平衡
第2课时 化学平衡常数
第二节 化学平衡
CHEMICAL REACTION RATE AND CHEMICAL EQUILIBRIUM
第二章
阅读思考
分析图表,你能得出什么结论呢?
起始浓度/mol·L-1 平衡浓度/mol·L-1 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI)
1.197×10-2 6.944×10-3 0 5.617×10-3 5.936×10-4 1.270×10-2 48.37
1.228×10-2 9.964×10-3 0 3.841×10-3 1.524×10-3 1.687×10-2 48.62
1.201×10-2 8.430×10-3 0 4.580×10-3 9.733×10-4 1.486×10-2 49.54
0 0 1.520×10-2 1.696×10-3 1.696×10-3 1.181×10-2 48.49
0 0 1.287×10-2 1.433×10-3 1.433×10-3 1.000×10-2 48.70
0 0 3.777×10-2 4.213×10-3 4.213×10-3 2.934×10-2 48.50
平均值 48.70
在457.6℃时,反应体系H2(g) + I2(g) 2HI(g)中各物质的浓度:
结论
结论2:与反应物的起始浓度大小无关。
结论1: 为常数。
c2(HI)
c(H2) · c(I2)
H2(g) + I2(g) 2HI(g)
化学平衡常数
结论3:与正向建立还是逆向建立平衡无关,即与平衡建立的过程无关。
一、化学平衡常数概念及表达式
概念
在一定温度下,当一个可逆反应达到化学平衡时,体系内生成物浓度幂(以其化学计量数为幂)之积与反应物浓度幂之积的比值是一个常数,叫做该反应的化学平衡常数(简称平衡常数),用符号K表示。
表达式
K
=
生成物浓度幂之积
反应物浓度幂之积
=
cp(C)·cq(D)
cm(A)·cn(B)
m A(g) + n B(g) p C(g) + q D(g)
其中c为各组分的平衡时浓度
固体或液体纯物质
不列入平衡常数表达式中
典例精讲
反应01
反应02
反应03
反应04
【例1】写出下列可逆反应的平衡常数表达式。
N2(g) + 3H2(g) 2NH3(g)
2NH3(g) N2(g) + 3H2(g)
N2(g) + H2(g) NH3(g)
1
2
3
2
Fe3O4(s) + 4H2(g) 3Fe(s) + 4H2O(g)
高温
反应05
C2H5OH+CH3COOH CH3COOC2H5+H2O
一、化学平衡常数概念及表达式
平衡常数与化学方程式的关系
(1)对于同一可逆反应,正反应和逆反应的平衡常数互为倒数;
(2)若化学方程式中各物质的化学计量数都扩大或缩小至原来的n倍,则化学平衡常数变为原来的n次幂或次幂。
(3)若干方程式相加,则总反应的平衡常数等于分步平衡常数之乘积;若干方程式相减,则总反应的平衡常数等于分步平衡常数之商。(多重平衡规则)
① C (s) + H2O (g) CO (g) + H2 (g) K1=
② CO (g) +H2O (g) CO2 (g) + H2 (g) K2=
③ C (s) + CO2(g) 2CO(g) K3=
化学方程式 平衡常数 ( K )
F2(g) + H2(g) 2HF(g) 6.5 ×1095
Cl2(g) + H2(g) 2HCl(g) 2.57 ×1033
Br2(g) + H2(g) 2HBr(g) 1.91 ×1019
I2(g) + H2(g) 2HI(g) 8.67 ×102
二、化学平衡常数的影响因素
数据分析
结论:平衡常数的大小,与反应中物质的性质有关。(内因)
25 ℃ 时,生成卤化氢反应的平衡常数
序号 起始浓度(×10-2 mol·L-1) 不同温度下的平衡常数(K ) c(H2) c(I2) c(HI) 457.6 ℃ 425.6 ℃ 25 ℃
1 1.197 0.694 0 48.38 54.51 867
2 1.228 0.996 0 48.61 54.62 867
3 1.201 0.840 0 49.54 54.21 867
4 0 0 1.520 48.48 54.10 867
5 0 0 1.287 48.71 54.42 867
二、化学平衡常数的影响因素
数据分析
H2(g) + I2(g) 2HI(g)
在容积不变的密闭容器中发生反应:
结论:
平衡常数不受浓度的影响,受温度影响。(外因)
二、化学平衡常数的影响因素
数据分析
结论:
平衡常数不受浓度的影响,受温度影响。(外因)
体系压强改变会影响平衡常数吗?
压强改变可能会影响体系中物质的浓度,而浓度的改变不影响平衡常数。因此压强不影响平衡常数的大小。
二、化学平衡常数的影响因素
小结
(1)内因:同一温度下,不同的反应化学平衡常数不同
(2)外因:在化学方程式一定的情况下,K只受温度影响。与压强、起始浓度、起始反方向均无关。
升高温度,吸热反应的平衡常数增大,放热反应的平衡常数减小
降低温度,吸热反应的平衡常数减小,放热反应的平衡常数增大
三、化学平衡常数的意义
化学平衡常数的大小反映了化学反应进行的程度
K值越大,表示反应进行得越完全,平衡时反应物的转化率越大。一般来说,对于同类型的化学反应,K≥105时可认为该反应进行得基本完全了。
K值越小,表示反应进行得越不完全,平衡时反应物的转化率越小。同样地,K ≤10-5则认为这个反应很难进行。
化学平衡常数的大小反映的是反应进行的程度大小,并不涉及反应时间和化学反应速率。也就是说,某个化学反应的平衡常数很大,可能化学反应速率却很小。
四、化学平衡常数的应用
判断可逆反应的进行方向
浓度商
定义:对于一般的可逆反应:mA(g)+nB(g) pC(g)+qD(g), 在任意时刻的 ,称为浓度商,常用Q表示,即 Q= 。
cp(C)·cq(D)
cm(A)·cn(B)
cp(C)·cq(D)
cm(A)·cn(B)
Q<K ,反应向正方向进行
Q=K ,反应处于平衡状态
Q>K ,反应向逆方向进行
指任意时刻的浓度
典例精讲
【例2】高炉炼铁中发生的基本反应如下: FeO(s)+CO(g) Fe(s)+CO2(g) (条件省略)
已知1100℃,K=0.263,某时刻测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1 在这种情况下:
(1)该反应是否处于平衡状态_____(填“是”或“否”);
(2)此时反应会向______进行?(填“正向”或“逆向”);
(3)此时化学反应速率是ν正 _____ν逆(填“大于”、“小于”或“等于”)。
否
正向
大于
四、化学平衡常数的应用
判断可逆反应的热效应
在化学方程式一定的情况下,K只受温度影响。与压强、起始浓度、起始反方向均无关。
若升高温度,K增大,正反应是吸热反应;
若升高温度,K减小,正反应是放热反应。
【例3】不同温度时,反应:H2(g)+I2(g)2HI(g),的平衡常数与温度的关系如表所示,可以判断该可逆反应的正方向是______反应。
温度 623K 698K 763K
平衡常数 66 .9 54.4 45.9
放热
四、化学平衡常数的应用
用“三段式”法计算化学平衡常数与平衡时转化率
mX(g) + nY(g)pZ(g)
始(mol/L)
变(mol/L)
平(mol/L)
c1 c2 c3
mx nx px
c1-mx c2-nx c3-px
K=
α=100%=
已知平衡时各物质或某物质平衡时物质的量浓度,求K;
已知起始浓度C0和平衡常数K,求平衡时物质的浓度或转化率;
已知起始浓度C0和平衡时转化率,求平衡常数K。
典例精讲
【例3】一定温度下,将0.050 mol SO2(g)和0.030 mol O2(g)注入体积为1.0 L的密闭反应器,发生反应2SO2(g)+O2(g) 2SO3(g),达到平衡后,测得SO3的平衡浓度为0.044 mol·L-1。该温度下的平衡常数K为 。
【例4】某温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=0.25,若在此温度下,在10 L的密闭容器中充入0.2 mol HI气体,达到平衡时,HI的分解率为______。
【例5】在830 K时,在密闭容器中发生可逆反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。试回答下列问题:
若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,4 s后达到平衡,此时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____。
80%
1
课堂小结
CLASS SUMMARY
化学平衡常数
化学平衡常数
化学平衡常数的应用
概念及表达式
判断可逆反应进行的方向
意义
影响因素
判断可逆反应热效应
计算
1.某温度下气体反应体系达到化学平衡,平衡常数K= ,下列说法正确的是
A.该反应的化学方程式为2E(g)+F(g) A(g)+2B(g)
B.降低温度,正反应速率增大
C.该温度时,v(F)=v(A)则反应达到平衡状态
D.增大c(A)、c(B),K增大
演练—题组冲关
A
2.对于下列反应,其反应过程的能量变化示意图如下:
演练—题组冲关
编号 反应 平衡常数 反应热
反应① A(g) B(g)+C(g) K1 ΔH1
反应② B(g)+C(g) D(g) K2 ΔH2
反应③ A(g) D(g) K3 ΔH3
下列说法正确的是( )
A.K3=K1+K2
B.ΔH3=ΔH1+ΔH2
C.加催化剂,反应①的反应热降低,反应速率加快
D.增大压强,K1减小,K2增大,K3不变
B
3.五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g) PCl5(g)△H=-93.0kJ/mol。某温度下,在2.0L密闭容器中充入1.0molPCl3和0.5molCl2,一段时间后反应达平衡状态,实验数据如下表所示,下列说法不正确的是
A.0~150s内,PCl3的反应速率为0.0012mol/(L s)
B.反应至250s,该反应放出的热量为37.2kJ
C.该温度下,此反应的化学平衡常数数值为40/3
D.在此温度下,该密闭容器中若初始充入1.0molPCl3、1molCl2、2.0molPCl5,则应向逆反应方向进行
演练—题组冲关
t/s 0 50 150 250 350
n(PCl5)/mol 0 0.21 0.36 0.40 0.40
D
