1.2.1有机化合物的分离、提纯 课件(共48张PPT)高中化学选修三有机化学基础课件(人教版)
文档属性
| 名称 | 1.2.1有机化合物的分离、提纯 课件(共48张PPT)高中化学选修三有机化学基础课件(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-04 11:43:14 | ||
图片预览








文档简介
(共48张PPT)
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
第1课时 有机化合物的分离、提纯
1.通过蒸馏法、萃取法、重结晶法实验原理和基本操作的学习,认识科学探究过程的步骤,学会研究有机化合物的一般步骤和方法。
2.初步学会分离提纯有机化合物的常规方法。
学习目标
科学探究与创新意识:
能在复杂的化学问题情境中提出有价值的实验探究课题,能设计有关物质转化、分离提纯、性质应用等的综合实验方案。
核心素养
新课导入
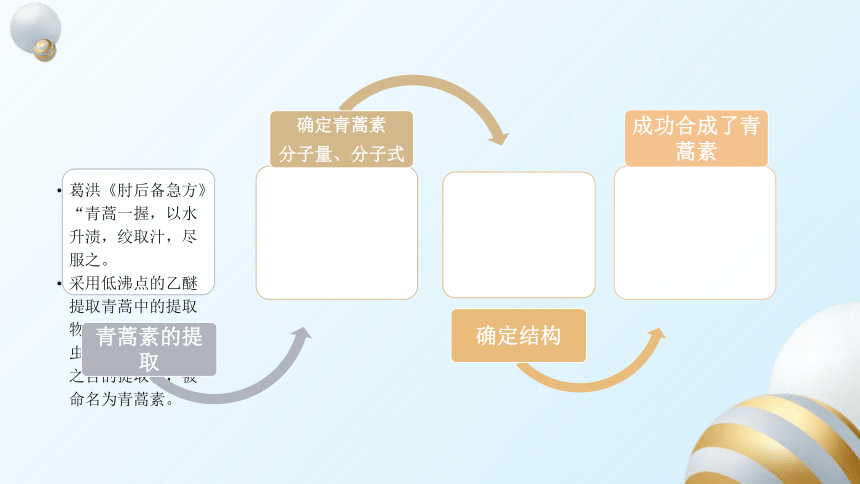
青蒿素的研究过程
疟疾是一种古老的疾病,还是危害人类最大的疾病之一。
2015年诺贝尔生理学或医学奖揭晓,中国女药学家屠呦呦,以及另外两名科学家获了该奖项。屠呦呦也成为首位获得诺贝尔奖科学类奖项的中国人。屠呦呦的获奖则依靠的是被世卫组织称为最有效的抗疟疾药物青蒿素。
在研究过程中,葛洪《肘后备急方》中的几句话引起了屠呦呦的注意:“青蒿一握,以水升渍,绞取汁,尽服之。”这不禁让她想到,会不会是因为青蒿对温度比较敏感,从而影响了对疟原虫抑制作用,问题或许岀在了常用的“水煎”法上?于是她转换思路,采用低沸点的乙醚提取青蒿中的提取物,最终她得到了对疟原虫抑制率可达百分之百的提取物,被命名为青蒿素。
虽然发现了有效成分,这个项目却还没有结束,要将它作为药物使用,还有很多步要走。首先,就是要确定它的分子量和分子式,之后确定结构。而这并不是专攻中药学的屠呦呦所能做的了。最终经过众多科学家的努力,周维善小组最终测定出青蒿素的结构。之后,经过努力,他们又成功合成了青蒿素,至此抗疟疾药物的研究方可告一段落。
从上述信息,你能总结出研究有机化合物的一般方法吗?
知识梳理
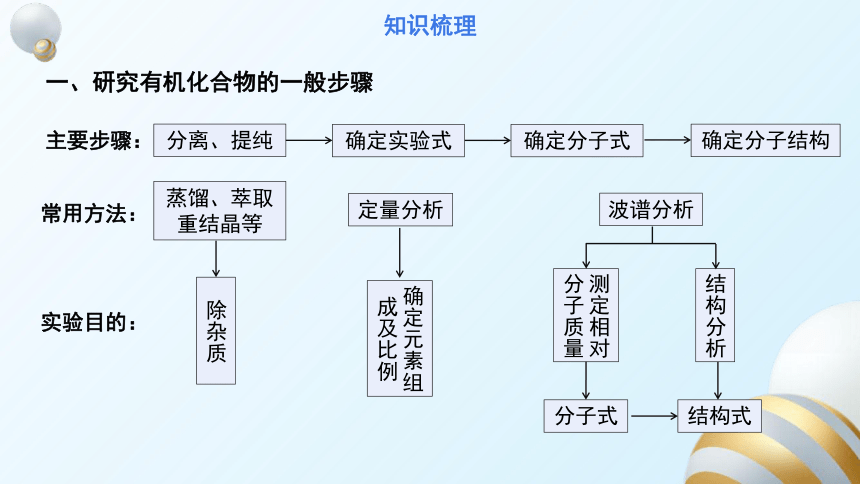
一、研究有机化合物的一般步骤
主要步骤:
分离、提纯
定量分析
波谱分析
除杂质
确定元素组成及比例
测定相对
分子质量
分子式
结构分析
结构式
确定实验式
确定分子式
确定分子结构
常用方法:
蒸馏、萃取
重结晶等
实验目的:
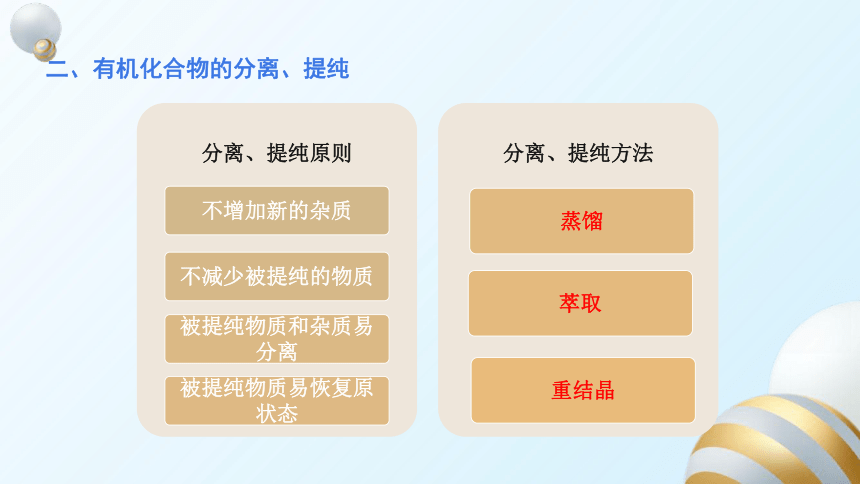
二、有机化合物的分离、提纯
工业上常用水蒸气蒸馏的方法从柠檬、橙子和柚子等水果的果皮中提取的精油(香料)90%以上是柠檬烯。提取柠檬烯的实验操作步骤如下:
(1)将1~2个橙子皮剪成碎片,投入乙装置中,加入约30 mL水。
(2)松开活塞K,加热甲装置至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧,打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。
活动探究
1.蒸馏操作完成的标志是什么?
提示:当馏出液无明显油珠,澄清透明时,说明蒸馏完成。
2.长玻璃管的作用是什么?
提示:长玻璃管作安全管,能平衡气压,防止由于导管堵塞引起爆炸的作用。
3.蒸馏结束后,为防止倒吸,立即停止加热吗?
提示:蒸馏结束后,先把乙中的导气管从溶液中移出,再停止加热。
4.要得到纯精油,还需要用到哪些分离提纯方法?
提示:得到的精油中含有其他成分,要想得到纯的柠檬烯,要进行萃取、分液、蒸馏操作才能实现目的。
[思考交流]
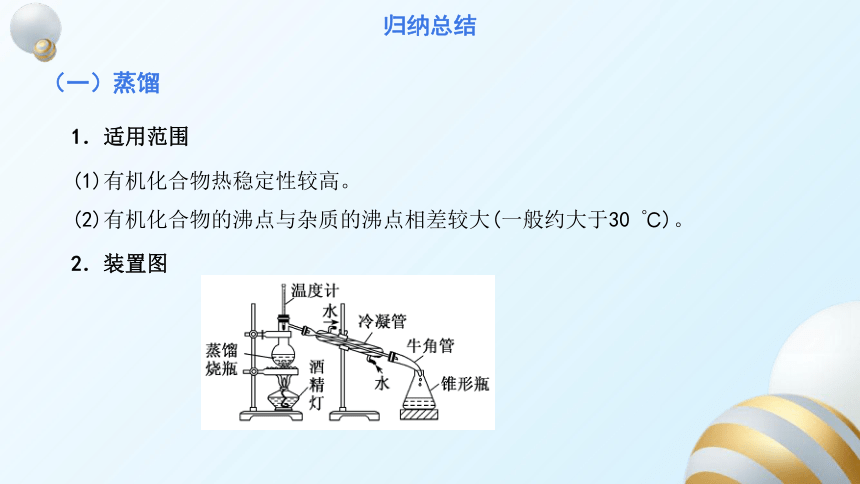
1.适用范围
(1)有机化合物热稳定性较高。
(2)有机化合物的沸点与杂质的沸点相差较大(一般约大于30 ℃)。
2.装置图
(一)蒸馏
归纳总结
3.注意事项
(1)使用前要检查装置气密性。
(2)蒸馏烧瓶需垫石棉网加热。
(3)蒸馏时液体体积应占蒸馏烧瓶容积的~。
(4)蒸馏烧瓶应加入碎瓷片以防暴沸。
(5)温度计水银球应位于蒸馏烧瓶的支管口处。
(6)冷凝水方向为下口进上口出。
1.蒸馏操作一定不需要用到的仪器是( )
A.温度计 B.冷凝管 C.玻璃棒 D.蒸馏烧瓶
【解析】蒸馏是利用物质的沸点不同,将液体混合物分离的操作方法,蒸馏时,为防止液体剧烈沸腾,应加入碎瓷片,使用温度计时,温度计水银球应位于蒸馏烧瓶支管口附近,且冷凝管进出水的方向是下进上出,以保证充分冷凝,馏出物质用牛角管接在锥形瓶中,需要的仪器主要有蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶等,不需要的仪器为玻璃棒。
巩固练习
C
2.实验室可通过蒸馏石油得到多种沸点范围不同的馏分,装置如图所示。下列说法不正确的是( )
A.沸点较低的汽油比沸点较高的柴油先馏出
B.蒸馏烧瓶中放入沸石可防止蒸馏时发生暴沸
C.冷凝管中的冷凝水应该从 a 口进 b 口出
D.温度计水银球的上限和蒸馏烧瓶支管口下沿相平
C
【解析】在蒸馏时,沸点较低的先馏出,所以沸点较低的汽油比沸点较高的柴油先馏出,A正确;沸石具有防暴沸作用,所以蒸馏烧瓶中放入沸石可防止蒸馏时发生暴沸,减少安全事故的发生,B正确;冷凝管中水采用逆流方式,防止馏分温度急剧降低而炸裂冷凝管,所以冷凝水应该b为进水口、a为出水口,C错误;温度计测量馏分温度时,温度计水银球的上限和蒸馏烧瓶支管口下沿相平,D正确。
2019年9月29日,国家主席习近平向诺贝尔生理学或医学奖获得者屠呦呦授予“共和国勋章”,以表彰她在青蒿素研究方面作出的突出贡献。屠呦呦率领团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终确认只有用低温、乙醚冷浸等方法才能成功从青蒿中提取出对治疗疟疾有特效的青蒿素。
活动探究
1.屠呦呦及团队用乙醚从青蒿中提取青蒿素的实验方法是什么?其提取原理是什么?
提示:实验方法是萃取;其萃取原理是利用青蒿素在乙醚中的溶解度远大于在水中的溶解度,所以能将青蒿素从水中转移到乙醚中。
2.屠呦呦及团队用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,其中乙醚的作用是什么?常用的萃取剂有哪些?
提示:乙醚的作用是萃取剂,常用的萃取剂除乙醚外还有苯、CCl4、乙酸乙酯、二氯甲烷等。
[思考交流]
3.乙醇能作萃取剂吗?试总结萃取剂的选择条件有哪些?
提示:乙醇一般不能作萃取剂,原因是乙醇与水互溶,不分层,不能用分液漏斗分液。选取萃取剂需满足以下三个条件:一是被萃取的物质在萃取剂中的溶解度远大于在原溶剂中的溶解度;二是萃取剂与被萃取的物质不发生化学反应;三是萃取剂与原溶剂互不相溶。
1.原理
(1)液 液萃取:利用待分离组分在两种互不相溶的溶剂中的溶解度不同,将其从一种溶剂转移到另一种溶剂的过程。
(2)固 液萃取:用溶剂从固体物质中溶解出待分离组分的过程。
2.装置图
(二)萃取
归纳总结
分液漏斗
3.注意事项
(1)萃取剂的选择条件:溶质在萃取剂中的溶解度必须远大于在原溶剂中;萃取剂必须与原溶剂互不相溶,且有一定的密度差别;萃取剂与原溶剂和溶质不反应。
(2)常用的萃取剂:乙醚(结构简式C2H5OC2H5)、乙酸乙酯(结构简式CH3COOC2H5)、苯、二氯甲烷等。
(3)将萃取后的两层液体分开的操作叫做分液。分液时下层液体从下口放出,上层液体从上口倒出。
1.下列关于萃取操作的说法正确的是( )
A.从溴水中提取溴,可加入四氯化碳或酒精作萃取剂
B.萃取操作完成后,静置分液,先将下层液体从下口放出,然后将上层液体从下口放出
C.用一种有机溶剂提取水溶液中的某物质,静置分液后,“水层”应在上层
D.萃取时,所加入的溶剂应与原溶剂互不相溶,且与溶质相互间不反应
巩固练习
D
【解析】酒精与水互溶,不能作为萃取剂;萃取操作完成后,分液漏斗中下层液体从下口放出,上层液体从上口倒出;萃取操作后,水层的位置取决于水和有机溶剂的密度的相对大小,若有机溶剂的密度小于水的密度,则水层应该在下层。
2.以下关于萃取、分液操作的叙述中,正确的是( )
A.把混合液体转移至分液漏斗,塞上玻璃塞,用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分液漏斗静置待液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗口上的小孔,再打开活塞
D
【解析】为使液体混合均匀,两手分别顶住玻璃塞和活塞,使分液漏斗倒转过来,不能用力振荡,A错误;振荡几次后打开活塞放气,不需打开分液漏斗上口的玻璃塞放气,B错误;液体混合均匀后将分液漏斗放在铁架台上静置待液体分层,C错误。
苯甲酸可用作食品防腐剂。纯净的苯甲酸为无色结晶,其结构可表示为 ,熔点122 ℃,沸点249 ℃。苯甲酸微溶于水,易溶于乙醇等有机溶剂。苯甲酸在水中的溶解度如下:
温度/℃ 25 50 75
溶解度/g 0.34 0.85 2.2
活动探究
【实验】
(1)观察粗苯甲酸样品的状态。
(2)将1 g粗苯甲酸放入100 mL烧杯,加入50 mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
1.重结晶法提取苯甲酸的原理是什么?
提示:根据苯甲酸、氯化钠在水中溶解度的不同,使苯甲酸从饱和溶液中结晶析出,而氯化钠全部或大部分留在溶液中除去。
2.溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
提示:溶解粗苯甲酸时加热是为了溶解较多的苯甲酸,得到热的饱和苯甲酸溶液。趁热过滤的目的是防止溶液冷却析出苯甲酸晶体。
[思考交流]
3.如何检验提纯后的苯甲酸中氯化钠已被除净?
4.温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
提示:冷却结晶时,并不是温度越低越好,因为温度过低时,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯苯甲酸的目的。
提示:将提纯后的苯甲酸样品,溶于水后,加入硝酸银溶液,观察是否有白色沉淀生成,若无白色沉淀生成,说明氯化钠已被除净。
1.原理
利用被提纯物质与杂质在同一溶剂中溶解度不同而将杂质除去。
2.溶剂的选择
(三)重结晶
归纳总结
加热溶解
趁热过滤
冷却结晶
3.实验仪器与操作步骤
结晶的三种类型
(1)蒸发结晶:将溶剂蒸发获取晶体,此法适用于溶解度随温度变化不大的溶液,如粗盐的提纯。
(2)降温结晶:将热的饱和溶液慢慢冷却后析出晶体,此法适用于溶解度随温度变化较大的溶液。如氯化钠和硝酸钾的分离。
(3)重结晶:将已知的晶体用蒸馏水溶解,经过滤、蒸发、冷却等步骤,再次析出晶体,得到更纯净的晶体的过程。
名师点拨
1.关于苯甲酸的重结晶实验,其结论或解释错误的是( )
选项 实验步骤 实验现象 结论或解释
A 常温溶解 苯甲酸几乎不溶 苯甲酸常温时不溶于水或微溶于水
B 加热溶解 苯甲酸完全溶解 温度升高,苯甲酸溶解度增大
C 趁热过滤 过滤时伴有晶体析出 此晶体为杂质所形成
D 冷却结晶,滤出晶体 针状晶体 针状晶体为苯甲酸
巩固练习
C
【解析】常温下,苯甲酸的溶解度较小,所以常温溶解时,苯甲酸几乎不溶解,A正确;苯甲酸的溶解度随温度的升高增大,加热苯甲酸完全溶解,B正确;过滤时,过滤器的温度低,所以与过滤器接触的溶液的温度降低析出苯甲酸,即过滤时析出的晶体为苯甲酸,C错误;冷却苯甲酸的浓溶液,会析出苯甲酸晶体,所以冷却结晶时,溶液中析出的针状晶体是苯甲酸晶体,D正确。
2.硝酸钾、氯化钠的溶解度曲线如图所示,在较高温度下的某溶液中,硝酸钾、氯化钠均达饱和,冷却析出晶体的成分是( )
A.纯硝酸钾
B.大量硝酸钾,少量氯化钠
C.等量的硝酸钾和氯化钠
D.大量氯化钠,少量硝酸钾
B
【解析】不同物质的溶解度受温度变化影响不同,硝酸钾的溶解度随温度升高而升高,氯化钠的溶解度随温度变化影响不大。在冷却热饱和溶液时硝酸钾容易析出晶体,氯化钠析出较少,所以冷却析出晶体的成分是大量硝酸钾,少量氯化钠。
已知苯甲醛易被氧气氧化,苯甲醇的沸点为205.3 ℃,苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为 0.34 g;乙醚的沸点为34.8 ℃,难溶于水。实验室制备苯甲醇和苯甲酸的化学原理是:
能力提升
1.操作Ⅰ的名称是什么?乙醚溶液中所溶解的主要成分有哪些?
提示:由题意可知,白色糊状物为苯甲醇和苯甲酸钾,加入水和乙醚后,根据相似相溶原理,乙醚中溶有苯甲醇,水中溶有苯甲酸钾,两种液体可用分液法分离。
制备苯甲醇和苯甲酸的主要过程如下图所示:
2.操作Ⅱ的名称是什么?有什么判断依据?产品甲是什么?
提示:溶解在乙醚中的苯甲醇沸点高于乙醚,可蒸馏分离,所以操作Ⅱ是蒸馏,产品甲是苯甲醇。
3.操作Ⅲ的名称是什么?有什么判断依据?产品乙是什么?
提示:加入盐酸后生成的苯甲酸为微溶于水的晶体,可过滤分离。所以操作Ⅲ是过滤,产品乙是苯甲酸。
首先要熟记各种分离和提纯方法的适用范围,然后根据被提纯物与杂质性质的差异选择合适的分离提纯方法。
1.固体与液体的混合物
方法 适用条件 实例
过滤 难溶固体与液体混合物 碳酸钙悬浊液、泥水等
蒸发结晶 溶质的溶解度受温度变化影响较小 从NaCl溶液中提取NaCl晶体
归纳总结
方法 适用条件 实例
溶解、过滤 在某种试剂中一种可溶而另一种不溶的固体混合物 碳酸钠和碳酸钙
结晶 用于溶解度随温度变化相差较大的可溶性固体混合物 除去KNO3中混有的少量NaCl
升华 分离某种组分易升华的混合物 分离I2和NaCl固体
2.固体与固体的混合物
方法 适用条件 实例
萃取、分液 互不相溶的液体混合物 分离CCl4和水等
蒸馏 两种或两种以上互溶的液体,沸点相差较大 分离酒精和水
3.液体与液体的混合物
A.步骤1中有机相应从分液漏斗下口放出,无机相从上口倒出
B.步骤2分离方法为过滤
C.步骤3可在装置 中完成
D.步骤4中,将溶液蒸发至只剩少量水时,用余热蒸干
某化学兴趣小组从含有KI、KNO3等成分的工业废水中回收I2和KNO3,其流程如图。下列说法正确的是( )
迁移应用
C
【解析】含有KI、KNO3的废水中通入过量的氯气,加入苯萃取,分液,有机相含有苯、碘,经蒸馏可得到苯以及粗碘,经升华得到碘,无机相为硝酸钾溶液,经蒸发浓缩、冷却结晶得到硝酸钾。苯的密度比水小,应从上口倒出,A错误;步骤2应为蒸馏,B错误;步骤3为碘的升华,C正确;硝酸钾易分解,应蒸发浓缩、冷却结晶,D错误。
1.甘油是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1.26 g·mL-1,沸点约290 ℃,分离水和甘油最合理的方法是( )
A.蒸馏 B.蒸发
C.过滤 D.萃取分液
【解析】甘油和水互溶,不能用过滤、蒸发、分液的方法分离,而二者沸点不同,可用蒸馏的方法分离。
当堂检测
A
2.下列操作中选择的仪器正确的是( )
①分离汽油和氯化钠溶液 ②从含Fe3+的自来水中得到蒸馏水 ③分离氯化钾和二氧化锰混合物 ④从食盐水中提取溶质
A.①—丁 ②—丙 ③—甲 ④—乙
B.①—乙 ②—丙 ③—甲 ④—丁
C.①—丁 ②—丙 ③—乙 ④—甲
D.①—丙 ②—乙 ③—丁 ④—甲
A
【解析】①汽油和氯化钠溶液不互溶,可用分液法分离;②从含Fe3+的自来水中得到蒸馏水,可利用蒸馏法;③氯化钾易溶于水,二氧化锰难溶于水,可溶解后过滤分离;④从氯化钠溶液中得到氯化钠晶体,可利用蒸发的方法。
3.下列有关实验的说法错误的是( )
A.在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点
B.用结晶法分离硝酸钾和氯化钠的混合物,用分液法分离水和硝基苯的混合物
C.在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失
D.作为重结晶实验的溶剂,杂质在此溶液中的溶解度受温度影响应该很大
D
【解析】在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点,故A正确;硝酸钾的溶解度随温度升高而急剧增大,氯化钠的溶解度随温度变化很小,所以用结晶法分离硝酸钾和氯化钠的混合物,水和硝基苯不互溶,所以用分液法分离水和硝基苯的混合物,故B正确;在重结晶实验中,要求被提纯物和杂质的溶解度随温度的变化差别很大,杂质在此溶液中的溶解度受温度影响不一定很大,故D错误。
4.现有四组混合物:①乙酸乙酯和乙酸钠溶液 ②乙醇和水 ③溴化钠和溴单质的水溶液 ④碘和四氯化碳的混合物,分离以上各混合物的正确方法依次是( )
A.分液、萃取、蒸馏、萃取 B.萃取、蒸馏、分液、萃取
C.分液、蒸馏、萃取、蒸馏 D.蒸馏、萃取、分液、萃取
C
【解析】①乙酸乙酯和乙酸钠溶液互不相溶,可用分液的方法分离;②乙醇和水、④碘和四氯化碳互溶,但沸点不同,可用蒸馏的方法分离;③溴化钠易溶于水,而溴单质不易溶于水,易溶于有机溶剂,两者可用萃取法分离。
5.选择下列实验方法分离提纯物质,将分离提纯方法的字母填在横线上。
A.萃取分液 B.升华 C.重结晶 D.分液 E.蒸馏 F.过滤 G.洗气
(1)________从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
(2)________分离水和汽油的混合物。
(3)________分离CCl4(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。
(4)________除去混在乙烷中的乙烯。
(5)________提取碘水中的碘。
CF
D
E
G
A
【解析】硝酸钾在水中的溶解度随温度升高明显增大而NaCl在水中的溶解度受温度影响不大,采用重结晶法和过滤可将其分离;水和汽油互不相溶,分层,可用分液法进行分离;CCl4和甲苯两种互溶的液体,沸点差大于30 ℃,可用蒸馏法分离;乙烯可被溴水吸收,可用洗气的方法除去;碘在有机溶剂中溶解度大,可用萃取分液方法提纯。
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
第1课时 有机化合物的分离、提纯
1.通过蒸馏法、萃取法、重结晶法实验原理和基本操作的学习,认识科学探究过程的步骤,学会研究有机化合物的一般步骤和方法。
2.初步学会分离提纯有机化合物的常规方法。
学习目标
科学探究与创新意识:
能在复杂的化学问题情境中提出有价值的实验探究课题,能设计有关物质转化、分离提纯、性质应用等的综合实验方案。
核心素养
新课导入
青蒿素的研究过程
疟疾是一种古老的疾病,还是危害人类最大的疾病之一。
2015年诺贝尔生理学或医学奖揭晓,中国女药学家屠呦呦,以及另外两名科学家获了该奖项。屠呦呦也成为首位获得诺贝尔奖科学类奖项的中国人。屠呦呦的获奖则依靠的是被世卫组织称为最有效的抗疟疾药物青蒿素。
在研究过程中,葛洪《肘后备急方》中的几句话引起了屠呦呦的注意:“青蒿一握,以水升渍,绞取汁,尽服之。”这不禁让她想到,会不会是因为青蒿对温度比较敏感,从而影响了对疟原虫抑制作用,问题或许岀在了常用的“水煎”法上?于是她转换思路,采用低沸点的乙醚提取青蒿中的提取物,最终她得到了对疟原虫抑制率可达百分之百的提取物,被命名为青蒿素。
虽然发现了有效成分,这个项目却还没有结束,要将它作为药物使用,还有很多步要走。首先,就是要确定它的分子量和分子式,之后确定结构。而这并不是专攻中药学的屠呦呦所能做的了。最终经过众多科学家的努力,周维善小组最终测定出青蒿素的结构。之后,经过努力,他们又成功合成了青蒿素,至此抗疟疾药物的研究方可告一段落。
从上述信息,你能总结出研究有机化合物的一般方法吗?
知识梳理
一、研究有机化合物的一般步骤
主要步骤:
分离、提纯
定量分析
波谱分析
除杂质
确定元素组成及比例
测定相对
分子质量
分子式
结构分析
结构式
确定实验式
确定分子式
确定分子结构
常用方法:
蒸馏、萃取
重结晶等
实验目的:
二、有机化合物的分离、提纯
工业上常用水蒸气蒸馏的方法从柠檬、橙子和柚子等水果的果皮中提取的精油(香料)90%以上是柠檬烯。提取柠檬烯的实验操作步骤如下:
(1)将1~2个橙子皮剪成碎片,投入乙装置中,加入约30 mL水。
(2)松开活塞K,加热甲装置至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧,打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。
活动探究
1.蒸馏操作完成的标志是什么?
提示:当馏出液无明显油珠,澄清透明时,说明蒸馏完成。
2.长玻璃管的作用是什么?
提示:长玻璃管作安全管,能平衡气压,防止由于导管堵塞引起爆炸的作用。
3.蒸馏结束后,为防止倒吸,立即停止加热吗?
提示:蒸馏结束后,先把乙中的导气管从溶液中移出,再停止加热。
4.要得到纯精油,还需要用到哪些分离提纯方法?
提示:得到的精油中含有其他成分,要想得到纯的柠檬烯,要进行萃取、分液、蒸馏操作才能实现目的。
[思考交流]
1.适用范围
(1)有机化合物热稳定性较高。
(2)有机化合物的沸点与杂质的沸点相差较大(一般约大于30 ℃)。
2.装置图
(一)蒸馏
归纳总结
3.注意事项
(1)使用前要检查装置气密性。
(2)蒸馏烧瓶需垫石棉网加热。
(3)蒸馏时液体体积应占蒸馏烧瓶容积的~。
(4)蒸馏烧瓶应加入碎瓷片以防暴沸。
(5)温度计水银球应位于蒸馏烧瓶的支管口处。
(6)冷凝水方向为下口进上口出。
1.蒸馏操作一定不需要用到的仪器是( )
A.温度计 B.冷凝管 C.玻璃棒 D.蒸馏烧瓶
【解析】蒸馏是利用物质的沸点不同,将液体混合物分离的操作方法,蒸馏时,为防止液体剧烈沸腾,应加入碎瓷片,使用温度计时,温度计水银球应位于蒸馏烧瓶支管口附近,且冷凝管进出水的方向是下进上出,以保证充分冷凝,馏出物质用牛角管接在锥形瓶中,需要的仪器主要有蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶等,不需要的仪器为玻璃棒。
巩固练习
C
2.实验室可通过蒸馏石油得到多种沸点范围不同的馏分,装置如图所示。下列说法不正确的是( )
A.沸点较低的汽油比沸点较高的柴油先馏出
B.蒸馏烧瓶中放入沸石可防止蒸馏时发生暴沸
C.冷凝管中的冷凝水应该从 a 口进 b 口出
D.温度计水银球的上限和蒸馏烧瓶支管口下沿相平
C
【解析】在蒸馏时,沸点较低的先馏出,所以沸点较低的汽油比沸点较高的柴油先馏出,A正确;沸石具有防暴沸作用,所以蒸馏烧瓶中放入沸石可防止蒸馏时发生暴沸,减少安全事故的发生,B正确;冷凝管中水采用逆流方式,防止馏分温度急剧降低而炸裂冷凝管,所以冷凝水应该b为进水口、a为出水口,C错误;温度计测量馏分温度时,温度计水银球的上限和蒸馏烧瓶支管口下沿相平,D正确。
2019年9月29日,国家主席习近平向诺贝尔生理学或医学奖获得者屠呦呦授予“共和国勋章”,以表彰她在青蒿素研究方面作出的突出贡献。屠呦呦率领团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终确认只有用低温、乙醚冷浸等方法才能成功从青蒿中提取出对治疗疟疾有特效的青蒿素。
活动探究
1.屠呦呦及团队用乙醚从青蒿中提取青蒿素的实验方法是什么?其提取原理是什么?
提示:实验方法是萃取;其萃取原理是利用青蒿素在乙醚中的溶解度远大于在水中的溶解度,所以能将青蒿素从水中转移到乙醚中。
2.屠呦呦及团队用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,其中乙醚的作用是什么?常用的萃取剂有哪些?
提示:乙醚的作用是萃取剂,常用的萃取剂除乙醚外还有苯、CCl4、乙酸乙酯、二氯甲烷等。
[思考交流]
3.乙醇能作萃取剂吗?试总结萃取剂的选择条件有哪些?
提示:乙醇一般不能作萃取剂,原因是乙醇与水互溶,不分层,不能用分液漏斗分液。选取萃取剂需满足以下三个条件:一是被萃取的物质在萃取剂中的溶解度远大于在原溶剂中的溶解度;二是萃取剂与被萃取的物质不发生化学反应;三是萃取剂与原溶剂互不相溶。
1.原理
(1)液 液萃取:利用待分离组分在两种互不相溶的溶剂中的溶解度不同,将其从一种溶剂转移到另一种溶剂的过程。
(2)固 液萃取:用溶剂从固体物质中溶解出待分离组分的过程。
2.装置图
(二)萃取
归纳总结
分液漏斗
3.注意事项
(1)萃取剂的选择条件:溶质在萃取剂中的溶解度必须远大于在原溶剂中;萃取剂必须与原溶剂互不相溶,且有一定的密度差别;萃取剂与原溶剂和溶质不反应。
(2)常用的萃取剂:乙醚(结构简式C2H5OC2H5)、乙酸乙酯(结构简式CH3COOC2H5)、苯、二氯甲烷等。
(3)将萃取后的两层液体分开的操作叫做分液。分液时下层液体从下口放出,上层液体从上口倒出。
1.下列关于萃取操作的说法正确的是( )
A.从溴水中提取溴,可加入四氯化碳或酒精作萃取剂
B.萃取操作完成后,静置分液,先将下层液体从下口放出,然后将上层液体从下口放出
C.用一种有机溶剂提取水溶液中的某物质,静置分液后,“水层”应在上层
D.萃取时,所加入的溶剂应与原溶剂互不相溶,且与溶质相互间不反应
巩固练习
D
【解析】酒精与水互溶,不能作为萃取剂;萃取操作完成后,分液漏斗中下层液体从下口放出,上层液体从上口倒出;萃取操作后,水层的位置取决于水和有机溶剂的密度的相对大小,若有机溶剂的密度小于水的密度,则水层应该在下层。
2.以下关于萃取、分液操作的叙述中,正确的是( )
A.把混合液体转移至分液漏斗,塞上玻璃塞,用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分液漏斗静置待液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗口上的小孔,再打开活塞
D
【解析】为使液体混合均匀,两手分别顶住玻璃塞和活塞,使分液漏斗倒转过来,不能用力振荡,A错误;振荡几次后打开活塞放气,不需打开分液漏斗上口的玻璃塞放气,B错误;液体混合均匀后将分液漏斗放在铁架台上静置待液体分层,C错误。
苯甲酸可用作食品防腐剂。纯净的苯甲酸为无色结晶,其结构可表示为 ,熔点122 ℃,沸点249 ℃。苯甲酸微溶于水,易溶于乙醇等有机溶剂。苯甲酸在水中的溶解度如下:
温度/℃ 25 50 75
溶解度/g 0.34 0.85 2.2
活动探究
【实验】
(1)观察粗苯甲酸样品的状态。
(2)将1 g粗苯甲酸放入100 mL烧杯,加入50 mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
1.重结晶法提取苯甲酸的原理是什么?
提示:根据苯甲酸、氯化钠在水中溶解度的不同,使苯甲酸从饱和溶液中结晶析出,而氯化钠全部或大部分留在溶液中除去。
2.溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
提示:溶解粗苯甲酸时加热是为了溶解较多的苯甲酸,得到热的饱和苯甲酸溶液。趁热过滤的目的是防止溶液冷却析出苯甲酸晶体。
[思考交流]
3.如何检验提纯后的苯甲酸中氯化钠已被除净?
4.温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
提示:冷却结晶时,并不是温度越低越好,因为温度过低时,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯苯甲酸的目的。
提示:将提纯后的苯甲酸样品,溶于水后,加入硝酸银溶液,观察是否有白色沉淀生成,若无白色沉淀生成,说明氯化钠已被除净。
1.原理
利用被提纯物质与杂质在同一溶剂中溶解度不同而将杂质除去。
2.溶剂的选择
(三)重结晶
归纳总结
加热溶解
趁热过滤
冷却结晶
3.实验仪器与操作步骤
结晶的三种类型
(1)蒸发结晶:将溶剂蒸发获取晶体,此法适用于溶解度随温度变化不大的溶液,如粗盐的提纯。
(2)降温结晶:将热的饱和溶液慢慢冷却后析出晶体,此法适用于溶解度随温度变化较大的溶液。如氯化钠和硝酸钾的分离。
(3)重结晶:将已知的晶体用蒸馏水溶解,经过滤、蒸发、冷却等步骤,再次析出晶体,得到更纯净的晶体的过程。
名师点拨
1.关于苯甲酸的重结晶实验,其结论或解释错误的是( )
选项 实验步骤 实验现象 结论或解释
A 常温溶解 苯甲酸几乎不溶 苯甲酸常温时不溶于水或微溶于水
B 加热溶解 苯甲酸完全溶解 温度升高,苯甲酸溶解度增大
C 趁热过滤 过滤时伴有晶体析出 此晶体为杂质所形成
D 冷却结晶,滤出晶体 针状晶体 针状晶体为苯甲酸
巩固练习
C
【解析】常温下,苯甲酸的溶解度较小,所以常温溶解时,苯甲酸几乎不溶解,A正确;苯甲酸的溶解度随温度的升高增大,加热苯甲酸完全溶解,B正确;过滤时,过滤器的温度低,所以与过滤器接触的溶液的温度降低析出苯甲酸,即过滤时析出的晶体为苯甲酸,C错误;冷却苯甲酸的浓溶液,会析出苯甲酸晶体,所以冷却结晶时,溶液中析出的针状晶体是苯甲酸晶体,D正确。
2.硝酸钾、氯化钠的溶解度曲线如图所示,在较高温度下的某溶液中,硝酸钾、氯化钠均达饱和,冷却析出晶体的成分是( )
A.纯硝酸钾
B.大量硝酸钾,少量氯化钠
C.等量的硝酸钾和氯化钠
D.大量氯化钠,少量硝酸钾
B
【解析】不同物质的溶解度受温度变化影响不同,硝酸钾的溶解度随温度升高而升高,氯化钠的溶解度随温度变化影响不大。在冷却热饱和溶液时硝酸钾容易析出晶体,氯化钠析出较少,所以冷却析出晶体的成分是大量硝酸钾,少量氯化钠。
已知苯甲醛易被氧气氧化,苯甲醇的沸点为205.3 ℃,苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为 0.34 g;乙醚的沸点为34.8 ℃,难溶于水。实验室制备苯甲醇和苯甲酸的化学原理是:
能力提升
1.操作Ⅰ的名称是什么?乙醚溶液中所溶解的主要成分有哪些?
提示:由题意可知,白色糊状物为苯甲醇和苯甲酸钾,加入水和乙醚后,根据相似相溶原理,乙醚中溶有苯甲醇,水中溶有苯甲酸钾,两种液体可用分液法分离。
制备苯甲醇和苯甲酸的主要过程如下图所示:
2.操作Ⅱ的名称是什么?有什么判断依据?产品甲是什么?
提示:溶解在乙醚中的苯甲醇沸点高于乙醚,可蒸馏分离,所以操作Ⅱ是蒸馏,产品甲是苯甲醇。
3.操作Ⅲ的名称是什么?有什么判断依据?产品乙是什么?
提示:加入盐酸后生成的苯甲酸为微溶于水的晶体,可过滤分离。所以操作Ⅲ是过滤,产品乙是苯甲酸。
首先要熟记各种分离和提纯方法的适用范围,然后根据被提纯物与杂质性质的差异选择合适的分离提纯方法。
1.固体与液体的混合物
方法 适用条件 实例
过滤 难溶固体与液体混合物 碳酸钙悬浊液、泥水等
蒸发结晶 溶质的溶解度受温度变化影响较小 从NaCl溶液中提取NaCl晶体
归纳总结
方法 适用条件 实例
溶解、过滤 在某种试剂中一种可溶而另一种不溶的固体混合物 碳酸钠和碳酸钙
结晶 用于溶解度随温度变化相差较大的可溶性固体混合物 除去KNO3中混有的少量NaCl
升华 分离某种组分易升华的混合物 分离I2和NaCl固体
2.固体与固体的混合物
方法 适用条件 实例
萃取、分液 互不相溶的液体混合物 分离CCl4和水等
蒸馏 两种或两种以上互溶的液体,沸点相差较大 分离酒精和水
3.液体与液体的混合物
A.步骤1中有机相应从分液漏斗下口放出,无机相从上口倒出
B.步骤2分离方法为过滤
C.步骤3可在装置 中完成
D.步骤4中,将溶液蒸发至只剩少量水时,用余热蒸干
某化学兴趣小组从含有KI、KNO3等成分的工业废水中回收I2和KNO3,其流程如图。下列说法正确的是( )
迁移应用
C
【解析】含有KI、KNO3的废水中通入过量的氯气,加入苯萃取,分液,有机相含有苯、碘,经蒸馏可得到苯以及粗碘,经升华得到碘,无机相为硝酸钾溶液,经蒸发浓缩、冷却结晶得到硝酸钾。苯的密度比水小,应从上口倒出,A错误;步骤2应为蒸馏,B错误;步骤3为碘的升华,C正确;硝酸钾易分解,应蒸发浓缩、冷却结晶,D错误。
1.甘油是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1.26 g·mL-1,沸点约290 ℃,分离水和甘油最合理的方法是( )
A.蒸馏 B.蒸发
C.过滤 D.萃取分液
【解析】甘油和水互溶,不能用过滤、蒸发、分液的方法分离,而二者沸点不同,可用蒸馏的方法分离。
当堂检测
A
2.下列操作中选择的仪器正确的是( )
①分离汽油和氯化钠溶液 ②从含Fe3+的自来水中得到蒸馏水 ③分离氯化钾和二氧化锰混合物 ④从食盐水中提取溶质
A.①—丁 ②—丙 ③—甲 ④—乙
B.①—乙 ②—丙 ③—甲 ④—丁
C.①—丁 ②—丙 ③—乙 ④—甲
D.①—丙 ②—乙 ③—丁 ④—甲
A
【解析】①汽油和氯化钠溶液不互溶,可用分液法分离;②从含Fe3+的自来水中得到蒸馏水,可利用蒸馏法;③氯化钾易溶于水,二氧化锰难溶于水,可溶解后过滤分离;④从氯化钠溶液中得到氯化钠晶体,可利用蒸发的方法。
3.下列有关实验的说法错误的是( )
A.在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点
B.用结晶法分离硝酸钾和氯化钠的混合物,用分液法分离水和硝基苯的混合物
C.在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失
D.作为重结晶实验的溶剂,杂质在此溶液中的溶解度受温度影响应该很大
D
【解析】在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点,故A正确;硝酸钾的溶解度随温度升高而急剧增大,氯化钠的溶解度随温度变化很小,所以用结晶法分离硝酸钾和氯化钠的混合物,水和硝基苯不互溶,所以用分液法分离水和硝基苯的混合物,故B正确;在重结晶实验中,要求被提纯物和杂质的溶解度随温度的变化差别很大,杂质在此溶液中的溶解度受温度影响不一定很大,故D错误。
4.现有四组混合物:①乙酸乙酯和乙酸钠溶液 ②乙醇和水 ③溴化钠和溴单质的水溶液 ④碘和四氯化碳的混合物,分离以上各混合物的正确方法依次是( )
A.分液、萃取、蒸馏、萃取 B.萃取、蒸馏、分液、萃取
C.分液、蒸馏、萃取、蒸馏 D.蒸馏、萃取、分液、萃取
C
【解析】①乙酸乙酯和乙酸钠溶液互不相溶,可用分液的方法分离;②乙醇和水、④碘和四氯化碳互溶,但沸点不同,可用蒸馏的方法分离;③溴化钠易溶于水,而溴单质不易溶于水,易溶于有机溶剂,两者可用萃取法分离。
5.选择下列实验方法分离提纯物质,将分离提纯方法的字母填在横线上。
A.萃取分液 B.升华 C.重结晶 D.分液 E.蒸馏 F.过滤 G.洗气
(1)________从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
(2)________分离水和汽油的混合物。
(3)________分离CCl4(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。
(4)________除去混在乙烷中的乙烯。
(5)________提取碘水中的碘。
CF
D
E
G
A
【解析】硝酸钾在水中的溶解度随温度升高明显增大而NaCl在水中的溶解度受温度影响不大,采用重结晶法和过滤可将其分离;水和汽油互不相溶,分层,可用分液法进行分离;CCl4和甲苯两种互溶的液体,沸点差大于30 ℃,可用蒸馏法分离;乙烯可被溴水吸收,可用洗气的方法除去;碘在有机溶剂中溶解度大,可用萃取分液方法提纯。
