3.2.2 酚 课件(共39张PPT) 高中化学人教版(2019)选择性必修3
文档属性
| 名称 | 3.2.2 酚 课件(共39张PPT) 高中化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-04 15:45:59 | ||
图片预览





文档简介
(共39张PPT)
第2课时 酚
第二节 醇 酚
1.结合代表物苯酚了解酚的结构,理解酚的性质及应用。
2.根据苯酚的化学性质,理解有机物中基团之间的相互影响。
学习目标
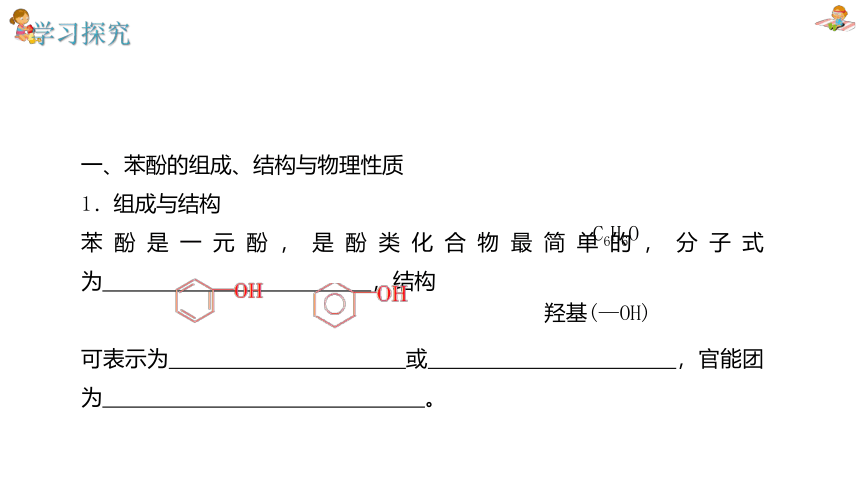
一、苯酚的组成、结构与物理性质
1.组成与结构
苯酚是一元酚,是酚类化合物最简单的,分子式为 ,结构
可表示为 或 ,官能团为 。
羟基(—OH)
C6H6O
学习探究
2.物理性质
(1)纯净的苯酚是 晶体,有 气味,易被空气氧化呈 。
(2)苯酚室温下在水中的溶解度为9.2 g,当温度高于65 ℃时能与水 ,苯酚易溶于 。
(3)苯酚有毒,对皮肤有 ,
如不慎沾到皮肤上,应立即用 冲
洗,再用水冲洗。
无色
特殊
粉红色
混溶
有机溶剂
腐蚀性
乙醇
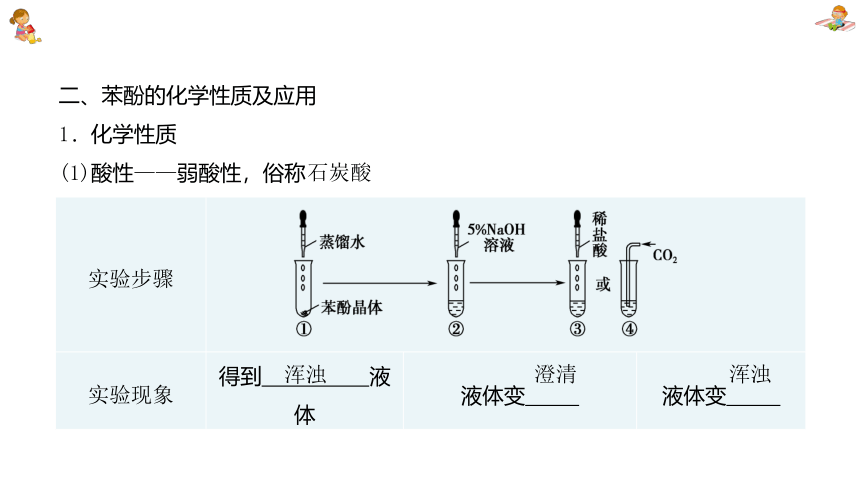
实验步骤 实验现象 得到 液体 液体变_____ 液体变_____
石炭酸
浑浊
澄清
浑浊
二、苯酚的化学性质及应用
1.化学性质
(1)酸性——弱酸性,俗称
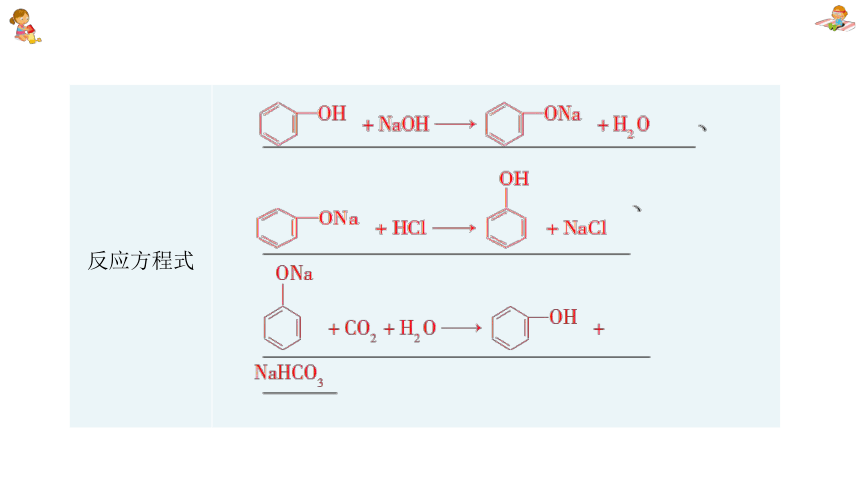
反应方程式
结论 室温下,苯酚在水中溶解度 。 苯酚能与NaOH溶液反应,表现出 性 酸性:
____H2CO3
解释 苯环对羟基的影响,使羟基上的氢原子更活泼,在水溶液中发生电离,显示 性 较小
酸
<
酸
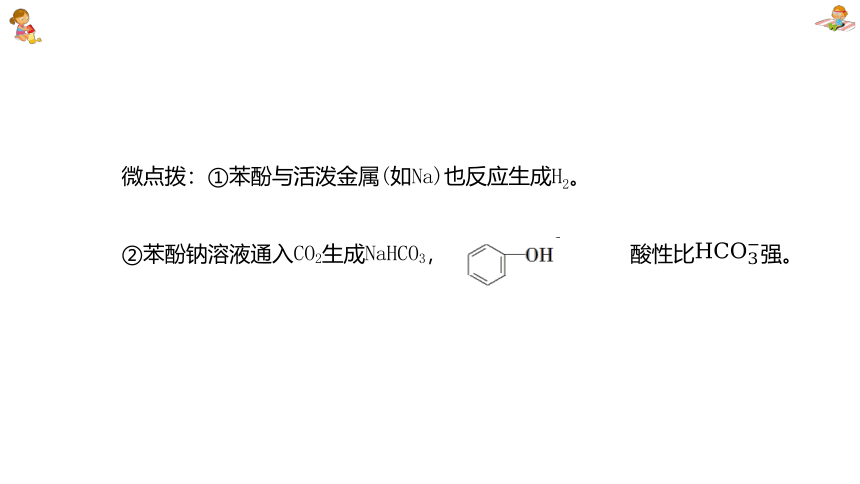
微点拨:①苯酚与活泼金属(如Na)也反应生成H2。
②苯酚钠溶液通入CO2生成NaHCO3, 酸性比强。
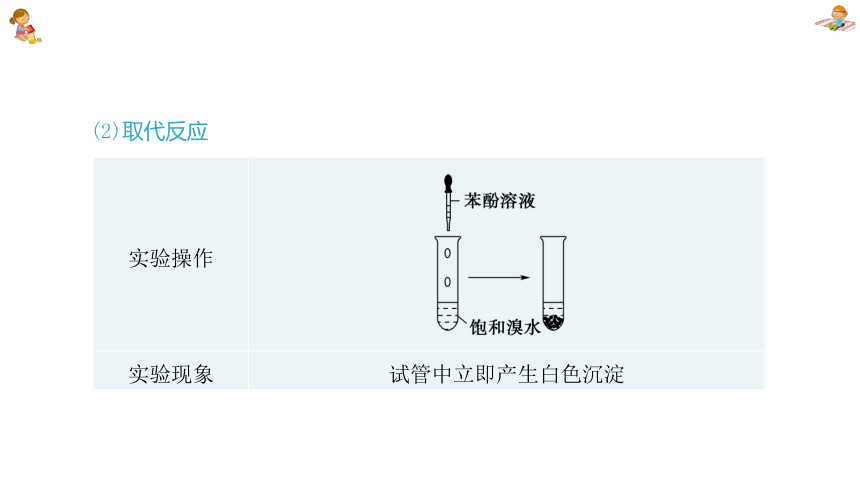
实验操作
实验现象 试管中立即产生白色沉淀
(2)取代反应
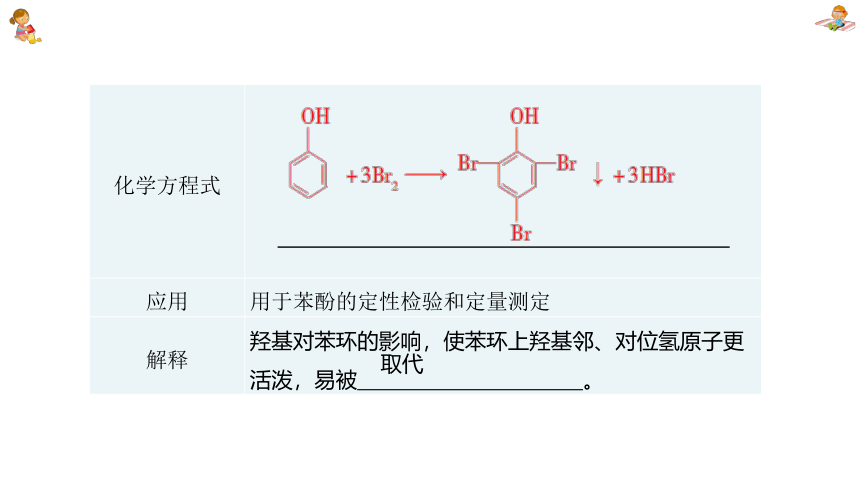
化学方程式
应用 用于苯酚的定性检验和定量测定
解释 羟基对苯环的影响,使苯环上羟基邻、对位氢原子更活泼,易被 。
取代
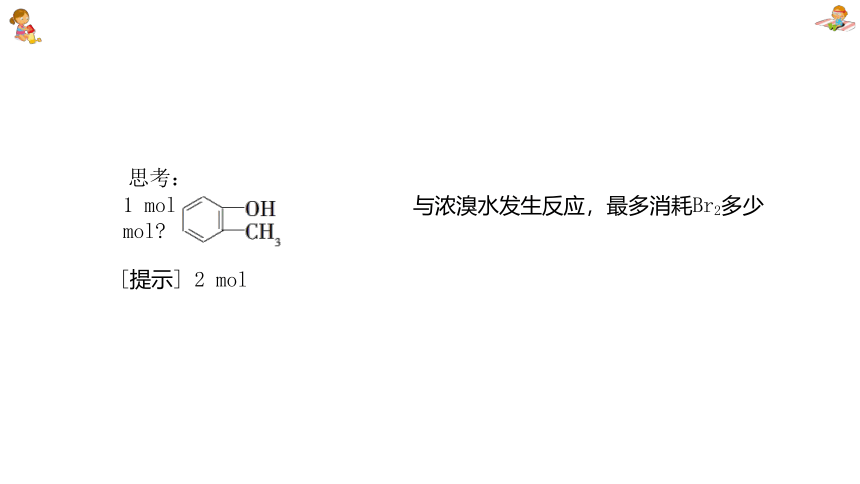
1 mol 与浓溴水发生反应,最多消耗Br2多少mol
思考:
[提示] 2 mol
(3)显色反应
苯酚与FeCl3溶液作用显紫色,利用此性质也可以检验苯酚的存在。酚类物质一般都可以与FeCl3作用显色,可用于检验其存在。
紫色溶液
2.应用
(1)苯酚是一种重要的化工原料,广泛用于制造酚醛树脂、染料、医药、农药等。
(2)苯酚的稀溶液可以直接杀菌消毒,如日常药皂中常加入少量的苯酚。
苯酚的用途
酚醛树脂
合成纤维
合成香料
医药
消毒剂
染料
农药
防腐剂
3.危害:含酚类物质的废水对生物具有毒害作用,会对水体造成严重污染。化工厂和炼焦厂的废水中常含有酚类物质,在排放前必须经过处理。
小试牛刀
1.判断正误(对的在括号内打“√”,错的在括号内打“×”。)
(1) 互称为同系物。 ( )
(2)苯酚可以燃烧,但常温下不与O2反应。 ( )
(3)苯酚不慎沾到皮肤,可以用Na2CO3溶液冲洗。 ( )
(4)苯酚与醇中的—OH活性相似均不与碱反应。 ( )
×
×
×
×
2.下列关于苯酚的叙述中,正确的是( )
A.苯酚常温下易溶于水
B.分子中的13个原子有可能处于同一平面内
C.可以和NaHCO3溶液反应产生气体
D.能与FeCl3溶液反应生成紫色沉淀
B
3.下列物质中:
(1)与Na反应生成H2的有 (填序号, 下同)
(2)与NaOH反应的有 。
(3)与浓溴水反应的有 。
(4)与FeCl3溶液显色的有 。
①②③④
②③
②③
②③
酚类与醇类的结构与化学性质比较
重难点探究
1. 的化学性质有哪些?并给予解释。
[提示](1)弱酸性:—OH受苯环的影响在水中可以发生微弱电离,表现酸性。
(2)与Br2的取代反应:苯环分子中相对于—OH的邻、对位碳上氢原子受—OH的影响,易发生取代反应。
(3)显色反应:与FeCl3溶液生成有色结合物而显紫色。
(4)氧化反应:苯环上受—OH的影响,易被氧化。
问题探究:
2. 的化学性质有哪些?请具体说明。
[提示](1)与活泼金属(Na)反应,
(2)与羧酸的酯化反应,
(3)催化氧化为醛,
(4)被酸性KMnO4氧化为 ,
(5)与HX的取代反应,
(6)分子间的取代反应生成醚。
[提示](1)均与活泼金属Na反应,
(2)均可以燃烧和被酸性KMnO4溶液氧化,
(3)均可以发生取代反应。
3. 共性有哪些?
醇 酚
共性 ①与Na反应 ②取代反应 ③氧化反应(燃烧)和被酸性KMnO4溶液氧化 1.醇和酚的化学性质比较
特性 ①某些醇消去反应 ②某些醇催化氧化生成醛(或酮) ①显色反应(遇FeCl3溶液显紫色)
②弱酸性
③与饱和溴水反应产生白色沉淀
核心归纳:
2.酚类分子中羟基与苯环的相互影响
(1)苯环对羟基的影响
醇不与NaOH溶液反应,而苯酚呈弱酸性能与NaOH溶液反应,说明苯酚分子中的羟基受到苯环的影响,使羟基中的氢原子变得更容易电离,表现出一定的酸性。
(2)羟基对苯环的影响:苯环中,羟基邻、对位上的氢原子的活泼性增强,更易被取代。
3.苯的同系物中烃基与苯环的相互影响
(1)苯的硝化反应生成—硝基苯,而苯的同系物的硝化反应受烃基影响,使烃基所连碳的邻、对位上的C—H易发生取代,生成多硝基化合物。
(2)烷烃和苯均不能使酸性KMnO4溶液褪色,但苯的同系物中受苯环的影响,当连接苯环的第一个碳原子上有氢原子时,能使酸性KMnO4溶液褪色。
对点练习:
1.关于 的说法中,
不正确的是( )
A.都能与金属钠反应放出氢气
B.三者互为同系物
C.都能使酸性KMnO4溶液褪色
D.都能在一定条件下发生取代反应
B
2.下列说法正确的是( )
A.苯甲醇和苯酚都能与饱和溴水反应产生白色沉淀
B.苯甲醇、苯酚在分子组成上相差一个CH2原子团,故两者互为同系物
C. 互为同分异构体
D.乙醇、苯甲醇、苯酚都既能与钠反应,又能与NaOH反应
C
3.漆酚是我国特产漆的主要成分,结构如下所示,
苯环侧链烃基为链状结构,则下列说法错误的是 ( )
A.能与FeCl3溶液发生显色反应
B.能使酸性KMnO4溶液褪色
C.能与NaHCO3溶液反应放出CO2
D.1 mol漆酚与足量浓溴水反应最多消耗5 mol Br2
C
4.有机物分子中的原子(团)之间会相互影响,导致相同的原子(团)表现不同的性质。下列各项事实不能说明上述观点的是 ( )
A.甲苯能使酸性高锰酸钾溶液褪色,而甲基环己烷不能使酸性高锰酸钾溶液褪色
B.乙烯能与溴水发生加成反应,而乙烷不能发生加成反应
C.苯酚可以与NaOH反应,而乙醇不能与NaOH反应
D.苯酚与溴水可直接反应,而苯与液溴反应则需要FeBr3作催化剂
B
情境探究
苯酚的分离与提纯
苯酚是一种重要的化工原料,广泛用于制造酚醛树脂、染料、医药、农药等。含酚类物质的废水对生物具有毒害作用,会对水体造成严重污染。化工厂和炼焦厂的废水中常含有酚类物质,在排放前必须经过处理。下列提供了两种分离、回收苯酚的方案:
类型一 废水中含有苯酚,其回收方案为
类型二 乙醇中混有苯酚,其回收方案为
问题探究:
1.对于类型一中:
(1)开始加入苯,利用苯的什么性质?能否改用酒精?为什么?
(2)分液用到的玻璃仪器是什么?分液时上、下层液体如何分离?
(3)苯酚的苯溶液中加入NaOH溶液,写出反应的化学方程式。
(4)从苯酚的浊液中分离苯酚为什么用分液而不用过滤?
[提示](1)苯酚易溶于苯,且苯与水不相溶。不能改用酒精,因为酒精与水互溶。
(2)分液漏斗,先把下层液体从分液漏斗的下端放出,然后再把上层液体从分液漏斗的上口倒出。
(4)苯酚与水形成的是乳浊液而非悬浊液,静置后分层,用分液法分离。
2.对于类型二中:
(1)不加NaOH溶液,直接蒸馏可以吗?为什么?
(2)蒸馏所用的玻璃仪器有哪些?
(3)蒸馏后所得的水溶液中通入足量CO2充分反应,写出有关的化学方程式。
(4)含苯酚的浊液静置后分层,苯酚在哪层?
[提示](1)不可以,苯酚和乙醇均易挥发,无法分离。
(2)蒸馏烧瓶、温度计、酒精灯、冷凝管、牛角管、锥形瓶。
(4)苯酚在下层。
当堂检测
1.下列物质中与苯酚互为同系物的是( )
C
2.下列关于苯酚的叙述中,不正确的是( )
A.其浓溶液如果不慎沾在皮肤上,应立即用酒精擦洗
B.其水溶液显强酸性,俗称石炭酸
C.超过65 ℃可以与水以任意比互溶
D.纯净的苯酚是无色晶体,在空气中易被氧化而呈粉红色
B
3.已知酸性强弱顺序为H2CO3>C6H5OH>,下列化学方程式正确的是( )
A.2C6H5ONa+H2O+CO2―→2C6H5OH+Na2CO3
B.C6H5OH+NaHCO3―→C6H5ONa+H2O+CO2↑
C.2C6H5OH+Na2CO3―→2C6H5ONa+H2O+CO2↑
D.C6H5OH+Na2CO3―→C6H5ONa+NaHCO3
D
4.下列四种有机化合物均含有多个官能团,其结构简式如下所示,下列有关说法中正确的是( )
A.①属于酚类,可与NaHCO3溶液反应产生CO2
B.②属于酚类,能使FeCl3溶液显紫色
C.1 mol③最多能与3 mol Br2发生苯环上的取代反应
D.④可以发生消去反应
D
5.含苯酚的工业废水必须处理达标后才能排放,苯酚含量在1 g·L-1以上的工业废水应回收苯酚。某研究性学习小组设计下列流程,探究废水中苯酚的回收方法。
(1)可用 为试剂检验水样中是否含有苯酚。
(2)操作Ⅰ的名称为 ,试剂a为 。
(3)通入CO2发生反应生成苯酚的化学方程式为
。
FeCl3溶液或浓溴水
萃取(或萃取、分液)
NaOH溶液
第2课时 酚
第二节 醇 酚
1.结合代表物苯酚了解酚的结构,理解酚的性质及应用。
2.根据苯酚的化学性质,理解有机物中基团之间的相互影响。
学习目标
一、苯酚的组成、结构与物理性质
1.组成与结构
苯酚是一元酚,是酚类化合物最简单的,分子式为 ,结构
可表示为 或 ,官能团为 。
羟基(—OH)
C6H6O
学习探究
2.物理性质
(1)纯净的苯酚是 晶体,有 气味,易被空气氧化呈 。
(2)苯酚室温下在水中的溶解度为9.2 g,当温度高于65 ℃时能与水 ,苯酚易溶于 。
(3)苯酚有毒,对皮肤有 ,
如不慎沾到皮肤上,应立即用 冲
洗,再用水冲洗。
无色
特殊
粉红色
混溶
有机溶剂
腐蚀性
乙醇
实验步骤 实验现象 得到 液体 液体变_____ 液体变_____
石炭酸
浑浊
澄清
浑浊
二、苯酚的化学性质及应用
1.化学性质
(1)酸性——弱酸性,俗称
反应方程式
结论 室温下,苯酚在水中溶解度 。 苯酚能与NaOH溶液反应,表现出 性 酸性:
____H2CO3
解释 苯环对羟基的影响,使羟基上的氢原子更活泼,在水溶液中发生电离,显示 性 较小
酸
<
酸
微点拨:①苯酚与活泼金属(如Na)也反应生成H2。
②苯酚钠溶液通入CO2生成NaHCO3, 酸性比强。
实验操作
实验现象 试管中立即产生白色沉淀
(2)取代反应
化学方程式
应用 用于苯酚的定性检验和定量测定
解释 羟基对苯环的影响,使苯环上羟基邻、对位氢原子更活泼,易被 。
取代
1 mol 与浓溴水发生反应,最多消耗Br2多少mol
思考:
[提示] 2 mol
(3)显色反应
苯酚与FeCl3溶液作用显紫色,利用此性质也可以检验苯酚的存在。酚类物质一般都可以与FeCl3作用显色,可用于检验其存在。
紫色溶液
2.应用
(1)苯酚是一种重要的化工原料,广泛用于制造酚醛树脂、染料、医药、农药等。
(2)苯酚的稀溶液可以直接杀菌消毒,如日常药皂中常加入少量的苯酚。
苯酚的用途
酚醛树脂
合成纤维
合成香料
医药
消毒剂
染料
农药
防腐剂
3.危害:含酚类物质的废水对生物具有毒害作用,会对水体造成严重污染。化工厂和炼焦厂的废水中常含有酚类物质,在排放前必须经过处理。
小试牛刀
1.判断正误(对的在括号内打“√”,错的在括号内打“×”。)
(1) 互称为同系物。 ( )
(2)苯酚可以燃烧,但常温下不与O2反应。 ( )
(3)苯酚不慎沾到皮肤,可以用Na2CO3溶液冲洗。 ( )
(4)苯酚与醇中的—OH活性相似均不与碱反应。 ( )
×
×
×
×
2.下列关于苯酚的叙述中,正确的是( )
A.苯酚常温下易溶于水
B.分子中的13个原子有可能处于同一平面内
C.可以和NaHCO3溶液反应产生气体
D.能与FeCl3溶液反应生成紫色沉淀
B
3.下列物质中:
(1)与Na反应生成H2的有 (填序号, 下同)
(2)与NaOH反应的有 。
(3)与浓溴水反应的有 。
(4)与FeCl3溶液显色的有 。
①②③④
②③
②③
②③
酚类与醇类的结构与化学性质比较
重难点探究
1. 的化学性质有哪些?并给予解释。
[提示](1)弱酸性:—OH受苯环的影响在水中可以发生微弱电离,表现酸性。
(2)与Br2的取代反应:苯环分子中相对于—OH的邻、对位碳上氢原子受—OH的影响,易发生取代反应。
(3)显色反应:与FeCl3溶液生成有色结合物而显紫色。
(4)氧化反应:苯环上受—OH的影响,易被氧化。
问题探究:
2. 的化学性质有哪些?请具体说明。
[提示](1)与活泼金属(Na)反应,
(2)与羧酸的酯化反应,
(3)催化氧化为醛,
(4)被酸性KMnO4氧化为 ,
(5)与HX的取代反应,
(6)分子间的取代反应生成醚。
[提示](1)均与活泼金属Na反应,
(2)均可以燃烧和被酸性KMnO4溶液氧化,
(3)均可以发生取代反应。
3. 共性有哪些?
醇 酚
共性 ①与Na反应 ②取代反应 ③氧化反应(燃烧)和被酸性KMnO4溶液氧化 1.醇和酚的化学性质比较
特性 ①某些醇消去反应 ②某些醇催化氧化生成醛(或酮) ①显色反应(遇FeCl3溶液显紫色)
②弱酸性
③与饱和溴水反应产生白色沉淀
核心归纳:
2.酚类分子中羟基与苯环的相互影响
(1)苯环对羟基的影响
醇不与NaOH溶液反应,而苯酚呈弱酸性能与NaOH溶液反应,说明苯酚分子中的羟基受到苯环的影响,使羟基中的氢原子变得更容易电离,表现出一定的酸性。
(2)羟基对苯环的影响:苯环中,羟基邻、对位上的氢原子的活泼性增强,更易被取代。
3.苯的同系物中烃基与苯环的相互影响
(1)苯的硝化反应生成—硝基苯,而苯的同系物的硝化反应受烃基影响,使烃基所连碳的邻、对位上的C—H易发生取代,生成多硝基化合物。
(2)烷烃和苯均不能使酸性KMnO4溶液褪色,但苯的同系物中受苯环的影响,当连接苯环的第一个碳原子上有氢原子时,能使酸性KMnO4溶液褪色。
对点练习:
1.关于 的说法中,
不正确的是( )
A.都能与金属钠反应放出氢气
B.三者互为同系物
C.都能使酸性KMnO4溶液褪色
D.都能在一定条件下发生取代反应
B
2.下列说法正确的是( )
A.苯甲醇和苯酚都能与饱和溴水反应产生白色沉淀
B.苯甲醇、苯酚在分子组成上相差一个CH2原子团,故两者互为同系物
C. 互为同分异构体
D.乙醇、苯甲醇、苯酚都既能与钠反应,又能与NaOH反应
C
3.漆酚是我国特产漆的主要成分,结构如下所示,
苯环侧链烃基为链状结构,则下列说法错误的是 ( )
A.能与FeCl3溶液发生显色反应
B.能使酸性KMnO4溶液褪色
C.能与NaHCO3溶液反应放出CO2
D.1 mol漆酚与足量浓溴水反应最多消耗5 mol Br2
C
4.有机物分子中的原子(团)之间会相互影响,导致相同的原子(团)表现不同的性质。下列各项事实不能说明上述观点的是 ( )
A.甲苯能使酸性高锰酸钾溶液褪色,而甲基环己烷不能使酸性高锰酸钾溶液褪色
B.乙烯能与溴水发生加成反应,而乙烷不能发生加成反应
C.苯酚可以与NaOH反应,而乙醇不能与NaOH反应
D.苯酚与溴水可直接反应,而苯与液溴反应则需要FeBr3作催化剂
B
情境探究
苯酚的分离与提纯
苯酚是一种重要的化工原料,广泛用于制造酚醛树脂、染料、医药、农药等。含酚类物质的废水对生物具有毒害作用,会对水体造成严重污染。化工厂和炼焦厂的废水中常含有酚类物质,在排放前必须经过处理。下列提供了两种分离、回收苯酚的方案:
类型一 废水中含有苯酚,其回收方案为
类型二 乙醇中混有苯酚,其回收方案为
问题探究:
1.对于类型一中:
(1)开始加入苯,利用苯的什么性质?能否改用酒精?为什么?
(2)分液用到的玻璃仪器是什么?分液时上、下层液体如何分离?
(3)苯酚的苯溶液中加入NaOH溶液,写出反应的化学方程式。
(4)从苯酚的浊液中分离苯酚为什么用分液而不用过滤?
[提示](1)苯酚易溶于苯,且苯与水不相溶。不能改用酒精,因为酒精与水互溶。
(2)分液漏斗,先把下层液体从分液漏斗的下端放出,然后再把上层液体从分液漏斗的上口倒出。
(4)苯酚与水形成的是乳浊液而非悬浊液,静置后分层,用分液法分离。
2.对于类型二中:
(1)不加NaOH溶液,直接蒸馏可以吗?为什么?
(2)蒸馏所用的玻璃仪器有哪些?
(3)蒸馏后所得的水溶液中通入足量CO2充分反应,写出有关的化学方程式。
(4)含苯酚的浊液静置后分层,苯酚在哪层?
[提示](1)不可以,苯酚和乙醇均易挥发,无法分离。
(2)蒸馏烧瓶、温度计、酒精灯、冷凝管、牛角管、锥形瓶。
(4)苯酚在下层。
当堂检测
1.下列物质中与苯酚互为同系物的是( )
C
2.下列关于苯酚的叙述中,不正确的是( )
A.其浓溶液如果不慎沾在皮肤上,应立即用酒精擦洗
B.其水溶液显强酸性,俗称石炭酸
C.超过65 ℃可以与水以任意比互溶
D.纯净的苯酚是无色晶体,在空气中易被氧化而呈粉红色
B
3.已知酸性强弱顺序为H2CO3>C6H5OH>,下列化学方程式正确的是( )
A.2C6H5ONa+H2O+CO2―→2C6H5OH+Na2CO3
B.C6H5OH+NaHCO3―→C6H5ONa+H2O+CO2↑
C.2C6H5OH+Na2CO3―→2C6H5ONa+H2O+CO2↑
D.C6H5OH+Na2CO3―→C6H5ONa+NaHCO3
D
4.下列四种有机化合物均含有多个官能团,其结构简式如下所示,下列有关说法中正确的是( )
A.①属于酚类,可与NaHCO3溶液反应产生CO2
B.②属于酚类,能使FeCl3溶液显紫色
C.1 mol③最多能与3 mol Br2发生苯环上的取代反应
D.④可以发生消去反应
D
5.含苯酚的工业废水必须处理达标后才能排放,苯酚含量在1 g·L-1以上的工业废水应回收苯酚。某研究性学习小组设计下列流程,探究废水中苯酚的回收方法。
(1)可用 为试剂检验水样中是否含有苯酚。
(2)操作Ⅰ的名称为 ,试剂a为 。
(3)通入CO2发生反应生成苯酚的化学方程式为
。
FeCl3溶液或浓溴水
萃取(或萃取、分液)
NaOH溶液
