高中化学选修三有机化学基础课件(人教版)2.1烷 烃(共51张PPT)
文档属性
| 名称 | 高中化学选修三有机化学基础课件(人教版)2.1烷 烃(共51张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-04 17:23:04 | ||
图片预览





文档简介
(共51张PPT)
01
第一节 烷烃
学习目标
1. 掌握烷烃的结构特点和性质。
2. 理解同系物的涵义。
3. 理解烃基和常见烷基的意义。
4. 掌握烷烃的习惯命名法以及系统命名法。
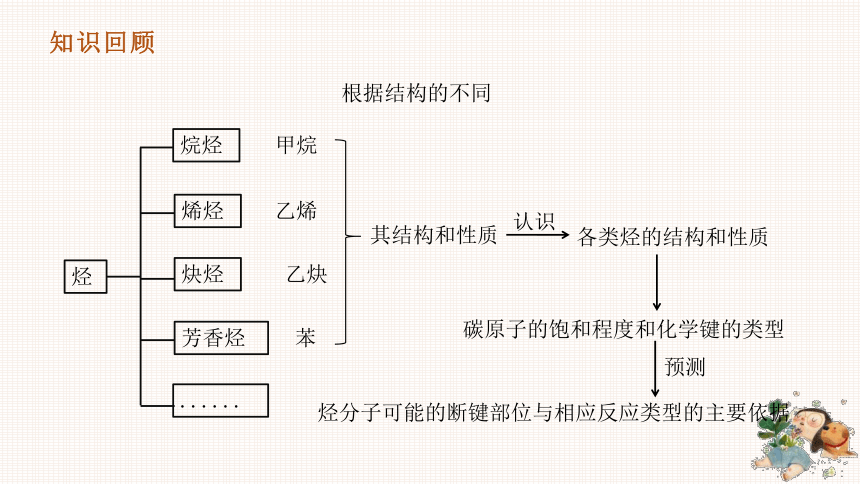
烃
根据结构的不同
烷烃
烯烃
炔烃
芳香烃
......
甲烷
乙烯
乙炔
苯
其结构和性质
认识
各类烃的结构和性质
碳原子的饱和程度和化学键的类型
烃分子可能的断键部位与相应反应类型的主要依据
预测
知识回顾
天然气
液化石油气
汽油、柴油
凡士林
石蜡
生活中常见的烷烃
一、烷烃的结构和性质
通常我们把链状的烃叫脂肪烃,烷烃是一类饱和的脂肪烃
1.烷烃的存在
天然气、液化石油气、汽油、柴油、凡士林、石蜡等,它们的主要成分都是烷烃。
学习探究
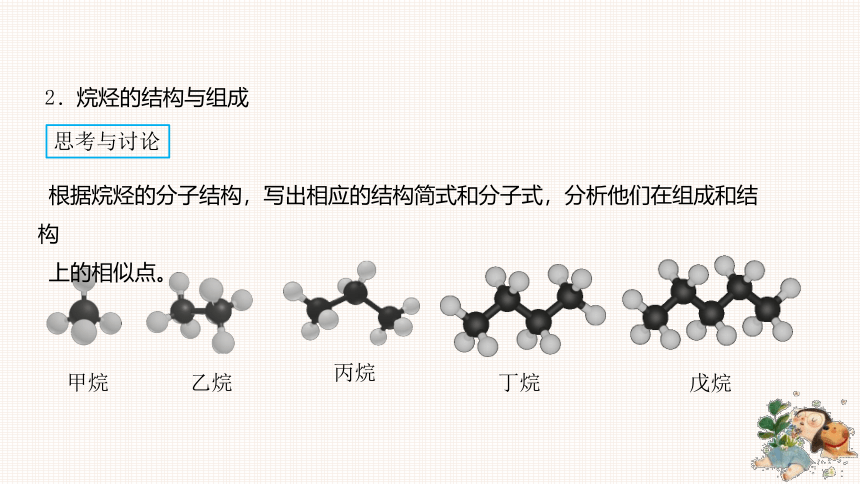
甲烷
乙烷
丙烷
丁烷
戊烷
根据烷烃的分子结构,写出相应的结构简式和分子式,分析他们在组成和结构
上的相似点。
思考与讨论
2.烷烃的结构与组成
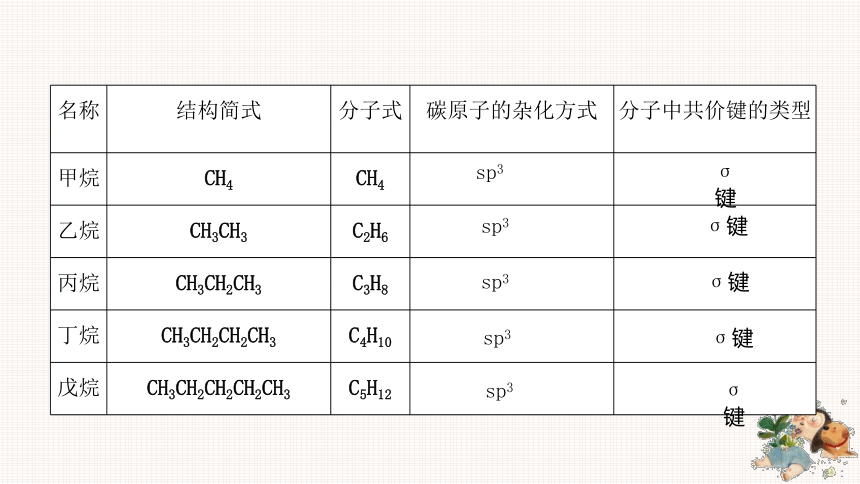
名称 结构简式 分子式 碳原子的杂化方式 分子中共价键的类型
甲烷 CH4 CH4
乙烷 CH3CH3 C2H6
丙烷 CH3CH2CH3 C3H8
丁烷 CH3CH2CH2CH3 C4H10
戊烷 CH3CH2CH2CH2CH3 C5H12
sp3
sp3
sp3
sp3
sp3
σ键
σ键
σ键
σ键
σ键
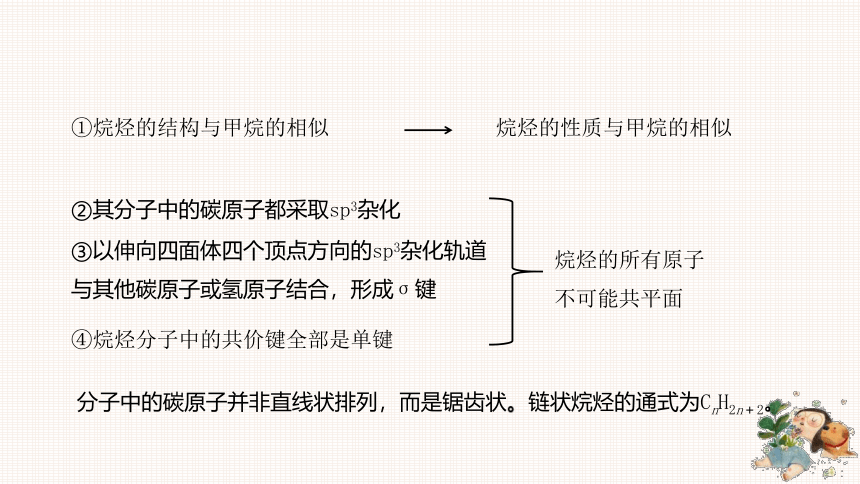
①烷烃的结构与甲烷的相似
②其分子中的碳原子都采取sp3杂化
③以伸向四面体四个顶点方向的sp3杂化轨道与其他碳原子或氢原子结合,形成σ键
④烷烃分子中的共价键全部是单键
烷烃的性质与甲烷的相似
烷烃的所有原子不可能共平面
分子中的碳原子并非直线状排列,而是锯齿状。链状烷烃的通式为CnH2n+2。
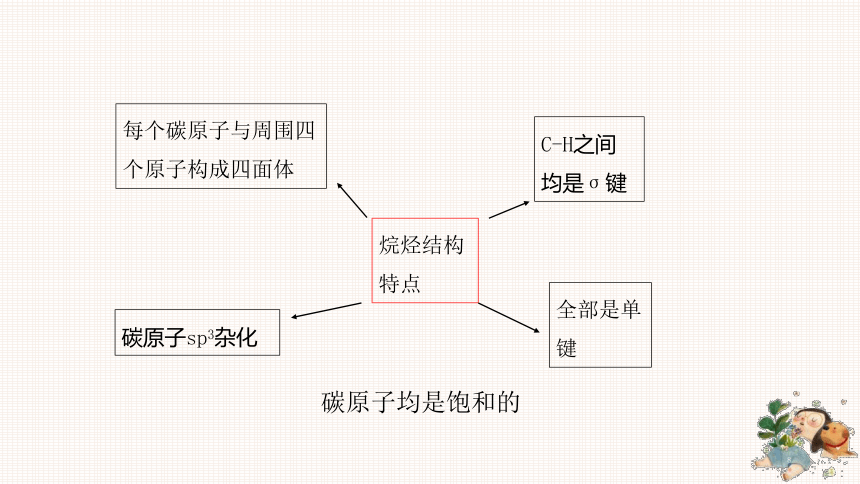
烷烃结构特点碳原子sp3杂化全部是单键C-H之间均是σ键每个碳原子与周围四个原子构成四面体碳原子均是饱和的3.甲烷的性质
甲烷的化学性质比较稳定,常温下不能被酸性高锰酸钾溶液氧化。也不与强酸、强碱及溴的四氯化碳溶液反应。
①在空气中燃烧(可燃性)发生氧化反应
②能在光照下与氯气发生取代反应
甲烷的主要化学性质表现为能在
纯净的甲烷是无色、无臭的气体,难溶于水,密度比空气的小
(1)根据甲烷的性质推测烷烃可能具有的性质,填写下表。
颜色 溶解性 可燃性 与酸性高锰酸钾溶液 与溴的四氯化碳溶液 与强酸、强碱溶液 与氯气(在光照下)
(2)根据甲烷的燃烧反应,写出汽油的成分之一辛烷(C8H18)完全燃烧的化学方程式。
无色
难溶
于水
空气中
可以燃烧
不反应
取代反应
不反应
不反应
2C8H18+25O2 16CO2+18H2O
点燃
思考与讨论
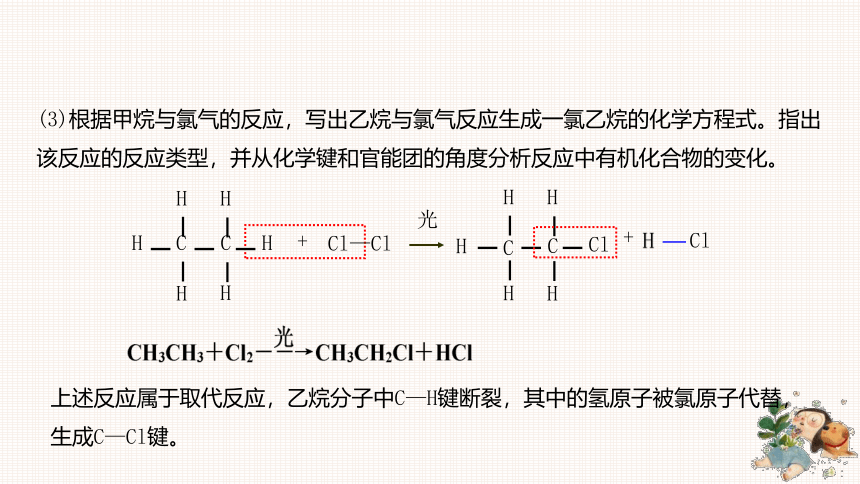
(3)根据甲烷与氯气的反应,写出乙烷与氯气反应生成一氯乙烷的化学方程式。指出该反应的反应类型,并从化学键和官能团的角度分析反应中有机化合物的变化。
+
Cl—Cl
光
C
C
H
H
H
H
H
H
C
C
Cl
H
H
H
H
H
Cl
H
+
上述反应属于取代反应,乙烷分子中C—H键断裂,其中的氢原子被氯原子代替,生成C—Cl键。
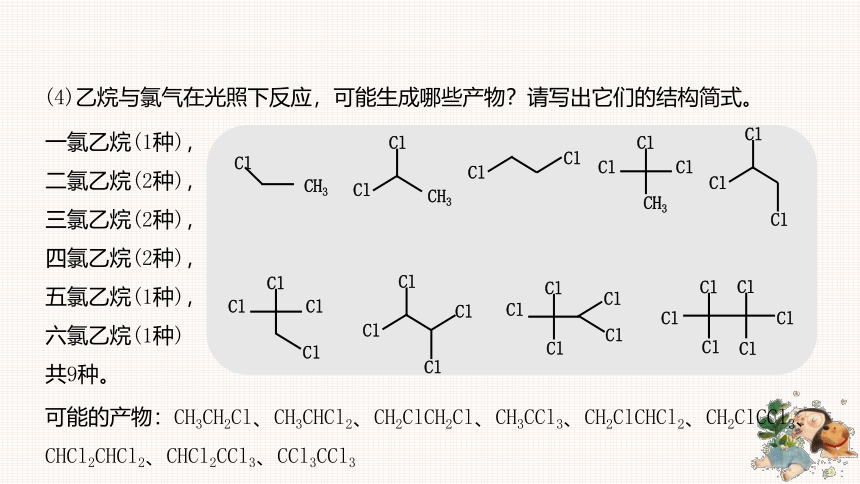
(4)乙烷与氯气在光照下反应,可能生成哪些产物?请写出它们的结构简式。
CH3
Cl
Cl
Cl
Cl
Cl
CH3
Cl
Cl
Cl
Cl
CH3
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
一氯乙烷(1种),二氯乙烷(2种),三氯乙烷(2种),四氯乙烷(2种),五氯乙烷(1种),六氯乙烷(1种)
共9种。
可能的产物:CH3CH2Cl、CH3CHCl2、CH2ClCH2Cl、CH3CCl3、CH2ClCHCl2、CH2ClCCl3、CHCl2CHCl2、CHCl2CCl3、CCl3CCl3
(1)甲烷的化学性质比较稳定,常温下不能被酸性KMnO4溶液氧化,也不与强酸、强碱及溴的四氯化碳溶液反应。但能在空气中发生燃烧反应和在光照下与Cl2发生取代反应。
4.烷烃的化学性质
(2)烷烃的性质与甲烷相似
①不与酸性KMnO4溶液、溴的四氯化碳溶液、强酸溶液、强碱溶液反应。
②氧化反应——可燃性
注:当碳含量少时,产生淡蓝色火焰,但随着碳原子数的增多,碳的质量分数逐渐增大,有黑烟产生
乙烷的取代反应
H-C-C-H+Cl-Cl → H-C-C-Cl+HCl
H H
H H
H H
H H
光照
键断裂
③特征反应——取代反应
烷烃可以与卤素单质(气态)在光照下发生取代反应生成卤代烃和卤化氢。
乙烷断裂的键为C—H键,形成键为C—Cl键和H—Cl键。
烷烃取代反应的特点:
①在光照条件下;
②与纯卤素反应;
③1 mol卤素单质只能取代1 mol H
④连锁反应,有多种产物(卤代烃和卤化氢气体)
④受热分解:烷烃在隔绝空气的条件下,加热或加催化剂可发生裂化或裂解
通式:一分子烷烃
一分子烷烃+一分子烯烃
举例:
烷烃的性质
溶解性(对水) 可燃性 与酸性高锰酸钾溶液 与溴的四氯化碳溶液 与强酸、强碱溶液 与氯气(在光照下)
难溶 可燃 不反应 不反应 不反应 取代反应
5.同系物:
(1)定义:
结构相似,在组成上相差一个或若干个CH2原子团的物质互称为同系物
(2)特点:
①通式相同,结构相似,化学性质相似属于同一类物质;
②物理性质一般随碳原子数目的增多而呈规律性变化,如随着碳原子数的增多,同系物的溶沸点逐渐升高,密度逐渐增大 ;
③在分子组成上相差一个或若干个“CH2”原子团,所以同系物一定具有不同的分子式,但相对分子质量的差值一定是14的整数倍。
同系物判断的三个关键点:
同
两种物质属于同一类物质,官能团的种类和数目一样。
似
差
两种物质结构相似,碳骨架的链接方式相同。
两种物质分子组成上相差一个或多个CH2原子团
(1)同系物一定具有不同的碳原子数(或分子式)。
(2)同系物一定具有不同的相对分子质量(相差14 n)。
部分烷烃的熔点、沸点和密度
烷烃名称 分子式 结构简式 常温下状态 熔点/℃ 沸点/℃ 密度/(g·cm-3)
甲烷 CH4 CH4 气体 -182 -164 0.423
乙烷 C2H6 CH3CH3 气体 -172 -89 0.545
丙烷 C3H8 CH3CH2CH3 气体 -187 -42 0.501
丁烷 C4H10 CH3CH2CH2CH3 气体 -138 -0.5 0.579
戊烷 C5H12 CH3(CH2)3CH3 气体 -129 36 0.626
壬烷 C9H20 CH3(CH2)7CH3 气体 -54 151 0.718
十一烷 C11H24 CH3(CH2)9CH3 气体 -26 196 0.740
十六烷 C16H34 CH3(CH2)14CH3 气体 18 280 0.775
十八烷 C18H38 CH3(CH2)16CH3 气体 28 308 0.777
分子中碳原子数
分子中碳原子数
③常温下的存在状态,由气态逐渐过渡到液态、固态。
①随着分子中碳原子数的递增,烷烃沸点逐渐升高。
② 随着分子中碳原子数的递增,烷烃密度逐渐增大。
友情提示:
②常温下烷烃的状态:
①所有烷烃均难溶于水,密度均小于1
C17以上为固态
C5~C16液态
C1~C4气态
6.烷烃同系物的物理性质的递变规律
物理性质 变化规律
状态 当碳原子数小于或等于4时,烷烃在常温下呈气态,其他的烷烃常温下呈液态或固态(新戊烷常温下为气态)
溶解性 都不溶于水,易溶于有机溶剂
沸点 随碳原子数的增加,沸点逐渐升高。碳原子数相同的烃,支链越多,沸点越低
密度 随碳原子数的增加,相对密度逐渐增大。烷烃、烯烃的密度小于水的密度
小试牛刀
(1)烷烃分子中的所有共价键全部是σ键。 ( )
(2)汽油、煤油、石蜡中的主要成分为烷烃。 ( )
(3)烷烃的化学性质稳定,不能发生氧化反应。 ( )
(4)乙烷的熔、沸点比丙烷的高。 ( )
判断正误(对的在括号内打“√”,错的在括号内打“×”。)
√
√
×
×
(5)烷烃能使酸性KMnO4溶液褪色。 ( )
(6)烷烃在一定条件下与卤素单质反应生成卤代烃。( )
(7)符合CnH2n+2的烃一定为烷烃。 ( )
(8)制取1-氯乙烷时可用乙烷和氯气反应。( )
×
×
√
√
二、烷烃的命名
1.烃基
(1)定义:烃分子中去掉1个或几个氢原子后所剩余的原子团叫烃基
(2)表示方法:-R
(3)烷基:
烷烃分子中去掉一个氢原子后剩余的基团称为烷基
(4)举例:
烷基的通式:-CnH2n+1。
烯基:乙烯基(-CH=CH2)
苯基: 或-C6H5,
(5)特点:呈电中性,不能单独存在
甲烷分子去掉1个氢原子是甲基(—CH3)
乙烷分子去掉1个氢原子是乙基(—CH2CH3)
丙烷(CH3CH2CH3)分子中有两组处于不同化学环境的氢原子,因此丙基有两种不同的结构
—CH2CH2CH3
正丙基
—CHCH3
CH3
异丙基
提示:4种。结构简式分别为—CH2CH2CH2CH3、CH(CH3)CH2CH3、
—CH2CH(CH3)CH3、—C(CH3)3。
试根据正丁烷和异丁烷的结构简式思考丁基有几种,并分别写出结构简式。
思考与讨论
(1)碳原子数在1~10之间用“天干” 甲、乙、丙、丁、戊、己、庚、辛、壬、癸 表示称某烷
(2)11个C原子以上的烷烃,用实际碳原子数表示:如:C11H24 称为十一烷
(3)若存在少量同分异构体: 依分子中支链多少以正、异、新表示
戊烷
C5H12
C8H18
辛烷
2.烷烃的命名法
习惯命名法
①丁烷有两种即正丁烷和异丁烷,结构简式分别为 和
②戊烷有三种,即正戊烷、异戊烷、新戊烷,其结构简式分别为
CH3CH2CH2CH3
CH3CH2CH2CH2CH3
正戊烷、异戊烷、新戊烷的沸点逐渐降低,原因是同种烷烃的不同异构体
中,支链越多其沸点越低。
由于烷烃分子中碳原子数目越多,结构越复杂,同分异构体的数目也越多,习惯命名法在实际应用中有很大的局限性。一套系统合理的命名方法便应运而生,这就是我们今天要学习的系统命名法。
系统命名法
(1)选主链、称“某烷”——“最长”碳链为主链
该分子最长碳链上有6个碳原,可称为己烷。
如图所示,应选A为主链。
说明:如果最长链不只一条,应选择连有支链多的最长链为主链。
CH3—CH—CH2—CH—CH3
CH3 CH2—CH3
把主链里离取代基(支链)最近的一端作为起点,用1、2、3等数字给主链的各碳原子依次编号定位,以确定支链所在的位置。
2
3
4
5
1
5
6
2
1
3
4
(2)选起点编序号、定支链
说明:两端等距离均有不同的支链时,从简单取代基开始编号
①把支链作为取代基。把取代基的名称写在烷烃名称的前面,在取代基的前面用阿拉伯数字注明它在烷烃主链上的位置,并在号数后连一短线,中间用“–”隔开。
CH3—CH—CH2—CH—CH3
CH3 CH2—CH3
己烷
甲基
2,4
(3)写名称
取代基写在前,注位置,连短线,不同基,简在前,相同基,合并写
5
6
1
2
3
4
②当有相同的取代基,则相加,然后用大写的二、三、四等数字表示写在取代基前面。但表示相同取代基位置的阿拉伯数字要用“,”隔开;如果几个取代基不同,就把简单的写在前面,复杂的写在后面。
己烷
甲基
2、4
二
说明:有多种支链时,支链编号数和要小
CH3—CH—CH2—CH—CH3
CH3 CH2—CH3
5
6
1
2
3
4
1.选主链,称某烷(最长碳链)
2.编号码,定支链(支链最近原则)
3.取代基,写在前,注位置,连短线
4.不同基,简在前,相同基,要合并
5.同位置,简在前。
6.支链序号的合数要最小
取代基位置-取代基数目 取代基名称 主链
阿拉伯数字 中文
(阿拉伯数字之间用“,”隔开;阿拉伯数字与文字之间用“—”隔开。)
系统命名法步骤:
(1)最长原则:应选最长的碳链做主链;
(2)最近原则:应从离支链最近一端对主链碳原子进行编号;
(3)最多原则:若存在多条等长主链时,应选择含支链数较多的碳链做主链;
(4)最简原则:若不同的支链距主链两端等长时,应从靠近简单支链的一端对主链碳原子进行编号;
(5)最小原则:若相同的支链距主链两端等长时,应以支链位号之和最小为原则,对主链碳原子进行编号。
烷烃命名五原则:
(1)请按下列步骤写出己烷同分异构体的结构简式,并用系统命名法进行命名。
步骤 结构简式 名称
①先写有最长碳链结构的同分异构体
②主链碳原子由6个减为5个,甲基有两种可能的位置分布
③主链碳原子由5个减为4个,两个甲基有两种可能的位置分布
己烷
2 -甲基戊烷
3 -甲基戊烷
2,3- 二甲基丁烷
2,2 -二甲基丁烷
思考与讨论
(2)根据丁烷两种同分异构体的结构,写出4种丁基(—C4H9)的结构简式。
共4种同分异构体
CH3—CH2—CH2—CH2—
丁烷有两种即正丁烷和异丁烷,结构简式分别为 和
CH3CH2CH2CH3
CH3—CH2—CH—
CH3
CH3—C—
CH3
CH3
CH3—CH—CH2—
CH3
(3)现在你能将C6H14的所有同分异构体用系统命名法命名吗?
CH3CH2CH2CH2CH2CH3
CH3CHCH2CH2CH3
CH3
CH3CH2CHCH2CH3
CH3
CH3
CH3CH2CCH3
CH3
CH3
CH3CH-CHCH3
CH3
1 2 3 4 5 6
己烷
1 2 3 4 5
1 2 3 4 5
1 2 3 4
4 3 2 1
2-甲基戊烷
3-甲基戊烷
2,3-二甲基丁烷
2,2-二甲基丁烷
编号位
定支链
烷烃命名的纲要
选主链称某烷
取代基写在前
标位置短线连
不同基简到繁
相同基合并算
2,2,3-三甲基丁烷
4-乙基庚烷
CH2 CH2 CH CH2 CH2
CH3
CH3
CH3
CH2
用系统命名法给下列烷烃命名。
CH3
CH3
CH3 C CH CH3
CH3
2,2,4,4-四甲基己烷
C2H5 CH3
CH3 C CH2 C CH3
CH3 CH3
小试牛刀
课堂小结
结
质
质
烷烃分子中的共价键全部是单键
化
学
性
物
理
性
构
烷烃的结构与甲烷的相似
其分子中的碳原子都采取sp3杂化,碳原子与碳原子或其他原子形成σ键
烷烃的结构与性质
能在光照下与氯气发生取代反应
常温下不能被酸性高锰酸钾溶液氧化,不与强酸、强碱及溴的四氯化碳溶液反应
能在空气中燃烧(可燃性)
随着烷烃碳原子数的增加,烷烃的熔点和沸点逐渐升高
随着烷烃碳原子数的增加,烷烃的密度逐渐增大
随着烷烃碳原子数的增加,常温下的存在状态也由气态逐渐过渡到液态、固态。
最长最多原则,称某烷
近,简,小原则,定支链
支链前主链后,还有短线隔
编号位,定支链;
取代基,写在前,
不同基, 简到繁,
选主链,称某烷;
标位置,短线连;
相同基,合并算。
1)选主链
3)写名称
2)编号位
烷烃的命名
1.下列有机物:①正丁烷,②丙烷,③2 -甲基丁烷,④异丁烷,⑤己烷。沸点由高到低的顺序为( )
A.②①④③⑤ B.⑤③④①②
C.⑤③①④② D.②①③④⑤
解析:五种有机物均为烷烃,烷烃分子中碳原子数目越多,其沸点越高;碳原子数目相同的烷烃,其支链越多,沸点越低,故五种烷烃的沸点由高到低的顺序为⑤③①④②。
C
课堂检测
2.关于烷烃的说法不正确的是( )
A.所有链状烷烃均符合通式CnH2n+2
B.烷烃分子中一定存在C—C σ键
C.烷烃分子中的碳原子均采取sp3杂化
D.烷烃分子中碳原子不一定在一条直线
解析:甲烷中不存在C—C键,B错误。
B
3.下列叙述错误的是 ( )
A.甲烷与氯气反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4,都属于取代反应
B.烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
C.分子通式为CnH2n+2的烃一定是链状烷烃
D.甲烷能够燃烧,在一定条件下会发生爆炸
解析:所有烷烃包括CH4都不能使酸性KMnO4溶液褪色,B错误。
B
4.下列物质的命名中肯定正确的是( )
A.2,2- 二甲基丁烷 B.3,3 -二甲基丁烷
C.2 -甲基- 3- 乙基丁烷 D.4- 甲基- 3 -乙基己烷
解析:先根据选项名称写结构简式,再重新命名。
A
5.在系统命名法中,下列有机化合物主链名称是丁烷的是( )
A.(CH3)2CHCH2CH2CH3 B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2 D.(CH3)3CCH2CH2CH3
C
解析:要求主链名称是丁烷,即分子中的最长碳链有4个碳原子。A、B、D分子中的最长碳链均为5个碳原子。
01
第一节 烷烃
学习目标
1. 掌握烷烃的结构特点和性质。
2. 理解同系物的涵义。
3. 理解烃基和常见烷基的意义。
4. 掌握烷烃的习惯命名法以及系统命名法。
烃
根据结构的不同
烷烃
烯烃
炔烃
芳香烃
......
甲烷
乙烯
乙炔
苯
其结构和性质
认识
各类烃的结构和性质
碳原子的饱和程度和化学键的类型
烃分子可能的断键部位与相应反应类型的主要依据
预测
知识回顾
天然气
液化石油气
汽油、柴油
凡士林
石蜡
生活中常见的烷烃
一、烷烃的结构和性质
通常我们把链状的烃叫脂肪烃,烷烃是一类饱和的脂肪烃
1.烷烃的存在
天然气、液化石油气、汽油、柴油、凡士林、石蜡等,它们的主要成分都是烷烃。
学习探究
甲烷
乙烷
丙烷
丁烷
戊烷
根据烷烃的分子结构,写出相应的结构简式和分子式,分析他们在组成和结构
上的相似点。
思考与讨论
2.烷烃的结构与组成
名称 结构简式 分子式 碳原子的杂化方式 分子中共价键的类型
甲烷 CH4 CH4
乙烷 CH3CH3 C2H6
丙烷 CH3CH2CH3 C3H8
丁烷 CH3CH2CH2CH3 C4H10
戊烷 CH3CH2CH2CH2CH3 C5H12
sp3
sp3
sp3
sp3
sp3
σ键
σ键
σ键
σ键
σ键
①烷烃的结构与甲烷的相似
②其分子中的碳原子都采取sp3杂化
③以伸向四面体四个顶点方向的sp3杂化轨道与其他碳原子或氢原子结合,形成σ键
④烷烃分子中的共价键全部是单键
烷烃的性质与甲烷的相似
烷烃的所有原子不可能共平面
分子中的碳原子并非直线状排列,而是锯齿状。链状烷烃的通式为CnH2n+2。
烷烃结构特点碳原子sp3杂化全部是单键C-H之间均是σ键每个碳原子与周围四个原子构成四面体碳原子均是饱和的3.甲烷的性质
甲烷的化学性质比较稳定,常温下不能被酸性高锰酸钾溶液氧化。也不与强酸、强碱及溴的四氯化碳溶液反应。
①在空气中燃烧(可燃性)发生氧化反应
②能在光照下与氯气发生取代反应
甲烷的主要化学性质表现为能在
纯净的甲烷是无色、无臭的气体,难溶于水,密度比空气的小
(1)根据甲烷的性质推测烷烃可能具有的性质,填写下表。
颜色 溶解性 可燃性 与酸性高锰酸钾溶液 与溴的四氯化碳溶液 与强酸、强碱溶液 与氯气(在光照下)
(2)根据甲烷的燃烧反应,写出汽油的成分之一辛烷(C8H18)完全燃烧的化学方程式。
无色
难溶
于水
空气中
可以燃烧
不反应
取代反应
不反应
不反应
2C8H18+25O2 16CO2+18H2O
点燃
思考与讨论
(3)根据甲烷与氯气的反应,写出乙烷与氯气反应生成一氯乙烷的化学方程式。指出该反应的反应类型,并从化学键和官能团的角度分析反应中有机化合物的变化。
+
Cl—Cl
光
C
C
H
H
H
H
H
H
C
C
Cl
H
H
H
H
H
Cl
H
+
上述反应属于取代反应,乙烷分子中C—H键断裂,其中的氢原子被氯原子代替,生成C—Cl键。
(4)乙烷与氯气在光照下反应,可能生成哪些产物?请写出它们的结构简式。
CH3
Cl
Cl
Cl
Cl
Cl
CH3
Cl
Cl
Cl
Cl
CH3
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
一氯乙烷(1种),二氯乙烷(2种),三氯乙烷(2种),四氯乙烷(2种),五氯乙烷(1种),六氯乙烷(1种)
共9种。
可能的产物:CH3CH2Cl、CH3CHCl2、CH2ClCH2Cl、CH3CCl3、CH2ClCHCl2、CH2ClCCl3、CHCl2CHCl2、CHCl2CCl3、CCl3CCl3
(1)甲烷的化学性质比较稳定,常温下不能被酸性KMnO4溶液氧化,也不与强酸、强碱及溴的四氯化碳溶液反应。但能在空气中发生燃烧反应和在光照下与Cl2发生取代反应。
4.烷烃的化学性质
(2)烷烃的性质与甲烷相似
①不与酸性KMnO4溶液、溴的四氯化碳溶液、强酸溶液、强碱溶液反应。
②氧化反应——可燃性
注:当碳含量少时,产生淡蓝色火焰,但随着碳原子数的增多,碳的质量分数逐渐增大,有黑烟产生
乙烷的取代反应
H-C-C-H+Cl-Cl → H-C-C-Cl+HCl
H H
H H
H H
H H
光照
键断裂
③特征反应——取代反应
烷烃可以与卤素单质(气态)在光照下发生取代反应生成卤代烃和卤化氢。
乙烷断裂的键为C—H键,形成键为C—Cl键和H—Cl键。
烷烃取代反应的特点:
①在光照条件下;
②与纯卤素反应;
③1 mol卤素单质只能取代1 mol H
④连锁反应,有多种产物(卤代烃和卤化氢气体)
④受热分解:烷烃在隔绝空气的条件下,加热或加催化剂可发生裂化或裂解
通式:一分子烷烃
一分子烷烃+一分子烯烃
举例:
烷烃的性质
溶解性(对水) 可燃性 与酸性高锰酸钾溶液 与溴的四氯化碳溶液 与强酸、强碱溶液 与氯气(在光照下)
难溶 可燃 不反应 不反应 不反应 取代反应
5.同系物:
(1)定义:
结构相似,在组成上相差一个或若干个CH2原子团的物质互称为同系物
(2)特点:
①通式相同,结构相似,化学性质相似属于同一类物质;
②物理性质一般随碳原子数目的增多而呈规律性变化,如随着碳原子数的增多,同系物的溶沸点逐渐升高,密度逐渐增大 ;
③在分子组成上相差一个或若干个“CH2”原子团,所以同系物一定具有不同的分子式,但相对分子质量的差值一定是14的整数倍。
同系物判断的三个关键点:
同
两种物质属于同一类物质,官能团的种类和数目一样。
似
差
两种物质结构相似,碳骨架的链接方式相同。
两种物质分子组成上相差一个或多个CH2原子团
(1)同系物一定具有不同的碳原子数(或分子式)。
(2)同系物一定具有不同的相对分子质量(相差14 n)。
部分烷烃的熔点、沸点和密度
烷烃名称 分子式 结构简式 常温下状态 熔点/℃ 沸点/℃ 密度/(g·cm-3)
甲烷 CH4 CH4 气体 -182 -164 0.423
乙烷 C2H6 CH3CH3 气体 -172 -89 0.545
丙烷 C3H8 CH3CH2CH3 气体 -187 -42 0.501
丁烷 C4H10 CH3CH2CH2CH3 气体 -138 -0.5 0.579
戊烷 C5H12 CH3(CH2)3CH3 气体 -129 36 0.626
壬烷 C9H20 CH3(CH2)7CH3 气体 -54 151 0.718
十一烷 C11H24 CH3(CH2)9CH3 气体 -26 196 0.740
十六烷 C16H34 CH3(CH2)14CH3 气体 18 280 0.775
十八烷 C18H38 CH3(CH2)16CH3 气体 28 308 0.777
分子中碳原子数
分子中碳原子数
③常温下的存在状态,由气态逐渐过渡到液态、固态。
①随着分子中碳原子数的递增,烷烃沸点逐渐升高。
② 随着分子中碳原子数的递增,烷烃密度逐渐增大。
友情提示:
②常温下烷烃的状态:
①所有烷烃均难溶于水,密度均小于1
C17以上为固态
C5~C16液态
C1~C4气态
6.烷烃同系物的物理性质的递变规律
物理性质 变化规律
状态 当碳原子数小于或等于4时,烷烃在常温下呈气态,其他的烷烃常温下呈液态或固态(新戊烷常温下为气态)
溶解性 都不溶于水,易溶于有机溶剂
沸点 随碳原子数的增加,沸点逐渐升高。碳原子数相同的烃,支链越多,沸点越低
密度 随碳原子数的增加,相对密度逐渐增大。烷烃、烯烃的密度小于水的密度
小试牛刀
(1)烷烃分子中的所有共价键全部是σ键。 ( )
(2)汽油、煤油、石蜡中的主要成分为烷烃。 ( )
(3)烷烃的化学性质稳定,不能发生氧化反应。 ( )
(4)乙烷的熔、沸点比丙烷的高。 ( )
判断正误(对的在括号内打“√”,错的在括号内打“×”。)
√
√
×
×
(5)烷烃能使酸性KMnO4溶液褪色。 ( )
(6)烷烃在一定条件下与卤素单质反应生成卤代烃。( )
(7)符合CnH2n+2的烃一定为烷烃。 ( )
(8)制取1-氯乙烷时可用乙烷和氯气反应。( )
×
×
√
√
二、烷烃的命名
1.烃基
(1)定义:烃分子中去掉1个或几个氢原子后所剩余的原子团叫烃基
(2)表示方法:-R
(3)烷基:
烷烃分子中去掉一个氢原子后剩余的基团称为烷基
(4)举例:
烷基的通式:-CnH2n+1。
烯基:乙烯基(-CH=CH2)
苯基: 或-C6H5,
(5)特点:呈电中性,不能单独存在
甲烷分子去掉1个氢原子是甲基(—CH3)
乙烷分子去掉1个氢原子是乙基(—CH2CH3)
丙烷(CH3CH2CH3)分子中有两组处于不同化学环境的氢原子,因此丙基有两种不同的结构
—CH2CH2CH3
正丙基
—CHCH3
CH3
异丙基
提示:4种。结构简式分别为—CH2CH2CH2CH3、CH(CH3)CH2CH3、
—CH2CH(CH3)CH3、—C(CH3)3。
试根据正丁烷和异丁烷的结构简式思考丁基有几种,并分别写出结构简式。
思考与讨论
(1)碳原子数在1~10之间用“天干” 甲、乙、丙、丁、戊、己、庚、辛、壬、癸 表示称某烷
(2)11个C原子以上的烷烃,用实际碳原子数表示:如:C11H24 称为十一烷
(3)若存在少量同分异构体: 依分子中支链多少以正、异、新表示
戊烷
C5H12
C8H18
辛烷
2.烷烃的命名法
习惯命名法
①丁烷有两种即正丁烷和异丁烷,结构简式分别为 和
②戊烷有三种,即正戊烷、异戊烷、新戊烷,其结构简式分别为
CH3CH2CH2CH3
CH3CH2CH2CH2CH3
正戊烷、异戊烷、新戊烷的沸点逐渐降低,原因是同种烷烃的不同异构体
中,支链越多其沸点越低。
由于烷烃分子中碳原子数目越多,结构越复杂,同分异构体的数目也越多,习惯命名法在实际应用中有很大的局限性。一套系统合理的命名方法便应运而生,这就是我们今天要学习的系统命名法。
系统命名法
(1)选主链、称“某烷”——“最长”碳链为主链
该分子最长碳链上有6个碳原,可称为己烷。
如图所示,应选A为主链。
说明:如果最长链不只一条,应选择连有支链多的最长链为主链。
CH3—CH—CH2—CH—CH3
CH3 CH2—CH3
把主链里离取代基(支链)最近的一端作为起点,用1、2、3等数字给主链的各碳原子依次编号定位,以确定支链所在的位置。
2
3
4
5
1
5
6
2
1
3
4
(2)选起点编序号、定支链
说明:两端等距离均有不同的支链时,从简单取代基开始编号
①把支链作为取代基。把取代基的名称写在烷烃名称的前面,在取代基的前面用阿拉伯数字注明它在烷烃主链上的位置,并在号数后连一短线,中间用“–”隔开。
CH3—CH—CH2—CH—CH3
CH3 CH2—CH3
己烷
甲基
2,4
(3)写名称
取代基写在前,注位置,连短线,不同基,简在前,相同基,合并写
5
6
1
2
3
4
②当有相同的取代基,则相加,然后用大写的二、三、四等数字表示写在取代基前面。但表示相同取代基位置的阿拉伯数字要用“,”隔开;如果几个取代基不同,就把简单的写在前面,复杂的写在后面。
己烷
甲基
2、4
二
说明:有多种支链时,支链编号数和要小
CH3—CH—CH2—CH—CH3
CH3 CH2—CH3
5
6
1
2
3
4
1.选主链,称某烷(最长碳链)
2.编号码,定支链(支链最近原则)
3.取代基,写在前,注位置,连短线
4.不同基,简在前,相同基,要合并
5.同位置,简在前。
6.支链序号的合数要最小
取代基位置-取代基数目 取代基名称 主链
阿拉伯数字 中文
(阿拉伯数字之间用“,”隔开;阿拉伯数字与文字之间用“—”隔开。)
系统命名法步骤:
(1)最长原则:应选最长的碳链做主链;
(2)最近原则:应从离支链最近一端对主链碳原子进行编号;
(3)最多原则:若存在多条等长主链时,应选择含支链数较多的碳链做主链;
(4)最简原则:若不同的支链距主链两端等长时,应从靠近简单支链的一端对主链碳原子进行编号;
(5)最小原则:若相同的支链距主链两端等长时,应以支链位号之和最小为原则,对主链碳原子进行编号。
烷烃命名五原则:
(1)请按下列步骤写出己烷同分异构体的结构简式,并用系统命名法进行命名。
步骤 结构简式 名称
①先写有最长碳链结构的同分异构体
②主链碳原子由6个减为5个,甲基有两种可能的位置分布
③主链碳原子由5个减为4个,两个甲基有两种可能的位置分布
己烷
2 -甲基戊烷
3 -甲基戊烷
2,3- 二甲基丁烷
2,2 -二甲基丁烷
思考与讨论
(2)根据丁烷两种同分异构体的结构,写出4种丁基(—C4H9)的结构简式。
共4种同分异构体
CH3—CH2—CH2—CH2—
丁烷有两种即正丁烷和异丁烷,结构简式分别为 和
CH3CH2CH2CH3
CH3—CH2—CH—
CH3
CH3—C—
CH3
CH3
CH3—CH—CH2—
CH3
(3)现在你能将C6H14的所有同分异构体用系统命名法命名吗?
CH3CH2CH2CH2CH2CH3
CH3CHCH2CH2CH3
CH3
CH3CH2CHCH2CH3
CH3
CH3
CH3CH2CCH3
CH3
CH3
CH3CH-CHCH3
CH3
1 2 3 4 5 6
己烷
1 2 3 4 5
1 2 3 4 5
1 2 3 4
4 3 2 1
2-甲基戊烷
3-甲基戊烷
2,3-二甲基丁烷
2,2-二甲基丁烷
编号位
定支链
烷烃命名的纲要
选主链称某烷
取代基写在前
标位置短线连
不同基简到繁
相同基合并算
2,2,3-三甲基丁烷
4-乙基庚烷
CH2 CH2 CH CH2 CH2
CH3
CH3
CH3
CH2
用系统命名法给下列烷烃命名。
CH3
CH3
CH3 C CH CH3
CH3
2,2,4,4-四甲基己烷
C2H5 CH3
CH3 C CH2 C CH3
CH3 CH3
小试牛刀
课堂小结
结
质
质
烷烃分子中的共价键全部是单键
化
学
性
物
理
性
构
烷烃的结构与甲烷的相似
其分子中的碳原子都采取sp3杂化,碳原子与碳原子或其他原子形成σ键
烷烃的结构与性质
能在光照下与氯气发生取代反应
常温下不能被酸性高锰酸钾溶液氧化,不与强酸、强碱及溴的四氯化碳溶液反应
能在空气中燃烧(可燃性)
随着烷烃碳原子数的增加,烷烃的熔点和沸点逐渐升高
随着烷烃碳原子数的增加,烷烃的密度逐渐增大
随着烷烃碳原子数的增加,常温下的存在状态也由气态逐渐过渡到液态、固态。
最长最多原则,称某烷
近,简,小原则,定支链
支链前主链后,还有短线隔
编号位,定支链;
取代基,写在前,
不同基, 简到繁,
选主链,称某烷;
标位置,短线连;
相同基,合并算。
1)选主链
3)写名称
2)编号位
烷烃的命名
1.下列有机物:①正丁烷,②丙烷,③2 -甲基丁烷,④异丁烷,⑤己烷。沸点由高到低的顺序为( )
A.②①④③⑤ B.⑤③④①②
C.⑤③①④② D.②①③④⑤
解析:五种有机物均为烷烃,烷烃分子中碳原子数目越多,其沸点越高;碳原子数目相同的烷烃,其支链越多,沸点越低,故五种烷烃的沸点由高到低的顺序为⑤③①④②。
C
课堂检测
2.关于烷烃的说法不正确的是( )
A.所有链状烷烃均符合通式CnH2n+2
B.烷烃分子中一定存在C—C σ键
C.烷烃分子中的碳原子均采取sp3杂化
D.烷烃分子中碳原子不一定在一条直线
解析:甲烷中不存在C—C键,B错误。
B
3.下列叙述错误的是 ( )
A.甲烷与氯气反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4,都属于取代反应
B.烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
C.分子通式为CnH2n+2的烃一定是链状烷烃
D.甲烷能够燃烧,在一定条件下会发生爆炸
解析:所有烷烃包括CH4都不能使酸性KMnO4溶液褪色,B错误。
B
4.下列物质的命名中肯定正确的是( )
A.2,2- 二甲基丁烷 B.3,3 -二甲基丁烷
C.2 -甲基- 3- 乙基丁烷 D.4- 甲基- 3 -乙基己烷
解析:先根据选项名称写结构简式,再重新命名。
A
5.在系统命名法中,下列有机化合物主链名称是丁烷的是( )
A.(CH3)2CHCH2CH2CH3 B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2 D.(CH3)3CCH2CH2CH3
C
解析:要求主链名称是丁烷,即分子中的最长碳链有4个碳原子。A、B、D分子中的最长碳链均为5个碳原子。
