3.2.1醇 课件(共36张PPT)高中化学选修三有机化学基础课件(人教版)
文档属性
| 名称 | 3.2.1醇 课件(共36张PPT)高中化学选修三有机化学基础课件(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-04 20:28:55 | ||
图片预览











文档简介
(共36张PPT)
第二节 醇 酚
第1课时 醇
学习目标
1.结合醇的代表物了解醇的分类、组成和结构,理解醇的性质。
2.以乙醇为代表物,从化学键的变化理解醇的取代、消去、氧化反应的原理及转化关系。
一、醇的分类、组成与物理性质
1.醇与酚的定义
(1)醇是指羟基与 相连的化合物。
如1 丙醇 ,苯甲醇 ,
可命名为 。
3- 甲基- 2 -戊醇
饱和碳原子
CH3CH2CH2OH
学习探究
(2)酚是指羟基与 直接相连而形成的化合物。如苯酚 。
苯环
微点拨:醇的命名步骤:①选主链:含—OH的最长碳链,称“某醇”;②编号码:从离羟基最近的一端的碳原子依次编号;③写名称:醇的名称前用阿拉伯数字标出羟基位置,用汉字数字标出羟基个数。
如 命名为1,2 -丙二醇。
C3H8O3
C2H6O2
2.醇的分类与组成
按羟基数目分为一元醇、二元醇和多元醇,其中饱和一元醇的分子通式为CnH2n+1OH。乙二醇和丙三醇的分子式分别为 、 ,
结构简式分别为 、 。
3.醇的物理性质
(1)甲醇、乙二醇与丙三醇(又叫甘油)及应用
甲醇(CH3OH)是无色、具有 性的液体, 溶于水,沸点为65 ℃。甲醇有毒,误服会损伤视神经,甚至致人死亡。甲醇广泛应用于化工生产,也可作为车用燃料。乙二醇和丙三醇都是 色、黏稠的液体,都 溶于水和乙醇,是重要的化工原料。
挥发
易
无
易
丙三醇
(2)溶解性:①醇在水中的溶解度随着分子中碳原子数的增加而 ,原因是极性的—OH在分子中所占的比例逐渐减少。羟基越多,溶解度越大。
②醇的溶解度 含有相同碳原子数烃类的溶解度,原因是醇分子中的羟基属于极性基团且能与水形成 。
降低
大于
氢键
(3)熔沸点:
①随分子中碳原子数的增多,熔沸点逐渐升高。
②醇的沸点远远 于相对分子质量相近的烃、卤代烃等的沸点,原因是醇分子之间形成了 (醇分子中羟基的氧原子与另一醇分子中羟基的氢原子间存在着 )。
高
氢键
氢键
微点拨:多元醇分子中存在多个羟基,彼此形成分子间氢键的概率增加,分子间作用力增强,故碳原子数相同的醇,随着羟基数的增多,其沸点逐渐升高;此外,与水分子间形成氢键的概率也增大,从而使多元醇具有易溶于水的性质。
羟基
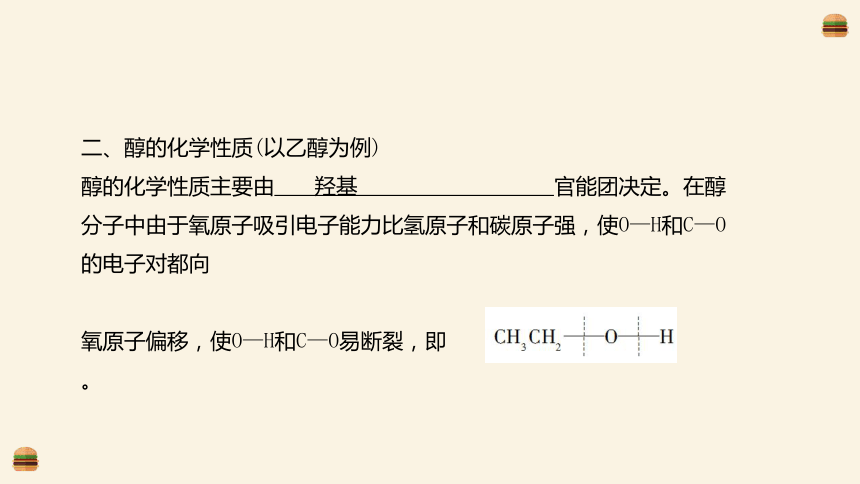
二、醇的化学性质(以乙醇为例)
醇的化学性质主要由 官能团决定。在醇分子中由于氧原子吸引电子能力比氢原子和碳原子强,使O—H和C—O的电子对都向
氧原子偏移,使O—H和C—O易断裂,即 。
1.置换反应
与活泼金属(如Na)发生置换反应,其反应方程式为
_____________________________________,反应时乙醇分子断裂的化学键为 。
2.取代反应
(1)酯化反应:与乙酸发生反应的方程式为
O—H
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
(2)与氢卤酸反应
与HBr反应的化学方程式为___________________________________,反应时,乙醇分子断裂的键为 。
(3)分子间脱水生成醚
乙醇在浓硫酸作用下加热至140 ℃时,生成乙醚,其反应方程式为
C—O
注意:①乙醚是一种无色、易 的液体,沸点34.5 ℃,有特殊气味,具有 作用。乙醚 于水,易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机物。
②醚的官能团叫 ,表示为 ,醚的结构可用 表示,R、R′都是 ,可以相同也可以不同。
挥发
麻醉
微溶
醚键
R—O—R′
烃基
3.消去反应
乙醇在浓硫酸的作用下,加热至 时生成乙烯,
反应方程式为 ,浓
硫酸的作用是______________________。反应时乙醇
分子断的键是 与 。
C—O
170℃
催化剂和脱水剂
C—H
4.氧化反应
(1)实例:
②乙醇被酸性重铬酸钾(K2Cr2O7)溶液氧化的过程为
(2)有机反应中的氧化、还原反应
①有机物分子中 氢原子或 氧原子的反应叫氧化反应。如乙醇在氧化剂的作用下失去氢原子转化为乙醛,乙醛在氧化剂的作用下加入氧原子转化为乙酸。
②有机物分子中 氢原子或 氧原子的反应叫还原反应。如烯烃与H2的加成反应,也属于还原反应。
失去
加入
加 入
失去
1.判断正误(对的在括号内打“√”,错的在括号内打“×”。)
(1)烃分子中的氢原子被羟基取代而生成的羟基化合物一定为醇。 ( )
(2)醇的熔沸点高于相应烃的熔沸点,是因醇分子间形成氢键。 ( )
(3)乙醇发生酯化反应时,乙醇断裂的键是C—O键。 ( )
(4)乙醇生成醚的反应属于消去反应。 ( )
小试牛刀
×
√
×
×
2.下列物质不是醇类的是( )
C
3.指出下列转化的反应类型
①________ ②________ ③________ ④________ ⑤________ ⑥________ ⑦________
[答案] ①取代反应 ②消去反应 ③加成反应 ④消去反应 ⑤加成反应 ⑥取代反应 ⑦氧化反应
醇的三大反应规律及应用
重难点探究
(1)上述物质能与HX发生取代反应有 (填序号)。
(2)上述物质能发生消去反应的有 。
(3)上述物质能发生催化氧化的有 ,其中生成醛的
有 生成酮的有 。
[提示](1)①②③④⑤⑥ (2)②③④⑤ (3)①②③④⑥ ①②④⑥ ③
核心归纳:
1.醇的取代反应规律
醇分子中,—OH或—OH上的氢原子在一定条件下可被其他原子或原子团取代,如醇与羧酸的酯化反应、醇分子间脱水及与HX的取代反应。
2.醇的消去反应规律
(1)醇分子中,连有—OH的碳原子的相邻碳原子上连有氢原子时,才能
发生消去反应而形成不饱和键。
(2)若醇分子中与—OH相连的碳原子无相邻碳原子或其相邻碳原子上无氢原子,则不能发生消去反应。如CH3OH、(CH3)3CCH2OH不能发生消去反应生成烯烃。
3.醇的催化氧化规律
醇能否被氧化以及被氧化的产物的类别,取决于与羟基相连的碳原子上的氢原子的个数,具体分析如下:
1.有关下列两种物质的说法正确的是( )
跟踪练习:
A.二者都能发生消去反应
B.二者都能在Cu作催化剂条件下发生催化氧化反应
C.相同物质的量的①和②分别与足量Na反应,产生H2的量:①>②
D.二者在一定条件下可与乙酸、氢溴酸发生取代反应
D
D
2.将浓硫酸和分子式为C2H6O、C3H8O的醇的混合物共热,所得到的有机产物最多有( )
A.5种 B.6种
C.7种 D.8种
实验探究
乙烯的实验室制取及其性质探究
[实验操作与装置]
①将浓硫酸和乙醇按体积比3∶1混合,冷却后加入几片碎瓷片。
②加热混合液,使液体温度迅速升温到170 ℃,并稳定在170 ℃,将生成的气体先通入NaOH溶液中,再依次通入溴的四氯化碳溶液和酸性KMnO4溶液中,观察现象。
思考:
(1)实验室制乙烯,请写出反应方程式。
(2)浓硫酸、碎瓷片、10%NaOH溶液的作用是什么?
(3)溴的CCl4溶液和酸性高锰酸钾溶液中有什么现象?可以得出乙烯的什么性质?
[提示]浓硫酸起催化剂和脱水剂作用;碎瓷片防止加热时液体暴沸;
10% NaOH溶液吸收乙烯中杂质气体SO2和乙醇,防止干扰验证乙烯的性质。
[提示]二者均褪色,分别说明乙烯能发生加成反应和氧化反应。
思考:
(4)乙烯中的主要杂质气体是什么?如何产生的?
(5)如果温度没有迅速升到170 ℃,有什么副反应?写出有关化学方程式。
[提示] SO2,浓H2SO4被还原生成的。
当堂检测
1.下列物质中既属于芳香族化合物又属于醇的是( )
B
物质 分子式 沸点/℃ 溶解性
乙醇 C2H6O 78.5 与水以任意比混溶
乙二醇 C2H6O2 197.3 与水和乙醇以任意比混溶
2.结合下表数据分析,下列说法不合理的是 ( )
A.二者的溶解性与其在水中能够形成氢键有关
B.可以采用蒸馏的方法将二者进行分离
C.丙三醇的沸点应该高于乙二醇的沸点
D.二者组成和结构相似,互为同系物
D
3.以下四种有机化合物分子式均为C4H10O:
其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是 ( )
A.①和② B.只有②
C.②和③ D.③和④
C
4.将一定量的饱和一元醇平均分成两份,将其中一份完全燃烧,消耗28.8 g氧气,在另一份中加入过量金属钠,产生2.24 L(标准状况)H2,则该醇为 ( )
A.乙醇 B.丙醇
C.丁醇 D.甲醇
B
5.用如图所示装置进行制取乙烯和验证乙烯性质实验。
请回答:
(1)圆底烧瓶中碎瓷片的作用是 ,装置中的明显错误
是 。
(2)实验步骤:
a. ;
b.在各装置中注入相应的试剂(如图所示);
c. 。
实验时,圆底烧瓶中液体混合物逐渐变黑。
防止暴沸
温度计水银球没有插入反应液中央
组装仪器,检查装置的气密性
加热,使温度迅速升到170 ℃
(3)能够说明乙烯具有还原性的现象是 ;
装置甲的作是 ;
若无甲装置,是否也能检验乙烯具有还原性,简述其理由:
。
乙中酸性KMnO4溶液褪色
除去乙烯中混有的SO2、CO2、乙醇蒸气等杂质
不能,SO2、乙醇具有还原性,也可以使酸性KMnO4溶液褪色
第二节 醇 酚
第1课时 醇
学习目标
1.结合醇的代表物了解醇的分类、组成和结构,理解醇的性质。
2.以乙醇为代表物,从化学键的变化理解醇的取代、消去、氧化反应的原理及转化关系。
一、醇的分类、组成与物理性质
1.醇与酚的定义
(1)醇是指羟基与 相连的化合物。
如1 丙醇 ,苯甲醇 ,
可命名为 。
3- 甲基- 2 -戊醇
饱和碳原子
CH3CH2CH2OH
学习探究
(2)酚是指羟基与 直接相连而形成的化合物。如苯酚 。
苯环
微点拨:醇的命名步骤:①选主链:含—OH的最长碳链,称“某醇”;②编号码:从离羟基最近的一端的碳原子依次编号;③写名称:醇的名称前用阿拉伯数字标出羟基位置,用汉字数字标出羟基个数。
如 命名为1,2 -丙二醇。
C3H8O3
C2H6O2
2.醇的分类与组成
按羟基数目分为一元醇、二元醇和多元醇,其中饱和一元醇的分子通式为CnH2n+1OH。乙二醇和丙三醇的分子式分别为 、 ,
结构简式分别为 、 。
3.醇的物理性质
(1)甲醇、乙二醇与丙三醇(又叫甘油)及应用
甲醇(CH3OH)是无色、具有 性的液体, 溶于水,沸点为65 ℃。甲醇有毒,误服会损伤视神经,甚至致人死亡。甲醇广泛应用于化工生产,也可作为车用燃料。乙二醇和丙三醇都是 色、黏稠的液体,都 溶于水和乙醇,是重要的化工原料。
挥发
易
无
易
丙三醇
(2)溶解性:①醇在水中的溶解度随着分子中碳原子数的增加而 ,原因是极性的—OH在分子中所占的比例逐渐减少。羟基越多,溶解度越大。
②醇的溶解度 含有相同碳原子数烃类的溶解度,原因是醇分子中的羟基属于极性基团且能与水形成 。
降低
大于
氢键
(3)熔沸点:
①随分子中碳原子数的增多,熔沸点逐渐升高。
②醇的沸点远远 于相对分子质量相近的烃、卤代烃等的沸点,原因是醇分子之间形成了 (醇分子中羟基的氧原子与另一醇分子中羟基的氢原子间存在着 )。
高
氢键
氢键
微点拨:多元醇分子中存在多个羟基,彼此形成分子间氢键的概率增加,分子间作用力增强,故碳原子数相同的醇,随着羟基数的增多,其沸点逐渐升高;此外,与水分子间形成氢键的概率也增大,从而使多元醇具有易溶于水的性质。
羟基
二、醇的化学性质(以乙醇为例)
醇的化学性质主要由 官能团决定。在醇分子中由于氧原子吸引电子能力比氢原子和碳原子强,使O—H和C—O的电子对都向
氧原子偏移,使O—H和C—O易断裂,即 。
1.置换反应
与活泼金属(如Na)发生置换反应,其反应方程式为
_____________________________________,反应时乙醇分子断裂的化学键为 。
2.取代反应
(1)酯化反应:与乙酸发生反应的方程式为
O—H
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
(2)与氢卤酸反应
与HBr反应的化学方程式为___________________________________,反应时,乙醇分子断裂的键为 。
(3)分子间脱水生成醚
乙醇在浓硫酸作用下加热至140 ℃时,生成乙醚,其反应方程式为
C—O
注意:①乙醚是一种无色、易 的液体,沸点34.5 ℃,有特殊气味,具有 作用。乙醚 于水,易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机物。
②醚的官能团叫 ,表示为 ,醚的结构可用 表示,R、R′都是 ,可以相同也可以不同。
挥发
麻醉
微溶
醚键
R—O—R′
烃基
3.消去反应
乙醇在浓硫酸的作用下,加热至 时生成乙烯,
反应方程式为 ,浓
硫酸的作用是______________________。反应时乙醇
分子断的键是 与 。
C—O
170℃
催化剂和脱水剂
C—H
4.氧化反应
(1)实例:
②乙醇被酸性重铬酸钾(K2Cr2O7)溶液氧化的过程为
(2)有机反应中的氧化、还原反应
①有机物分子中 氢原子或 氧原子的反应叫氧化反应。如乙醇在氧化剂的作用下失去氢原子转化为乙醛,乙醛在氧化剂的作用下加入氧原子转化为乙酸。
②有机物分子中 氢原子或 氧原子的反应叫还原反应。如烯烃与H2的加成反应,也属于还原反应。
失去
加入
加 入
失去
1.判断正误(对的在括号内打“√”,错的在括号内打“×”。)
(1)烃分子中的氢原子被羟基取代而生成的羟基化合物一定为醇。 ( )
(2)醇的熔沸点高于相应烃的熔沸点,是因醇分子间形成氢键。 ( )
(3)乙醇发生酯化反应时,乙醇断裂的键是C—O键。 ( )
(4)乙醇生成醚的反应属于消去反应。 ( )
小试牛刀
×
√
×
×
2.下列物质不是醇类的是( )
C
3.指出下列转化的反应类型
①________ ②________ ③________ ④________ ⑤________ ⑥________ ⑦________
[答案] ①取代反应 ②消去反应 ③加成反应 ④消去反应 ⑤加成反应 ⑥取代反应 ⑦氧化反应
醇的三大反应规律及应用
重难点探究
(1)上述物质能与HX发生取代反应有 (填序号)。
(2)上述物质能发生消去反应的有 。
(3)上述物质能发生催化氧化的有 ,其中生成醛的
有 生成酮的有 。
[提示](1)①②③④⑤⑥ (2)②③④⑤ (3)①②③④⑥ ①②④⑥ ③
核心归纳:
1.醇的取代反应规律
醇分子中,—OH或—OH上的氢原子在一定条件下可被其他原子或原子团取代,如醇与羧酸的酯化反应、醇分子间脱水及与HX的取代反应。
2.醇的消去反应规律
(1)醇分子中,连有—OH的碳原子的相邻碳原子上连有氢原子时,才能
发生消去反应而形成不饱和键。
(2)若醇分子中与—OH相连的碳原子无相邻碳原子或其相邻碳原子上无氢原子,则不能发生消去反应。如CH3OH、(CH3)3CCH2OH不能发生消去反应生成烯烃。
3.醇的催化氧化规律
醇能否被氧化以及被氧化的产物的类别,取决于与羟基相连的碳原子上的氢原子的个数,具体分析如下:
1.有关下列两种物质的说法正确的是( )
跟踪练习:
A.二者都能发生消去反应
B.二者都能在Cu作催化剂条件下发生催化氧化反应
C.相同物质的量的①和②分别与足量Na反应,产生H2的量:①>②
D.二者在一定条件下可与乙酸、氢溴酸发生取代反应
D
D
2.将浓硫酸和分子式为C2H6O、C3H8O的醇的混合物共热,所得到的有机产物最多有( )
A.5种 B.6种
C.7种 D.8种
实验探究
乙烯的实验室制取及其性质探究
[实验操作与装置]
①将浓硫酸和乙醇按体积比3∶1混合,冷却后加入几片碎瓷片。
②加热混合液,使液体温度迅速升温到170 ℃,并稳定在170 ℃,将生成的气体先通入NaOH溶液中,再依次通入溴的四氯化碳溶液和酸性KMnO4溶液中,观察现象。
思考:
(1)实验室制乙烯,请写出反应方程式。
(2)浓硫酸、碎瓷片、10%NaOH溶液的作用是什么?
(3)溴的CCl4溶液和酸性高锰酸钾溶液中有什么现象?可以得出乙烯的什么性质?
[提示]浓硫酸起催化剂和脱水剂作用;碎瓷片防止加热时液体暴沸;
10% NaOH溶液吸收乙烯中杂质气体SO2和乙醇,防止干扰验证乙烯的性质。
[提示]二者均褪色,分别说明乙烯能发生加成反应和氧化反应。
思考:
(4)乙烯中的主要杂质气体是什么?如何产生的?
(5)如果温度没有迅速升到170 ℃,有什么副反应?写出有关化学方程式。
[提示] SO2,浓H2SO4被还原生成的。
当堂检测
1.下列物质中既属于芳香族化合物又属于醇的是( )
B
物质 分子式 沸点/℃ 溶解性
乙醇 C2H6O 78.5 与水以任意比混溶
乙二醇 C2H6O2 197.3 与水和乙醇以任意比混溶
2.结合下表数据分析,下列说法不合理的是 ( )
A.二者的溶解性与其在水中能够形成氢键有关
B.可以采用蒸馏的方法将二者进行分离
C.丙三醇的沸点应该高于乙二醇的沸点
D.二者组成和结构相似,互为同系物
D
3.以下四种有机化合物分子式均为C4H10O:
其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是 ( )
A.①和② B.只有②
C.②和③ D.③和④
C
4.将一定量的饱和一元醇平均分成两份,将其中一份完全燃烧,消耗28.8 g氧气,在另一份中加入过量金属钠,产生2.24 L(标准状况)H2,则该醇为 ( )
A.乙醇 B.丙醇
C.丁醇 D.甲醇
B
5.用如图所示装置进行制取乙烯和验证乙烯性质实验。
请回答:
(1)圆底烧瓶中碎瓷片的作用是 ,装置中的明显错误
是 。
(2)实验步骤:
a. ;
b.在各装置中注入相应的试剂(如图所示);
c. 。
实验时,圆底烧瓶中液体混合物逐渐变黑。
防止暴沸
温度计水银球没有插入反应液中央
组装仪器,检查装置的气密性
加热,使温度迅速升到170 ℃
(3)能够说明乙烯具有还原性的现象是 ;
装置甲的作是 ;
若无甲装置,是否也能检验乙烯具有还原性,简述其理由:
。
乙中酸性KMnO4溶液褪色
除去乙烯中混有的SO2、CO2、乙醇蒸气等杂质
不能,SO2、乙醇具有还原性,也可以使酸性KMnO4溶液褪色
