1.3.2氧化还原反应规律 课件(共58张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.2氧化还原反应规律 课件(共58张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 17.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-04 20:29:32 | ||
图片预览










文档简介
(共58张PPT)
多看、多学、多试。如果有成果,绝不炫耀。一个人如果怕费时、费事,则将一事无成。
拉姆赛(William Ramsay, 1852~1916),英国化学家,1904年诺贝尔化学奖得主。他发现了氦、氖、氩、氪、氙和氡六种惰性气体,并确定了它们的化学性质和在元素周期表上的位置。
重铬酸铵[(NH4)2Cr2O7]受热分解发生氧化还原反应,下列各组关于其分解产物的判断合理的是
思考﹒ 运用
A.NH3、CrO3、H2O
B.NH3、Cr2O3、H2O
C.N2、CrO3、H2O
D.N2、Cr2O3、H2O
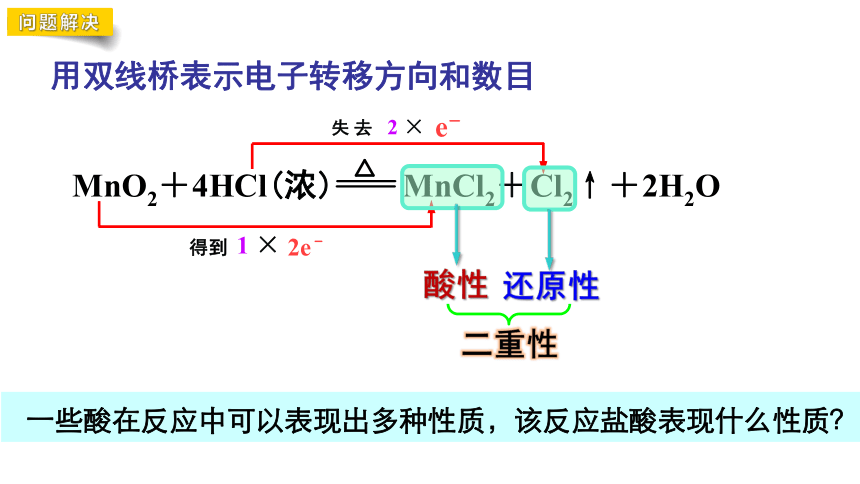
用双线桥表示电子转移方向和数目
问题解决
2 ×
1 ×
一些酸在反应中可以表现出多种性质,该反应盐酸表现什么性质?
还原性
酸性
二重性
2NaOH+H2SO4=Na2SO4+H2O
分析下列反应中硫酸的作用
你学会了吗?
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
酸性
氧化性
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
酸性
氧化性
化学与生活
榨的苹果汁
只用苹果榨苹果汁放置后变色
苹果汁加点柠檬汁放置后不变色
为何苹果汁中加柠檬汁后就不变色了?
氧化还原反应规律
氧化还原反应规律
学
习
目
标
据方程式,判断微粒氧化性、还原性强弱。
溶液中有多种物质,能判断加入新物质时哪种先反应。
01
据元素的价态,判断是否有氧化性或还原性。
02
03
能应用电子守恒原理进行计算。
04
同种元素不同价态物质间,能否发生氧化还原反应。
05
1
物质的氧化性、还原性
与元素的价态有何关系?
硫元素化合价有:-2、0、+4、+6,请判断下列微粒中硫元素具有下列哪些性质:
① 只有氧化性
② 只有还原性
③ 既有氧化性又有还原性
思考﹒ 讨论
S价态
-2
0
+4
+6
1. H2SO4 ___________
2. SO2 _____________________
3. Na2S ____________
只有氧化性
既有氧化性又有还原性
只有还原性
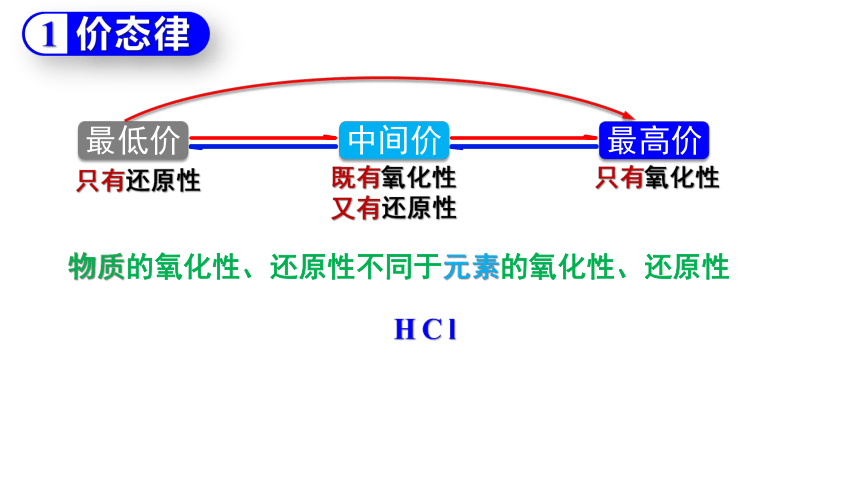
物质的氧化性、还原性不同于元素的氧化性、还原性
价态律
1
最低价
最高价
中间价
只有还原性
只有氧化性
既有氧化性
又有还原性
HCl
下列物质中某种元素既有氧化性又有还原性的是
A.FeCl2
B.Al2O3
C.SO2
D.CO2
你学会了吗?
问题探究
氧化剂中表现氧化性的元素,其价态是高或低?
目前,你知道哪些物质可做氧化剂?
常见氧化剂
氧化剂 还原产物
类别 物质 活泼非金属单质
氧化性酸
高价盐
过氧化物
O2
O2-
Cl2
Cl-
浓硫酸
NO2 NO
HNO3
HMnO4
Mn2+
SO2
FeCl3
FeCl2
H2O2
H2O
温馨提醒
问题探究
还原剂中表现还原性的元素,其价态是高或低?
目前,你知道哪些物质可做还原剂?
常见还原剂
还原剂 氧化产物
类别 物质 少数非金属单质
金属单质
阴离子
阳离子
C
CO CO2
H2
H2O
Na
Cu2+
Cu
I-
I2
Na+
S2-
S
Fe2+
Fe3+
温馨提醒
下列反应中双氧水表现什么性质(氧化性或还原性)?
Cl2+H2O2=2HCl+O2↑
2FeCl2+H2O2+2HCl=2FeCl3+2H2O
2H2O2 H2O+O2↑
你学会了吗?
化学与生活
榨的苹果汁
只用苹果榨苹果汁放置后变色
苹果汁加点柠檬汁放置后不变色
苹果汁中和柠檬汁中的某种物质都有还原性
哪一个的还原性强?
2
物质的氧化性、还原性
其强弱如何判断?
CuSO4与FeSO4谁的氧化性强?
Fe与Cu谁的还原性强?
问题探究
难
依据反应Fe+CuSO4=FeSO4+Cu,请你总结一下:
根据方程式, 判断有关微粒的氧化性与还原性的强弱有何规律?
考考你的智慧
强弱律
2
________>_________
氧化性
氧化剂
氧化产物
强制弱
还原性
________>_________
还原剂
还原产物
比什么性,找什么剂,
产物之性小于剂,联合对比自成序
前强后弱
方程式
氧化性
还原性
Cl2>I2
KI>KCl
请完成下表:
考考你自己
如何证明维生素C还原性强于二价铁离子?
身边的化学
证明维生素C还原性强于二价铁离子?
维生素C+ → Fe2+
?
FeCl3溶液
实验探究
你学会了吗?
根据反应式:①2Fe3++2I-==2Fe2++I2,②Br2+2Fe2+==2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是
A.Br-、Fe2+、I-
B.I-、Fe2+、Br-
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-
请按要求各写一道化学方程式。
①还原性:Cu>Ag
②氧化性:Br2>I2
Cu
Ag
Cu2+
Ag+
Cu+2AgNO3=Cu(NO3)2+2Ag
Br2
I2
Br-
I-
Br2+2KI=2KBr+I2
考考你的智慧
化学与生活
榨的苹果汁
只用苹果榨苹果汁放置后变色
苹果汁加点柠檬汁放置后不变色
苹果汁中的酚类物质和柠檬汁中的维生素C都有还原性
哪一个先与空气中的O2反应?
3
多种物质共体系中加入一试剂
哪种物质先反应?
若溶液中有若干物质具有还原性,加入一氧化剂,哪种物质先和氧化剂反应呢?
问题解决
在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入适量锌粉,首先置换出的是
A.Mg B.Cu C.Ag D.H2
思考﹒ 运用
优先律
3
按照氧化性由强到弱的顺序依次与还原剂反应
存在多种还原剂
01
按照还原性由强到弱的顺序依次与氧化剂反应
存在多种氧化剂
02
原子数均为NA的镁、铝,分别与足量的硫酸反应,求生成氢气的个数之比。
请你试一试
Mg+H2SO4=MgSO4+H2↑
解析:
1
1
NA
NA
2Al+3H2SO4=Al2(SO4)2 +3H2↑
2
3
NA
1.5NA
4
氧化还原反应中
得失电子数相等的应用
H2SO4
+2e-
H2
请你试一试
解析:
Mg
-2e-
Mg2+
Al
-3e-
Al3+
失去的电子数与生成H2的个数成正比!
2∶3
原子数均为NA的镁、铝,分别与足量的硫酸反应,求产生氢气的个数之比。
等质量的镁、铝,分别与足量的硫酸反应,求产生氢气的质量比。
Mg
-2e-
Mg2+
Al
-3e-
Al3+
1/24
1/27
失去的电子数分别为
1/24
1/27
你学会了吗?
解析:
1/12∶1/9
实验室用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O制备氯气,若参加反应的氧化剂为20个,则被氧化的还原剂的个数为
A.160
B.32
C.20
D.100
请你试一试
用双线桥表示电子转移方向和数目:
10 ×
2 ×
2
被氧化
10
20
100
问题解决
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
KMnO4与HCl(浓) 反应生成KCl 、MnCl2 、Cl 2 和H2O制备氯气,若参加反应的氧化剂为20个,求被氧化的还原剂的个数。
KMnO4得电子的数目
HCl失电子的数目
得失电子数目之间有何关系?
看我七十二变
20
×
5
N(HCl)
×
1
=
N(HCl)=100
解析:
设被氧化的还原剂的个数为N(HCl)
氧化剂得电子总数与还原剂失电子总数相等
电子守恒
4
原理
01
步骤
02
找物质
1
2
3
定得失
列关系
氧化剂→还原产物 还原剂→氧化产物
确定1个粒子得失电子数
化合价变化值×变价原子个数
三步曲
N(氧化剂)×1个粒子得电子数
N(还原剂)×1个粒子失电子数
在KI和KIO3混合溶液中加入稀硫酸,发生反应,生成碘、硫酸钾和水。此反应中被氧化的碘元素与被还原的碘元素的原子个数比是
A.5∶1 B.2∶1 C.1∶3 D.1∶5
解析:
KI
失去1e-
I2
KIO3
得到5e-
I2
N(KI)
×
1
N(KIO3)
×
5
=
KI中碘被氧化,KIO3中碘被还原
N(KI)
∶
N(KIO3)
=
5∶1
动动脑
以下物质间能否发生氧化还原反应?
1. C与CO2
0
+4
+2
2. CO与CO2
0
+4
+2
5
同种元素发生氧化还原反应
有何要求?
KClO3+6HCl=3Cl2↑+KCl+3H2O
请用双线桥表示以下反应电子转移的方向和数目。
问题探究
KClO3+6HCl=3Cl2↑+KCl+3H2O
6 ×
1 ×
KClO3+6HCl=3Cl2↑+KCl+3H2O
5 ×
1 ×
KClO3+6HCl=3Cl2↑+KCl+3H2O
先将以下反应改写这离子方程式,再用又线桥表示电子转移的方向和数目。
问题探究
ClO3-+5Cl-+6H+=3Cl2↑+Cl-+3H2O
5
失去
e-
×
得到
5e-
1
×
价态互不换位原理
5
同种元素不同价态间的反应,其价态只靠拢不交叉
即价态向中看齐
高价+低价
中间价态
中间价态可相同、可不同
KClO3+6HCl=3Cl2↑+KCl+3H2O
6 ×
1 ×
KClO3+6HCl=3Cl2↑+KCl+3H2O
5 ×
1 ×
H2S+H2SO4(浓)=SO2↑+S↓+2H2O
请用双线桥表示以下反应电子转移的方向和数目。
你学会了吗?
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
1
氧化还原反应五规律
氧化性还原性与元素价态有关
价态律
课堂小结
2
氧化性:氧化剂大于氧化产物
强弱律
3
谁的性强,则先反应
优先律
4
氧化剂与还原剂得失电子数相等
守恒律
5
同种元素的不同价态,最终向中看齐
互不换位律
在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气。当制得相同数目的氧气时,三个反应中转移的电子数之比
A.1∶1∶1 B.2∶2∶1
C.2∶3∶1 D.4∶3∶2
KMnO4
-4e-
O2
KClO3
-4e-
O2
H2O2
-2e-
O2
牛刀小试
ClO2是广谱型的消毒剂,用于自来水的消毒。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化的反应制得,在以上反应中NaClO3和Na2SO3的个数比为________。
Na2SO3
-2e-
Na2SO4
NaClO3
+1e-
ClO2
N(NaClO3)×1
+5
+4
+4
+6
N(Na2SO3)×2
N(NaClO3)
N(Na2SO3)
∶
=
2∶1
考考你的智慧
实验室将NaClO3和Na2SO3按个数比2 ∶ 1倒入烧瓶 中,用水浴加热,同时滴入硫酸溶液,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应(已知Na2SO3生成Na2SO4),则X为
A.Cl2 B.Cl2O
C.ClO2 D.Cl2O3
Na2SO3
-2e-
Na2SO4
NaClO3
+(5-x)e-
Cl
+5
x
+4
+6
N(NaClO3)×1
N(Na2SO3)×2
2 ×(5-x)
1 ×2
x
4
看我七十二变
氧化还原反应
惯穿于整个中学化学
学好规律 解决问题
多看、多学、多试。如果有成果,绝不炫耀。一个人如果怕费时、费事,则将一事无成。
拉姆赛(William Ramsay, 1852~1916),英国化学家,1904年诺贝尔化学奖得主。他发现了氦、氖、氩、氪、氙和氡六种惰性气体,并确定了它们的化学性质和在元素周期表上的位置。
重铬酸铵[(NH4)2Cr2O7]受热分解发生氧化还原反应,下列各组关于其分解产物的判断合理的是
思考﹒ 运用
A.NH3、CrO3、H2O
B.NH3、Cr2O3、H2O
C.N2、CrO3、H2O
D.N2、Cr2O3、H2O
用双线桥表示电子转移方向和数目
问题解决
2 ×
1 ×
一些酸在反应中可以表现出多种性质,该反应盐酸表现什么性质?
还原性
酸性
二重性
2NaOH+H2SO4=Na2SO4+H2O
分析下列反应中硫酸的作用
你学会了吗?
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
酸性
氧化性
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
酸性
氧化性
化学与生活
榨的苹果汁
只用苹果榨苹果汁放置后变色
苹果汁加点柠檬汁放置后不变色
为何苹果汁中加柠檬汁后就不变色了?
氧化还原反应规律
氧化还原反应规律
学
习
目
标
据方程式,判断微粒氧化性、还原性强弱。
溶液中有多种物质,能判断加入新物质时哪种先反应。
01
据元素的价态,判断是否有氧化性或还原性。
02
03
能应用电子守恒原理进行计算。
04
同种元素不同价态物质间,能否发生氧化还原反应。
05
1
物质的氧化性、还原性
与元素的价态有何关系?
硫元素化合价有:-2、0、+4、+6,请判断下列微粒中硫元素具有下列哪些性质:
① 只有氧化性
② 只有还原性
③ 既有氧化性又有还原性
思考﹒ 讨论
S价态
-2
0
+4
+6
1. H2SO4 ___________
2. SO2 _____________________
3. Na2S ____________
只有氧化性
既有氧化性又有还原性
只有还原性
物质的氧化性、还原性不同于元素的氧化性、还原性
价态律
1
最低价
最高价
中间价
只有还原性
只有氧化性
既有氧化性
又有还原性
HCl
下列物质中某种元素既有氧化性又有还原性的是
A.FeCl2
B.Al2O3
C.SO2
D.CO2
你学会了吗?
问题探究
氧化剂中表现氧化性的元素,其价态是高或低?
目前,你知道哪些物质可做氧化剂?
常见氧化剂
氧化剂 还原产物
类别 物质 活泼非金属单质
氧化性酸
高价盐
过氧化物
O2
O2-
Cl2
Cl-
浓硫酸
NO2 NO
HNO3
HMnO4
Mn2+
SO2
FeCl3
FeCl2
H2O2
H2O
温馨提醒
问题探究
还原剂中表现还原性的元素,其价态是高或低?
目前,你知道哪些物质可做还原剂?
常见还原剂
还原剂 氧化产物
类别 物质 少数非金属单质
金属单质
阴离子
阳离子
C
CO CO2
H2
H2O
Na
Cu2+
Cu
I-
I2
Na+
S2-
S
Fe2+
Fe3+
温馨提醒
下列反应中双氧水表现什么性质(氧化性或还原性)?
Cl2+H2O2=2HCl+O2↑
2FeCl2+H2O2+2HCl=2FeCl3+2H2O
2H2O2 H2O+O2↑
你学会了吗?
化学与生活
榨的苹果汁
只用苹果榨苹果汁放置后变色
苹果汁加点柠檬汁放置后不变色
苹果汁中和柠檬汁中的某种物质都有还原性
哪一个的还原性强?
2
物质的氧化性、还原性
其强弱如何判断?
CuSO4与FeSO4谁的氧化性强?
Fe与Cu谁的还原性强?
问题探究
难
依据反应Fe+CuSO4=FeSO4+Cu,请你总结一下:
根据方程式, 判断有关微粒的氧化性与还原性的强弱有何规律?
考考你的智慧
强弱律
2
________>_________
氧化性
氧化剂
氧化产物
强制弱
还原性
________>_________
还原剂
还原产物
比什么性,找什么剂,
产物之性小于剂,联合对比自成序
前强后弱
方程式
氧化性
还原性
Cl2>I2
KI>KCl
请完成下表:
考考你自己
如何证明维生素C还原性强于二价铁离子?
身边的化学
证明维生素C还原性强于二价铁离子?
维生素C+ → Fe2+
?
FeCl3溶液
实验探究
你学会了吗?
根据反应式:①2Fe3++2I-==2Fe2++I2,②Br2+2Fe2+==2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是
A.Br-、Fe2+、I-
B.I-、Fe2+、Br-
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-
请按要求各写一道化学方程式。
①还原性:Cu>Ag
②氧化性:Br2>I2
Cu
Ag
Cu2+
Ag+
Cu+2AgNO3=Cu(NO3)2+2Ag
Br2
I2
Br-
I-
Br2+2KI=2KBr+I2
考考你的智慧
化学与生活
榨的苹果汁
只用苹果榨苹果汁放置后变色
苹果汁加点柠檬汁放置后不变色
苹果汁中的酚类物质和柠檬汁中的维生素C都有还原性
哪一个先与空气中的O2反应?
3
多种物质共体系中加入一试剂
哪种物质先反应?
若溶液中有若干物质具有还原性,加入一氧化剂,哪种物质先和氧化剂反应呢?
问题解决
在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入适量锌粉,首先置换出的是
A.Mg B.Cu C.Ag D.H2
思考﹒ 运用
优先律
3
按照氧化性由强到弱的顺序依次与还原剂反应
存在多种还原剂
01
按照还原性由强到弱的顺序依次与氧化剂反应
存在多种氧化剂
02
原子数均为NA的镁、铝,分别与足量的硫酸反应,求生成氢气的个数之比。
请你试一试
Mg+H2SO4=MgSO4+H2↑
解析:
1
1
NA
NA
2Al+3H2SO4=Al2(SO4)2 +3H2↑
2
3
NA
1.5NA
4
氧化还原反应中
得失电子数相等的应用
H2SO4
+2e-
H2
请你试一试
解析:
Mg
-2e-
Mg2+
Al
-3e-
Al3+
失去的电子数与生成H2的个数成正比!
2∶3
原子数均为NA的镁、铝,分别与足量的硫酸反应,求产生氢气的个数之比。
等质量的镁、铝,分别与足量的硫酸反应,求产生氢气的质量比。
Mg
-2e-
Mg2+
Al
-3e-
Al3+
1/24
1/27
失去的电子数分别为
1/24
1/27
你学会了吗?
解析:
1/12∶1/9
实验室用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O制备氯气,若参加反应的氧化剂为20个,则被氧化的还原剂的个数为
A.160
B.32
C.20
D.100
请你试一试
用双线桥表示电子转移方向和数目:
10 ×
2 ×
2
被氧化
10
20
100
问题解决
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
KMnO4与HCl(浓) 反应生成KCl 、MnCl2 、Cl 2 和H2O制备氯气,若参加反应的氧化剂为20个,求被氧化的还原剂的个数。
KMnO4得电子的数目
HCl失电子的数目
得失电子数目之间有何关系?
看我七十二变
20
×
5
N(HCl)
×
1
=
N(HCl)=100
解析:
设被氧化的还原剂的个数为N(HCl)
氧化剂得电子总数与还原剂失电子总数相等
电子守恒
4
原理
01
步骤
02
找物质
1
2
3
定得失
列关系
氧化剂→还原产物 还原剂→氧化产物
确定1个粒子得失电子数
化合价变化值×变价原子个数
三步曲
N(氧化剂)×1个粒子得电子数
N(还原剂)×1个粒子失电子数
在KI和KIO3混合溶液中加入稀硫酸,发生反应,生成碘、硫酸钾和水。此反应中被氧化的碘元素与被还原的碘元素的原子个数比是
A.5∶1 B.2∶1 C.1∶3 D.1∶5
解析:
KI
失去1e-
I2
KIO3
得到5e-
I2
N(KI)
×
1
N(KIO3)
×
5
=
KI中碘被氧化,KIO3中碘被还原
N(KI)
∶
N(KIO3)
=
5∶1
动动脑
以下物质间能否发生氧化还原反应?
1. C与CO2
0
+4
+2
2. CO与CO2
0
+4
+2
5
同种元素发生氧化还原反应
有何要求?
KClO3+6HCl=3Cl2↑+KCl+3H2O
请用双线桥表示以下反应电子转移的方向和数目。
问题探究
KClO3+6HCl=3Cl2↑+KCl+3H2O
6 ×
1 ×
KClO3+6HCl=3Cl2↑+KCl+3H2O
5 ×
1 ×
KClO3+6HCl=3Cl2↑+KCl+3H2O
先将以下反应改写这离子方程式,再用又线桥表示电子转移的方向和数目。
问题探究
ClO3-+5Cl-+6H+=3Cl2↑+Cl-+3H2O
5
失去
e-
×
得到
5e-
1
×
价态互不换位原理
5
同种元素不同价态间的反应,其价态只靠拢不交叉
即价态向中看齐
高价+低价
中间价态
中间价态可相同、可不同
KClO3+6HCl=3Cl2↑+KCl+3H2O
6 ×
1 ×
KClO3+6HCl=3Cl2↑+KCl+3H2O
5 ×
1 ×
H2S+H2SO4(浓)=SO2↑+S↓+2H2O
请用双线桥表示以下反应电子转移的方向和数目。
你学会了吗?
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
1
氧化还原反应五规律
氧化性还原性与元素价态有关
价态律
课堂小结
2
氧化性:氧化剂大于氧化产物
强弱律
3
谁的性强,则先反应
优先律
4
氧化剂与还原剂得失电子数相等
守恒律
5
同种元素的不同价态,最终向中看齐
互不换位律
在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气。当制得相同数目的氧气时,三个反应中转移的电子数之比
A.1∶1∶1 B.2∶2∶1
C.2∶3∶1 D.4∶3∶2
KMnO4
-4e-
O2
KClO3
-4e-
O2
H2O2
-2e-
O2
牛刀小试
ClO2是广谱型的消毒剂,用于自来水的消毒。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化的反应制得,在以上反应中NaClO3和Na2SO3的个数比为________。
Na2SO3
-2e-
Na2SO4
NaClO3
+1e-
ClO2
N(NaClO3)×1
+5
+4
+4
+6
N(Na2SO3)×2
N(NaClO3)
N(Na2SO3)
∶
=
2∶1
考考你的智慧
实验室将NaClO3和Na2SO3按个数比2 ∶ 1倒入烧瓶 中,用水浴加热,同时滴入硫酸溶液,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应(已知Na2SO3生成Na2SO4),则X为
A.Cl2 B.Cl2O
C.ClO2 D.Cl2O3
Na2SO3
-2e-
Na2SO4
NaClO3
+(5-x)e-
Cl
+5
x
+4
+6
N(NaClO3)×1
N(Na2SO3)×2
2 ×(5-x)
1 ×2
x
4
看我七十二变
氧化还原反应
惯穿于整个中学化学
学好规律 解决问题
