2.2.3 氯气的实验室制法 氯离子的检验 课件(共26张PPT) 高中化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.3 氯气的实验室制法 氯离子的检验 课件(共26张PPT) 高中化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 58.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-05 19:18:08 | ||
图片预览







文档简介
(共26张PPT)
第二章 海水中的重要元素——钠和氯
第二节 氯及其化合物
第3课时 氯气的实验室制法
氯离子的检验
目录
氯气的实验室制法
01
氯离子的检验
02
习
学
目
标
1.根据Cl2的性质,掌握Cl2的实验室制法(发生、除杂、收集和尾气处理),培养“科学探究与创新意识”的核心素养。
2.掌握Cl-的一般检验方法(试剂、步骤),培养“证据推理与模型认知”的核心素养。
舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热来发现氯气的方法至今还是实验室制取氯气的主要方法之一。
NO.1
氯气的实验室制法
软锰矿MnO2
+
盐酸
加热
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
△
+4 -1 +2 0
MnO2 + 4H+ + 2Cl- ==Mn2+ + Cl2↑ + 2H2O
△
问题1:写出软锰矿和浓盐酸制氯气的方程式
浓HCl表现的性质:还原性和酸性
注意: MnO2只与浓盐酸反应,随着反应进行,浓盐酸变为稀盐酸,反应停止
在实验室中,通常用氧化剂在酸性溶液里氧化Cl-的方法制备氯气。例如:
Ⅰ.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
Ⅱ. 2KMnO4+16HCl(浓)==2KCl+MnCl2+5Cl2↑+8H2O
注意:反应Ⅰ必须加热,反应Ⅱ不需要加热。
制备原理
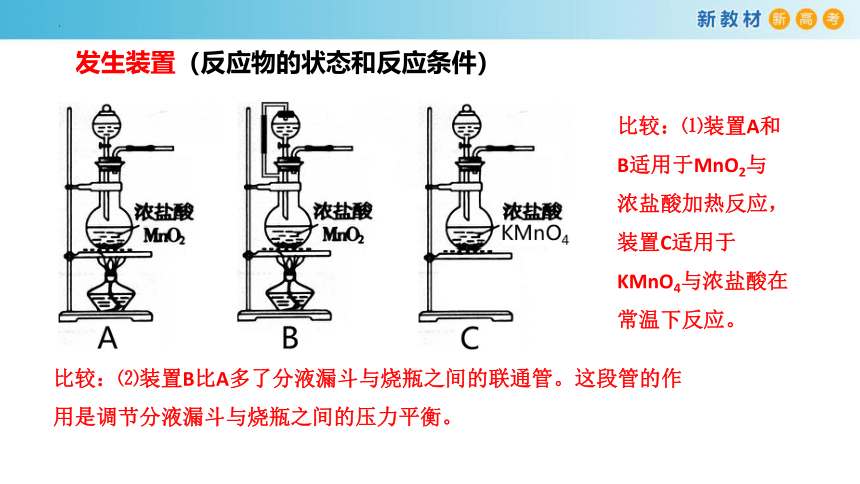
发生装置(反应物的状态和反应条件)
比较:⑴装置A和B适用于MnO2与浓盐酸加热反应,装置C适用于KMnO4与浓盐酸在常温下反应。
比较:⑵装置B比A多了分液漏斗与烧瓶之间的联通管。这段管的作用是调节分液漏斗与烧瓶之间的压力平衡。
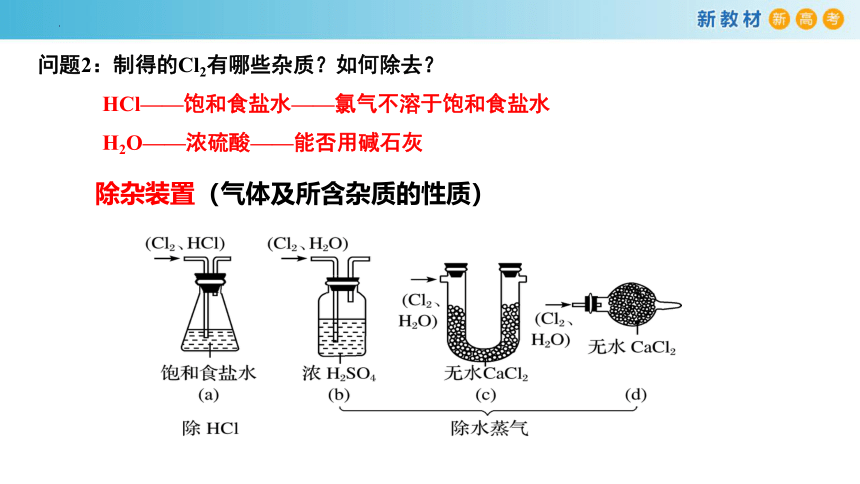
除杂装置(气体及所含杂质的性质)
问题2:制得的Cl2有哪些杂质?如何除去?
HCl——饱和食盐水——氯气不溶于饱和食盐水
H2O——浓硫酸——能否用碱石灰
收集装置(气体的密度,气体在水中的溶解性、是否与水反应)
尾气处理装置(气体的性质)
问题3:想要制备干燥、纯净的氯气,需要用到下列哪些装置,装入哪些药品,装置如何连接?
如何检验氯气是否已经收集满?
Cl2的验满方法
(1)将湿润的淀粉-KI试纸放在集气瓶口,观察到试纸立即变蓝,则证明已集满。
原理:Cl2 + 2KI === I2 + 2KCl,置换出的I2遇淀粉变蓝;
(2)将湿润的蓝色石蕊试纸放在集气瓶口,观察到试纸____________,则证明已集满。
发生装置:
净化装置:
饱和食盐水(除Cl2中的HCl气体)
固+ 液 气
△
饱和食盐水
问题4:制备实验中,一套装置大概有那几部分组成?
Cl2的实验室制法
Cl2的实验室制法
收集装置:
向上排空气法
(或排饱和食盐水法)
干燥装置:
浓硫酸(除Cl2中的H2O)
尾气处理:
NaOH溶液吸收
(Cl2 +2NaOH NaCl+NaClO+H2O)
浓硫酸
实验目的
实验室制取纯净干燥的氯气
反应原理
核心元素→类别、化合价变化→试剂选择
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
装置设计
发生→除杂(如需要)→收集→尾气处理(如需要)
操作事项
药品加入的顺序,化学反应条件的控制等
△
氯气的实验室制法
方法总结:
拓展:(1)若要制备FeCl3,应该如何设计装置
拓展:(1)若要制备FeCl3,应该如何设计装置
(2)若已知FeCl3易与水反应,应该如何改进装置
拓展:(3)若又知FeCl3加热时易升华,如何收集?如何改进装置?
发生装置
除杂装置(如需要)
收集装置
尾气处理装置
(如需要)
反应物状态、反应条件
气体及所含杂质的性质
气体的密度、气体在水中溶解性、是否与水反应等
气体的性质
选择和组装实验室制取气体的装置时,应该考虑装置的选取依据和连接顺序。
总结:
不同离子的检验方法不同,一般采用可产生的特殊现象来判断,高中常用的如:
1.观察颜色法:
2.焰色试验法:
3.沉淀法:
4.气体法:
钾元素焰色:紫色(通过蓝色钴玻璃观察)、钠元素焰色:
黄色
Cu2+ ( )、Fe3+( )、Fe2+( )、
MnO4-( )
蓝色
棕黄色
浅绿色
紫红色
用于能转化为特殊沉淀的离子检验,如BaSO4、AgCl、Fe(OH)3等
用于能转化为特殊气体的离子检验,如CO2、NH3
往某溶液中滴加AgNO3,若产生白色沉淀,能否说明溶液中含有Cl-?
NO.2
氯离子的检验
【实验2-9】氯离子的检验——沉淀法
在三支试管中分别加入2~3mL稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
试液2~3 mL 实验现象 离子方程式
滴入几滴AgNO3溶液 加入少量稀硝酸 ①稀盐酸 ______________ __________ __________________
②NaCl溶液 ______________ __________ __________________
③Na2CO3溶液 ______________ ____________________ __________________________________________________________
有白色沉淀生成
有白色沉淀生成
沉淀不溶解
有白色沉淀生成
有气泡产生
沉淀溶解,
Cl-+Ag+= AgCl↓
Cl-+Ag+= AgCl↓
CO32-+2Ag+= Ag2CO3↓
Ag2CO3+2H+= 2Ag++CO2↑+H2O
沉淀不溶解
问题探究
氯离子检验
取少量溶液于试管中,
加硝酸酸化,
滴加几滴AgNO3溶液,
若出现白色沉淀,说明有Cl—,
反之则无
取样
排除CO32—的干扰
检验
判断方法(结论)
第二章 海水中的重要元素——钠和氯
第二节 氯及其化合物
第3课时 氯气的实验室制法
氯离子的检验
目录
氯气的实验室制法
01
氯离子的检验
02
习
学
目
标
1.根据Cl2的性质,掌握Cl2的实验室制法(发生、除杂、收集和尾气处理),培养“科学探究与创新意识”的核心素养。
2.掌握Cl-的一般检验方法(试剂、步骤),培养“证据推理与模型认知”的核心素养。
舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热来发现氯气的方法至今还是实验室制取氯气的主要方法之一。
NO.1
氯气的实验室制法
软锰矿MnO2
+
盐酸
加热
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
△
+4 -1 +2 0
MnO2 + 4H+ + 2Cl- ==Mn2+ + Cl2↑ + 2H2O
△
问题1:写出软锰矿和浓盐酸制氯气的方程式
浓HCl表现的性质:还原性和酸性
注意: MnO2只与浓盐酸反应,随着反应进行,浓盐酸变为稀盐酸,反应停止
在实验室中,通常用氧化剂在酸性溶液里氧化Cl-的方法制备氯气。例如:
Ⅰ.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
Ⅱ. 2KMnO4+16HCl(浓)==2KCl+MnCl2+5Cl2↑+8H2O
注意:反应Ⅰ必须加热,反应Ⅱ不需要加热。
制备原理
发生装置(反应物的状态和反应条件)
比较:⑴装置A和B适用于MnO2与浓盐酸加热反应,装置C适用于KMnO4与浓盐酸在常温下反应。
比较:⑵装置B比A多了分液漏斗与烧瓶之间的联通管。这段管的作用是调节分液漏斗与烧瓶之间的压力平衡。
除杂装置(气体及所含杂质的性质)
问题2:制得的Cl2有哪些杂质?如何除去?
HCl——饱和食盐水——氯气不溶于饱和食盐水
H2O——浓硫酸——能否用碱石灰
收集装置(气体的密度,气体在水中的溶解性、是否与水反应)
尾气处理装置(气体的性质)
问题3:想要制备干燥、纯净的氯气,需要用到下列哪些装置,装入哪些药品,装置如何连接?
如何检验氯气是否已经收集满?
Cl2的验满方法
(1)将湿润的淀粉-KI试纸放在集气瓶口,观察到试纸立即变蓝,则证明已集满。
原理:Cl2 + 2KI === I2 + 2KCl,置换出的I2遇淀粉变蓝;
(2)将湿润的蓝色石蕊试纸放在集气瓶口,观察到试纸____________,则证明已集满。
发生装置:
净化装置:
饱和食盐水(除Cl2中的HCl气体)
固+ 液 气
△
饱和食盐水
问题4:制备实验中,一套装置大概有那几部分组成?
Cl2的实验室制法
Cl2的实验室制法
收集装置:
向上排空气法
(或排饱和食盐水法)
干燥装置:
浓硫酸(除Cl2中的H2O)
尾气处理:
NaOH溶液吸收
(Cl2 +2NaOH NaCl+NaClO+H2O)
浓硫酸
实验目的
实验室制取纯净干燥的氯气
反应原理
核心元素→类别、化合价变化→试剂选择
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
装置设计
发生→除杂(如需要)→收集→尾气处理(如需要)
操作事项
药品加入的顺序,化学反应条件的控制等
△
氯气的实验室制法
方法总结:
拓展:(1)若要制备FeCl3,应该如何设计装置
拓展:(1)若要制备FeCl3,应该如何设计装置
(2)若已知FeCl3易与水反应,应该如何改进装置
拓展:(3)若又知FeCl3加热时易升华,如何收集?如何改进装置?
发生装置
除杂装置(如需要)
收集装置
尾气处理装置
(如需要)
反应物状态、反应条件
气体及所含杂质的性质
气体的密度、气体在水中溶解性、是否与水反应等
气体的性质
选择和组装实验室制取气体的装置时,应该考虑装置的选取依据和连接顺序。
总结:
不同离子的检验方法不同,一般采用可产生的特殊现象来判断,高中常用的如:
1.观察颜色法:
2.焰色试验法:
3.沉淀法:
4.气体法:
钾元素焰色:紫色(通过蓝色钴玻璃观察)、钠元素焰色:
黄色
Cu2+ ( )、Fe3+( )、Fe2+( )、
MnO4-( )
蓝色
棕黄色
浅绿色
紫红色
用于能转化为特殊沉淀的离子检验,如BaSO4、AgCl、Fe(OH)3等
用于能转化为特殊气体的离子检验,如CO2、NH3
往某溶液中滴加AgNO3,若产生白色沉淀,能否说明溶液中含有Cl-?
NO.2
氯离子的检验
【实验2-9】氯离子的检验——沉淀法
在三支试管中分别加入2~3mL稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
试液2~3 mL 实验现象 离子方程式
滴入几滴AgNO3溶液 加入少量稀硝酸 ①稀盐酸 ______________ __________ __________________
②NaCl溶液 ______________ __________ __________________
③Na2CO3溶液 ______________ ____________________ __________________________________________________________
有白色沉淀生成
有白色沉淀生成
沉淀不溶解
有白色沉淀生成
有气泡产生
沉淀溶解,
Cl-+Ag+= AgCl↓
Cl-+Ag+= AgCl↓
CO32-+2Ag+= Ag2CO3↓
Ag2CO3+2H+= 2Ag++CO2↑+H2O
沉淀不溶解
问题探究
氯离子检验
取少量溶液于试管中,
加硝酸酸化,
滴加几滴AgNO3溶液,
若出现白色沉淀,说明有Cl—,
反之则无
取样
排除CO32—的干扰
检验
判断方法(结论)
