2.2.2氯气与水、碱的反应 课件(共25张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.2氯气与水、碱的反应 课件(共25张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-05 00:00:00 | ||
图片预览







文档简介
(共25张PPT)
第二章 海水中的重要元素——钠和氯
第二节 氯及其化合物
第2课时 氯气与水、碱的反应
目录
氯气与水的反应
01
氯气与碱的反应
02
1.能通过实验探究Cl2、HClO、次氯酸盐的性质,培养“实验探究与证据推理”的核心素养。
2.建立含氯元素的物质间的转化关系,培养“变化观念与模型认知”的核心素养。
3.了解Cl2的主要用途和发现史,培养“科学态度与社会责任”的核心素养。
习
学
目
标
新制氯水
久置氯水
放置一段时间之后的氯水
黄绿色
无色
变浅
NO.1
氯气与水的反应
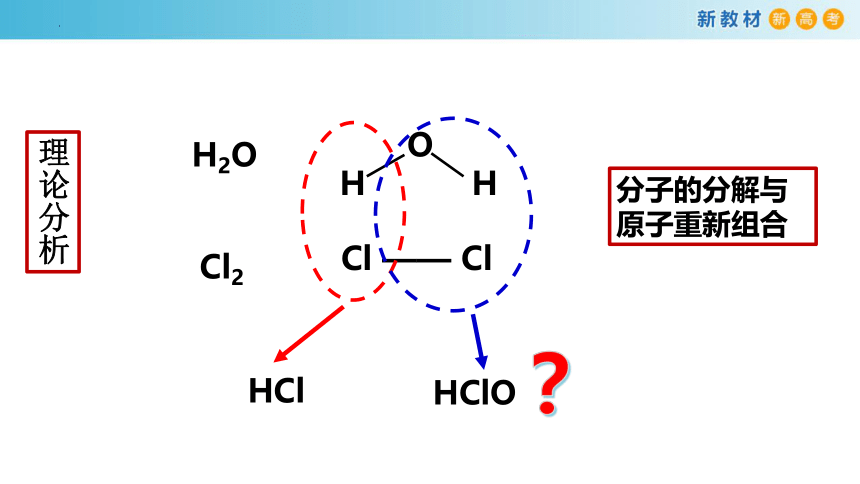
Cl2与H2O反应吗?若反应是否彻底反应?
提出问题
作出假设
①假设Cl2与H2O不反应,则氯水中只含有 。
②假设Cl2与H2O全部反应,则氯水中除了含有 , 还可能生成 。
③假设Cl2部分与H2O反应,则氯水中除了含有 ,还可能生成 。
Cl2、H2O
新物质
新物质
Cl2、H2O
H2O
Cl —— Cl
H2O
Cl2
O
H H
HCl
分子的分解与原子重新组合
HClO
?
理论分析
如何检验Cl2与H2O 反应的产物?
实验验证
检验离子 检验试剂 实验现象 实验结论
H+
Cl-
蓝色石蕊试纸
酸化的硝酸银
1、验H+ :用注射器将1~2滴Cl2与H2O 的混合物(即新制氯水)注入瓶中的蓝色石蕊试纸上,并观察现象。
2、验Cl- :将1ml新制氯水注入稀硝酸酸化的硝酸银溶液中,并观察现象。
操作过程
变红
产生白色沉淀
存在H+
存在Cl-
Cl2与H2O反应生成 HCl
得出结论
后褪色
部分Cl2和水简单混合
新制氯水
次氯酸
部分Cl2和水发生化学反应
新制氯水的成分: H2O、Cl2、H+、Cl-、ClO - 、HClO
氯气+水
二.氯气的化学性质
根据刚刚的“氯气溶于水的实验”可知:氯水的颜色为浅黄绿色,说明氯水中仍然有氯气分子存在
1. 与水反应
既是氧化剂、
又是还原剂
强氧化性:
杀菌、消毒
Cl2 + H2O HCl + HClO
0
-1
+1
结构
性质
强氧化性
①氯气有强氧化性,可能是氯气有漂白性
②可能是新物质HClO
作出假设
理论分析
化合价
性质
强氧化性
+1
具有漂白性物质是Cl2还是HClO?
作出假设
①干燥的氯气无漂白性
② 氯水中的HClO有漂白性
得出结论
检验物质 实验操作 实验现象
氯气
氯水
红色纸条不褪色
红色纸条褪色
提出问题
实验验证
3.消防员的衣服和周围的草木为什么会褪色?
( HClO 具有漂白性)
1. 氯气与水反应
(1)用双线桥法表示电子转移关系并找出氧化剂和还原剂。
(2)写出离子方程式(提示:HClO 是一种弱酸)
Cl2 + H2O = HCl + HClO(次氯酸)
结合氧化还原反应原理与离子反应知识分析下列问题
该反应是氧化还原反应吗?
HClO
的性质
杀菌、消毒、漂白
酸性:H2CO3>HClO
弱酸性
强氧化性
Cl2、HClO、H2O
H+、Cl-
不稳定易分解
2HClO 2HCl + O2↑
光照
+1
三分:
四离:
氯水的成分
= H+ + Cl- + HClO
Cl2 + H2O
、ClO-、OH-(少量)
【总结】新制氯水的性质
参与反应微粒 所加试剂 实验现象 离子方程式或解释
Cl- AgNO3溶液 白色沉淀 Cl-+Ag+===AgCl↓
H+ Na2CO3 固体 有气泡产生 2H++CO32-==CO2↑+H2O
HClO 有色布条 布条颜色褪去 发生氧化还原反应
Cl2 FeCl2溶液 溶液变棕黄色 2Fe2++Cl2=2Fe3++2Cl-
Cl2、H2O SO2 黄绿色褪去 SO2+Cl2+2H2O===4H++2Cl-+SO42-
HClO、H+ 紫色石蕊 溶液 先变红后褪色 酸性和漂白性
Cl2、 H+ 镁粉 氯水的颜色褪去并有气泡产生 Mg+Cl2===Mg2++2Cl-Mg+2H+===Mg2++H2↑
NO.2
氯气与碱的反应
4.消防员为什么要在氯气泄漏现场喷H2O后撒生石灰(CaO) ?
(1) 2Ca(OH)2+2Cl2 = Ca(ClO)2+CaCl2+2H2O
有效成分:Ca(ClO)2
漂白粉
Cl2 + H2O HCl + HClO
2HCl + Ca(OH)2 CaCl2 + 2H2O
2HClO + Ca(OH)2 Ca(ClO)2 + 2H2O
次氯酸钙
思考:实验结束后针筒中剩余的氯水还呈浅黄绿色,说明有氯气残留,直接排放会污染空气,该如何处理?
2. 氯气与碱反应
(2)2NaOH+Cl2 = NaClO+NaCl+H2O
有效成分:NaClO
①写出氯气与氢氧化钠反应的化学方程式。
漂白液
加氢氧化钠溶液
③将化学反应方程式改写成离子方程式。
②该反应是氧化还原反应吗?若是找出氧化剂和还原剂。
化学服务于生产生活
Ca(ClO)2
NaClO
漂白粉和漂白液的漂白原理
Ca(ClO)2 + CO2 + H2O = CaCO3 ↓ + 2 HClO
2NaClO+ CO2 + H2O = Na2CO3 + 2HClO
思考与讨论2:怎样保存漂白粉?
密封保存。
思考与讨论1:次氯酸盐如何转化为次氯酸
思考与讨论3:上述反应的原理是?酸性:H2CO3和HClO的哪个更强?能否用稀盐酸或稀硫酸代替H2CO3
强酸(相对强的酸)制取弱酸的原理;酸性:H2CO3>HClO。可以
原理:强酸制取弱酸
酸性:HClO < H2CO3
(1)漂白液
(2)漂白粉、漂粉精
【注意】工业上制取漂白粉是用氯气与石灰乳反应制得,而不是用氯气与石灰水反应。
漂白液
有效成分
制备原理
用途
________
___________________________________
杀菌、消毒
NaClO
2NaOH+Cl2 == NaCl+NaClO+H2O
小 结:漂白液、漂白粉和漂粉精
课 堂 小 结
物理
性质
化学
性质
用途
黄绿色气体,有刺激性气味、有毒的气体,密度比空气大,可溶于水。
制作消毒剂、漂白剂等
Cl2
1.与水反应
2.与碱反应
Cl2 + H2O = HCl + HClO(次氯酸)
1.下列关于氯水的说法中正确的是( )
A. 新制氯水中只含有Cl2和H2O分子
B. 新制氯水能杀菌消毒是因为Cl2有毒,能毒杀细菌
C. 光照氯水有气泡逸出,该气体是Cl2
D. 氯水放置数天后酸性增强
D
2.自来水是用氯气杀菌消毒的,不法商贩用自来水冒充纯净水销售,为辨别纯净水真伪,可用下列哪种试剂鉴别( )
A.氢氧化钠溶液 B.氯化铁溶液
C.硝酸银溶液 D.酚酞试液
C
3.如图所示,A处通入湿润的Cl2,关闭B阀时,C处干燥的红布看不到明显现象,当打开B阀后,C处干燥的红布条逐渐褪色,则洗气瓶D中装的是( )
①浓硫酸 ②NaOH溶液 ③饱和NaCl溶液.
A.①②③ B.①②
C.②③ D.①③
B
4.有些地方的自来水用氯气消毒,某学生用这种自来水配制下列溶液,不会使药品变质的是( )
A.NaOH溶液 B .AgNO3溶液 C.Na2CO3溶液 D. 盐酸
D
5.液氯与氯水的区别?新制氯水与久置氯水的区别?
液氯 氯水 分类
成分
性质
纯净物
混合物
新制
久置
只有Cl2
分子:
Cl2 ,HClO,H2O
离子:
H+,Cl-,ClO-
分子:H2O
离子:H+,Cl-
有氧化性,无酸性和漂白性
有酸性,强氧化性,能漂白,消毒,光照时HClO分解
只有酸性
实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中
第二章 海水中的重要元素——钠和氯
第二节 氯及其化合物
第2课时 氯气与水、碱的反应
目录
氯气与水的反应
01
氯气与碱的反应
02
1.能通过实验探究Cl2、HClO、次氯酸盐的性质,培养“实验探究与证据推理”的核心素养。
2.建立含氯元素的物质间的转化关系,培养“变化观念与模型认知”的核心素养。
3.了解Cl2的主要用途和发现史,培养“科学态度与社会责任”的核心素养。
习
学
目
标
新制氯水
久置氯水
放置一段时间之后的氯水
黄绿色
无色
变浅
NO.1
氯气与水的反应
Cl2与H2O反应吗?若反应是否彻底反应?
提出问题
作出假设
①假设Cl2与H2O不反应,则氯水中只含有 。
②假设Cl2与H2O全部反应,则氯水中除了含有 , 还可能生成 。
③假设Cl2部分与H2O反应,则氯水中除了含有 ,还可能生成 。
Cl2、H2O
新物质
新物质
Cl2、H2O
H2O
Cl —— Cl
H2O
Cl2
O
H H
HCl
分子的分解与原子重新组合
HClO
?
理论分析
如何检验Cl2与H2O 反应的产物?
实验验证
检验离子 检验试剂 实验现象 实验结论
H+
Cl-
蓝色石蕊试纸
酸化的硝酸银
1、验H+ :用注射器将1~2滴Cl2与H2O 的混合物(即新制氯水)注入瓶中的蓝色石蕊试纸上,并观察现象。
2、验Cl- :将1ml新制氯水注入稀硝酸酸化的硝酸银溶液中,并观察现象。
操作过程
变红
产生白色沉淀
存在H+
存在Cl-
Cl2与H2O反应生成 HCl
得出结论
后褪色
部分Cl2和水简单混合
新制氯水
次氯酸
部分Cl2和水发生化学反应
新制氯水的成分: H2O、Cl2、H+、Cl-、ClO - 、HClO
氯气+水
二.氯气的化学性质
根据刚刚的“氯气溶于水的实验”可知:氯水的颜色为浅黄绿色,说明氯水中仍然有氯气分子存在
1. 与水反应
既是氧化剂、
又是还原剂
强氧化性:
杀菌、消毒
Cl2 + H2O HCl + HClO
0
-1
+1
结构
性质
强氧化性
①氯气有强氧化性,可能是氯气有漂白性
②可能是新物质HClO
作出假设
理论分析
化合价
性质
强氧化性
+1
具有漂白性物质是Cl2还是HClO?
作出假设
①干燥的氯气无漂白性
② 氯水中的HClO有漂白性
得出结论
检验物质 实验操作 实验现象
氯气
氯水
红色纸条不褪色
红色纸条褪色
提出问题
实验验证
3.消防员的衣服和周围的草木为什么会褪色?
( HClO 具有漂白性)
1. 氯气与水反应
(1)用双线桥法表示电子转移关系并找出氧化剂和还原剂。
(2)写出离子方程式(提示:HClO 是一种弱酸)
Cl2 + H2O = HCl + HClO(次氯酸)
结合氧化还原反应原理与离子反应知识分析下列问题
该反应是氧化还原反应吗?
HClO
的性质
杀菌、消毒、漂白
酸性:H2CO3>HClO
弱酸性
强氧化性
Cl2、HClO、H2O
H+、Cl-
不稳定易分解
2HClO 2HCl + O2↑
光照
+1
三分:
四离:
氯水的成分
= H+ + Cl- + HClO
Cl2 + H2O
、ClO-、OH-(少量)
【总结】新制氯水的性质
参与反应微粒 所加试剂 实验现象 离子方程式或解释
Cl- AgNO3溶液 白色沉淀 Cl-+Ag+===AgCl↓
H+ Na2CO3 固体 有气泡产生 2H++CO32-==CO2↑+H2O
HClO 有色布条 布条颜色褪去 发生氧化还原反应
Cl2 FeCl2溶液 溶液变棕黄色 2Fe2++Cl2=2Fe3++2Cl-
Cl2、H2O SO2 黄绿色褪去 SO2+Cl2+2H2O===4H++2Cl-+SO42-
HClO、H+ 紫色石蕊 溶液 先变红后褪色 酸性和漂白性
Cl2、 H+ 镁粉 氯水的颜色褪去并有气泡产生 Mg+Cl2===Mg2++2Cl-Mg+2H+===Mg2++H2↑
NO.2
氯气与碱的反应
4.消防员为什么要在氯气泄漏现场喷H2O后撒生石灰(CaO) ?
(1) 2Ca(OH)2+2Cl2 = Ca(ClO)2+CaCl2+2H2O
有效成分:Ca(ClO)2
漂白粉
Cl2 + H2O HCl + HClO
2HCl + Ca(OH)2 CaCl2 + 2H2O
2HClO + Ca(OH)2 Ca(ClO)2 + 2H2O
次氯酸钙
思考:实验结束后针筒中剩余的氯水还呈浅黄绿色,说明有氯气残留,直接排放会污染空气,该如何处理?
2. 氯气与碱反应
(2)2NaOH+Cl2 = NaClO+NaCl+H2O
有效成分:NaClO
①写出氯气与氢氧化钠反应的化学方程式。
漂白液
加氢氧化钠溶液
③将化学反应方程式改写成离子方程式。
②该反应是氧化还原反应吗?若是找出氧化剂和还原剂。
化学服务于生产生活
Ca(ClO)2
NaClO
漂白粉和漂白液的漂白原理
Ca(ClO)2 + CO2 + H2O = CaCO3 ↓ + 2 HClO
2NaClO+ CO2 + H2O = Na2CO3 + 2HClO
思考与讨论2:怎样保存漂白粉?
密封保存。
思考与讨论1:次氯酸盐如何转化为次氯酸
思考与讨论3:上述反应的原理是?酸性:H2CO3和HClO的哪个更强?能否用稀盐酸或稀硫酸代替H2CO3
强酸(相对强的酸)制取弱酸的原理;酸性:H2CO3>HClO。可以
原理:强酸制取弱酸
酸性:HClO < H2CO3
(1)漂白液
(2)漂白粉、漂粉精
【注意】工业上制取漂白粉是用氯气与石灰乳反应制得,而不是用氯气与石灰水反应。
漂白液
有效成分
制备原理
用途
________
___________________________________
杀菌、消毒
NaClO
2NaOH+Cl2 == NaCl+NaClO+H2O
小 结:漂白液、漂白粉和漂粉精
课 堂 小 结
物理
性质
化学
性质
用途
黄绿色气体,有刺激性气味、有毒的气体,密度比空气大,可溶于水。
制作消毒剂、漂白剂等
Cl2
1.与水反应
2.与碱反应
Cl2 + H2O = HCl + HClO(次氯酸)
1.下列关于氯水的说法中正确的是( )
A. 新制氯水中只含有Cl2和H2O分子
B. 新制氯水能杀菌消毒是因为Cl2有毒,能毒杀细菌
C. 光照氯水有气泡逸出,该气体是Cl2
D. 氯水放置数天后酸性增强
D
2.自来水是用氯气杀菌消毒的,不法商贩用自来水冒充纯净水销售,为辨别纯净水真伪,可用下列哪种试剂鉴别( )
A.氢氧化钠溶液 B.氯化铁溶液
C.硝酸银溶液 D.酚酞试液
C
3.如图所示,A处通入湿润的Cl2,关闭B阀时,C处干燥的红布看不到明显现象,当打开B阀后,C处干燥的红布条逐渐褪色,则洗气瓶D中装的是( )
①浓硫酸 ②NaOH溶液 ③饱和NaCl溶液.
A.①②③ B.①②
C.②③ D.①③
B
4.有些地方的自来水用氯气消毒,某学生用这种自来水配制下列溶液,不会使药品变质的是( )
A.NaOH溶液 B .AgNO3溶液 C.Na2CO3溶液 D. 盐酸
D
5.液氯与氯水的区别?新制氯水与久置氯水的区别?
液氯 氯水 分类
成分
性质
纯净物
混合物
新制
久置
只有Cl2
分子:
Cl2 ,HClO,H2O
离子:
H+,Cl-,ClO-
分子:H2O
离子:H+,Cl-
有氧化性,无酸性和漂白性
有酸性,强氧化性,能漂白,消毒,光照时HClO分解
只有酸性
实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中
