九年级化学上册第三单元课题3元素 同步练习(含答案解析)
文档属性
| 名称 | 九年级化学上册第三单元课题3元素 同步练习(含答案解析) |  | |
| 格式 | docx | ||
| 文件大小 | 781.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-07 09:15:07 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
中小学教育资源及组卷应用平台
九年级化学上册 第三单元 课题3 元素 同步练习
一、单选题
1.氧元素和碳元素的本质区别是( )
A.质子数不同 B.中子数不同 C.相对原子质量不同 D.电子数不同
2.下列关于镁原子和镁离子的说法正确的是( )
A.它们的核内质子数相间 B.它们的化学性质相同
C.它们的核外电子数相同 D.镁原子因得到电子形成镁离子
3.地球上的几千万种物质由一百多种元素组成。地壳中含量最多的金属元素是( )
A.Si B.Fe C.Al D.O
4.1774年,瑞典化学家舍勒在从事软锰矿的研究时发现氯元素。如图是氯元素在元素周期表中的相关信息及原子结构示意图。下列叙述错误的是( )
A.n=8 B.氯元素原子核外有3个电子层
C.氯元素的相对原子质量为35.45 D.氯元素属于非金属元素
5.归纳推理是一种重要的化学思维方法.下列归纳推理正确的是( )
A.原子不显电性,所以构成原子的粒子也不显电性
B.氢气和氯气反应生成氯化氢是化合反应,故化合反应的反应物只有两种
C.同种元素原子含有相同质子数,故质子数相同的粒子一定是同种元素的原子
D.混合物中各种成分保持各自性质,故氮气和氧气混合,其各自化学性质不变
6.如图所示,①②③④⑤分别是五种微观粒子的结构示意图,下列说法不正确的是( )
A.①中 B.五种粒子共表示4种元素
C.五种微观粒子中属于阳离子的是③ D.①、②、⑤的化学性质相似
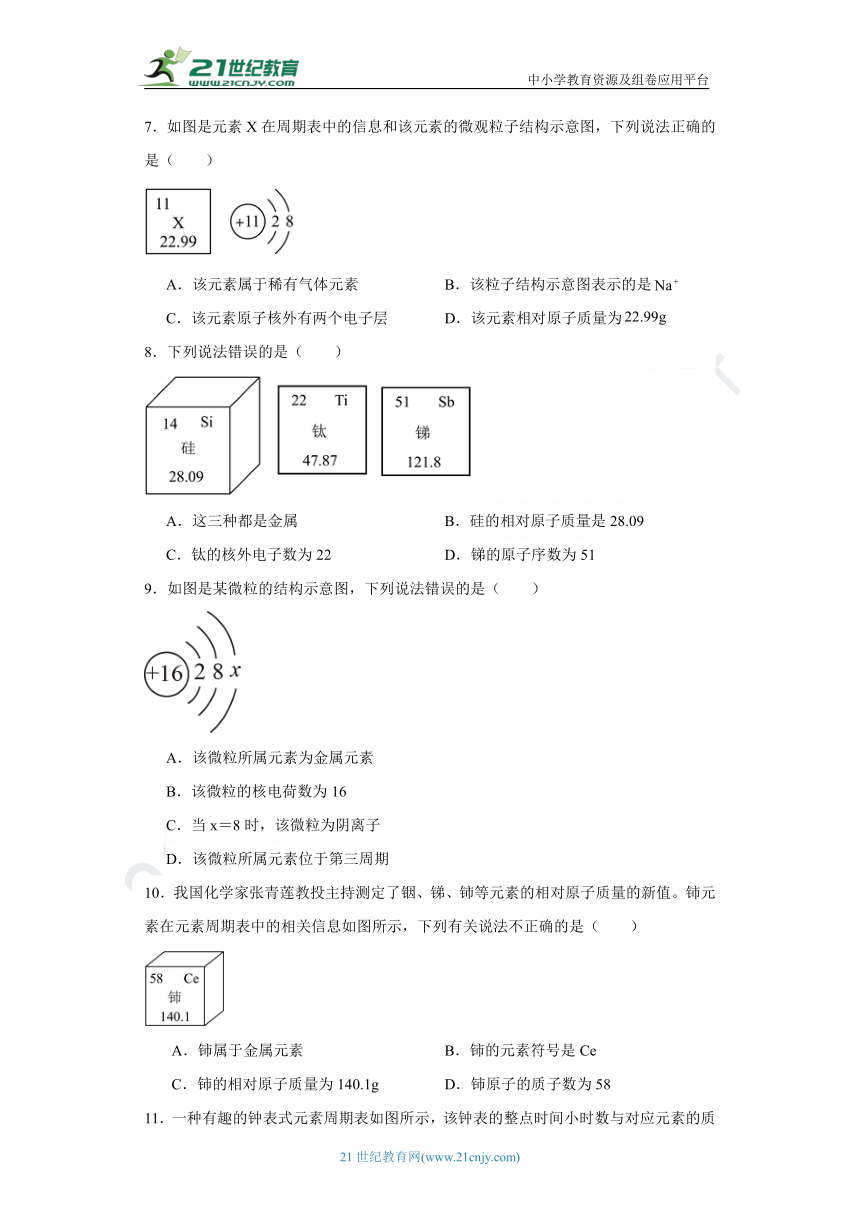
7.如图是元素X在周期表中的信息和该元素的微观粒子结构示意图,下列说法正确的是( )
A.该元素属于稀有气体元素 B.该粒子结构示意图表示的是
C.该元素原子核外有两个电子层 D.该元素相对原子质量为
8.下列说法错误的是( )
A.这三种都是金属 B.硅的相对原子质量是28.09
C.钛的核外电子数为22 D.锑的原子序数为51
9.如图是某微粒的结构示意图,下列说法错误的是( )
A.该微粒所属元素为金属元素
B.该微粒的核电荷数为16
C.当x=8时,该微粒为阴离子
D.该微粒所属元素位于第三周期
10.我国化学家张青莲教投主持测定了铟、锑、铈等元素的相对原子质量的新值。铈元素在元素周期表中的相关信息如图所示,下列有关说法不正确的是( )
A.铈属于金属元素 B.铈的元素符号是Ce
C.铈的相对原子质量为140.1g D.铈原子的质子数为58
11.一种有趣的钟表式元素周期表如图所示,该钟表的整点时间小时数与对应元素的质子数相等。下列说法中正确的是( )
A.12:00对应的元素为金属元素
B.10:00对应的元素易形成化合物
C.9:00对应元素的离子符号为
D.该钟表的整点时间与原子结构中的中子数数目相等
12.硼是制造火箭耐热合金的原料。下列说法错误的是( )
A.硼属于金属元素 B.硼的原子序数是5
C.硼的相对原子质量是10.81 D.硼原子的质子数是5
13.下列排序正确的是( )
A.分子间的间隔由大到小:氧气、液氧、固体氧
B.原子核外电子层数由多到少:氢、碳、铝
C.地壳中元素含量由高到低:氧、铝、硅
D.空气中气体的体积分数由多到少:氧气、二氧化碳、氮气
14.中国芯彰显中国“智”造,芯片的基材主要是高纯硅。硅元素在元素周期表中的信息及硅原子的结构示意图如图。下列说法不正确的是( )
A.硅元素属于金属元素
B.硅的相对原子质量为28.09
C.硅元素位于元素周期表中第三周期
D.硅原子核外有3个电子层,最外层有4个电子
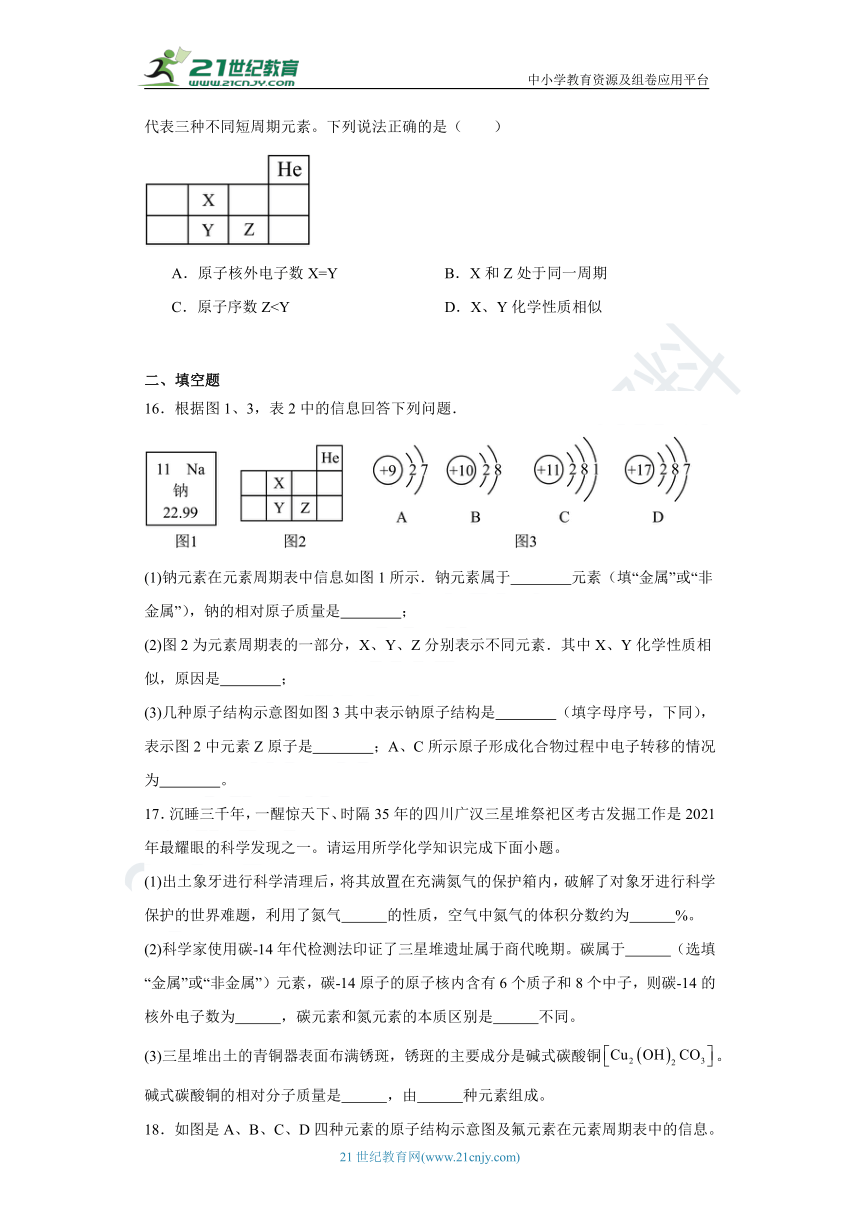
15.元素周期表是学习和研究化学的重要工具。如图是元素周期表的一部分,X、Y、Z代表三种不同短周期元素。下列说法正确的是( )
A.原子核外电子数X=Y B.X和Z处于同一周期
C.原子序数Z二、填空题
16.根据图1、3,表2中的信息回答下列问题.
(1)钠元素在元素周期表中信息如图1所示.钠元素属于 元素(填“金属”或“非金属”),钠的相对原子质量是 ;
(2)图2为元素周期表的一部分,X、Y、Z分别表示不同元素.其中X、Y化学性质相似,原因是 ;
(3)几种原子结构示意图如图3其中表示钠原子结构是 (填字母序号,下同),表示图2中元素Z原子是 ;A、C所示原子形成化合物过程中电子转移的情况为 。
17.沉睡三千年,一醒惊天下、时隔35年的四川广汉三星堆祭祀区考古发掘工作是2021年最耀眼的科学发现之一。请运用所学化学知识完成下面小题。
(1)出土象牙进行科学清理后,将其放置在充满氮气的保护箱内,破解了对象牙进行科学保护的世界难题,利用了氮气 的性质,空气中氮气的体积分数约为 %。
(2)科学家使用碳-14年代检测法印证了三星堆遗址属于商代晚期。碳属于 (选填“金属”或“非金属”)元素,碳-14原子的原子核内含有6个质子和8个中子,则碳-14的核外电子数为 ,碳元素和氮元素的本质区别是 不同。
(3)三星堆出土的青铜器表面布满锈斑,锈斑的主要成分是碱式碳酸铜。碱式碳酸铜的相对分子质量是 ,由 种元素组成。
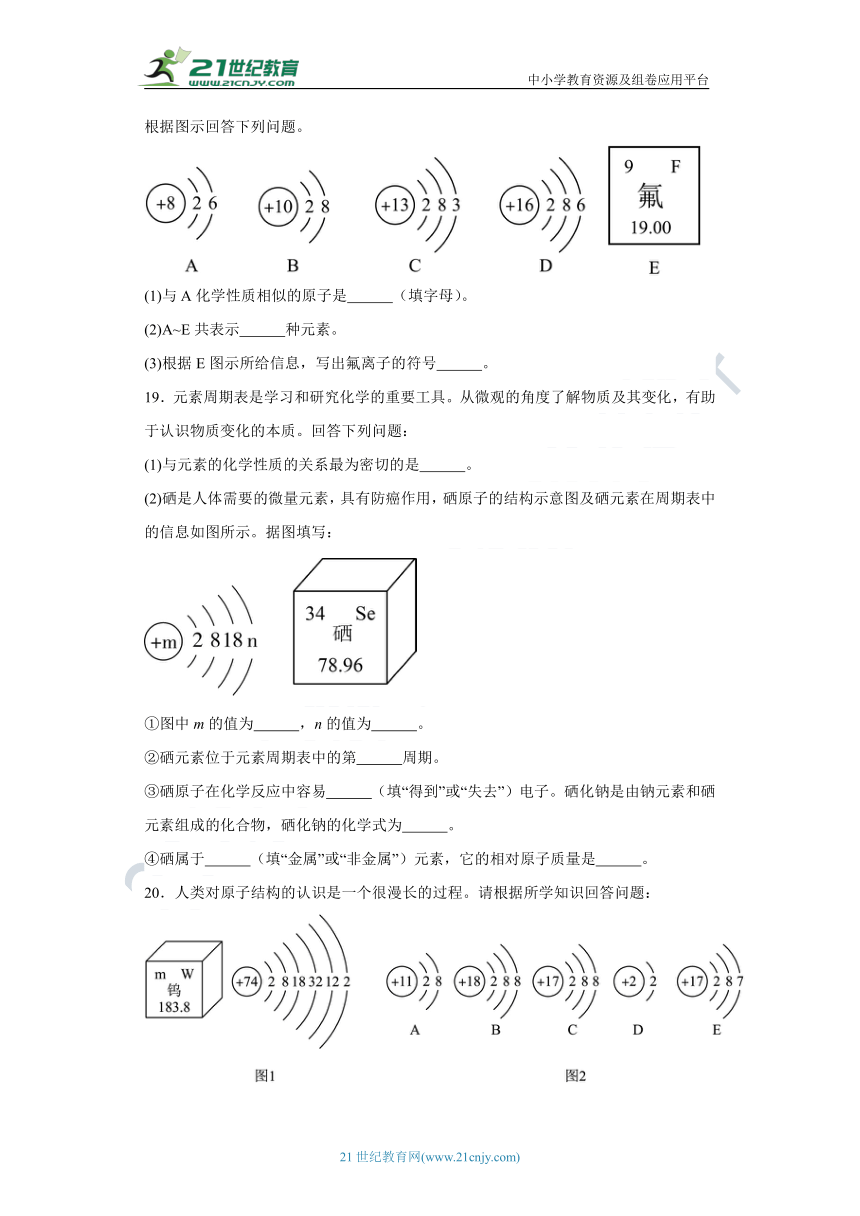
18.如图是A、B、C、D四种元素的原子结构示意图及氟元素在元素周期表中的信息。根据图示回答下列问题。
(1)与A化学性质相似的原子是 (填字母)。
(2)A~E共表示 种元素。
(3)根据E图示所给信息,写出氟离子的符号 。
19.元素周期表是学习和研究化学的重要工具。从微观的角度了解物质及其变化,有助于认识物质变化的本质。回答下列问题:
(1)与元素的化学性质的关系最为密切的是 。
(2)硒是人体需要的微量元素,具有防癌作用,硒原子的结构示意图及硒元素在周期表中的信息如图所示。据图填写:
①图中m的值为 ,n的值为 。
②硒元素位于元素周期表中的第 周期。
③硒原子在化学反应中容易 (填“得到”或“失去”)电子。硒化钠是由钠元素和硒元素组成的化合物,硒化钠的化学式为 。
④硒属于 (填“金属”或“非金属”)元素,它的相对原子质量是 。
20.人类对原子结构的认识是一个很漫长的过程。请根据所学知识回答问题:
(1)赣州素有“世界钨都”的美誉。钨在元素周期表中的信息以及原子结构示意图如图1,则m的数值为 ,其相对原子质量为 ,该元素位于元素周期表的第 周期。
(2)图2中A、B、C、D、E是五种粒子的结构示意图。请回答下列问题:
①图中A、B、C、D、E共有 种元素;属于阴离子的是 (填序号)。
②A、B、C、D、E五种粒子中,与B化学性质相似的原子是 (填序号)。
三、实验题
21.如图是测定空气中氧气含量的简易实验装置。
资料:白磷在40°C左右着火。
【实验过程】
Ⅰ.用手指顶住空注射器(60mL)末端的小孔,轻轻推动活塞,看活塞是否弹回。
Ⅱ.取下注射器的活塞,在底部放一枚圆形铜片,铜片上放足量的白磷,推入活塞使其停在50mL刻度处,并用橡胶塞封闭注射器管口。
Ⅲ.将注射器放入80°C热水中,片刻后白磷开始燃烧,待白磷熄灭后,取出注射器放入室温水中冷却。
(1)步骤I的实验目的是 。
(2)实验中热水的作用是 。
(3)磷在空气中燃烧时的主要现象是 ,写出该反应的文字或符号表达式是 。
(4)白磷从燃烧至熄灭的过程中,可观察到注射器活塞的运动情况是 。
(5)注射器的活塞最终停在 mL处:注射器冷却时不能用温度过低的水,其原因是 。
(6)红磷与白磷的质子数都为 ,属于 元素(填“同种”或“不同种”)。
22.填空:
(1)水是由 组成;
(2)水是由 构成;
(3)水分子是由 构成;
(4)1个水(H2O)分子是由 构成;
(5)铁是由 组成;
(6)铁是由 构成。
23.生活中常见物质的性质、制法等是化学研究的重要内容.
铈是一种稀土元素,如图是铈元素在元素周期表中的某些信息,下列有关铈的说法正确的是 .
A 元素符号为 B 属于非金属元素
C 相对原子质量为 D 原子核内质子数为
碳元素是形成化合物种类最多的元素,含碳物质是中学化学中研究的重要内容.
①“低碳生活”倡导低能量、低消费,主要是为了减少 (填化学式)的排放量.
②丁烷是液化石油气的成分之一,丁烷完全燃烧后与甲烷完全燃烧后的产物相同,其化学反应方程式是 .
如图是“测定空气中氧气含量”的简易装置图.
①待红磷熄灭并冷却后,打开弹簧夹,发生的现象 .
②该实验不能用木炭代替红磷,可能原因是 .
如图装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物.
①装置玻璃管里可观察到的现象为 .
②实验开始时应先通混合气体再加热,这样做的目的是 .
③装置的作用是 .
克甲烷在空气中完全燃烧,生成多少克水 ?
四、计算题
24.据《自然》杂志报道,科学家最近研制出一种以元素锶(Sr)的原子做钟摆的钟是世界上最精确的钟。这是锶原子的结构示意图如图,锶原子的相对原子质量近似值为88,一个碳原子质量为1.993×10-26kg。则求:
(1)锶原子的原子序数为 ,在元素周期表中位于第 周期,核内中子数为 ,核电荷数为 ;
(2)求锶元素原子的质量(写出计算过程,结果保留四位有效数字)
五、综合应用题
25.2022年北京冬奥会举世瞩目,新能源的开发利用践行了我国“绿色办奥”的理念,请回答下列问题。
(1)“雪如意”国家跳台滑雪中心,采用了地表水收集技术,可用积雪融化形成的雪水造雪。雪融化成水,发生变化的是______(填序号,下同)。
A.分子种类 B.分子间隔 C.分子质量
(2)北京冬奥会采用CO2跨临界直冷制冰技术(如图一所示)。
①液态CO2蒸发吸热实现制冷,使水变成冰。此过程中,CO2的化学性质并没有改变,原因是 (从微观的角度解释)。
②超临界状态CO2通过冷却器实现循环,并释放热量为场馆除湿、供热。此技术的优点是 (写出1点即可)。
(3)场馆“冰丝带”是由3360块发电玻璃拼成。发电玻璃是在普通玻璃上覆盖一层碲化镉(化学式CdTe)。碲化镉在弱光照射下也能持续发电。
①根据图二信息判断,下列说法正确的是 。
A.Te的相对原子质量是127.6g
B.Te原子核内的质子数是52
C.CdTe中Te的化合价是-2价
D.符号“Cd”表示镉元素;一个镉原子;金属镉
②下图是元素周期表(部分)与碲原子结构示意图。碲元素化学性质与图中 元素化学性质相似。碲元素与13号元素形成的化合物化学式为: 。
中小学教育资源及组卷应用平台
中小学教育资源及组卷应用平台
21世纪教育网(www.21cnjy.com)
21世纪教育网(www.21cnjy.com)
参考答案:
1.A
【详解】具有相同质子数的一类原子总称为元素,氧元素和碳元素的本质区别是质子数不同,故选A。
2.A
【详解】A、镁原子和镁离子的质子数都是12,核内质子数相间,符合题意;
B、镁原子最外层电子数为2,镁离子最外层电子数为8,最外层电子数不同,化学性质不同,不符合题意;
C、镁原子核外电子数为12,镁离子核外电子数为10,不符合题意;
D、镁原子失去2个电子形成带正电荷的镁离子,不符合题意;
故选A。
3.C
【详解】地壳中含量前五位的元素为氧、硅、铝、铁、钙,故地壳中含量最多的金属元素是Al。
故选C。
4.A
【详解】A、在原子中,质子数=核外电子数,故17=2+8+n,n=7,符合题意;
B、在元素周期表中,元素名称左上角的数字表示原子序数,在原子中,原子序数=质子数=核外电子数,故氯原子核外电子排布为2、8、7,故氯元素原子核外有3个电子层,不符合题意;
C、在元素周期表中,元素名称下方的数字表示相对原子质量,故氯元素的相对原子质量为35.45,不符合题意;
D、由“气”字旁可知,氯元素属于非金属元素,不符合题意。
故选A。
5.D
【详解】A、原子不显电性,构成原子的粒子显电性,其中原子核带正电荷,电子带负电荷,原子核与电子所带的电荷数相等,电性相反,故选项说法错误;
B、氢气和氯气反应生成氯化氢是化合反应,但是化合反应的反应物也可能有两种以上的物质,如Cu 、H2O、O2、CO2反应生成Cu2(OH)2CO3,故选项说法错误;
C、同种元素原子含有相同质子数,但是质子数相同的粒子不一定是同种元素的原子,如H2O中含有10个质子,Ne含有10个质子,两种微粒不属于同种元素,故选项说法错误;
D、分子是保持物质化学性质的最小微粒,氮气与氧气混合后,构成物质的分子不发生变化,则各自化学性质不变,故选项说法正确。
故选D。
6.D
【详解】A、在原子中,质子数=核外电子数,20=2+8+x+2,x=8,故选项说法正确;
B、不同种元素最本质的区别是质子数不同,③和④核内质子数相同,属于同一种元素,图中共表示4种元素,故选项说法正确;
C、③质子数=12,核外电子数=10,质子数>核外电子数,为阳离子,故选项说法正确;
D、②中原子的最外层电子数为2,但其核外只有一个电子层,属于稀有气体元素的原子,化学性质稳定;①⑤的最外层电子数均为2,在化学反应中易失去2个电子而形成阳离子,故①⑤的化学性质相似,故选项说法错误;
故选:D。
7.B
【详解】A、由信息示意图可知,元素X原子序数为11,故为钠元素,钠元素不是稀有气体元素,故A错误,不符合题意;
B、由该粒子结构示意图可知,该粒子核电荷数为11,核电荷数=质子数=电子数=原子序数,故该粒子为钠元素对应的粒子,质子数为11,电子数为10,故为钠离子,故B正确,符合题意;
C、由A解析可知,该元素为钠元素,钠原子的电子数=质子数=原子序数=核电荷数=11,故核外电子排布为第一层2个电子,第二层8个电子,第三层1个电子,故该元素原子核外有三个电子层,故C错误,不符合题意;
D、由信息示意图可知,该元素相对原子质量为22.99,单位为“1”,不为g,故D错误,不符合题意。
故选:B。
8.A
【详解】A、硅带有石字旁,属于非金属元素,钛和锑带有金字旁,属于金属元素,故A说法错误;
B、由元素周期表中的一格可知,汉字下方的数字表示相对原子质量,硅的相对原子质量为28.09,故B说法正确;
C、由元素周期表中的一格可知,左上角的数字表示原子序数,钛的原子序数为22,根据在原子中,质子数=核外电子数=原子序数,故钛的核外电子数为22,故C说法正确;
D、由元素周期表中的一格可知,左上角的数字表示原子序数,锑的原子序数为51,故D说法正确;
故选A。
9.A
【详解】A、据图可知,该微粒为质子数为16的硫原子或离子,硫是石字旁属于非金属元素。A错误;
B、由结构示意图可以知道该微粒的核电荷数为16。B正确;
C、根据原子结构示意图的特点:x=8时,质子数16小于核外电子数18,是阴离子;C正确。
D、由结构示意图可以知道该原子核外有3个电子层,在原子中,电子层数=周期数,所以该微粒所属元素位于第三周期。D正确。
综上所述:选择A。
10.C
【详解】A、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是铈,属于金属元素,故选项说法正确。
B、根据铈元素在元素周期表中的信息图可知,该元素的元素符号是Ce,故选项说法正确。
C、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,元素的相对原子质量为140.1,相对原子质量单位是“1”,不写,不是“g”,故选项说法错误。
D、根据元素周期表中的信息图可知,左上角的数字为58,表示原子序数为58;根据原子序数=核电荷数=质子数=核外电子数,则铈原子的核电荷数为58,故选项说法正确。
故选:C。
11.A
【详解】A.12:00对应的元素为镁元素,汉字偏旁是“金”,属于金属元素,此选项正确;
B.10:00对应的元素是氖元素,化学性质稳定,不易形成化合物,此选项错误;
C.9:00对应元素是氟元素,氟原子的最外层有7个电子,在化学反应中易得到1个电子而形成带有一个单位负电荷的氟离子,离子符号为,此选项错误;
D.由图示可知,该钟表的整点时间与原子结构中的质子数相等,此选项错误。
故选A。
12.A
【详解】A、由“石”字旁可知,硼属于非金属元素,符合题意;
B、在元素周期表中,元素名称左上角的数字表示原子序数,故硼的原子序数是5,不符合题意;
C、在元素周期表中,元素名称下方的数字表示相对原子质量,故硼的相对原子质量是10.81,不符合题意;
D、在原子中,质子数=原子序数,故硼原子的质子数是5,不符合题意。
故选A。
13.A
【详解】A、分子间的间隔由大到小分别是气体、液体、固体,所以分子间的间隔由大到小分别是氧气、液氧、固体氧,故选项排序正确;
B、氢元素在第一周期,原子核外电子层数为1;碳元素位于第二周期,原子核外电子层数为2;铝元素位于第三周期,原子核外电子层数为3;所以原子核外电子层数由多到少分别是铝、碳、氢,故选项排序错误;
C、地壳中含量较多的元素按含量从高到低的排序为氧、硅、铝,故选项排序错误;
D、空气中各成分的体积分数分别是:氮气约占空气总体积的78%、氧气约占空气总体积的21%、稀有气体约占空气总体积的0.94%、二氧化碳约占空气总体积的0.03%、其它气体和杂质约占空气总体积的0.03%,所以空气中气体的体积分数按由多到少分别是氮气、氧气、二氧化碳,故选项排序错误;
故选:A。
14.A
【详解】A、硅带有石字旁,属于非金属元素,故A说法不正确;
B、由元素周期表中的一格可知,汉字下方的数字表示相对原子质量,故硅的相对原子质量为28.09,故B说法正确;
C、根据原子核外电子层数=周期数,由硅原子结构示意图可知,硅原子核外有3个电子层,则硅元素位于元素周期表中第三周期,故C说法正确;
D、由硅原子结构示意图可知,硅原子核外有3个电子层,最外层有4个电子,故D说法正确;
故选A。
15.D
【详解】A、同一个一种核外电子数才会相同,原子核外电子数X>Y,错误;
B、X在第二周期,Z在第三周期,所以X和Z处于不同周期,错误;
C、Z在Y后面,所以原子序数Z>Y,错误;
D、X、Y在同一个主族,最外层电子数相同所以化学性质相似,正确。
故选:D。
16.(1) 金属 22.99
(2)原子核最外层电子数相同
(3) C D 钠原子失去一个电子,氟原子得到一个电子
【详解】(1)钠的偏旁为“钅”,则属于金属元素;元素周期表中最下方数字为相对原子质量,则Na的相对原子质量为22.99,单位为“1”;
(2)根据图示可推断出X、Y为O、S,O的原子核最外层电子数为6,S的原子核最外层电子数为6,原子核最外层电子数相同的原子化学性质相似,则O、S的化学性质相似;
(3)Na的原子核外有11个电子,根据原子核外电子排布规律可知,第一层有2个电子,第二层有8个电子,第三层有1个电子,则原子结构示意图为C;
根据元素的在元素周期表中的位置可知Z为Cl,Cl的原子核外有17个电子,根据原子核外电子排布规律可知,第一层有2个电子,第二层有8个电子,第三层有7个电子,则原子结构示意图为D;
微粒A中核电荷数为9,核外电子数为9,则为F;微粒C中核电荷数为11,核外电子数为11,则为Na,Na与F结合形成NaF过程中,钠原子失去一个电子,氟原子得到一个电子。
17.(1) 不活泼 78
(2) 非金属 6 质子数/核电荷数
(3) 222 四/4
【详解】(1)①出土象牙进行科学清理后,将其放置在充满氮气的保护箱内,利用了氮气化学性质不活波,故填:不活波;
②空气中氮气的体积分数约为78%,故填:78;
(2)①碳字带有石字旁,属于非金属元素,故填:非金属;
②原子中质子数=核电荷数=核外电子数,碳-14原子的原子核内含有6个质子和8个中子,则碳-14的核外电子数为6,故填:6;
③具有相同质子数或核电荷数的一类原子的总称为元素,因此碳元素和氮元素的本质区别是质子数不同或核电荷数不同,故填:质子数不同或核电荷数不同;
(3)①锈斑的主要成分是碱式碳酸铜 [Cu2(OH)2CO3] ,相对分子质量是(2×64)+(16+1)×2+(1×12)+(3×16)=222,故填:222;
②由化学式可知,它是由铜、氧、碳、氢四种元素组成,故填:四或4。
18.(1)D
(2)五/5
(3)
【详解】(1)元素的化学性质与其原子的核外电子排布,特别是最外层电子的数目有关,则A与D化学性质相似,因为它们原子的最外层电子数相同,故填:D;
(2)元素是具有相同核电荷数(或质子数)的一类原子总称,则A~E共表示5种元素,故填:五或5;
(3)根据元素周期表的信息可知,左上角的数字表示原子序数,氟的原子序数为9,原子中原子序数=质子数=核外电子数,所以氟原子的核外电子数为9,核外电子数分二层排布,第一层排2个电子,第二层排7个电子,最外层电子数大于4,在化学反应中易得到电子,形成带1个单位负电荷的阴离子,其离子符号为,故填:。
19.(1)最外层电子层数
(2) 34 6 四/4 得到 非金属 78.96
【详解】(1)与元素的化学性质的关系最为密切的是最外层电子层数,故填:最外层电子层数;
(2)
最外层8个电子的结构叫做稳定结构 (特殊的是稀有气体中的氦是最外层2个电子),原子最外层电子数小于4易失电子,原子原子最外层电子数大于4 容易得到电子。
①、原子结构示意图画法:1.画出原子核(圆圈),在圆圈内标出+x,用+x表示正电荷; 2.用弧表示电子层,并标上各层所含的电子数; 3.检查核外电子数和核内质子数是否相等; 原子核外第一层最多排2个电子,第二层最多排8个电子,最外层不多于8个;所以m的值是34,n=34-2+8+18=6,故填:34;6;
②、原子核外电子层数等于周期数,所以硒元素位于元素周期表中的第四周期,故填:四(或4);
③、根据分析硒原子在化学反应中容易得到电子,钠元素常显+1价,硒元素最外层电子数为6,易得到2个电子形成稳定结构,显-2价,所以硒化钠的化学式为,故填:得到;;
④、根据分析硒属于非金属元素,下对原子质量为78.96,故填:非金属;78.96。
20.(1) 74
183.84
六/6
(2) 四/4 C D
【详解】(1)元素周期表单元格中,左上角的数字表示原子序数,原子序数=原子的质子数,则m=74;
元素周期表单元格中,最下方的数字表示相对原子质量,则其相对原子质量为183.84;
钨原子核外有6个电子层,则钨元素位于元素周期表第六周期。
(2)①CE质子数相同,属于同种元素,则共有四种元素;
A粒子质子数>核外电子数,属于阳离子;
B粒子质子数=核外电子数,属于原子;
C粒子质子数<核外电子数,属于阴离子;
D粒子质子数=核外电子数,属于原子;
E粒子质子数=核外电子数,属于原子。
则属于阴离子的为C。
②结合前面分析可知,BDE为原子,且BD最外层电子数均为稳定结构,则化学性质相似。
21.(1)检查装置的气密性
(2)提供热量,引燃白磷
(3) 产生大量的白烟,放出大量的热,生成一种白色固体 /
(4)先向上移动,后向下移动
(5) 40 用温度过低的水会造成注射器内的温度降低,压强减小,会使测量结果偏大
(6) 15 同种
【详解】(1)步骤I的实验目的是检查注射器的气密性,若活塞能弹回则气密性良好。
(2)实验中热水的作用是引燃白磷。
(3)磷在空气中燃烧的现象:产生大量的白烟,放出大量的热,生成一种白色固体;红磷与氧气发生燃烧反应生成五氧化二磷,反应的文字、符号表达式是、。
(4)白磷燃烧时,放出大量的热量,使得注射器内气体分子之间的间隔变大,压强增大,活塞会先向上移动;当白磷熄灭,装置冷却到室温后,由于白磷燃烧消耗氧气,生成五氧化二磷固体,使得注射器内气体减少,气压减小,活塞会向下移动。
(5)根据步骤II可知,注射器内空气的总体积为50mL,则消耗的氧气的体积为50mL×1/5=10mL,所以活塞最终停在50mL-10mL=40mL处;注射器冷却时用温度过低的水,会导致注射器内剩余气体分子之间间隔变小,体积减小,活塞最终停的位置小于40mL,导致测得的氧气含量偏大。
(6)红磷与白磷的质子数都为15,其属于同种元素。
22.(1)氢元素和氧元素(或氢、氧两种元素)
(2)水分子
(3)氢原子和氧原子(或氢、氧两种原子)
(4)两个氢原子和一个氧原子
(5)铁元素
(6)铁原子
【分析】从宏观方面看,物质由元素组成,物质中含有元素,元素只讲种类,不讲个数;从微观方面看,分子由原子构成,分子即讲种类又讲个数;构成物质的基本微粒有分子、原子和离子。
(1)
从宏观方面看,水是由氢元素和氧元素组成的,也可以表述为水是由氢、氧两种元素组成的。
(2)
水是非金属化合中物,大多数非金属化合物由分子构成,水由水分子构成。
(3)
从微观方面看,水分子是由氢原子和氧原子构成,也可以表述为水分子由氢、氧两种原子构成。
(4)
分了由原子构成,一个水分子是由两个氢原子和一个氧原子构成。
(5)
铁由铁元素组成。
(6)
铁属于金属单质,金属由原子直接构成,故铁由铁原子构成。
23. AD 水进入集气瓶,进入水体积约占瓶中空气体积的 木炭燃烧后会生成二氧化碳气体,装置内气体压强保持不变,水不会进入集气瓶 红棕色粉末逐渐变黑 排净装置内的空气,以防加热时发生爆炸 检验一氧化碳还原氧化铁后的产物是否是二氧化碳,并吸收了尾气中的二氧化碳 .
【详解】(1)A、由图可知,铈元素的元素符号是,故正确;B、由汉字结构可知,铈元素是金属元素,故错误;C、相对原子质量不能带g,故错误;D、铈是58号元素,原子序数=质子数,故铈原子的质子数是58,正确。故选AD。
(2)①低碳生活”倡导低能量、低消费,主要是为了减少的排放量。
②丁烷燃烧后生成二氧化碳和水,根据化学方程式的书写规则,反应方程式为
(3)①测定空气中氧气含量的实验中,待红磷熄灭并冷却后,打开弹簧夹,发生的现象水进入集气瓶,进入水的体积约占瓶中空气体积的。②该实验不能用木炭代替红磷,因为木炭燃烧后会生成二氧化碳气体,装置内气体压强保持不变,水不会进入集气瓶。
(4)①B管中是一氧化碳与氧化铁反应生成铁和二氧化碳,反应的现象是固体粉末由红色变为黑色。②一氧化碳是易燃性气体,如混有氧气的话,会燃烧引起爆炸,故要先通入一段时间一氧化碳,排进管中的氧气。③C装置中是澄清石灰水,作用是检验一氧化碳还原氧化铁后的产物是否是二氧化碳,并吸收了尾气中的二氧化碳。
(5)克甲烷在空气中完全燃烧,生成水的质量为x
x=144g
答:克甲烷在空气中完全燃烧,生成水的质量为144g。
24.(1) 38 五/5 50 38
(2)解: 设锶元素原子的质量为x
由相对原子质量的定义可知,=88
x=1.462×10-25kg
答:锶元素原子的质量为1.462×10-25kg。
【详解】(1)原子中的质子数等于核外电子数,则x=2+8+18+8+2=38,元素的原子序数等于原子的质子数,所以锶原子的原子序数为38,故填38;
由图可知,锶原子核外有5个电子层,则锶在元素周期表中位于第五周期,故填五或5;
相对原子质量≈质子数+中子数,则锶原子的中子数=88 38=50,故填50;
核电荷数等于核内质子数。锶原子的质子数为38,则其核电荷数为38,故填38。
(2)见答案
25.(1)B
(2) CO2的分子没有改变 成本低或环保等(合理即可)
(3) BCD 氧、硫 Al2Te3
【详解】(1)A、雪融化成水,一直是水分子,不符合题意;
B、雪融化成水,分子间隔增大,符合题意;
C、雪融化成水,一直是水分子,分子质量不变,不符合题意;
故选B。
(2)①液态CO2蒸发吸热实现制冷,此过程中二氧化碳分子没有变成其它分子,分子是保持物质化学性质的最小微粒,故CO2的化学性质并没有改变。
②通过冷却器实现循环,并释放热量为场馆除湿、供热,一个设备多个用途,故优点为成本低、环保等。
(3)①A、Te的相对原子质量是127.6,不符合题意;
B、对于Te原子而言,质子数=原子序数=52,符合题意;
C、Cd的最外层电子数为2,反应中易失去2个电子,CdTe中Cd的化合价为+2,化合物整体化合价为0,故Te的化合价是-2价,符合题意;
D、镉属于金属元素,故Cd可表示镉元素、一个镉原子、金属镉,符合题意;
故选BCD。
②碲最外层电子数为6,最外层电子数相同的化学性质相似,O、S的最外层电子数为6,故Te的化学性质与Al2Te3。
21世纪教育网(www.21cnjy.com)
21世纪教育网(www.21cnjy.com)
中小学教育资源及组卷应用平台
九年级化学上册 第三单元 课题3 元素 同步练习
一、单选题
1.氧元素和碳元素的本质区别是( )
A.质子数不同 B.中子数不同 C.相对原子质量不同 D.电子数不同
2.下列关于镁原子和镁离子的说法正确的是( )
A.它们的核内质子数相间 B.它们的化学性质相同
C.它们的核外电子数相同 D.镁原子因得到电子形成镁离子
3.地球上的几千万种物质由一百多种元素组成。地壳中含量最多的金属元素是( )
A.Si B.Fe C.Al D.O
4.1774年,瑞典化学家舍勒在从事软锰矿的研究时发现氯元素。如图是氯元素在元素周期表中的相关信息及原子结构示意图。下列叙述错误的是( )
A.n=8 B.氯元素原子核外有3个电子层
C.氯元素的相对原子质量为35.45 D.氯元素属于非金属元素
5.归纳推理是一种重要的化学思维方法.下列归纳推理正确的是( )
A.原子不显电性,所以构成原子的粒子也不显电性
B.氢气和氯气反应生成氯化氢是化合反应,故化合反应的反应物只有两种
C.同种元素原子含有相同质子数,故质子数相同的粒子一定是同种元素的原子
D.混合物中各种成分保持各自性质,故氮气和氧气混合,其各自化学性质不变
6.如图所示,①②③④⑤分别是五种微观粒子的结构示意图,下列说法不正确的是( )
A.①中 B.五种粒子共表示4种元素
C.五种微观粒子中属于阳离子的是③ D.①、②、⑤的化学性质相似
7.如图是元素X在周期表中的信息和该元素的微观粒子结构示意图,下列说法正确的是( )
A.该元素属于稀有气体元素 B.该粒子结构示意图表示的是
C.该元素原子核外有两个电子层 D.该元素相对原子质量为
8.下列说法错误的是( )
A.这三种都是金属 B.硅的相对原子质量是28.09
C.钛的核外电子数为22 D.锑的原子序数为51
9.如图是某微粒的结构示意图,下列说法错误的是( )
A.该微粒所属元素为金属元素
B.该微粒的核电荷数为16
C.当x=8时,该微粒为阴离子
D.该微粒所属元素位于第三周期
10.我国化学家张青莲教投主持测定了铟、锑、铈等元素的相对原子质量的新值。铈元素在元素周期表中的相关信息如图所示,下列有关说法不正确的是( )
A.铈属于金属元素 B.铈的元素符号是Ce
C.铈的相对原子质量为140.1g D.铈原子的质子数为58
11.一种有趣的钟表式元素周期表如图所示,该钟表的整点时间小时数与对应元素的质子数相等。下列说法中正确的是( )
A.12:00对应的元素为金属元素
B.10:00对应的元素易形成化合物
C.9:00对应元素的离子符号为
D.该钟表的整点时间与原子结构中的中子数数目相等
12.硼是制造火箭耐热合金的原料。下列说法错误的是( )
A.硼属于金属元素 B.硼的原子序数是5
C.硼的相对原子质量是10.81 D.硼原子的质子数是5
13.下列排序正确的是( )
A.分子间的间隔由大到小:氧气、液氧、固体氧
B.原子核外电子层数由多到少:氢、碳、铝
C.地壳中元素含量由高到低:氧、铝、硅
D.空气中气体的体积分数由多到少:氧气、二氧化碳、氮气
14.中国芯彰显中国“智”造,芯片的基材主要是高纯硅。硅元素在元素周期表中的信息及硅原子的结构示意图如图。下列说法不正确的是( )
A.硅元素属于金属元素
B.硅的相对原子质量为28.09
C.硅元素位于元素周期表中第三周期
D.硅原子核外有3个电子层,最外层有4个电子
15.元素周期表是学习和研究化学的重要工具。如图是元素周期表的一部分,X、Y、Z代表三种不同短周期元素。下列说法正确的是( )
A.原子核外电子数X=Y B.X和Z处于同一周期
C.原子序数Z
16.根据图1、3,表2中的信息回答下列问题.
(1)钠元素在元素周期表中信息如图1所示.钠元素属于 元素(填“金属”或“非金属”),钠的相对原子质量是 ;
(2)图2为元素周期表的一部分,X、Y、Z分别表示不同元素.其中X、Y化学性质相似,原因是 ;
(3)几种原子结构示意图如图3其中表示钠原子结构是 (填字母序号,下同),表示图2中元素Z原子是 ;A、C所示原子形成化合物过程中电子转移的情况为 。
17.沉睡三千年,一醒惊天下、时隔35年的四川广汉三星堆祭祀区考古发掘工作是2021年最耀眼的科学发现之一。请运用所学化学知识完成下面小题。
(1)出土象牙进行科学清理后,将其放置在充满氮气的保护箱内,破解了对象牙进行科学保护的世界难题,利用了氮气 的性质,空气中氮气的体积分数约为 %。
(2)科学家使用碳-14年代检测法印证了三星堆遗址属于商代晚期。碳属于 (选填“金属”或“非金属”)元素,碳-14原子的原子核内含有6个质子和8个中子,则碳-14的核外电子数为 ,碳元素和氮元素的本质区别是 不同。
(3)三星堆出土的青铜器表面布满锈斑,锈斑的主要成分是碱式碳酸铜。碱式碳酸铜的相对分子质量是 ,由 种元素组成。
18.如图是A、B、C、D四种元素的原子结构示意图及氟元素在元素周期表中的信息。根据图示回答下列问题。
(1)与A化学性质相似的原子是 (填字母)。
(2)A~E共表示 种元素。
(3)根据E图示所给信息,写出氟离子的符号 。
19.元素周期表是学习和研究化学的重要工具。从微观的角度了解物质及其变化,有助于认识物质变化的本质。回答下列问题:
(1)与元素的化学性质的关系最为密切的是 。
(2)硒是人体需要的微量元素,具有防癌作用,硒原子的结构示意图及硒元素在周期表中的信息如图所示。据图填写:
①图中m的值为 ,n的值为 。
②硒元素位于元素周期表中的第 周期。
③硒原子在化学反应中容易 (填“得到”或“失去”)电子。硒化钠是由钠元素和硒元素组成的化合物,硒化钠的化学式为 。
④硒属于 (填“金属”或“非金属”)元素,它的相对原子质量是 。
20.人类对原子结构的认识是一个很漫长的过程。请根据所学知识回答问题:
(1)赣州素有“世界钨都”的美誉。钨在元素周期表中的信息以及原子结构示意图如图1,则m的数值为 ,其相对原子质量为 ,该元素位于元素周期表的第 周期。
(2)图2中A、B、C、D、E是五种粒子的结构示意图。请回答下列问题:
①图中A、B、C、D、E共有 种元素;属于阴离子的是 (填序号)。
②A、B、C、D、E五种粒子中,与B化学性质相似的原子是 (填序号)。
三、实验题
21.如图是测定空气中氧气含量的简易实验装置。
资料:白磷在40°C左右着火。
【实验过程】
Ⅰ.用手指顶住空注射器(60mL)末端的小孔,轻轻推动活塞,看活塞是否弹回。
Ⅱ.取下注射器的活塞,在底部放一枚圆形铜片,铜片上放足量的白磷,推入活塞使其停在50mL刻度处,并用橡胶塞封闭注射器管口。
Ⅲ.将注射器放入80°C热水中,片刻后白磷开始燃烧,待白磷熄灭后,取出注射器放入室温水中冷却。
(1)步骤I的实验目的是 。
(2)实验中热水的作用是 。
(3)磷在空气中燃烧时的主要现象是 ,写出该反应的文字或符号表达式是 。
(4)白磷从燃烧至熄灭的过程中,可观察到注射器活塞的运动情况是 。
(5)注射器的活塞最终停在 mL处:注射器冷却时不能用温度过低的水,其原因是 。
(6)红磷与白磷的质子数都为 ,属于 元素(填“同种”或“不同种”)。
22.填空:
(1)水是由 组成;
(2)水是由 构成;
(3)水分子是由 构成;
(4)1个水(H2O)分子是由 构成;
(5)铁是由 组成;
(6)铁是由 构成。
23.生活中常见物质的性质、制法等是化学研究的重要内容.
铈是一种稀土元素,如图是铈元素在元素周期表中的某些信息,下列有关铈的说法正确的是 .
A 元素符号为 B 属于非金属元素
C 相对原子质量为 D 原子核内质子数为
碳元素是形成化合物种类最多的元素,含碳物质是中学化学中研究的重要内容.
①“低碳生活”倡导低能量、低消费,主要是为了减少 (填化学式)的排放量.
②丁烷是液化石油气的成分之一,丁烷完全燃烧后与甲烷完全燃烧后的产物相同,其化学反应方程式是 .
如图是“测定空气中氧气含量”的简易装置图.
①待红磷熄灭并冷却后,打开弹簧夹,发生的现象 .
②该实验不能用木炭代替红磷,可能原因是 .
如图装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物.
①装置玻璃管里可观察到的现象为 .
②实验开始时应先通混合气体再加热,这样做的目的是 .
③装置的作用是 .
克甲烷在空气中完全燃烧,生成多少克水 ?
四、计算题
24.据《自然》杂志报道,科学家最近研制出一种以元素锶(Sr)的原子做钟摆的钟是世界上最精确的钟。这是锶原子的结构示意图如图,锶原子的相对原子质量近似值为88,一个碳原子质量为1.993×10-26kg。则求:
(1)锶原子的原子序数为 ,在元素周期表中位于第 周期,核内中子数为 ,核电荷数为 ;
(2)求锶元素原子的质量(写出计算过程,结果保留四位有效数字)
五、综合应用题
25.2022年北京冬奥会举世瞩目,新能源的开发利用践行了我国“绿色办奥”的理念,请回答下列问题。
(1)“雪如意”国家跳台滑雪中心,采用了地表水收集技术,可用积雪融化形成的雪水造雪。雪融化成水,发生变化的是______(填序号,下同)。
A.分子种类 B.分子间隔 C.分子质量
(2)北京冬奥会采用CO2跨临界直冷制冰技术(如图一所示)。
①液态CO2蒸发吸热实现制冷,使水变成冰。此过程中,CO2的化学性质并没有改变,原因是 (从微观的角度解释)。
②超临界状态CO2通过冷却器实现循环,并释放热量为场馆除湿、供热。此技术的优点是 (写出1点即可)。
(3)场馆“冰丝带”是由3360块发电玻璃拼成。发电玻璃是在普通玻璃上覆盖一层碲化镉(化学式CdTe)。碲化镉在弱光照射下也能持续发电。
①根据图二信息判断,下列说法正确的是 。
A.Te的相对原子质量是127.6g
B.Te原子核内的质子数是52
C.CdTe中Te的化合价是-2价
D.符号“Cd”表示镉元素;一个镉原子;金属镉
②下图是元素周期表(部分)与碲原子结构示意图。碲元素化学性质与图中 元素化学性质相似。碲元素与13号元素形成的化合物化学式为: 。
中小学教育资源及组卷应用平台
中小学教育资源及组卷应用平台
21世纪教育网(www.21cnjy.com)
21世纪教育网(www.21cnjy.com)
参考答案:
1.A
【详解】具有相同质子数的一类原子总称为元素,氧元素和碳元素的本质区别是质子数不同,故选A。
2.A
【详解】A、镁原子和镁离子的质子数都是12,核内质子数相间,符合题意;
B、镁原子最外层电子数为2,镁离子最外层电子数为8,最外层电子数不同,化学性质不同,不符合题意;
C、镁原子核外电子数为12,镁离子核外电子数为10,不符合题意;
D、镁原子失去2个电子形成带正电荷的镁离子,不符合题意;
故选A。
3.C
【详解】地壳中含量前五位的元素为氧、硅、铝、铁、钙,故地壳中含量最多的金属元素是Al。
故选C。
4.A
【详解】A、在原子中,质子数=核外电子数,故17=2+8+n,n=7,符合题意;
B、在元素周期表中,元素名称左上角的数字表示原子序数,在原子中,原子序数=质子数=核外电子数,故氯原子核外电子排布为2、8、7,故氯元素原子核外有3个电子层,不符合题意;
C、在元素周期表中,元素名称下方的数字表示相对原子质量,故氯元素的相对原子质量为35.45,不符合题意;
D、由“气”字旁可知,氯元素属于非金属元素,不符合题意。
故选A。
5.D
【详解】A、原子不显电性,构成原子的粒子显电性,其中原子核带正电荷,电子带负电荷,原子核与电子所带的电荷数相等,电性相反,故选项说法错误;
B、氢气和氯气反应生成氯化氢是化合反应,但是化合反应的反应物也可能有两种以上的物质,如Cu 、H2O、O2、CO2反应生成Cu2(OH)2CO3,故选项说法错误;
C、同种元素原子含有相同质子数,但是质子数相同的粒子不一定是同种元素的原子,如H2O中含有10个质子,Ne含有10个质子,两种微粒不属于同种元素,故选项说法错误;
D、分子是保持物质化学性质的最小微粒,氮气与氧气混合后,构成物质的分子不发生变化,则各自化学性质不变,故选项说法正确。
故选D。
6.D
【详解】A、在原子中,质子数=核外电子数,20=2+8+x+2,x=8,故选项说法正确;
B、不同种元素最本质的区别是质子数不同,③和④核内质子数相同,属于同一种元素,图中共表示4种元素,故选项说法正确;
C、③质子数=12,核外电子数=10,质子数>核外电子数,为阳离子,故选项说法正确;
D、②中原子的最外层电子数为2,但其核外只有一个电子层,属于稀有气体元素的原子,化学性质稳定;①⑤的最外层电子数均为2,在化学反应中易失去2个电子而形成阳离子,故①⑤的化学性质相似,故选项说法错误;
故选:D。
7.B
【详解】A、由信息示意图可知,元素X原子序数为11,故为钠元素,钠元素不是稀有气体元素,故A错误,不符合题意;
B、由该粒子结构示意图可知,该粒子核电荷数为11,核电荷数=质子数=电子数=原子序数,故该粒子为钠元素对应的粒子,质子数为11,电子数为10,故为钠离子,故B正确,符合题意;
C、由A解析可知,该元素为钠元素,钠原子的电子数=质子数=原子序数=核电荷数=11,故核外电子排布为第一层2个电子,第二层8个电子,第三层1个电子,故该元素原子核外有三个电子层,故C错误,不符合题意;
D、由信息示意图可知,该元素相对原子质量为22.99,单位为“1”,不为g,故D错误,不符合题意。
故选:B。
8.A
【详解】A、硅带有石字旁,属于非金属元素,钛和锑带有金字旁,属于金属元素,故A说法错误;
B、由元素周期表中的一格可知,汉字下方的数字表示相对原子质量,硅的相对原子质量为28.09,故B说法正确;
C、由元素周期表中的一格可知,左上角的数字表示原子序数,钛的原子序数为22,根据在原子中,质子数=核外电子数=原子序数,故钛的核外电子数为22,故C说法正确;
D、由元素周期表中的一格可知,左上角的数字表示原子序数,锑的原子序数为51,故D说法正确;
故选A。
9.A
【详解】A、据图可知,该微粒为质子数为16的硫原子或离子,硫是石字旁属于非金属元素。A错误;
B、由结构示意图可以知道该微粒的核电荷数为16。B正确;
C、根据原子结构示意图的特点:x=8时,质子数16小于核外电子数18,是阴离子;C正确。
D、由结构示意图可以知道该原子核外有3个电子层,在原子中,电子层数=周期数,所以该微粒所属元素位于第三周期。D正确。
综上所述:选择A。
10.C
【详解】A、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是铈,属于金属元素,故选项说法正确。
B、根据铈元素在元素周期表中的信息图可知,该元素的元素符号是Ce,故选项说法正确。
C、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,元素的相对原子质量为140.1,相对原子质量单位是“1”,不写,不是“g”,故选项说法错误。
D、根据元素周期表中的信息图可知,左上角的数字为58,表示原子序数为58;根据原子序数=核电荷数=质子数=核外电子数,则铈原子的核电荷数为58,故选项说法正确。
故选:C。
11.A
【详解】A.12:00对应的元素为镁元素,汉字偏旁是“金”,属于金属元素,此选项正确;
B.10:00对应的元素是氖元素,化学性质稳定,不易形成化合物,此选项错误;
C.9:00对应元素是氟元素,氟原子的最外层有7个电子,在化学反应中易得到1个电子而形成带有一个单位负电荷的氟离子,离子符号为,此选项错误;
D.由图示可知,该钟表的整点时间与原子结构中的质子数相等,此选项错误。
故选A。
12.A
【详解】A、由“石”字旁可知,硼属于非金属元素,符合题意;
B、在元素周期表中,元素名称左上角的数字表示原子序数,故硼的原子序数是5,不符合题意;
C、在元素周期表中,元素名称下方的数字表示相对原子质量,故硼的相对原子质量是10.81,不符合题意;
D、在原子中,质子数=原子序数,故硼原子的质子数是5,不符合题意。
故选A。
13.A
【详解】A、分子间的间隔由大到小分别是气体、液体、固体,所以分子间的间隔由大到小分别是氧气、液氧、固体氧,故选项排序正确;
B、氢元素在第一周期,原子核外电子层数为1;碳元素位于第二周期,原子核外电子层数为2;铝元素位于第三周期,原子核外电子层数为3;所以原子核外电子层数由多到少分别是铝、碳、氢,故选项排序错误;
C、地壳中含量较多的元素按含量从高到低的排序为氧、硅、铝,故选项排序错误;
D、空气中各成分的体积分数分别是:氮气约占空气总体积的78%、氧气约占空气总体积的21%、稀有气体约占空气总体积的0.94%、二氧化碳约占空气总体积的0.03%、其它气体和杂质约占空气总体积的0.03%,所以空气中气体的体积分数按由多到少分别是氮气、氧气、二氧化碳,故选项排序错误;
故选:A。
14.A
【详解】A、硅带有石字旁,属于非金属元素,故A说法不正确;
B、由元素周期表中的一格可知,汉字下方的数字表示相对原子质量,故硅的相对原子质量为28.09,故B说法正确;
C、根据原子核外电子层数=周期数,由硅原子结构示意图可知,硅原子核外有3个电子层,则硅元素位于元素周期表中第三周期,故C说法正确;
D、由硅原子结构示意图可知,硅原子核外有3个电子层,最外层有4个电子,故D说法正确;
故选A。
15.D
【详解】A、同一个一种核外电子数才会相同,原子核外电子数X>Y,错误;
B、X在第二周期,Z在第三周期,所以X和Z处于不同周期,错误;
C、Z在Y后面,所以原子序数Z>Y,错误;
D、X、Y在同一个主族,最外层电子数相同所以化学性质相似,正确。
故选:D。
16.(1) 金属 22.99
(2)原子核最外层电子数相同
(3) C D 钠原子失去一个电子,氟原子得到一个电子
【详解】(1)钠的偏旁为“钅”,则属于金属元素;元素周期表中最下方数字为相对原子质量,则Na的相对原子质量为22.99,单位为“1”;
(2)根据图示可推断出X、Y为O、S,O的原子核最外层电子数为6,S的原子核最外层电子数为6,原子核最外层电子数相同的原子化学性质相似,则O、S的化学性质相似;
(3)Na的原子核外有11个电子,根据原子核外电子排布规律可知,第一层有2个电子,第二层有8个电子,第三层有1个电子,则原子结构示意图为C;
根据元素的在元素周期表中的位置可知Z为Cl,Cl的原子核外有17个电子,根据原子核外电子排布规律可知,第一层有2个电子,第二层有8个电子,第三层有7个电子,则原子结构示意图为D;
微粒A中核电荷数为9,核外电子数为9,则为F;微粒C中核电荷数为11,核外电子数为11,则为Na,Na与F结合形成NaF过程中,钠原子失去一个电子,氟原子得到一个电子。
17.(1) 不活泼 78
(2) 非金属 6 质子数/核电荷数
(3) 222 四/4
【详解】(1)①出土象牙进行科学清理后,将其放置在充满氮气的保护箱内,利用了氮气化学性质不活波,故填:不活波;
②空气中氮气的体积分数约为78%,故填:78;
(2)①碳字带有石字旁,属于非金属元素,故填:非金属;
②原子中质子数=核电荷数=核外电子数,碳-14原子的原子核内含有6个质子和8个中子,则碳-14的核外电子数为6,故填:6;
③具有相同质子数或核电荷数的一类原子的总称为元素,因此碳元素和氮元素的本质区别是质子数不同或核电荷数不同,故填:质子数不同或核电荷数不同;
(3)①锈斑的主要成分是碱式碳酸铜 [Cu2(OH)2CO3] ,相对分子质量是(2×64)+(16+1)×2+(1×12)+(3×16)=222,故填:222;
②由化学式可知,它是由铜、氧、碳、氢四种元素组成,故填:四或4。
18.(1)D
(2)五/5
(3)
【详解】(1)元素的化学性质与其原子的核外电子排布,特别是最外层电子的数目有关,则A与D化学性质相似,因为它们原子的最外层电子数相同,故填:D;
(2)元素是具有相同核电荷数(或质子数)的一类原子总称,则A~E共表示5种元素,故填:五或5;
(3)根据元素周期表的信息可知,左上角的数字表示原子序数,氟的原子序数为9,原子中原子序数=质子数=核外电子数,所以氟原子的核外电子数为9,核外电子数分二层排布,第一层排2个电子,第二层排7个电子,最外层电子数大于4,在化学反应中易得到电子,形成带1个单位负电荷的阴离子,其离子符号为,故填:。
19.(1)最外层电子层数
(2) 34 6 四/4 得到 非金属 78.96
【详解】(1)与元素的化学性质的关系最为密切的是最外层电子层数,故填:最外层电子层数;
(2)
最外层8个电子的结构叫做稳定结构 (特殊的是稀有气体中的氦是最外层2个电子),原子最外层电子数小于4易失电子,原子原子最外层电子数大于4 容易得到电子。
①、原子结构示意图画法:1.画出原子核(圆圈),在圆圈内标出+x,用+x表示正电荷; 2.用弧表示电子层,并标上各层所含的电子数; 3.检查核外电子数和核内质子数是否相等; 原子核外第一层最多排2个电子,第二层最多排8个电子,最外层不多于8个;所以m的值是34,n=34-2+8+18=6,故填:34;6;
②、原子核外电子层数等于周期数,所以硒元素位于元素周期表中的第四周期,故填:四(或4);
③、根据分析硒原子在化学反应中容易得到电子,钠元素常显+1价,硒元素最外层电子数为6,易得到2个电子形成稳定结构,显-2价,所以硒化钠的化学式为,故填:得到;;
④、根据分析硒属于非金属元素,下对原子质量为78.96,故填:非金属;78.96。
20.(1) 74
183.84
六/6
(2) 四/4 C D
【详解】(1)元素周期表单元格中,左上角的数字表示原子序数,原子序数=原子的质子数,则m=74;
元素周期表单元格中,最下方的数字表示相对原子质量,则其相对原子质量为183.84;
钨原子核外有6个电子层,则钨元素位于元素周期表第六周期。
(2)①CE质子数相同,属于同种元素,则共有四种元素;
A粒子质子数>核外电子数,属于阳离子;
B粒子质子数=核外电子数,属于原子;
C粒子质子数<核外电子数,属于阴离子;
D粒子质子数=核外电子数,属于原子;
E粒子质子数=核外电子数,属于原子。
则属于阴离子的为C。
②结合前面分析可知,BDE为原子,且BD最外层电子数均为稳定结构,则化学性质相似。
21.(1)检查装置的气密性
(2)提供热量,引燃白磷
(3) 产生大量的白烟,放出大量的热,生成一种白色固体 /
(4)先向上移动,后向下移动
(5) 40 用温度过低的水会造成注射器内的温度降低,压强减小,会使测量结果偏大
(6) 15 同种
【详解】(1)步骤I的实验目的是检查注射器的气密性,若活塞能弹回则气密性良好。
(2)实验中热水的作用是引燃白磷。
(3)磷在空气中燃烧的现象:产生大量的白烟,放出大量的热,生成一种白色固体;红磷与氧气发生燃烧反应生成五氧化二磷,反应的文字、符号表达式是、。
(4)白磷燃烧时,放出大量的热量,使得注射器内气体分子之间的间隔变大,压强增大,活塞会先向上移动;当白磷熄灭,装置冷却到室温后,由于白磷燃烧消耗氧气,生成五氧化二磷固体,使得注射器内气体减少,气压减小,活塞会向下移动。
(5)根据步骤II可知,注射器内空气的总体积为50mL,则消耗的氧气的体积为50mL×1/5=10mL,所以活塞最终停在50mL-10mL=40mL处;注射器冷却时用温度过低的水,会导致注射器内剩余气体分子之间间隔变小,体积减小,活塞最终停的位置小于40mL,导致测得的氧气含量偏大。
(6)红磷与白磷的质子数都为15,其属于同种元素。
22.(1)氢元素和氧元素(或氢、氧两种元素)
(2)水分子
(3)氢原子和氧原子(或氢、氧两种原子)
(4)两个氢原子和一个氧原子
(5)铁元素
(6)铁原子
【分析】从宏观方面看,物质由元素组成,物质中含有元素,元素只讲种类,不讲个数;从微观方面看,分子由原子构成,分子即讲种类又讲个数;构成物质的基本微粒有分子、原子和离子。
(1)
从宏观方面看,水是由氢元素和氧元素组成的,也可以表述为水是由氢、氧两种元素组成的。
(2)
水是非金属化合中物,大多数非金属化合物由分子构成,水由水分子构成。
(3)
从微观方面看,水分子是由氢原子和氧原子构成,也可以表述为水分子由氢、氧两种原子构成。
(4)
分了由原子构成,一个水分子是由两个氢原子和一个氧原子构成。
(5)
铁由铁元素组成。
(6)
铁属于金属单质,金属由原子直接构成,故铁由铁原子构成。
23. AD 水进入集气瓶,进入水体积约占瓶中空气体积的 木炭燃烧后会生成二氧化碳气体,装置内气体压强保持不变,水不会进入集气瓶 红棕色粉末逐渐变黑 排净装置内的空气,以防加热时发生爆炸 检验一氧化碳还原氧化铁后的产物是否是二氧化碳,并吸收了尾气中的二氧化碳 .
【详解】(1)A、由图可知,铈元素的元素符号是,故正确;B、由汉字结构可知,铈元素是金属元素,故错误;C、相对原子质量不能带g,故错误;D、铈是58号元素,原子序数=质子数,故铈原子的质子数是58,正确。故选AD。
(2)①低碳生活”倡导低能量、低消费,主要是为了减少的排放量。
②丁烷燃烧后生成二氧化碳和水,根据化学方程式的书写规则,反应方程式为
(3)①测定空气中氧气含量的实验中,待红磷熄灭并冷却后,打开弹簧夹,发生的现象水进入集气瓶,进入水的体积约占瓶中空气体积的。②该实验不能用木炭代替红磷,因为木炭燃烧后会生成二氧化碳气体,装置内气体压强保持不变,水不会进入集气瓶。
(4)①B管中是一氧化碳与氧化铁反应生成铁和二氧化碳,反应的现象是固体粉末由红色变为黑色。②一氧化碳是易燃性气体,如混有氧气的话,会燃烧引起爆炸,故要先通入一段时间一氧化碳,排进管中的氧气。③C装置中是澄清石灰水,作用是检验一氧化碳还原氧化铁后的产物是否是二氧化碳,并吸收了尾气中的二氧化碳。
(5)克甲烷在空气中完全燃烧,生成水的质量为x
x=144g
答:克甲烷在空气中完全燃烧,生成水的质量为144g。
24.(1) 38 五/5 50 38
(2)解: 设锶元素原子的质量为x
由相对原子质量的定义可知,=88
x=1.462×10-25kg
答:锶元素原子的质量为1.462×10-25kg。
【详解】(1)原子中的质子数等于核外电子数,则x=2+8+18+8+2=38,元素的原子序数等于原子的质子数,所以锶原子的原子序数为38,故填38;
由图可知,锶原子核外有5个电子层,则锶在元素周期表中位于第五周期,故填五或5;
相对原子质量≈质子数+中子数,则锶原子的中子数=88 38=50,故填50;
核电荷数等于核内质子数。锶原子的质子数为38,则其核电荷数为38,故填38。
(2)见答案
25.(1)B
(2) CO2的分子没有改变 成本低或环保等(合理即可)
(3) BCD 氧、硫 Al2Te3
【详解】(1)A、雪融化成水,一直是水分子,不符合题意;
B、雪融化成水,分子间隔增大,符合题意;
C、雪融化成水,一直是水分子,分子质量不变,不符合题意;
故选B。
(2)①液态CO2蒸发吸热实现制冷,此过程中二氧化碳分子没有变成其它分子,分子是保持物质化学性质的最小微粒,故CO2的化学性质并没有改变。
②通过冷却器实现循环,并释放热量为场馆除湿、供热,一个设备多个用途,故优点为成本低、环保等。
(3)①A、Te的相对原子质量是127.6,不符合题意;
B、对于Te原子而言,质子数=原子序数=52,符合题意;
C、Cd的最外层电子数为2,反应中易失去2个电子,CdTe中Cd的化合价为+2,化合物整体化合价为0,故Te的化合价是-2价,符合题意;
D、镉属于金属元素,故Cd可表示镉元素、一个镉原子、金属镉,符合题意;
故选BCD。
②碲最外层电子数为6,最外层电子数相同的化学性质相似,O、S的最外层电子数为6,故Te的化学性质与Al2Te3。
21世纪教育网(www.21cnjy.com)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
