1.3.3氧化还原反应方程式的配平 课件(共51张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.3氧化还原反应方程式的配平 课件(共51张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 18.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-05 23:19:01 | ||
图片预览





文档简介
(共51张PPT)
有了一些小成绩就不求上进,这完全不符合我的性格。攀登上一个阶梯,这固然很好,只要还有力气,那就意味着必须再继续前进一步。
Ca3(PO4)2+SiO2+C → P+CaSiO3+CO↑
你能配平上述方程式吗?
复杂氧化还原方程式
如何配平
信息方程式书写
据题意写出反应物和生成物
配平:电子守恒与质量守恒
配平类型
一般配平 自身配平 部分配平 缺项配平
配平原理
电子守恒 质量守恒 电荷守恒
配平步骤
一标 二等 三定 四平 五查
配平原理
01
配平原理
1
1
2
3
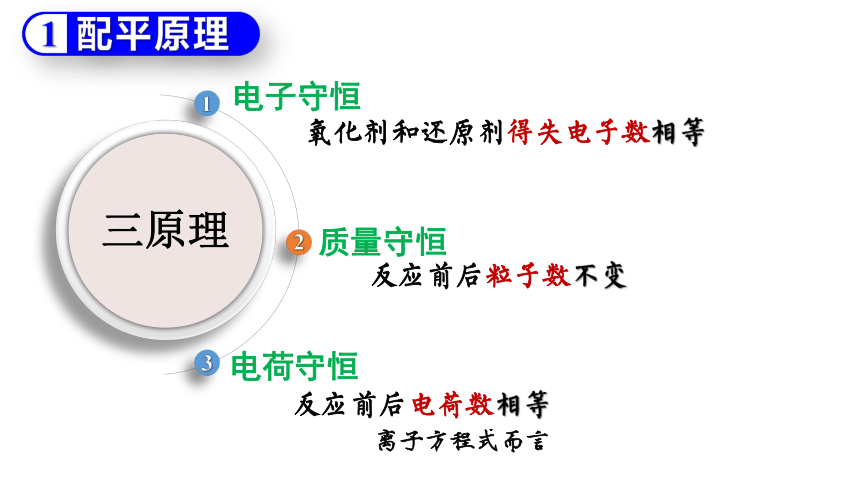
三原理
电子守恒
氧化剂和还原剂得失电子数相等
质量守恒
反应前后粒子数不变
电荷守恒
反应前后电荷数相等
离子方程式而言
配平步骤
02
配平步骤
2
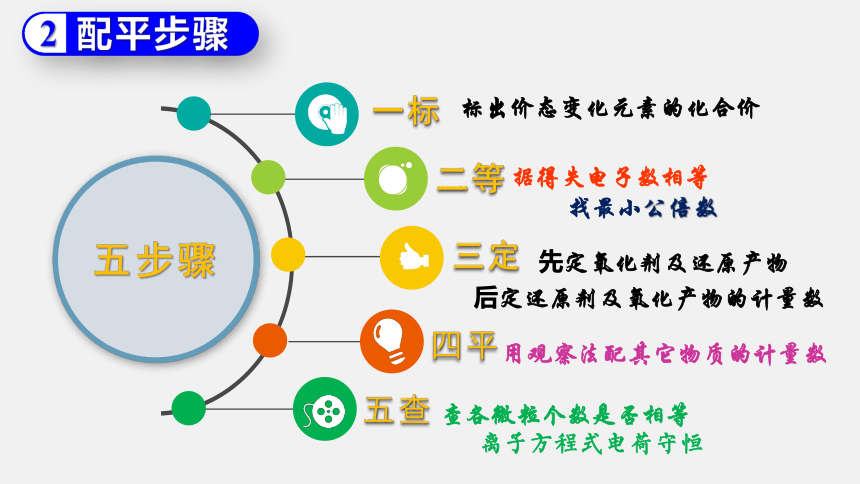
五步骤
一标
标出价态变化元素的化合价
二等
据得失电子数相等
找最小公倍数
三定
先定氧化剂及还原产物
后定还原剂及氧化产物的计量数
四平
用观察法配其它物质的计量数
五查
查各微粒个数是否相等
离子方程式电荷守恒
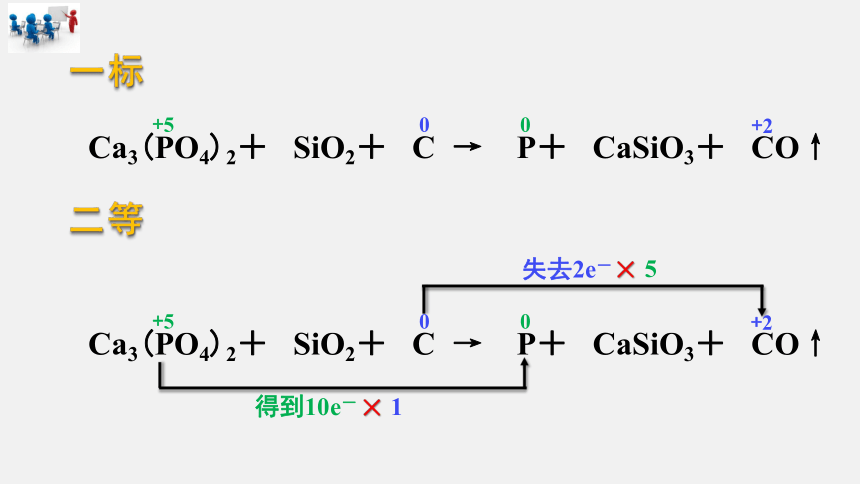
一标
Ca3(PO4)2+ SiO2+ C → P+ CaSiO3+ CO↑
+5
0
0
+2
二等
失去2e-
得到10e-
×
5
×
1
Ca3(PO4)2+ SiO2+ C → P+ CaSiO3+ CO↑
+5
0
0
+2
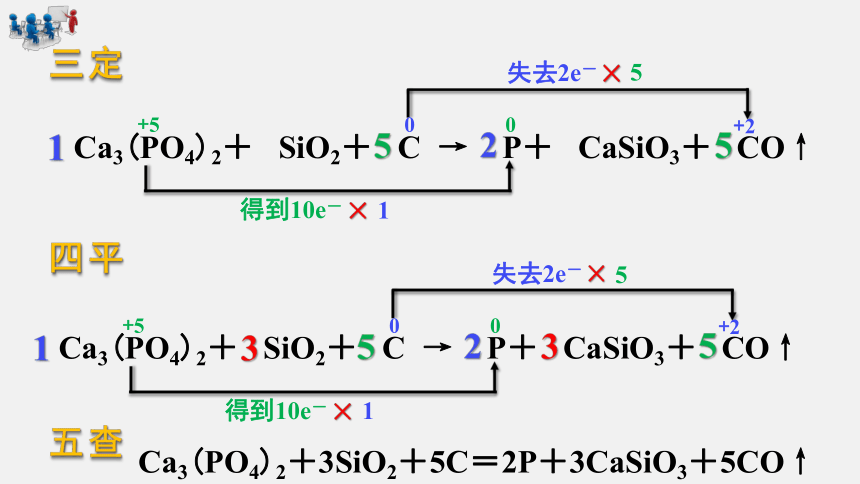
三定
失去2e-
得到10e-
×
5
×
1
Ca3(PO4)2+ SiO2+ C → P+ CaSiO3+ CO↑
+5
0
0
+2
1
5
2
5
四平
失去2e-
得到10e-
×
5
×
1
Ca3(PO4)2+ SiO2+ C → P+ CaSiO3+ CO↑
+5
0
0
+2
1
5
2
5
3
3
五查
Ca3(PO4)2+3SiO2+5C=2P+3CaSiO3+5CO↑
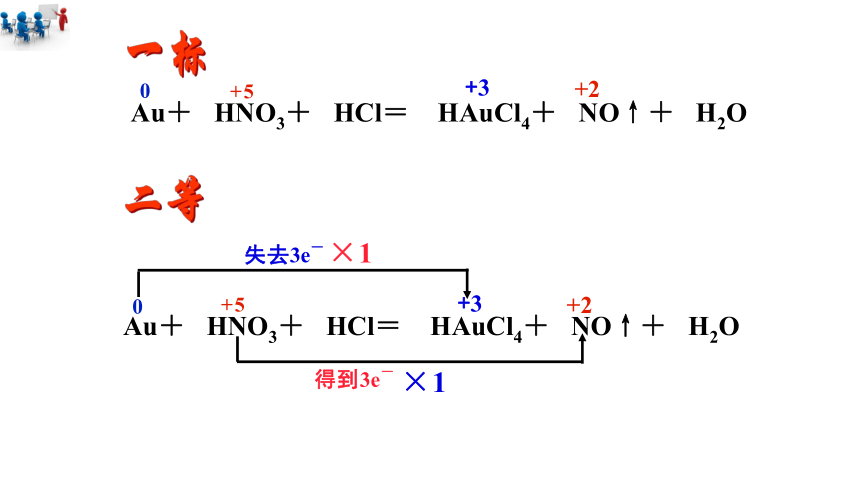
玻尔巧藏诺贝尔奖章的方程式:
Au+ HNO3+ HCl → HAuCl4+ NO↑+ H2O
1Au+1HNO3+4HCl = 1HAuCl4+1NO↑+2H2O
你学会了吗?
一标
二等
三定
1
1
1
1
四平
1
1
1
1
4
2
五查
看我七十二变
Fe2++Cr2O72-+H + → Fe3++Cr3++H2O
工业废水中含有的重铬酸根离子(Cr2O72-)有毒,必须处理达标后才能排放。工业上常用给绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下,请配平 :
6Fe2++1Cr2O72-+14H + =6Fe3++2Cr3++7H2O
配平类型
03
3.1 一般反应配平
配平类型
3
氧化剂+还原剂 = 还原产物+氧化产物
通过催化作用将氨氧化制成硝酸,这在当时都是很了不起的成就。
于1909年获得诺贝尔化学奖金。
化学趣史
NH3 + O2 → NO + H2O
NO + O2 → NO2
NO2 + H2O → HNO3 + NO
NH3 + O2 → NO + H2O
请你配平方程式:
请你试一试
5
4
NH3 + O2 → NO + H2O
-3
+2
0
-2
×
4
5
×
NH3 + O2 → NO + H2O
4
5
4
6
-2
KClO3+ KCl+ H2SO4 → Cl2↑+ K2SO4+ H2O
请你配平方程式:
1KClO3+5KCl +3H2SO4 = 3Cl2↑+3K2SO4+3H2O
看谁做得既准又快
洛杉矶光化学烟雾
NO、NO2惹的祸
可用NH3来消除。
两种氮的氧化物与氨反应生成可参与大气循环的气体。试写出化学方程式。
NH3 + NO → N2 + H2O
-3
0
3
×
+2
2
2
3
×
NH3 + NO → N2 + H2O
3
2
5/2
3
4NH3 +6NO = 5N2 +6H2O
请你配平方程式:
NH3 + NO2 → N2 + H2O
8 6 7 12
考考你自己
通过催化作用将氨氧化制成硝酸,这在当时都是很了不起的成就。于1909年获得诺贝尔化学奖金。
化学趣史
NH3 + O2 → NO + H2O
NO + O2 → NO2
NO2 + H2O → HNO3 + NO
NO2 + H2O → HNO3 + NO
+4
+5
+2
NO2既是氧化剂又是还原剂
NO2 + NO2 + H2O → HNO3 + NO
+4
+5
1
+4
+2
2
×
2
1
×
NO2 + NO2 + H2O → HNO3 + NO
2
1
2
1
3NO2 +1H2O = 2HNO3 +1NO
1
问题解决
NO2 + H2O → HNO3 + NO
+4
+5
+2
1
2
×
2
1
×
NO2 + H2O → HNO3 + NO
2
1
3
1
3.2 自身反应配平
配平类型
3
逆向配平
请你配平方程式:
3 6 5 1 3
Cl2 + KOH → KCl + KClO3 + H2O
小试身手
请你配平方程式:
Cu + HNO3 → Cu(NO3)2 + NO↑ + H2O
氧化剂只是部分被还原
另一部分表现其他性质,如酸性
即一部分作氧化剂,表现氧化性
考考你的智慧
Cu+ HNO3 → Cu(NO3) 2+ NO↑+ H2O
0
+5
+2
2
+2
3
Cu+ HNO3 → Cu(NO3) 2+ NO↑+ H2O
3
2
3
2
氧化性
酸性
6
3Cu+ HNO3 → 3Cu(NO3) 2+2NO↑+ H2O
8
4
3.3 部分氧化还原反应反应配平
配平类型
3
做氧化剂的加上酸性的
3.3.1 氧化剂计量数
请你配平方程式:
NH3+ Cl2= NH4Cl+ N2
即一部分作还原剂,表现还原性,
-3
0
0
-1
还原性
-3
碱性
还原剂只是部分被氧化
你学会了吗?
另一部分表现其他性质,如碱性。
NH3+ Cl2= NH4Cl+ N2
-3
0
0
-1
3
2
NH3+ Cl2= NH4Cl+ N2
2
3
1
6
6
8NH3+3Cl2=6NH4Cl+N2
3.3 部分氧化还原反应配平
配平类型
3
做氧化剂的加上酸性的
3.3.1 氧化剂计量数
做还原剂的加上碱性/酸性
3.3.2 还原剂计量数
请你配平方程式:
KMnO4+ HCl = MnCl2+ KCl+ Cl2↑+ H2O
2 16 2 2 5 8
用于实验室制备氯气
牛刀小试
KMnO4+ HCl = MnCl2+ KCl+ Cl2↑+ H2O
氯气通入浓氢氧化钠和过氧化氢混合液中,在导管口和混合液接触处有闪烁的红光出现。
这是因为反应产生能量较高的氧分子,他立即转变为普通氧分子,将多余的能量以红光放出。
发生的反应如下,请配平:
Cl2+ H2O2 + NaOH → NaCl+ O2↑+ ____ ______
问题解决
2
1
1
1
2
2
Cl2+ H2O2 + NaOH → NaCl+ O2↑+ ____ ______
0
-1
0
2
-1
Cl2+ H2O2 + NaOH → NaCl+ O2↑+ ____ ______
2
H
O
4
2
1
2
1
1
Cl2+ H2O2 + NaOH → NaCl+ O2↑+ ____ ______
2
H2O
3.4 缺项配平
配平类型
3
一般所缺的物质是
酸、碱、水
一种高效多功能的新型非氯绿色消毒剂
制备的方程式如下,请配平:
化工生产中用作磺酸、亚硝酸盐、亚铁氰化物和其他无机物的氧化剂
在炼锌时用于除锰、锑和砷
烟草工业用于香烟过滤嘴等
高铁酸钾
主要用于饮水处理
Cl2+ Fe(OH)3 + ___ ______ → K2FeO4+ KCl+ H2O
生活中的化学
2
8
6
3
2
Cl2+ Fe(OH)3 + ___ ______ → K2FeO4+ KCl+ H2O
+6
+3
3
0
-1
2
Cl2+ Fe(OH)3 + ___ ______ → K2FeO4+ KCl+ H2O
K
KOH
10
信息方程式书写
04
次氯酸钠(NaClO)溶液与盐酸反应生成了氯气
请写出反应的化学方程式。
NaClO+ HCl → Cl2↑
+1
0
-1
小试身手
1
1
NaClO+ HCl → Cl2↑
1
1
1
NaOH
1NaClO+ 1HCl → 1 Cl2↑
+ NaCl
1
1HCl
1NaClO+ 2HCl → 1 Cl2↑+ 1NaCl
+ 1H2O
信息方程式书写
4
1
2
3
根据信息,写出反应物、生成物
配平(电子守恒)
根据质量守恒,推测未知的生成物
已知溴用纯碱溶液吸收,主要生成溴化钠、溴酸钠,请写出反应的化学方程式。
3CO2
Br2+ Na2CO3= NaBr+ NaBrO3
0
+5
-1
1
5
Br2+ Na2CO3= NaBr+ NaBrO3
5
1
3
3
C:3
O:9
C:0
O:3
C:3
O:6
+3CO2↑
挑战自我
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
氧化还原反应方程式配平配平三原理氧化剂和还原剂得失电子数相等电子守恒反应前后原子的种类和个数不变质量守恒反应前后微粒电荷的数目相等电荷守恒课堂小结
配平五步骤
标
等
定
平
查
标出反应前后价态变化元素的化合价
求最小公倍数使化合价升降总数相等
确定氧化剂与还原剂的化学计量数
观察法配平其他物质的化学计量数
检查质量及电子是否分别守恒(离子反应电荷守恒)
课堂小结
信息方程式书写
1
2
由题意写出主要反应物和生成物
生成物
直接给出
由现象判断
据有关原理推理
由电子守恒及质量守恒配平
请配平:
MnO2+ KClO3+ KOH — K2MnO4+ KCl+ H2O
KI+KIO3+H2SO4 — I2+K2SO4+H2O
5 1 6= 3 1 3
5 1 3 = 3 3 3
考考你自己
氧化还原反应的配平
你学会了吗?
有了一些小成绩就不求上进,这完全不符合我的性格。攀登上一个阶梯,这固然很好,只要还有力气,那就意味着必须再继续前进一步。
Ca3(PO4)2+SiO2+C → P+CaSiO3+CO↑
你能配平上述方程式吗?
复杂氧化还原方程式
如何配平
信息方程式书写
据题意写出反应物和生成物
配平:电子守恒与质量守恒
配平类型
一般配平 自身配平 部分配平 缺项配平
配平原理
电子守恒 质量守恒 电荷守恒
配平步骤
一标 二等 三定 四平 五查
配平原理
01
配平原理
1
1
2
3
三原理
电子守恒
氧化剂和还原剂得失电子数相等
质量守恒
反应前后粒子数不变
电荷守恒
反应前后电荷数相等
离子方程式而言
配平步骤
02
配平步骤
2
五步骤
一标
标出价态变化元素的化合价
二等
据得失电子数相等
找最小公倍数
三定
先定氧化剂及还原产物
后定还原剂及氧化产物的计量数
四平
用观察法配其它物质的计量数
五查
查各微粒个数是否相等
离子方程式电荷守恒
一标
Ca3(PO4)2+ SiO2+ C → P+ CaSiO3+ CO↑
+5
0
0
+2
二等
失去2e-
得到10e-
×
5
×
1
Ca3(PO4)2+ SiO2+ C → P+ CaSiO3+ CO↑
+5
0
0
+2
三定
失去2e-
得到10e-
×
5
×
1
Ca3(PO4)2+ SiO2+ C → P+ CaSiO3+ CO↑
+5
0
0
+2
1
5
2
5
四平
失去2e-
得到10e-
×
5
×
1
Ca3(PO4)2+ SiO2+ C → P+ CaSiO3+ CO↑
+5
0
0
+2
1
5
2
5
3
3
五查
Ca3(PO4)2+3SiO2+5C=2P+3CaSiO3+5CO↑
玻尔巧藏诺贝尔奖章的方程式:
Au+ HNO3+ HCl → HAuCl4+ NO↑+ H2O
1Au+1HNO3+4HCl = 1HAuCl4+1NO↑+2H2O
你学会了吗?
一标
二等
三定
1
1
1
1
四平
1
1
1
1
4
2
五查
看我七十二变
Fe2++Cr2O72-+H + → Fe3++Cr3++H2O
工业废水中含有的重铬酸根离子(Cr2O72-)有毒,必须处理达标后才能排放。工业上常用给绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下,请配平 :
6Fe2++1Cr2O72-+14H + =6Fe3++2Cr3++7H2O
配平类型
03
3.1 一般反应配平
配平类型
3
氧化剂+还原剂 = 还原产物+氧化产物
通过催化作用将氨氧化制成硝酸,这在当时都是很了不起的成就。
于1909年获得诺贝尔化学奖金。
化学趣史
NH3 + O2 → NO + H2O
NO + O2 → NO2
NO2 + H2O → HNO3 + NO
NH3 + O2 → NO + H2O
请你配平方程式:
请你试一试
5
4
NH3 + O2 → NO + H2O
-3
+2
0
-2
×
4
5
×
NH3 + O2 → NO + H2O
4
5
4
6
-2
KClO3+ KCl+ H2SO4 → Cl2↑+ K2SO4+ H2O
请你配平方程式:
1KClO3+5KCl +3H2SO4 = 3Cl2↑+3K2SO4+3H2O
看谁做得既准又快
洛杉矶光化学烟雾
NO、NO2惹的祸
可用NH3来消除。
两种氮的氧化物与氨反应生成可参与大气循环的气体。试写出化学方程式。
NH3 + NO → N2 + H2O
-3
0
3
×
+2
2
2
3
×
NH3 + NO → N2 + H2O
3
2
5/2
3
4NH3 +6NO = 5N2 +6H2O
请你配平方程式:
NH3 + NO2 → N2 + H2O
8 6 7 12
考考你自己
通过催化作用将氨氧化制成硝酸,这在当时都是很了不起的成就。于1909年获得诺贝尔化学奖金。
化学趣史
NH3 + O2 → NO + H2O
NO + O2 → NO2
NO2 + H2O → HNO3 + NO
NO2 + H2O → HNO3 + NO
+4
+5
+2
NO2既是氧化剂又是还原剂
NO2 + NO2 + H2O → HNO3 + NO
+4
+5
1
+4
+2
2
×
2
1
×
NO2 + NO2 + H2O → HNO3 + NO
2
1
2
1
3NO2 +1H2O = 2HNO3 +1NO
1
问题解决
NO2 + H2O → HNO3 + NO
+4
+5
+2
1
2
×
2
1
×
NO2 + H2O → HNO3 + NO
2
1
3
1
3.2 自身反应配平
配平类型
3
逆向配平
请你配平方程式:
3 6 5 1 3
Cl2 + KOH → KCl + KClO3 + H2O
小试身手
请你配平方程式:
Cu + HNO3 → Cu(NO3)2 + NO↑ + H2O
氧化剂只是部分被还原
另一部分表现其他性质,如酸性
即一部分作氧化剂,表现氧化性
考考你的智慧
Cu+ HNO3 → Cu(NO3) 2+ NO↑+ H2O
0
+5
+2
2
+2
3
Cu+ HNO3 → Cu(NO3) 2+ NO↑+ H2O
3
2
3
2
氧化性
酸性
6
3Cu+ HNO3 → 3Cu(NO3) 2+2NO↑+ H2O
8
4
3.3 部分氧化还原反应反应配平
配平类型
3
做氧化剂的加上酸性的
3.3.1 氧化剂计量数
请你配平方程式:
NH3+ Cl2= NH4Cl+ N2
即一部分作还原剂,表现还原性,
-3
0
0
-1
还原性
-3
碱性
还原剂只是部分被氧化
你学会了吗?
另一部分表现其他性质,如碱性。
NH3+ Cl2= NH4Cl+ N2
-3
0
0
-1
3
2
NH3+ Cl2= NH4Cl+ N2
2
3
1
6
6
8NH3+3Cl2=6NH4Cl+N2
3.3 部分氧化还原反应配平
配平类型
3
做氧化剂的加上酸性的
3.3.1 氧化剂计量数
做还原剂的加上碱性/酸性
3.3.2 还原剂计量数
请你配平方程式:
KMnO4+ HCl = MnCl2+ KCl+ Cl2↑+ H2O
2 16 2 2 5 8
用于实验室制备氯气
牛刀小试
KMnO4+ HCl = MnCl2+ KCl+ Cl2↑+ H2O
氯气通入浓氢氧化钠和过氧化氢混合液中,在导管口和混合液接触处有闪烁的红光出现。
这是因为反应产生能量较高的氧分子,他立即转变为普通氧分子,将多余的能量以红光放出。
发生的反应如下,请配平:
Cl2+ H2O2 + NaOH → NaCl+ O2↑+ ____ ______
问题解决
2
1
1
1
2
2
Cl2+ H2O2 + NaOH → NaCl+ O2↑+ ____ ______
0
-1
0
2
-1
Cl2+ H2O2 + NaOH → NaCl+ O2↑+ ____ ______
2
H
O
4
2
1
2
1
1
Cl2+ H2O2 + NaOH → NaCl+ O2↑+ ____ ______
2
H2O
3.4 缺项配平
配平类型
3
一般所缺的物质是
酸、碱、水
一种高效多功能的新型非氯绿色消毒剂
制备的方程式如下,请配平:
化工生产中用作磺酸、亚硝酸盐、亚铁氰化物和其他无机物的氧化剂
在炼锌时用于除锰、锑和砷
烟草工业用于香烟过滤嘴等
高铁酸钾
主要用于饮水处理
Cl2+ Fe(OH)3 + ___ ______ → K2FeO4+ KCl+ H2O
生活中的化学
2
8
6
3
2
Cl2+ Fe(OH)3 + ___ ______ → K2FeO4+ KCl+ H2O
+6
+3
3
0
-1
2
Cl2+ Fe(OH)3 + ___ ______ → K2FeO4+ KCl+ H2O
K
KOH
10
信息方程式书写
04
次氯酸钠(NaClO)溶液与盐酸反应生成了氯气
请写出反应的化学方程式。
NaClO+ HCl → Cl2↑
+1
0
-1
小试身手
1
1
NaClO+ HCl → Cl2↑
1
1
1
NaOH
1NaClO+ 1HCl → 1 Cl2↑
+ NaCl
1
1HCl
1NaClO+ 2HCl → 1 Cl2↑+ 1NaCl
+ 1H2O
信息方程式书写
4
1
2
3
根据信息,写出反应物、生成物
配平(电子守恒)
根据质量守恒,推测未知的生成物
已知溴用纯碱溶液吸收,主要生成溴化钠、溴酸钠,请写出反应的化学方程式。
3CO2
Br2+ Na2CO3= NaBr+ NaBrO3
0
+5
-1
1
5
Br2+ Na2CO3= NaBr+ NaBrO3
5
1
3
3
C:3
O:9
C:0
O:3
C:3
O:6
+3CO2↑
挑战自我
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
氧化还原反应方程式配平配平三原理氧化剂和还原剂得失电子数相等电子守恒反应前后原子的种类和个数不变质量守恒反应前后微粒电荷的数目相等电荷守恒课堂小结
配平五步骤
标
等
定
平
查
标出反应前后价态变化元素的化合价
求最小公倍数使化合价升降总数相等
确定氧化剂与还原剂的化学计量数
观察法配平其他物质的化学计量数
检查质量及电子是否分别守恒(离子反应电荷守恒)
课堂小结
信息方程式书写
1
2
由题意写出主要反应物和生成物
生成物
直接给出
由现象判断
据有关原理推理
由电子守恒及质量守恒配平
请配平:
MnO2+ KClO3+ KOH — K2MnO4+ KCl+ H2O
KI+KIO3+H2SO4 — I2+K2SO4+H2O
5 1 6= 3 1 3
5 1 3 = 3 3 3
考考你自己
氧化还原反应的配平
你学会了吗?
