2023-2024学年(人教版2019)高中化学必修1第二章 第一节 第3课时 碳酸钠和碳酸氢钠 焰色试验 学案 (含答案)
文档属性
| 名称 | 2023-2024学年(人教版2019)高中化学必修1第二章 第一节 第3课时 碳酸钠和碳酸氢钠 焰色试验 学案 (含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 537.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-06 17:20:53 | ||
图片预览


文档简介
第3课时 碳酸钠和碳酸氢钠 焰色试验
[核心素养发展目标] 1.通过实验认识Na2CO3、NaHCO3的性质,培养科学探究意识。2.了解焰色试验的操作与应用。
一、碳酸钠和碳酸氢钠
1.Na2CO3、NaHCO3性质探究
(1)探究Na2CO3、NaHCO3的溶解性及水溶液的酸碱性
在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入表中。
盐 Na2CO3 NaHCO3
①观察两支试管中碳酸钠、碳酸氢钠的形态 细小的白色晶体
②加几滴水并将温度计伸入其中 加水后____________________,温度计示数________ 加水后______溶解,温度计示数____
③继续向②的试管中分别加5 mL水,用力振荡 振荡一段时间后可溶解 固体量减少
④分别向③所得溶液中滴加1~2滴酚酞溶液 溶液________,溶液碱性较强 溶液____,溶液碱性较弱
初步结论 碳酸钠、碳酸氢钠均______溶于水,水溶液均呈______性,但Na2CO3的溶解度更________,碱性更________
思考1 Na2CO3粉末遇水生成碳酸钠晶体(Na2CO3·xH2O),且在干燥空气中失去结晶水变成碳酸钠粉末,那么钠露置在空气中,最终会完全转变成什么?
思考2 向饱和的Na2CO3溶液中通入过量的CO2,会有什么现象?试分析其原因?
(2)碳酸钠、碳酸氢钠热稳定性的实验探究
实验操作 实验现象 实验结论
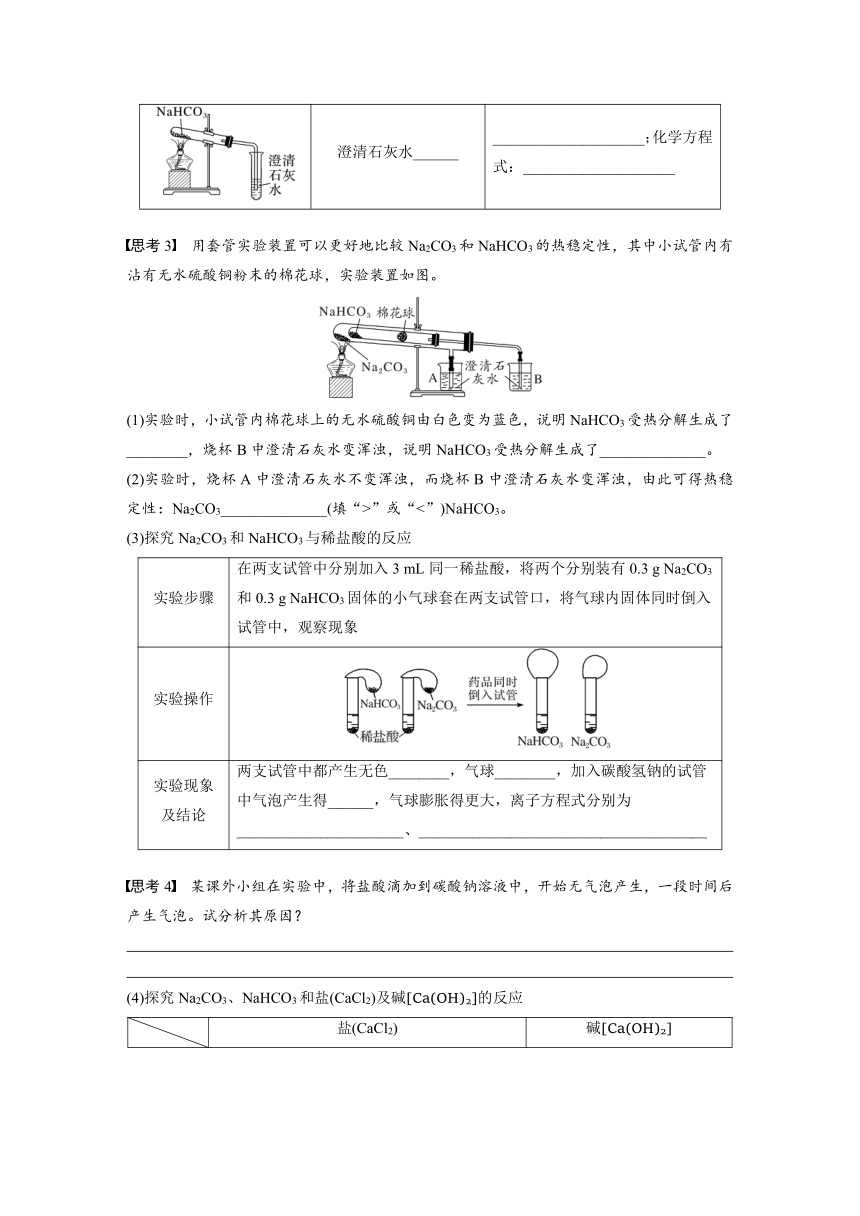
澄清石灰水______________
澄清石灰水______ ____________________;化学方程式:____________________
思考3 用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
(1)实验时,小试管内棉花球上的无水硫酸铜由白色变为蓝色,说明NaHCO3受热分解生成了________,烧杯B中澄清石灰水变浑浊,说明NaHCO3受热分解生成了______________。
(2)实验时,烧杯A中澄清石灰水不变浑浊,而烧杯B中澄清石灰水变浑浊,由此可得热稳定性:Na2CO3______________(填“>”或“<”)NaHCO3。
(3)探究Na2CO3和NaHCO3与稀盐酸的反应
实验步骤 在两支试管中分别加入3 mL同一稀盐酸,将两个分别装有0.3 g Na2CO3和0.3 g NaHCO3固体的小气球套在两支试管口,将气球内固体同时倒入试管中,观察现象
实验操作
实验现象及结论 两支试管中都产生无色________,气球________,加入碳酸氢钠的试管中气泡产生得______,气球膨胀得更大,离子方程式分别为______________________、______________________________________
思考4 某课外小组在实验中,将盐酸滴加到碳酸钠溶液中,开始无气泡产生,一段时间后产生气泡。试分析其原因?
(4)探究Na2CO3、NaHCO3和盐(CaCl2)及碱[Ca(OH)2]的反应
盐(CaCl2) 碱[Ca(OH)2]
实验操作及步骤
现象及 结论 ①加入稀Na2CO3溶液,立即产生白色沉淀,离子方程式:_________________________; ②加入少量稀NaHCO3溶液,无明显现象,说明稀CaCl2和少量稀NaHCO3溶液__________ 两支试管中都产生________。离子方程式分别为________________________、_________________________
思考5 (1)试写出足量的NaHCO3溶液和少量Ca(OH)2反应的离子方程式。
(2)试写出用适量的NaOH溶液除去Na2CO3溶液中少量NaHCO3的反应原理。
2.重要用途
(1)碳酸钠:纺织、制皂、造纸、制玻璃、食用碱或工业用碱等。
(2)碳酸氢钠:发酵粉、胃酸中和剂、食用碱或工业用碱等。
1.判断正误
(1)碳酸氢钠可用于治疗胃酸过多( )
(2)HCO在强酸性、强碱性溶液中均不能大量存在( )
(3)Na2CO3、NaHCO3都能与NaOH溶液反应( )
(4)Na2CO3俗称纯碱,所以Na2CO3属于碱( )
(5)可用加热法除去Na2CO3固体中少量的NaHCO3杂质( )
(6)只用盐酸无法鉴别等浓度的NaHCO3和Na2CO3溶液( )
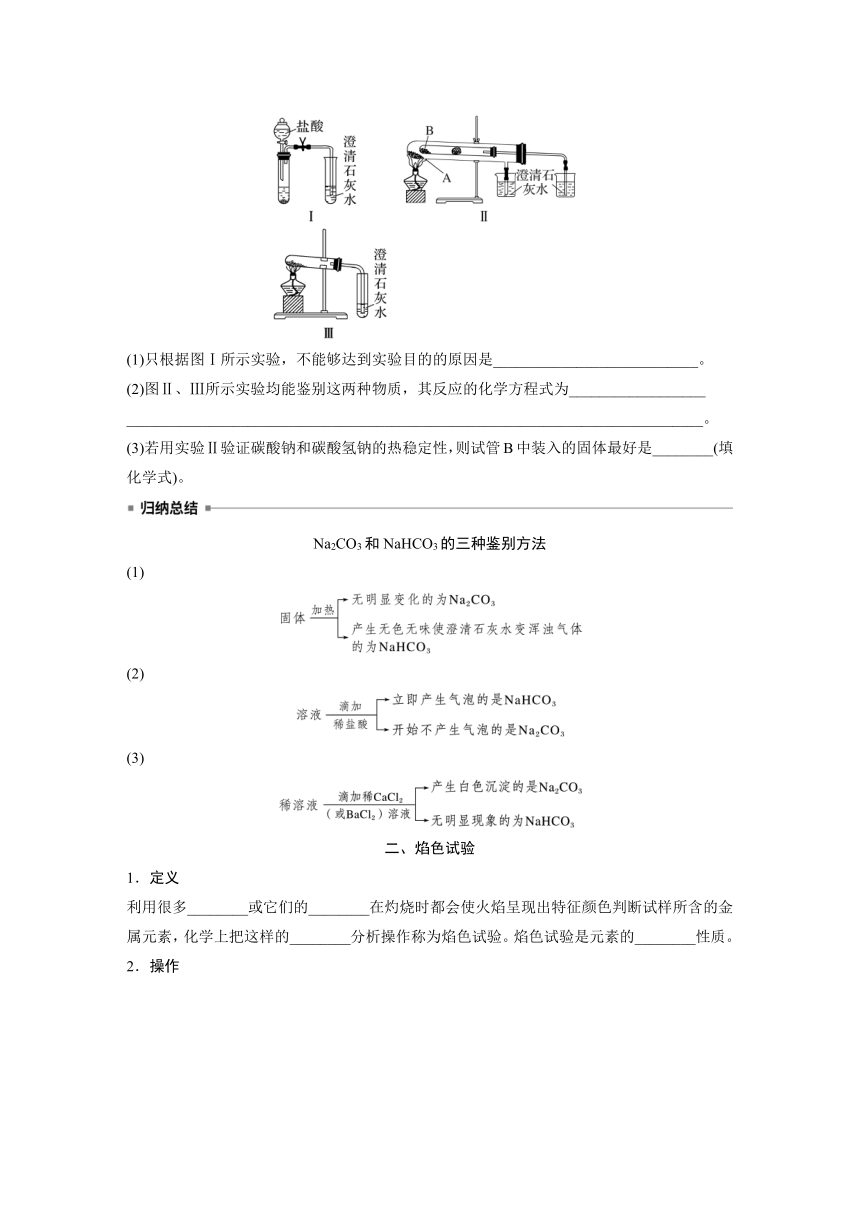
2.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示:
(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是___________________________。
(2)图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为__________________
____________________________________________________________________________。
(3)若用实验Ⅱ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是________(填化学式)。
Na2CO3和NaHCO3的三种鉴别方法
(1)
(2)
(3)
二、焰色试验
1.定义
利用很多________或它们的________在灼烧时都会使火焰呈现出特征颜色判断试样所含的金属元素,化学上把这样的________分析操作称为焰色试验。焰色试验是元素的________性质。
2.操作
3.一些金属元素的焰色
金属元素 锂 钠 钾 铷 钙 锶 钡 铜
焰色 紫红色 __色 __色 紫色 砖红色 洋红色 黄绿色 __色
思考1 为什么用盐酸洗涤铂丝而不用硫酸洗涤铂丝?为什么用铂丝或铁丝等蘸取试剂做焰色试验,而不采用铜丝?
思考2 利用焰色试验检验钾元素时,为什么要透过蓝色钴玻璃进行观察?
4.应用
(1)检验________________的存在。
(2)利用焰色试验制节日烟花。
1.判断正误
(1)焰色试验是物质在灼烧时发生了化学反应而呈现不同的焰色( )
(2)焰色试验的铂丝可用稀硫酸洗净( )
(3)可利用焰色试验来鉴别Na2CO3溶液和K2CO3溶液( )
(4)用洁净的铂丝蘸取某溶液在火焰上灼烧,火焰呈紫色(透过蓝色钴玻璃),则该溶液一定含有钾盐( )
2.用焰色试验检验K+时的操作有:①蘸取待测液;②置于酒精灯火焰上灼烧;③透过蓝色钴玻璃观察;④用稀盐酸洗净铂丝。正确的操作顺序为( )
A.①②③④ B.④②①②③
C.④①② D.①③②④
1.(2023·桂林高一检测)在做面包、蛋糕等面食点心时需要加入一定量的发酵粉,下列物质是发酵粉的主要成分之一的是( )
A.氯化钠 B.碳酸钠
C.硫酸钠 D.碳酸氢钠
2.(2022·长沙高一检测)为除去括号内的杂质,所选用的试剂或方法错误的是( )
A.CO2气体(HCl),饱和NaHCO3溶液
B.Na2CO3固体(NaHCO3),加热至不再产生气体
C.NaHCO3溶液(Na2CO3),通入过量的CO2后微热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
3.(2022·金华第八中学高一检测)用洁净的铂丝蘸取某无色溶液,放在无色火焰上灼烧,火焰的颜色呈黄色,下列说法错误的是( )
A.该溶液中可能含有钠离子,一定没有钾离子
B.该溶液中一定含有钠离子
C.该溶液中一定没有铜离子
D.该溶液中可能含有钾离子
4.(2022·邯郸高一月考)CO2、Na2CO3、NaHCO3三者的转化关系如图所示,下列说法错误的是( )
A.①转化时所加试剂可以是稀硫酸
B.向NaOH溶液中通入少量CO2可实现②转化
C.⑤转化时溶液中一定出现沉淀
D.⑥的转化条件可以是加热
5.碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题:
(1)碳酸氢钠的化学式是______________,俗称________,其水溶液显________(填“酸”“碱”或“中”)性。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为______________________________。等质量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量:前者__________(填“>”“<”或“=”)后者。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为_______________________________。
第3课时 碳酸钠和碳酸氢钠 焰色试验
一、
1.(1)白色粉末 结块变成晶体 升高 部分 降低 变红 变浅红 易 碱 大 强
思考1钠露置在空气中,最终完全转变为Na2CO3粉末。NaNa2ONaOHNaOH溶液Na2CO3·xH2ONa2CO3(风化是化学变化)。
思考2 有晶体析出。CO2与饱和Na2CO3溶液反应生成NaHCO3,所得NaHCO3的质量比参加反应的Na2CO3的质量大,又由于常温下NaHCO3的溶解度小于Na2CO3,且反应过程中消耗了水,故会有NaHCO3晶体从溶液中析出。
(2)不变浑浊 Na2CO3很稳定,受热不易发生分解 变浑浊 NaHCO3不稳定,受热容易分解 2NaHCO3Na2CO3+CO2↑+H2O
思考3 (1)H2O CO2 (2)>
(3)气泡 膨胀 更快 HCO+H+===CO2↑+H2O CO+2H+===CO2↑+H2O
思考4 Na2CO3和盐酸反应分两步进行:
①CO+H+===HCO;
②HCO+H+===H2O+CO2↑。
故开始无明显现象,后来产生气泡。
(4)Ca2++CO===CaCO3↓ 不反应 白色沉淀
Ca2++CO===CaCO3↓ HCO+Ca2++OH-===CaCO3↓+H2O
思考5 (1)2HCO+Ca2++2OH-===CaCO3↓+2H2O+CO (2)NaOH+NaHCO3===Na2CO3+H2O或OH-+HCO===H2O+CO
应用体验
1.(1)√ (2)√ (3)× (4)× (5)√ (6)×
2.(1)无论是Na2CO3还是NaHCO3,均可以与盐酸反应产生CO2,均可使澄清石灰水变浑浊,故达不到鉴别目的
(2)2NaHCO3Na2CO3+H2O+CO2↑,CO2+Ca(OH)2===CaCO3↓+H2O (3)NaHCO3
二、
1.金属 化合物 定性 物理
2.盐酸 原火焰颜色相同 试样 火焰的颜色
3.黄 紫 绿
思考1 盐酸沸点比硫酸低,加热时易挥发无残留。铂丝或铁丝做焰色试验时没有颜色,而铜在灼烧时有绿色的焰色。
思考2 因为含有钾元素的物质中往往会混有少量的钠元素,灼烧时,钠元素的黄色光会掩盖钾元素的紫色光,透过蓝色钴玻璃可以滤去黄色光,便于观察到钾元素的紫色光。
4.(1)金属元素
应用体验
1.(1)× (2)× (3)√ (4)×
2.B [根据焰色试验的操作步骤:洗、烧、蘸、烧、观,可知B项正确。应特别注意:检验K+时必须透过蓝色钴玻璃观察,以滤去黄光。]
随堂演练 知识落实
1.D 2.D 3.A
4.C [①的反应可以是Na2CO3+H2SO4===Na2SO4+H2O+CO2↑,①所加试剂可以是稀硫酸,A项正确;向NaOH溶液中通入少量CO2,生成Na2CO3,B项正确;NaHCO3的溶解度小于Na2CO3,向饱和Na2CO3溶液中通入CO2时,生成的NaHCO3以沉淀的形式析出,其他情况不一定有沉淀生成,C项错误;加热NaHCO3固体时可生成Na2CO3,⑥的转化条件可以是加热,D项正确。]
5.(1)NaHCO3 小苏打 碱
(2)H++HCO===H2O+CO2↑ <
(3)2NaHCO3Na2CO3+H2O+CO2↑
[核心素养发展目标] 1.通过实验认识Na2CO3、NaHCO3的性质,培养科学探究意识。2.了解焰色试验的操作与应用。
一、碳酸钠和碳酸氢钠
1.Na2CO3、NaHCO3性质探究
(1)探究Na2CO3、NaHCO3的溶解性及水溶液的酸碱性
在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入表中。
盐 Na2CO3 NaHCO3
①观察两支试管中碳酸钠、碳酸氢钠的形态 细小的白色晶体
②加几滴水并将温度计伸入其中 加水后____________________,温度计示数________ 加水后______溶解,温度计示数____
③继续向②的试管中分别加5 mL水,用力振荡 振荡一段时间后可溶解 固体量减少
④分别向③所得溶液中滴加1~2滴酚酞溶液 溶液________,溶液碱性较强 溶液____,溶液碱性较弱
初步结论 碳酸钠、碳酸氢钠均______溶于水,水溶液均呈______性,但Na2CO3的溶解度更________,碱性更________
思考1 Na2CO3粉末遇水生成碳酸钠晶体(Na2CO3·xH2O),且在干燥空气中失去结晶水变成碳酸钠粉末,那么钠露置在空气中,最终会完全转变成什么?
思考2 向饱和的Na2CO3溶液中通入过量的CO2,会有什么现象?试分析其原因?
(2)碳酸钠、碳酸氢钠热稳定性的实验探究
实验操作 实验现象 实验结论
澄清石灰水______________
澄清石灰水______ ____________________;化学方程式:____________________
思考3 用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
(1)实验时,小试管内棉花球上的无水硫酸铜由白色变为蓝色,说明NaHCO3受热分解生成了________,烧杯B中澄清石灰水变浑浊,说明NaHCO3受热分解生成了______________。
(2)实验时,烧杯A中澄清石灰水不变浑浊,而烧杯B中澄清石灰水变浑浊,由此可得热稳定性:Na2CO3______________(填“>”或“<”)NaHCO3。
(3)探究Na2CO3和NaHCO3与稀盐酸的反应
实验步骤 在两支试管中分别加入3 mL同一稀盐酸,将两个分别装有0.3 g Na2CO3和0.3 g NaHCO3固体的小气球套在两支试管口,将气球内固体同时倒入试管中,观察现象
实验操作
实验现象及结论 两支试管中都产生无色________,气球________,加入碳酸氢钠的试管中气泡产生得______,气球膨胀得更大,离子方程式分别为______________________、______________________________________
思考4 某课外小组在实验中,将盐酸滴加到碳酸钠溶液中,开始无气泡产生,一段时间后产生气泡。试分析其原因?
(4)探究Na2CO3、NaHCO3和盐(CaCl2)及碱[Ca(OH)2]的反应
盐(CaCl2) 碱[Ca(OH)2]
实验操作及步骤
现象及 结论 ①加入稀Na2CO3溶液,立即产生白色沉淀,离子方程式:_________________________; ②加入少量稀NaHCO3溶液,无明显现象,说明稀CaCl2和少量稀NaHCO3溶液__________ 两支试管中都产生________。离子方程式分别为________________________、_________________________
思考5 (1)试写出足量的NaHCO3溶液和少量Ca(OH)2反应的离子方程式。
(2)试写出用适量的NaOH溶液除去Na2CO3溶液中少量NaHCO3的反应原理。
2.重要用途
(1)碳酸钠:纺织、制皂、造纸、制玻璃、食用碱或工业用碱等。
(2)碳酸氢钠:发酵粉、胃酸中和剂、食用碱或工业用碱等。
1.判断正误
(1)碳酸氢钠可用于治疗胃酸过多( )
(2)HCO在强酸性、强碱性溶液中均不能大量存在( )
(3)Na2CO3、NaHCO3都能与NaOH溶液反应( )
(4)Na2CO3俗称纯碱,所以Na2CO3属于碱( )
(5)可用加热法除去Na2CO3固体中少量的NaHCO3杂质( )
(6)只用盐酸无法鉴别等浓度的NaHCO3和Na2CO3溶液( )
2.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示:
(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是___________________________。
(2)图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为__________________
____________________________________________________________________________。
(3)若用实验Ⅱ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是________(填化学式)。
Na2CO3和NaHCO3的三种鉴别方法
(1)
(2)
(3)
二、焰色试验
1.定义
利用很多________或它们的________在灼烧时都会使火焰呈现出特征颜色判断试样所含的金属元素,化学上把这样的________分析操作称为焰色试验。焰色试验是元素的________性质。
2.操作
3.一些金属元素的焰色
金属元素 锂 钠 钾 铷 钙 锶 钡 铜
焰色 紫红色 __色 __色 紫色 砖红色 洋红色 黄绿色 __色
思考1 为什么用盐酸洗涤铂丝而不用硫酸洗涤铂丝?为什么用铂丝或铁丝等蘸取试剂做焰色试验,而不采用铜丝?
思考2 利用焰色试验检验钾元素时,为什么要透过蓝色钴玻璃进行观察?
4.应用
(1)检验________________的存在。
(2)利用焰色试验制节日烟花。
1.判断正误
(1)焰色试验是物质在灼烧时发生了化学反应而呈现不同的焰色( )
(2)焰色试验的铂丝可用稀硫酸洗净( )
(3)可利用焰色试验来鉴别Na2CO3溶液和K2CO3溶液( )
(4)用洁净的铂丝蘸取某溶液在火焰上灼烧,火焰呈紫色(透过蓝色钴玻璃),则该溶液一定含有钾盐( )
2.用焰色试验检验K+时的操作有:①蘸取待测液;②置于酒精灯火焰上灼烧;③透过蓝色钴玻璃观察;④用稀盐酸洗净铂丝。正确的操作顺序为( )
A.①②③④ B.④②①②③
C.④①② D.①③②④
1.(2023·桂林高一检测)在做面包、蛋糕等面食点心时需要加入一定量的发酵粉,下列物质是发酵粉的主要成分之一的是( )
A.氯化钠 B.碳酸钠
C.硫酸钠 D.碳酸氢钠
2.(2022·长沙高一检测)为除去括号内的杂质,所选用的试剂或方法错误的是( )
A.CO2气体(HCl),饱和NaHCO3溶液
B.Na2CO3固体(NaHCO3),加热至不再产生气体
C.NaHCO3溶液(Na2CO3),通入过量的CO2后微热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
3.(2022·金华第八中学高一检测)用洁净的铂丝蘸取某无色溶液,放在无色火焰上灼烧,火焰的颜色呈黄色,下列说法错误的是( )
A.该溶液中可能含有钠离子,一定没有钾离子
B.该溶液中一定含有钠离子
C.该溶液中一定没有铜离子
D.该溶液中可能含有钾离子
4.(2022·邯郸高一月考)CO2、Na2CO3、NaHCO3三者的转化关系如图所示,下列说法错误的是( )
A.①转化时所加试剂可以是稀硫酸
B.向NaOH溶液中通入少量CO2可实现②转化
C.⑤转化时溶液中一定出现沉淀
D.⑥的转化条件可以是加热
5.碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题:
(1)碳酸氢钠的化学式是______________,俗称________,其水溶液显________(填“酸”“碱”或“中”)性。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为______________________________。等质量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量:前者__________(填“>”“<”或“=”)后者。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为_______________________________。
第3课时 碳酸钠和碳酸氢钠 焰色试验
一、
1.(1)白色粉末 结块变成晶体 升高 部分 降低 变红 变浅红 易 碱 大 强
思考1钠露置在空气中,最终完全转变为Na2CO3粉末。NaNa2ONaOHNaOH溶液Na2CO3·xH2ONa2CO3(风化是化学变化)。
思考2 有晶体析出。CO2与饱和Na2CO3溶液反应生成NaHCO3,所得NaHCO3的质量比参加反应的Na2CO3的质量大,又由于常温下NaHCO3的溶解度小于Na2CO3,且反应过程中消耗了水,故会有NaHCO3晶体从溶液中析出。
(2)不变浑浊 Na2CO3很稳定,受热不易发生分解 变浑浊 NaHCO3不稳定,受热容易分解 2NaHCO3Na2CO3+CO2↑+H2O
思考3 (1)H2O CO2 (2)>
(3)气泡 膨胀 更快 HCO+H+===CO2↑+H2O CO+2H+===CO2↑+H2O
思考4 Na2CO3和盐酸反应分两步进行:
①CO+H+===HCO;
②HCO+H+===H2O+CO2↑。
故开始无明显现象,后来产生气泡。
(4)Ca2++CO===CaCO3↓ 不反应 白色沉淀
Ca2++CO===CaCO3↓ HCO+Ca2++OH-===CaCO3↓+H2O
思考5 (1)2HCO+Ca2++2OH-===CaCO3↓+2H2O+CO (2)NaOH+NaHCO3===Na2CO3+H2O或OH-+HCO===H2O+CO
应用体验
1.(1)√ (2)√ (3)× (4)× (5)√ (6)×
2.(1)无论是Na2CO3还是NaHCO3,均可以与盐酸反应产生CO2,均可使澄清石灰水变浑浊,故达不到鉴别目的
(2)2NaHCO3Na2CO3+H2O+CO2↑,CO2+Ca(OH)2===CaCO3↓+H2O (3)NaHCO3
二、
1.金属 化合物 定性 物理
2.盐酸 原火焰颜色相同 试样 火焰的颜色
3.黄 紫 绿
思考1 盐酸沸点比硫酸低,加热时易挥发无残留。铂丝或铁丝做焰色试验时没有颜色,而铜在灼烧时有绿色的焰色。
思考2 因为含有钾元素的物质中往往会混有少量的钠元素,灼烧时,钠元素的黄色光会掩盖钾元素的紫色光,透过蓝色钴玻璃可以滤去黄色光,便于观察到钾元素的紫色光。
4.(1)金属元素
应用体验
1.(1)× (2)× (3)√ (4)×
2.B [根据焰色试验的操作步骤:洗、烧、蘸、烧、观,可知B项正确。应特别注意:检验K+时必须透过蓝色钴玻璃观察,以滤去黄光。]
随堂演练 知识落实
1.D 2.D 3.A
4.C [①的反应可以是Na2CO3+H2SO4===Na2SO4+H2O+CO2↑,①所加试剂可以是稀硫酸,A项正确;向NaOH溶液中通入少量CO2,生成Na2CO3,B项正确;NaHCO3的溶解度小于Na2CO3,向饱和Na2CO3溶液中通入CO2时,生成的NaHCO3以沉淀的形式析出,其他情况不一定有沉淀生成,C项错误;加热NaHCO3固体时可生成Na2CO3,⑥的转化条件可以是加热,D项正确。]
5.(1)NaHCO3 小苏打 碱
(2)H++HCO===H2O+CO2↑ <
(3)2NaHCO3Na2CO3+H2O+CO2↑
