2023—2024学年九年级化学鲁科版上册第五单元 定量研究化学反应 同步选题(含答案)
文档属性
| 名称 | 2023—2024学年九年级化学鲁科版上册第五单元 定量研究化学反应 同步选题(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 255.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-06 21:19:27 | ||
图片预览



文档简介
2023—2024学年九年级化学鲁科版上册第五单元 定量研究化学反应 同步选题含答案
鲁科版第五单元 定量研究化学反应
一、选择题。
1、在化学反应前后,肯定不会变化的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的质量总和
⑤物质的种类 ⑥物质的体积 ⑦物质的状态
A. ①③④ B. ①④⑥ C. ①③⑦ D. ②④⑤
2、“绿色化学”要求原料物质中所有的原子完全被利用,全部转入期望的产品中,即原子利用率为100%。一定条件下,CO和H2可以按照不同比例反应,只生成一种产物就能实现“绿色化学”,这种产物不可能是( )
A.甲醛(CH2O) B.甲醇(CH4O)
C.乙醇(C2H6O) D.乙酸(C2H4O2)
3、在反应中,C与D的相对分子质量比为,若 A与足量B充分反应,生成 D,则在此反应中,参加反应的B与生成C的质量比为( )
A.3∶2 B.12∶11 C.8∶11 D.35∶33
4、化学是在分子、原子的层次上研究物质的科学。如图是某化学反应的微观示意图下列有关说法错误的是( )
A.该反应属于氧化反应
B.一个甲物质分子由一个氮原子和三个氢原子构成
C.生成的丙、丁两种物质的分子个数比为2:3
D.参加反应的甲、乙两种物质的质量比为17:32
5、化学反应遵守质量守恒定律的原因在于反应前后( )
A.物质的种类没有改变 B.分子的种类没有改变
C.原子的种类、数目和质量都没有改变 D.分子的数目没有改变
6、连花清瘟胶囊自传统中医名方,可用于治疗流感,现代仪器测得其成分之一是没食子酸(化学式为C7H6O5),下列有关没食子酸的说法,正确的是( )
A.从分类上看:没食子酸属于氧化物
B.从宏观上看:没食子酸完全燃烧生成CO2和H2O
C.从微观上看:一个没食子酸分子中含有3个原子
D.从质量上看:没食子酸中碳、氢、氧元素的质量比为12:1:16
7、现取2.3g某有机物在空气中完全燃烧,生成4.4g二氧化碳和2.7g水。对该物质的组成有下列推断:①一定含碳氢元素 ②一定不含氧元素 ③可能含氧元素 ④一定含氧元素 ⑤分子中C、H的原子个数比为2∶5 ⑥分子中C、H、O的元素质量比为12∶3∶8。其中正确的是( )
A.①③⑤ B.①④⑥ C.①②⑤ D.①④⑤
8、在物质混合、反应等过程中,有时存在着“1+1≠2”的有趣现象。下列选项符合“1+1≠2”的是( )
A.1g酒精和1g水混合后溶液的总质量
B.1g碳和1g氧气充分反应后生成物的质量
C.1g硫和1g氧气充分反应后生成物的质量
D.1g黄豆和1g黑豆混合后物质的总质量
9、某物质4.4 g完全燃烧后生成8.8 g CO2和3.6 g H2O,对该物质的判断正确的是( )
A.该物质由碳、氢、氧元素组成
B.该物质只含有碳、氢两种元素
C.该物质中氧元素的质量分数为16%
D.该物质的分子中碳原子和氢原子的个数比为1∶1
10、Sb2O5是一种重要的阻燃剂,工业制取该物质的化学方程式为:Sb2O3+2X=Sb2O5+2H2O则X的化学式为( )
A.H2 B.O2 C.H2O2 D.H3SbO4
11、下列因果关系,不正确的是( )
A.微粒在不停运动一—酒香不怕巷子深
B.同种元素的质子数相同一一Na和Na+都属于钠元素
C.分子很小——18g水中大约有6.02×1023个水分子
D.质量守恒定律——5g碳与7g氧气完全反应生成12g二氧化碳
12、逻辑推理是学习化学常用的思维方法,下列推理正确的是( )
A.由同种分子构成的物质一定是纯净物,所以纯净物一定是由同种分子构成
B.离子是带电荷的粒子,所以带电荷的粒子一定是离子
C.氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧元素
D.分子可以构成物质,所以物质都是由分子构成
13、二氧化碳和氢气可在一定条件下反应,生产一种重要的化工原料甲醇,化学方程式为。下列有关该反应的说法错误的是( )
A.为 CO2的利用创造了一种新途径
B.属于化合反应
C.反应前后分子数发生了改变
D.钌-膦络合物的质量在反应前后没有改变
14、已知反应A+B=C+D,参加反应的A与B总质量为40g,若反应后生成C和D的质量比为2:3,则反应中生成C的质量为( )
A.16g B.20g C.24g D.32g
15、某化合物在4.8g氧气中完全燃烧,生成了4.4g二氧化碳和2.7g水。关于该物质的推断中不正确的是( )
A.该化合物的质量为2.3g
B.该化合物中一定含碳、氢、氧三种元素
C.该化合物中碳、氧元素质量比为3:2
D.分子中C、H原子个数比为1:2
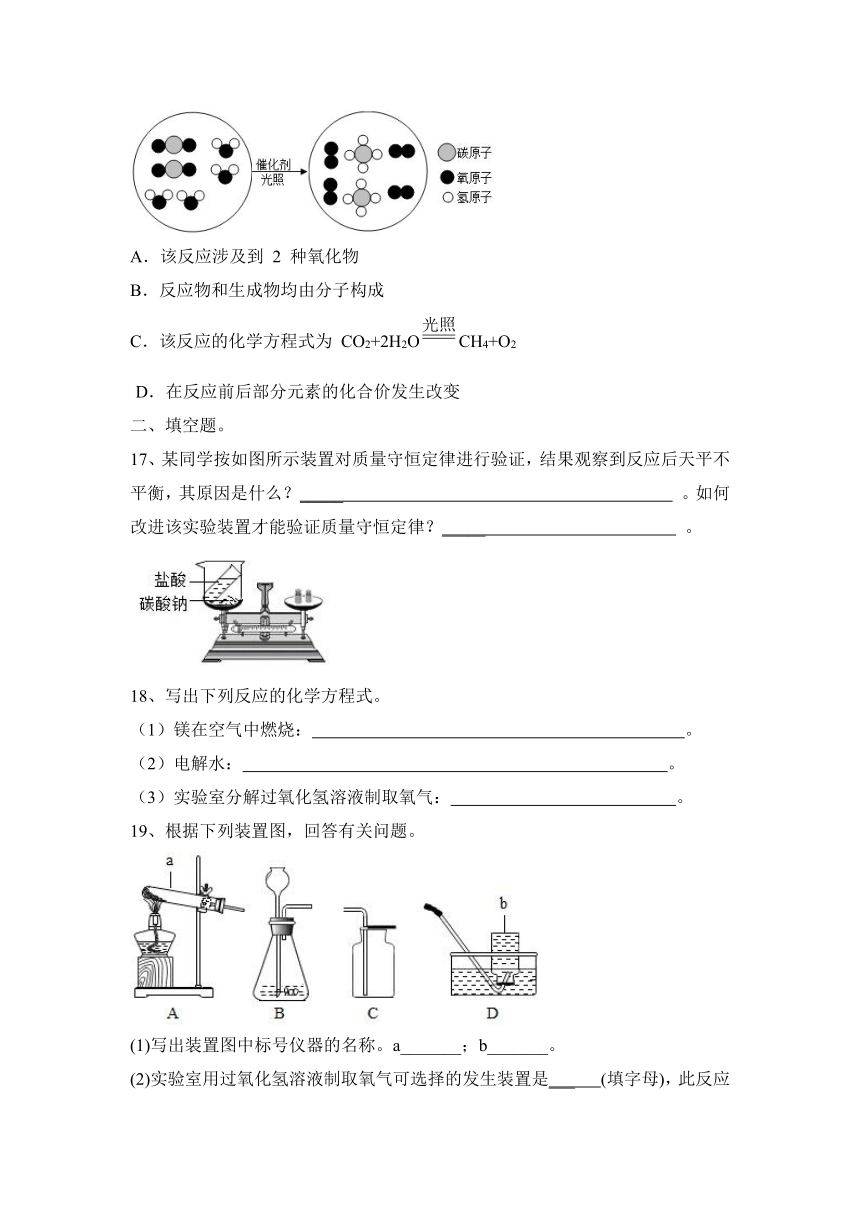
16、根据如图,下列说法不正确的是( )
A.该反应涉及到 2 种氧化物
B.反应物和生成物均由分子构成
C.该反应的化学方程式为 CO2+2H2OCH4+O2
D.在反应前后部分元素的化合价发生改变
二、填空题。
17、某同学按如图所示装置对质量守恒定律进行验证,结果观察到反应后天平不平衡,其原因是什么?_____ 。如何改进该实验装置才能验证质量守恒定律?_____ 。
18、写出下列反应的化学方程式。
(1)镁在空气中燃烧: 。
(2)电解水: 。
(3)实验室分解过氧化氢溶液制取氧气: 。
19、根据下列装置图,回答有关问题。
(1)写出装置图中标号仪器的名称。a_______;b_______。
(2)实验室用过氧化氢溶液制取氧气可选择的发生装置是___ (填字母),此反应的化学方程式__ 。
(3)若使用高锰酸钾制取氧气,可选用的装置组合是_____(填字母)。
(4)选用D装置收集氧气的原因是_____ 。
(5)加热15.8g高锰酸钾,完全反应后,理论上可以得到____氧气?
20、我国科研人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇(CH3OH),其微观示意图如图所示。
(1)该反应中,发生变化的是 (填“分子”或“原子”);参加反应的两种物质中,其分子的个数比为 ;丙分子中,碳、氢、氧三种原子的个数比为 。
(2)该反应的化学方程式为 。
21、青蒿素是一种抗疟疾药,若14.1g青蒿素完全燃烧生成33.0gCO2和9.9gH2O,则青蒿素燃烧消耗氧气的质量为__________________;青蒿素中所含元素的原子个数比为_____________。
22、(1)“84”消毒液可用于灾区防疫,其主要成分是次氯酸钠(NaClO),制取它的化学方程式为2NaOH+X═NaClO+NaCl+H2O,则X的化学式为 。求出NaClO中氯元素化合价并在该化学式中表示出来 .
(2)固体MgH2是氢能源汽车的供能剂,MgH2可以和水反应生成氢氧化镁,同时释放出氢气,该反应的化学方程式是 。
23、下列各组变化中,符合“1+1=2”的事实是(_____)
A、1L水与1L酒精混合后的体积等于2L
B、1g硫粉在1g氧气中完全燃烧后生成2g二氧化硫
C、1g镁与1g氧气反应得到2g氧化镁
D、_________________
三、综合应用题。
24、某小组以水为研究对象,开展针对水的构成奥秘的项目式学习。
【任务一】设计净化水的简易装置
图1是小组设计的野外求生的简易饮水装置。
(1)该饮水装置的净水措施是(填字母序号)。
A.静置 B.蒸馏 C.过滤 D.吸附
(2)实验室综合运用过滤、沉淀、蒸馏这三项操作进行净水,其先后顺序应该是_______。
【任务二】探究水的组成
小组同学用图2装置进行电解水并测得每分钟产生的气体体积数据如下表:
时间/分钟 1 2 3 4 5 6 7 8 9 10
阴极生成的气体体积(cm3) 6 12 20 29 39 49 55 65 75 85
阳极生成的气体体积(cm3) 2 4 7 11 16 21 24 29 35 40
(3)写出图2中反应的文字表达式:_______。
(4)仔细分析以上实验数据,从第_______分钟之后阴极、阳极产生的气体体积之比接近于2:1。
(5)请解释反应开始时阴极生成的气体和阳极生成的气体体积比大于2:1的原因可能是_______(答一点即可)。
【任务三】微观探析水的组成
(6)以“”表示氢原子,以“”表示氧原子,以“”表示水分子,请在下面的表格中绘制出电解水的微观示意图(注意保持反应前后的原子个数、种类不变)_______。
(7)已知通常状态下氢气的密度是ag/mL,氧气的密度是bg/mL,请列式表示水中氢元素和氧元素的质量比_______。
四、计算类综合题。
25、取只含碳酸氢钙的硬水a g,充分加热,发生如下反应:
Ca(HCO3)2CaCO3↓+CO2↑+H2O,得到沉淀1.0g.回答下列问题:
(1)碳酸氢钙中钙元素与氧元素的质量比为 。
(2)计算此硬水中碳酸氢钙的质量是多少?
2023—2024学年九年级化学鲁科版上册第五单元 定量研究化学反应 同步选题含答案
鲁科版第五单元 定量研究化学反应
一、选择题。
1、在化学反应前后,肯定不会变化的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的质量总和
⑤物质的种类 ⑥物质的体积 ⑦物质的状态
A. ①③④ B. ①④⑥ C. ①③⑦ D. ②④⑤
【答案】A
2、“绿色化学”要求原料物质中所有的原子完全被利用,全部转入期望的产品中,即原子利用率为100%。一定条件下,CO和H2可以按照不同比例反应,只生成一种产物就能实现“绿色化学”,这种产物不可能是( )
A.甲醛(CH2O) B.甲醇(CH4O)
C.乙醇(C2H6O) D.乙酸(C2H4O2)
【答案】C
3、在反应中,C与D的相对分子质量比为,若 A与足量B充分反应,生成 D,则在此反应中,参加反应的B与生成C的质量比为( )
A.3∶2 B.12∶11 C.8∶11 D.35∶33
【答案】B
4、化学是在分子、原子的层次上研究物质的科学。如图是某化学反应的微观示意图下列有关说法错误的是( )
A.该反应属于氧化反应
B.一个甲物质分子由一个氮原子和三个氢原子构成
C.生成的丙、丁两种物质的分子个数比为2:3
D.参加反应的甲、乙两种物质的质量比为17:32
【答案】D
5、化学反应遵守质量守恒定律的原因在于反应前后( )
A.物质的种类没有改变 B.分子的种类没有改变
C.原子的种类、数目和质量都没有改变 D.分子的数目没有改变
【答案】C
6、连花清瘟胶囊自传统中医名方,可用于治疗流感,现代仪器测得其成分之一是没食子酸(化学式为C7H6O5),下列有关没食子酸的说法,正确的是( )
A.从分类上看:没食子酸属于氧化物
B.从宏观上看:没食子酸完全燃烧生成CO2和H2O
C.从微观上看:一个没食子酸分子中含有3个原子
D.从质量上看:没食子酸中碳、氢、氧元素的质量比为12:1:16
【答案】B
7、现取2.3g某有机物在空气中完全燃烧,生成4.4g二氧化碳和2.7g水。对该物质的组成有下列推断:①一定含碳氢元素 ②一定不含氧元素 ③可能含氧元素 ④一定含氧元素 ⑤分子中C、H的原子个数比为2∶5 ⑥分子中C、H、O的元素质量比为12∶3∶8。其中正确的是( )
A.①③⑤ B.①④⑥ C.①②⑤ D.①④⑤
【答案】B
8、在物质混合、反应等过程中,有时存在着“1+1≠2”的有趣现象。下列选项符合“1+1≠2”的是( )
A.1g酒精和1g水混合后溶液的总质量
B.1g碳和1g氧气充分反应后生成物的质量
C.1g硫和1g氧气充分反应后生成物的质量
D.1g黄豆和1g黑豆混合后物质的总质量
【答案】B
9、某物质4.4 g完全燃烧后生成8.8 g CO2和3.6 g H2O,对该物质的判断正确的是( )
A.该物质由碳、氢、氧元素组成
B.该物质只含有碳、氢两种元素
C.该物质中氧元素的质量分数为16%
D.该物质的分子中碳原子和氢原子的个数比为1∶1
【答案】A
10、Sb2O5是一种重要的阻燃剂,工业制取该物质的化学方程式为:Sb2O3+2X=Sb2O5+2H2O则X的化学式为( )
A.H2 B.O2 C.H2O2 D.H3SbO4
【答案】C
11、下列因果关系,不正确的是( )
A.微粒在不停运动一—酒香不怕巷子深
B.同种元素的质子数相同一一Na和Na+都属于钠元素
C.分子很小——18g水中大约有6.02×1023个水分子
D.质量守恒定律——5g碳与7g氧气完全反应生成12g二氧化碳
【答案】D
12、逻辑推理是学习化学常用的思维方法,下列推理正确的是( )
A.由同种分子构成的物质一定是纯净物,所以纯净物一定是由同种分子构成
B.离子是带电荷的粒子,所以带电荷的粒子一定是离子
C.氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧元素
D.分子可以构成物质,所以物质都是由分子构成
【答案】C
13、二氧化碳和氢气可在一定条件下反应,生产一种重要的化工原料甲醇,化学方程式为。下列有关该反应的说法错误的是( )
A.为 CO2的利用创造了一种新途径
B.属于化合反应
C.反应前后分子数发生了改变
D.钌-膦络合物的质量在反应前后没有改变
【答案】B
14、已知反应A+B=C+D,参加反应的A与B总质量为40g,若反应后生成C和D的质量比为2:3,则反应中生成C的质量为( )
A.16g B.20g C.24g D.32g
【答案】A
15、某化合物在4.8g氧气中完全燃烧,生成了4.4g二氧化碳和2.7g水。关于该物质的推断中不正确的是( )
A.该化合物的质量为2.3g
B.该化合物中一定含碳、氢、氧三种元素
C.该化合物中碳、氧元素质量比为3:2
D.分子中C、H原子个数比为1:2
【答案】D
16、根据如图,下列说法不正确的是( )
A.该反应涉及到 2 种氧化物
B.反应物和生成物均由分子构成
C.该反应的化学方程式为 CO2+2H2OCH4+O2
D.在反应前后部分元素的化合价发生改变
【答案】C
二、填空题。
17、某同学按如图所示装置对质量守恒定律进行验证,结果观察到反应后天平不平衡,其原因是什么?_____ 。如何改进该实验装置才能验证质量守恒定律?_____ 。
【答案】反应生成的二氧化碳气体逸出,使质量减轻
在密闭体系中进行实验即可
18、写出下列反应的化学方程式。
(1)镁在空气中燃烧: 。
(2)电解水: 。
(3)实验室分解过氧化氢溶液制取氧气: 。
【答案】; ↑↑; ↑
19、根据下列装置图,回答有关问题。
(1)写出装置图中标号仪器的名称。a_______;b_______。
(2)实验室用过氧化氢溶液制取氧气可选择的发生装置是___ (填字母),此反应的化学方程式__ 。
(3)若使用高锰酸钾制取氧气,可选用的装置组合是_____(填字母)。
(4)选用D装置收集氧气的原因是_____ 。
(5)加热15.8g高锰酸钾,完全反应后,理论上可以得到____氧气?
【答案】(1)试管 集气瓶 B (2)
(3)AC或AD (4)氧气不易溶于水 (5)1.6g
20、我国科研人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇(CH3OH),其微观示意图如图所示。
(1)该反应中,发生变化的是 (填“分子”或“原子”);参加反应的两种物质中,其分子的个数比为 ;丙分子中,碳、氢、氧三种原子的个数比为 。
(2)该反应的化学方程式为 。
【答案】(1)分子;3:1(或1:3);1:4:1;
(2)CO2+3H2CH3OH+H2O。
21、青蒿素是一种抗疟疾药,若14.1g青蒿素完全燃烧生成33.0gCO2和9.9gH2O,则青蒿素燃烧消耗氧气的质量为__________________;青蒿素中所含元素的原子个数比为_____________。
【答案】28.8g 碳氢氧原子个数比为15∶22∶5
22、(1)“84”消毒液可用于灾区防疫,其主要成分是次氯酸钠(NaClO),制取它的化学方程式为2NaOH+X═NaClO+NaCl+H2O,则X的化学式为 。求出NaClO中氯元素化合价并在该化学式中表示出来 .
(2)固体MgH2是氢能源汽车的供能剂,MgH2可以和水反应生成氢氧化镁,同时释放出氢气,该反应的化学方程式是 。
【答案】(1)Cl2; ; (2)MgH2+2H2O=Mg(OH)2+2H2↑
23、下列各组变化中,符合“1+1=2”的事实是(_____)
A、1L水与1L酒精混合后的体积等于2L
B、1g硫粉在1g氧气中完全燃烧后生成2g二氧化硫
C、1g镁与1g氧气反应得到2g氧化镁
D、_________________
【答案】B 1g水与1g酒精混合后的质量等于2g
三、综合应用题。
24、某小组以水为研究对象,开展针对水的构成奥秘的项目式学习。
【任务一】设计净化水的简易装置
图1是小组设计的野外求生的简易饮水装置。
(1)该饮水装置的净水措施是(填字母序号)。
A.静置 B.蒸馏 C.过滤 D.吸附
(2)实验室综合运用过滤、沉淀、蒸馏这三项操作进行净水,其先后顺序应该是_______。
【任务二】探究水的组成
小组同学用图2装置进行电解水并测得每分钟产生的气体体积数据如下表:
时间/分钟 1 2 3 4 5 6 7 8 9 10
阴极生成的气体体积(cm3) 6 12 20 29 39 49 55 65 75 85
阳极生成的气体体积(cm3) 2 4 7 11 16 21 24 29 35 40
(3)写出图2中反应的文字表达式:_______。
(4)仔细分析以上实验数据,从第_______分钟之后阴极、阳极产生的气体体积之比接近于2:1。
(5)请解释反应开始时阴极生成的气体和阳极生成的气体体积比大于2:1的原因可能是_______(答一点即可)。
【任务三】微观探析水的组成
(6)以“”表示氢原子,以“”表示氧原子,以“”表示水分子,请在下面的表格中绘制出电解水的微观示意图(注意保持反应前后的原子个数、种类不变)_______。
(7)已知通常状态下氢气的密度是ag/mL,氧气的密度是bg/mL,请列式表示水中氢元素和氧元素的质量比_______。
【答案】(1)B (2)沉淀、过滤、蒸馏
(3) (4)4
(5)氧气与电极发生了反应,氧气比氢气在水中溶解得多,氧气被电极吸附等
(6)如图所示:
(7)
四、计算类综合题。
25、取只含碳酸氢钙的硬水a g,充分加热,发生如下反应:
Ca(HCO3)2CaCO3↓+CO2↑+H2O,得到沉淀1.0g.回答下列问题:
(1)碳酸氢钙中钙元素与氧元素的质量比为 。
(2)计算此硬水中碳酸氢钙的质量是多少?
【答案及解析】(1)碳酸氢钙中钙元素和氧元素的质量比为:
40:(16×6)=5:12;
(2)设Ca(HCO3)2 的质量为x
Ca(HCO3)2CaCO3↓+CO2↑+H2O
162 100
x 1.0g
解得:x=1.62g。
鲁科版第五单元 定量研究化学反应
一、选择题。
1、在化学反应前后,肯定不会变化的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的质量总和
⑤物质的种类 ⑥物质的体积 ⑦物质的状态
A. ①③④ B. ①④⑥ C. ①③⑦ D. ②④⑤
2、“绿色化学”要求原料物质中所有的原子完全被利用,全部转入期望的产品中,即原子利用率为100%。一定条件下,CO和H2可以按照不同比例反应,只生成一种产物就能实现“绿色化学”,这种产物不可能是( )
A.甲醛(CH2O) B.甲醇(CH4O)
C.乙醇(C2H6O) D.乙酸(C2H4O2)
3、在反应中,C与D的相对分子质量比为,若 A与足量B充分反应,生成 D,则在此反应中,参加反应的B与生成C的质量比为( )
A.3∶2 B.12∶11 C.8∶11 D.35∶33
4、化学是在分子、原子的层次上研究物质的科学。如图是某化学反应的微观示意图下列有关说法错误的是( )
A.该反应属于氧化反应
B.一个甲物质分子由一个氮原子和三个氢原子构成
C.生成的丙、丁两种物质的分子个数比为2:3
D.参加反应的甲、乙两种物质的质量比为17:32
5、化学反应遵守质量守恒定律的原因在于反应前后( )
A.物质的种类没有改变 B.分子的种类没有改变
C.原子的种类、数目和质量都没有改变 D.分子的数目没有改变
6、连花清瘟胶囊自传统中医名方,可用于治疗流感,现代仪器测得其成分之一是没食子酸(化学式为C7H6O5),下列有关没食子酸的说法,正确的是( )
A.从分类上看:没食子酸属于氧化物
B.从宏观上看:没食子酸完全燃烧生成CO2和H2O
C.从微观上看:一个没食子酸分子中含有3个原子
D.从质量上看:没食子酸中碳、氢、氧元素的质量比为12:1:16
7、现取2.3g某有机物在空气中完全燃烧,生成4.4g二氧化碳和2.7g水。对该物质的组成有下列推断:①一定含碳氢元素 ②一定不含氧元素 ③可能含氧元素 ④一定含氧元素 ⑤分子中C、H的原子个数比为2∶5 ⑥分子中C、H、O的元素质量比为12∶3∶8。其中正确的是( )
A.①③⑤ B.①④⑥ C.①②⑤ D.①④⑤
8、在物质混合、反应等过程中,有时存在着“1+1≠2”的有趣现象。下列选项符合“1+1≠2”的是( )
A.1g酒精和1g水混合后溶液的总质量
B.1g碳和1g氧气充分反应后生成物的质量
C.1g硫和1g氧气充分反应后生成物的质量
D.1g黄豆和1g黑豆混合后物质的总质量
9、某物质4.4 g完全燃烧后生成8.8 g CO2和3.6 g H2O,对该物质的判断正确的是( )
A.该物质由碳、氢、氧元素组成
B.该物质只含有碳、氢两种元素
C.该物质中氧元素的质量分数为16%
D.该物质的分子中碳原子和氢原子的个数比为1∶1
10、Sb2O5是一种重要的阻燃剂,工业制取该物质的化学方程式为:Sb2O3+2X=Sb2O5+2H2O则X的化学式为( )
A.H2 B.O2 C.H2O2 D.H3SbO4
11、下列因果关系,不正确的是( )
A.微粒在不停运动一—酒香不怕巷子深
B.同种元素的质子数相同一一Na和Na+都属于钠元素
C.分子很小——18g水中大约有6.02×1023个水分子
D.质量守恒定律——5g碳与7g氧气完全反应生成12g二氧化碳
12、逻辑推理是学习化学常用的思维方法,下列推理正确的是( )
A.由同种分子构成的物质一定是纯净物,所以纯净物一定是由同种分子构成
B.离子是带电荷的粒子,所以带电荷的粒子一定是离子
C.氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧元素
D.分子可以构成物质,所以物质都是由分子构成
13、二氧化碳和氢气可在一定条件下反应,生产一种重要的化工原料甲醇,化学方程式为。下列有关该反应的说法错误的是( )
A.为 CO2的利用创造了一种新途径
B.属于化合反应
C.反应前后分子数发生了改变
D.钌-膦络合物的质量在反应前后没有改变
14、已知反应A+B=C+D,参加反应的A与B总质量为40g,若反应后生成C和D的质量比为2:3,则反应中生成C的质量为( )
A.16g B.20g C.24g D.32g
15、某化合物在4.8g氧气中完全燃烧,生成了4.4g二氧化碳和2.7g水。关于该物质的推断中不正确的是( )
A.该化合物的质量为2.3g
B.该化合物中一定含碳、氢、氧三种元素
C.该化合物中碳、氧元素质量比为3:2
D.分子中C、H原子个数比为1:2
16、根据如图,下列说法不正确的是( )
A.该反应涉及到 2 种氧化物
B.反应物和生成物均由分子构成
C.该反应的化学方程式为 CO2+2H2OCH4+O2
D.在反应前后部分元素的化合价发生改变
二、填空题。
17、某同学按如图所示装置对质量守恒定律进行验证,结果观察到反应后天平不平衡,其原因是什么?_____ 。如何改进该实验装置才能验证质量守恒定律?_____ 。
18、写出下列反应的化学方程式。
(1)镁在空气中燃烧: 。
(2)电解水: 。
(3)实验室分解过氧化氢溶液制取氧气: 。
19、根据下列装置图,回答有关问题。
(1)写出装置图中标号仪器的名称。a_______;b_______。
(2)实验室用过氧化氢溶液制取氧气可选择的发生装置是___ (填字母),此反应的化学方程式__ 。
(3)若使用高锰酸钾制取氧气,可选用的装置组合是_____(填字母)。
(4)选用D装置收集氧气的原因是_____ 。
(5)加热15.8g高锰酸钾,完全反应后,理论上可以得到____氧气?
20、我国科研人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇(CH3OH),其微观示意图如图所示。
(1)该反应中,发生变化的是 (填“分子”或“原子”);参加反应的两种物质中,其分子的个数比为 ;丙分子中,碳、氢、氧三种原子的个数比为 。
(2)该反应的化学方程式为 。
21、青蒿素是一种抗疟疾药,若14.1g青蒿素完全燃烧生成33.0gCO2和9.9gH2O,则青蒿素燃烧消耗氧气的质量为__________________;青蒿素中所含元素的原子个数比为_____________。
22、(1)“84”消毒液可用于灾区防疫,其主要成分是次氯酸钠(NaClO),制取它的化学方程式为2NaOH+X═NaClO+NaCl+H2O,则X的化学式为 。求出NaClO中氯元素化合价并在该化学式中表示出来 .
(2)固体MgH2是氢能源汽车的供能剂,MgH2可以和水反应生成氢氧化镁,同时释放出氢气,该反应的化学方程式是 。
23、下列各组变化中,符合“1+1=2”的事实是(_____)
A、1L水与1L酒精混合后的体积等于2L
B、1g硫粉在1g氧气中完全燃烧后生成2g二氧化硫
C、1g镁与1g氧气反应得到2g氧化镁
D、_________________
三、综合应用题。
24、某小组以水为研究对象,开展针对水的构成奥秘的项目式学习。
【任务一】设计净化水的简易装置
图1是小组设计的野外求生的简易饮水装置。
(1)该饮水装置的净水措施是(填字母序号)。
A.静置 B.蒸馏 C.过滤 D.吸附
(2)实验室综合运用过滤、沉淀、蒸馏这三项操作进行净水,其先后顺序应该是_______。
【任务二】探究水的组成
小组同学用图2装置进行电解水并测得每分钟产生的气体体积数据如下表:
时间/分钟 1 2 3 4 5 6 7 8 9 10
阴极生成的气体体积(cm3) 6 12 20 29 39 49 55 65 75 85
阳极生成的气体体积(cm3) 2 4 7 11 16 21 24 29 35 40
(3)写出图2中反应的文字表达式:_______。
(4)仔细分析以上实验数据,从第_______分钟之后阴极、阳极产生的气体体积之比接近于2:1。
(5)请解释反应开始时阴极生成的气体和阳极生成的气体体积比大于2:1的原因可能是_______(答一点即可)。
【任务三】微观探析水的组成
(6)以“”表示氢原子,以“”表示氧原子,以“”表示水分子,请在下面的表格中绘制出电解水的微观示意图(注意保持反应前后的原子个数、种类不变)_______。
(7)已知通常状态下氢气的密度是ag/mL,氧气的密度是bg/mL,请列式表示水中氢元素和氧元素的质量比_______。
四、计算类综合题。
25、取只含碳酸氢钙的硬水a g,充分加热,发生如下反应:
Ca(HCO3)2CaCO3↓+CO2↑+H2O,得到沉淀1.0g.回答下列问题:
(1)碳酸氢钙中钙元素与氧元素的质量比为 。
(2)计算此硬水中碳酸氢钙的质量是多少?
2023—2024学年九年级化学鲁科版上册第五单元 定量研究化学反应 同步选题含答案
鲁科版第五单元 定量研究化学反应
一、选择题。
1、在化学反应前后,肯定不会变化的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的质量总和
⑤物质的种类 ⑥物质的体积 ⑦物质的状态
A. ①③④ B. ①④⑥ C. ①③⑦ D. ②④⑤
【答案】A
2、“绿色化学”要求原料物质中所有的原子完全被利用,全部转入期望的产品中,即原子利用率为100%。一定条件下,CO和H2可以按照不同比例反应,只生成一种产物就能实现“绿色化学”,这种产物不可能是( )
A.甲醛(CH2O) B.甲醇(CH4O)
C.乙醇(C2H6O) D.乙酸(C2H4O2)
【答案】C
3、在反应中,C与D的相对分子质量比为,若 A与足量B充分反应,生成 D,则在此反应中,参加反应的B与生成C的质量比为( )
A.3∶2 B.12∶11 C.8∶11 D.35∶33
【答案】B
4、化学是在分子、原子的层次上研究物质的科学。如图是某化学反应的微观示意图下列有关说法错误的是( )
A.该反应属于氧化反应
B.一个甲物质分子由一个氮原子和三个氢原子构成
C.生成的丙、丁两种物质的分子个数比为2:3
D.参加反应的甲、乙两种物质的质量比为17:32
【答案】D
5、化学反应遵守质量守恒定律的原因在于反应前后( )
A.物质的种类没有改变 B.分子的种类没有改变
C.原子的种类、数目和质量都没有改变 D.分子的数目没有改变
【答案】C
6、连花清瘟胶囊自传统中医名方,可用于治疗流感,现代仪器测得其成分之一是没食子酸(化学式为C7H6O5),下列有关没食子酸的说法,正确的是( )
A.从分类上看:没食子酸属于氧化物
B.从宏观上看:没食子酸完全燃烧生成CO2和H2O
C.从微观上看:一个没食子酸分子中含有3个原子
D.从质量上看:没食子酸中碳、氢、氧元素的质量比为12:1:16
【答案】B
7、现取2.3g某有机物在空气中完全燃烧,生成4.4g二氧化碳和2.7g水。对该物质的组成有下列推断:①一定含碳氢元素 ②一定不含氧元素 ③可能含氧元素 ④一定含氧元素 ⑤分子中C、H的原子个数比为2∶5 ⑥分子中C、H、O的元素质量比为12∶3∶8。其中正确的是( )
A.①③⑤ B.①④⑥ C.①②⑤ D.①④⑤
【答案】B
8、在物质混合、反应等过程中,有时存在着“1+1≠2”的有趣现象。下列选项符合“1+1≠2”的是( )
A.1g酒精和1g水混合后溶液的总质量
B.1g碳和1g氧气充分反应后生成物的质量
C.1g硫和1g氧气充分反应后生成物的质量
D.1g黄豆和1g黑豆混合后物质的总质量
【答案】B
9、某物质4.4 g完全燃烧后生成8.8 g CO2和3.6 g H2O,对该物质的判断正确的是( )
A.该物质由碳、氢、氧元素组成
B.该物质只含有碳、氢两种元素
C.该物质中氧元素的质量分数为16%
D.该物质的分子中碳原子和氢原子的个数比为1∶1
【答案】A
10、Sb2O5是一种重要的阻燃剂,工业制取该物质的化学方程式为:Sb2O3+2X=Sb2O5+2H2O则X的化学式为( )
A.H2 B.O2 C.H2O2 D.H3SbO4
【答案】C
11、下列因果关系,不正确的是( )
A.微粒在不停运动一—酒香不怕巷子深
B.同种元素的质子数相同一一Na和Na+都属于钠元素
C.分子很小——18g水中大约有6.02×1023个水分子
D.质量守恒定律——5g碳与7g氧气完全反应生成12g二氧化碳
【答案】D
12、逻辑推理是学习化学常用的思维方法,下列推理正确的是( )
A.由同种分子构成的物质一定是纯净物,所以纯净物一定是由同种分子构成
B.离子是带电荷的粒子,所以带电荷的粒子一定是离子
C.氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧元素
D.分子可以构成物质,所以物质都是由分子构成
【答案】C
13、二氧化碳和氢气可在一定条件下反应,生产一种重要的化工原料甲醇,化学方程式为。下列有关该反应的说法错误的是( )
A.为 CO2的利用创造了一种新途径
B.属于化合反应
C.反应前后分子数发生了改变
D.钌-膦络合物的质量在反应前后没有改变
【答案】B
14、已知反应A+B=C+D,参加反应的A与B总质量为40g,若反应后生成C和D的质量比为2:3,则反应中生成C的质量为( )
A.16g B.20g C.24g D.32g
【答案】A
15、某化合物在4.8g氧气中完全燃烧,生成了4.4g二氧化碳和2.7g水。关于该物质的推断中不正确的是( )
A.该化合物的质量为2.3g
B.该化合物中一定含碳、氢、氧三种元素
C.该化合物中碳、氧元素质量比为3:2
D.分子中C、H原子个数比为1:2
【答案】D
16、根据如图,下列说法不正确的是( )
A.该反应涉及到 2 种氧化物
B.反应物和生成物均由分子构成
C.该反应的化学方程式为 CO2+2H2OCH4+O2
D.在反应前后部分元素的化合价发生改变
【答案】C
二、填空题。
17、某同学按如图所示装置对质量守恒定律进行验证,结果观察到反应后天平不平衡,其原因是什么?_____ 。如何改进该实验装置才能验证质量守恒定律?_____ 。
【答案】反应生成的二氧化碳气体逸出,使质量减轻
在密闭体系中进行实验即可
18、写出下列反应的化学方程式。
(1)镁在空气中燃烧: 。
(2)电解水: 。
(3)实验室分解过氧化氢溶液制取氧气: 。
【答案】; ↑↑; ↑
19、根据下列装置图,回答有关问题。
(1)写出装置图中标号仪器的名称。a_______;b_______。
(2)实验室用过氧化氢溶液制取氧气可选择的发生装置是___ (填字母),此反应的化学方程式__ 。
(3)若使用高锰酸钾制取氧气,可选用的装置组合是_____(填字母)。
(4)选用D装置收集氧气的原因是_____ 。
(5)加热15.8g高锰酸钾,完全反应后,理论上可以得到____氧气?
【答案】(1)试管 集气瓶 B (2)
(3)AC或AD (4)氧气不易溶于水 (5)1.6g
20、我国科研人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇(CH3OH),其微观示意图如图所示。
(1)该反应中,发生变化的是 (填“分子”或“原子”);参加反应的两种物质中,其分子的个数比为 ;丙分子中,碳、氢、氧三种原子的个数比为 。
(2)该反应的化学方程式为 。
【答案】(1)分子;3:1(或1:3);1:4:1;
(2)CO2+3H2CH3OH+H2O。
21、青蒿素是一种抗疟疾药,若14.1g青蒿素完全燃烧生成33.0gCO2和9.9gH2O,则青蒿素燃烧消耗氧气的质量为__________________;青蒿素中所含元素的原子个数比为_____________。
【答案】28.8g 碳氢氧原子个数比为15∶22∶5
22、(1)“84”消毒液可用于灾区防疫,其主要成分是次氯酸钠(NaClO),制取它的化学方程式为2NaOH+X═NaClO+NaCl+H2O,则X的化学式为 。求出NaClO中氯元素化合价并在该化学式中表示出来 .
(2)固体MgH2是氢能源汽车的供能剂,MgH2可以和水反应生成氢氧化镁,同时释放出氢气,该反应的化学方程式是 。
【答案】(1)Cl2; ; (2)MgH2+2H2O=Mg(OH)2+2H2↑
23、下列各组变化中,符合“1+1=2”的事实是(_____)
A、1L水与1L酒精混合后的体积等于2L
B、1g硫粉在1g氧气中完全燃烧后生成2g二氧化硫
C、1g镁与1g氧气反应得到2g氧化镁
D、_________________
【答案】B 1g水与1g酒精混合后的质量等于2g
三、综合应用题。
24、某小组以水为研究对象,开展针对水的构成奥秘的项目式学习。
【任务一】设计净化水的简易装置
图1是小组设计的野外求生的简易饮水装置。
(1)该饮水装置的净水措施是(填字母序号)。
A.静置 B.蒸馏 C.过滤 D.吸附
(2)实验室综合运用过滤、沉淀、蒸馏这三项操作进行净水,其先后顺序应该是_______。
【任务二】探究水的组成
小组同学用图2装置进行电解水并测得每分钟产生的气体体积数据如下表:
时间/分钟 1 2 3 4 5 6 7 8 9 10
阴极生成的气体体积(cm3) 6 12 20 29 39 49 55 65 75 85
阳极生成的气体体积(cm3) 2 4 7 11 16 21 24 29 35 40
(3)写出图2中反应的文字表达式:_______。
(4)仔细分析以上实验数据,从第_______分钟之后阴极、阳极产生的气体体积之比接近于2:1。
(5)请解释反应开始时阴极生成的气体和阳极生成的气体体积比大于2:1的原因可能是_______(答一点即可)。
【任务三】微观探析水的组成
(6)以“”表示氢原子,以“”表示氧原子,以“”表示水分子,请在下面的表格中绘制出电解水的微观示意图(注意保持反应前后的原子个数、种类不变)_______。
(7)已知通常状态下氢气的密度是ag/mL,氧气的密度是bg/mL,请列式表示水中氢元素和氧元素的质量比_______。
【答案】(1)B (2)沉淀、过滤、蒸馏
(3) (4)4
(5)氧气与电极发生了反应,氧气比氢气在水中溶解得多,氧气被电极吸附等
(6)如图所示:
(7)
四、计算类综合题。
25、取只含碳酸氢钙的硬水a g,充分加热,发生如下反应:
Ca(HCO3)2CaCO3↓+CO2↑+H2O,得到沉淀1.0g.回答下列问题:
(1)碳酸氢钙中钙元素与氧元素的质量比为 。
(2)计算此硬水中碳酸氢钙的质量是多少?
【答案及解析】(1)碳酸氢钙中钙元素和氧元素的质量比为:
40:(16×6)=5:12;
(2)设Ca(HCO3)2 的质量为x
Ca(HCO3)2CaCO3↓+CO2↑+H2O
162 100
x 1.0g
解得:x=1.62g。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
