2023-2024学年鲁科版高中化学必修一 3.1铁的多样性-亚铁盐和铁盐 课件(共21张PPT)
文档属性
| 名称 | 2023-2024学年鲁科版高中化学必修一 3.1铁的多样性-亚铁盐和铁盐 课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-08 22:14:33 | ||
图片预览






文档简介
(共21张PPT)
111
3--1 铁的多样性
第1课时 亚铁盐、铁盐
预习提问:铁元素的含量和存在?
1、铁元素在地壳中的含量仅次于 。
2、铁元素在自然界中的存在形态:
游离态 (如陨铁)和化合态
氧、硅、铝
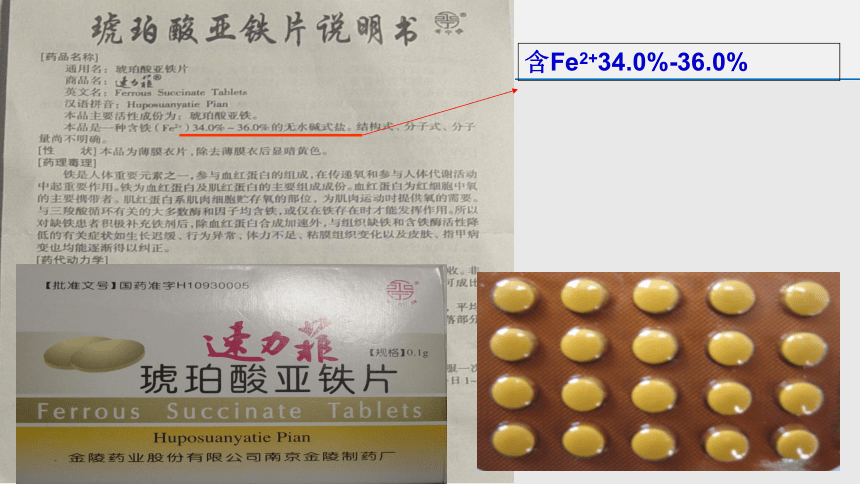
市售补铁补血血剂
含Fe2+34.0%-36.0%
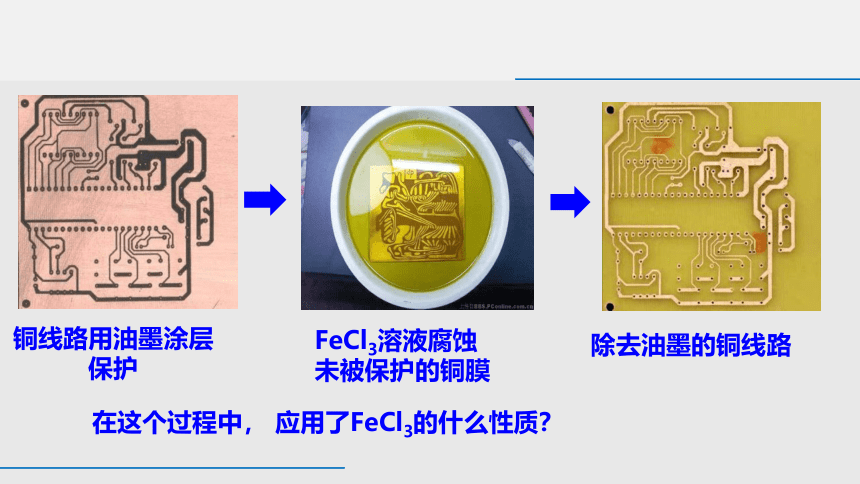
含铁物质在电子工业中也广泛应用, 电子工业是高科技产业,与数学、物理、化学等基础学科密切相关,近期美国举全国之力打击华为,也促使我们青年一代要奋发图强,发展科技,强大祖国。
在电子工业中,用 FeCl3溶液制造印刷电路板
在这个过程中, 应用了FeCl3的什么性质?
铜线路用油墨涂层保护
FeCl3溶液腐蚀
未被保护的铜膜
除去油墨的铜线路
1. 从物质类别和元素价态两个角度依据复分解反应和氧化还原规律,形成预测FeSO4和 FeCl3 的性质、设计实验方案、动手实验、寻找证据的探究过程,建立从以上两个角度研究物质性质的思路方法,培养科学探究与创新意识。
2.了解 Fe2+ 、Fe3+的检验方法,通过实验验证亚铁盐、铁盐的性质,能用化学用语解释实验现象及结论,培养宏观辨识与微观探析的能力。
3.建立含有铁元素的物质性质及应用之间的联系,能主动运用所学知识和方法解决生产、生活中的化学问题,提高社会意识,增强社会责任感。
学习与评价目标
单质 氧化物 碱 盐
+3
+2
0
铁元素化合价
Fe3+、FeCl3
物质类别
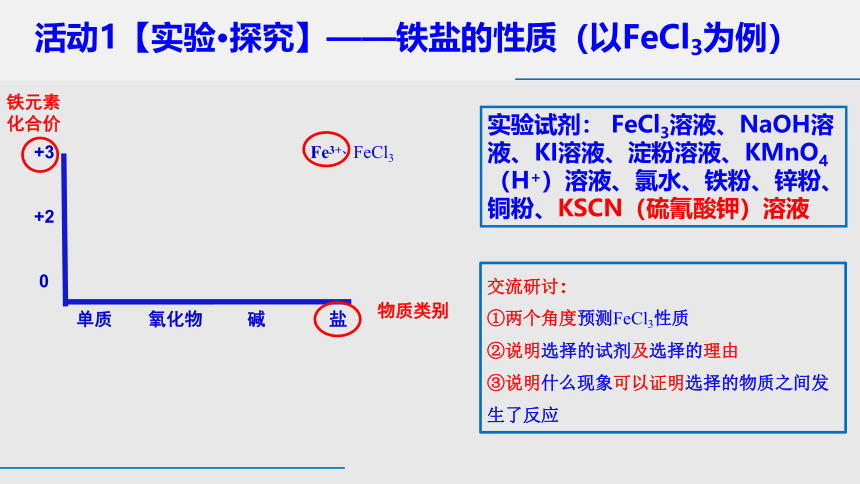
活动1【实验·探究】——铁盐的性质(以FeCl3为例)
实验试剂: FeCl3溶液、NaOH溶液、KI溶液、淀粉溶液、KMnO4(H+)溶液、氯水、铁粉、锌粉、铜粉、KSCN(硫氰酸钾)溶液
交流研讨:
①两个角度预测FeCl3性质
②说明选择的试剂及选择的理由
③说明什么现象可以证明选择的物质之间发生了反应
活动1【实验·探究】——铁盐的性质(以FeCl3为例)
预测 角度 预测 性质 选取 试剂 预测 现象 实验 现象 离子方程式
结论
物质类别
元素价态
盐的性质
氧化性
NaOH溶液
KI溶液、
淀粉溶液
铜粉
产生红褐色沉淀
溶液黄色变为蓝色
溶液变蓝
FeCl3溶液
NaOH溶液
实验1
FeCl3溶液
先KI溶液 后淀粉溶液
实验3
FeCl3溶液
铜粉
实验2
活动1【实验·探究】——铁盐的性质(以FeCl3为例)
1.安全提示: 药品不要沾到皮肤上
2.分工合作: 3名同学同时实验,其他同学观察并记录现象
3.试剂用量: FeCl3溶液1-2ml 少许金属粉末
4.特别注意: 边加试剂边振荡
实验要求:
活动1【实验·探究】——铁盐的性质(以FeCl3为例)
预测 角度 预测 性质 选取 试剂 预测 现象 实验 现象 离子方程式
结论
物质类别
元素价态
盐的性质
氧化性
NaOH溶液
KI溶液、
淀粉溶液
铜粉
产生红褐色沉淀
溶液黄色变为
蓝色
溶液变蓝
溶液变成蓝色
产生红褐色沉淀
溶液黄色变蓝色
Fe3++3OH- = Fe(OH)3↓
2 Fe3++2I- =2Fe2++I2
2Fe3++Cu = 2Fe2++Cu2+
跟踪评价
下列反应中,Fe3+表现氧化性的是( )
A.FeCl3溶液使淀粉碘化钾试纸变蓝
B.向 FeCl3溶液中加入NaOH溶液产生红褐色沉淀
C.向 FeCl3溶液中加入AgNO3溶液产生白色沉淀
D.向 FeCl3溶液中加入少量铁粉,铁粉消失
AD
由现象得出结论
设计方案、选取合适试剂、实验验证
视角一:物质类别
视角二:价态角度
预测物质的性质
请同学们回顾FeCl3性质的探究过程,小组内讨论总结: 探究物质性质的基本思路是什么?
探究物质性质的基本思路
合作探究、精彩纷呈:
请同学们按照以上思路,从学案提供的试剂中选取合适试剂,小组内讨论得出以FeSO4为例探究亚铁盐性质的最佳方案.并完成学案表格的前三列内容。
小组讨论后,投影展示交流。
预测 角度 预测 性质 选取 试剂 预测 现象 实验 现 象 离子方程式
结论
物质类别
活动2【实验·探究】——亚铁盐的性质(以FeSO4为例)
Fe2+
0
+3
预测 角度 预测 性质 选取 试剂 预测 现象 实验 现 象 离子方程式
结论
盐的性质
NaOH溶液
产生白色沉淀
氧化性
还原性
锌粉
高锰酸钾溶液
溶液浅绿色
褪去
溶液紫色褪去
活动2【实验·探究】——亚铁盐的性质(以FeSO4为例)
先KSCN
再氯水
先不变色
后变红
物质类别
Fe2+
0
+3
FeSO4溶液
NaOH溶液
实验1
实验3
酸性高锰酸钾溶液
FeSO4溶液
实验2
活动2【实验·探究】——亚铁盐的性质(以FeSO4为例)
FeSO4溶液
先KSCN溶液后氯水
实验4
Zn粉
1
FeSO4溶液
1.安全提示:药品不要沾到手上
2.分工合作:观察并记录现象
3.试剂用量:试剂取1-2ml KSCN溶液1-2滴
4.特别注意:向FeSO4溶液中滴加NaOH溶液时不要振荡试管
实验要求:
预测 角度 预测 性质 选取 试剂 预测 现象 实验 现 象 离子方程式
结论
盐的性质
NaOH溶液
产生白色沉淀
氧化性
还原性
锌粉
KMnO4(H+)
溶液浅绿色
褪去
紫色褪去
活动2【实验·探究】——亚铁盐的性质(以FeSO4为例)
先KSCN
再氯水
先不变色
后变红
物质类别
Fe2+
0价
+3价
溶液紫红色褪去
加KSCN无明显变化,加氯水变红色
溶液浅绿色褪去
白色沉淀
红褐色
灰绿色
迅速
最终
学以致用
请观察FeSO4溶液试剂瓶底部存在固体粉末,思考讨论该粉末可能是什么物质?为什么要加入该物质?请用方程式表示。
答案:铁粉; 防止Fe2+被氧化
2 Fe3++Fe =3Fe2+
1.方法收获
这种思想将引领我们对元素化合物的学习!
2.知识收获
学到了亚铁盐和铁盐的性质及其实际应用
自主话收获
单质 氧化物 碱 盐
+3
+2
0
物质类别
化合价
Fe3+
Fe2+
科学并不是真理,只是一种探索
知识并不是目的,只是一种构建
学习反思
祝同学们学业有成!
111
3--1 铁的多样性
第1课时 亚铁盐、铁盐
预习提问:铁元素的含量和存在?
1、铁元素在地壳中的含量仅次于 。
2、铁元素在自然界中的存在形态:
游离态 (如陨铁)和化合态
氧、硅、铝
市售补铁补血血剂
含Fe2+34.0%-36.0%
含铁物质在电子工业中也广泛应用, 电子工业是高科技产业,与数学、物理、化学等基础学科密切相关,近期美国举全国之力打击华为,也促使我们青年一代要奋发图强,发展科技,强大祖国。
在电子工业中,用 FeCl3溶液制造印刷电路板
在这个过程中, 应用了FeCl3的什么性质?
铜线路用油墨涂层保护
FeCl3溶液腐蚀
未被保护的铜膜
除去油墨的铜线路
1. 从物质类别和元素价态两个角度依据复分解反应和氧化还原规律,形成预测FeSO4和 FeCl3 的性质、设计实验方案、动手实验、寻找证据的探究过程,建立从以上两个角度研究物质性质的思路方法,培养科学探究与创新意识。
2.了解 Fe2+ 、Fe3+的检验方法,通过实验验证亚铁盐、铁盐的性质,能用化学用语解释实验现象及结论,培养宏观辨识与微观探析的能力。
3.建立含有铁元素的物质性质及应用之间的联系,能主动运用所学知识和方法解决生产、生活中的化学问题,提高社会意识,增强社会责任感。
学习与评价目标
单质 氧化物 碱 盐
+3
+2
0
铁元素化合价
Fe3+、FeCl3
物质类别
活动1【实验·探究】——铁盐的性质(以FeCl3为例)
实验试剂: FeCl3溶液、NaOH溶液、KI溶液、淀粉溶液、KMnO4(H+)溶液、氯水、铁粉、锌粉、铜粉、KSCN(硫氰酸钾)溶液
交流研讨:
①两个角度预测FeCl3性质
②说明选择的试剂及选择的理由
③说明什么现象可以证明选择的物质之间发生了反应
活动1【实验·探究】——铁盐的性质(以FeCl3为例)
预测 角度 预测 性质 选取 试剂 预测 现象 实验 现象 离子方程式
结论
物质类别
元素价态
盐的性质
氧化性
NaOH溶液
KI溶液、
淀粉溶液
铜粉
产生红褐色沉淀
溶液黄色变为蓝色
溶液变蓝
FeCl3溶液
NaOH溶液
实验1
FeCl3溶液
先KI溶液 后淀粉溶液
实验3
FeCl3溶液
铜粉
实验2
活动1【实验·探究】——铁盐的性质(以FeCl3为例)
1.安全提示: 药品不要沾到皮肤上
2.分工合作: 3名同学同时实验,其他同学观察并记录现象
3.试剂用量: FeCl3溶液1-2ml 少许金属粉末
4.特别注意: 边加试剂边振荡
实验要求:
活动1【实验·探究】——铁盐的性质(以FeCl3为例)
预测 角度 预测 性质 选取 试剂 预测 现象 实验 现象 离子方程式
结论
物质类别
元素价态
盐的性质
氧化性
NaOH溶液
KI溶液、
淀粉溶液
铜粉
产生红褐色沉淀
溶液黄色变为
蓝色
溶液变蓝
溶液变成蓝色
产生红褐色沉淀
溶液黄色变蓝色
Fe3++3OH- = Fe(OH)3↓
2 Fe3++2I- =2Fe2++I2
2Fe3++Cu = 2Fe2++Cu2+
跟踪评价
下列反应中,Fe3+表现氧化性的是( )
A.FeCl3溶液使淀粉碘化钾试纸变蓝
B.向 FeCl3溶液中加入NaOH溶液产生红褐色沉淀
C.向 FeCl3溶液中加入AgNO3溶液产生白色沉淀
D.向 FeCl3溶液中加入少量铁粉,铁粉消失
AD
由现象得出结论
设计方案、选取合适试剂、实验验证
视角一:物质类别
视角二:价态角度
预测物质的性质
请同学们回顾FeCl3性质的探究过程,小组内讨论总结: 探究物质性质的基本思路是什么?
探究物质性质的基本思路
合作探究、精彩纷呈:
请同学们按照以上思路,从学案提供的试剂中选取合适试剂,小组内讨论得出以FeSO4为例探究亚铁盐性质的最佳方案.并完成学案表格的前三列内容。
小组讨论后,投影展示交流。
预测 角度 预测 性质 选取 试剂 预测 现象 实验 现 象 离子方程式
结论
物质类别
活动2【实验·探究】——亚铁盐的性质(以FeSO4为例)
Fe2+
0
+3
预测 角度 预测 性质 选取 试剂 预测 现象 实验 现 象 离子方程式
结论
盐的性质
NaOH溶液
产生白色沉淀
氧化性
还原性
锌粉
高锰酸钾溶液
溶液浅绿色
褪去
溶液紫色褪去
活动2【实验·探究】——亚铁盐的性质(以FeSO4为例)
先KSCN
再氯水
先不变色
后变红
物质类别
Fe2+
0
+3
FeSO4溶液
NaOH溶液
实验1
实验3
酸性高锰酸钾溶液
FeSO4溶液
实验2
活动2【实验·探究】——亚铁盐的性质(以FeSO4为例)
FeSO4溶液
先KSCN溶液后氯水
实验4
Zn粉
1
FeSO4溶液
1.安全提示:药品不要沾到手上
2.分工合作:观察并记录现象
3.试剂用量:试剂取1-2ml KSCN溶液1-2滴
4.特别注意:向FeSO4溶液中滴加NaOH溶液时不要振荡试管
实验要求:
预测 角度 预测 性质 选取 试剂 预测 现象 实验 现 象 离子方程式
结论
盐的性质
NaOH溶液
产生白色沉淀
氧化性
还原性
锌粉
KMnO4(H+)
溶液浅绿色
褪去
紫色褪去
活动2【实验·探究】——亚铁盐的性质(以FeSO4为例)
先KSCN
再氯水
先不变色
后变红
物质类别
Fe2+
0价
+3价
溶液紫红色褪去
加KSCN无明显变化,加氯水变红色
溶液浅绿色褪去
白色沉淀
红褐色
灰绿色
迅速
最终
学以致用
请观察FeSO4溶液试剂瓶底部存在固体粉末,思考讨论该粉末可能是什么物质?为什么要加入该物质?请用方程式表示。
答案:铁粉; 防止Fe2+被氧化
2 Fe3++Fe =3Fe2+
1.方法收获
这种思想将引领我们对元素化合物的学习!
2.知识收获
学到了亚铁盐和铁盐的性质及其实际应用
自主话收获
单质 氧化物 碱 盐
+3
+2
0
物质类别
化合价
Fe3+
Fe2+
科学并不是真理,只是一种探索
知识并不是目的,只是一种构建
学习反思
祝同学们学业有成!
