鲁科版高中化学必修一 3.1铁的多样性 课件 (共25张PPT)
文档属性
| 名称 | 鲁科版高中化学必修一 3.1铁的多样性 课件 (共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-08 17:41:07 | ||
图片预览








文档简介
(共25张PPT)
第一节 铁的多样性
—亚铁盐和铁盐
山东科学技术出版社 化学1(必修) 第3章
学习目标
学习目标
1.聚焦铁元素,初步认识典型的含铁物质,建立以铁元素为核心的
物质家族(价类二维图),初步建立含铁物质与应用的关系,培养宏观辨识与微观探析的学科核心素养。
2.通过探究硫酸亚铁、氯化铁性质,掌握其性质以及典型的实验现象,能书写主要的化学方程式和离子方程式,培养科学探究与创新意识的学科核心素养。
3.通过探究铁盐和亚铁盐性质,建立研究物质性质的两个基本角度--物质类别和元素化合价,逐步提升证据推理和模型认知能力。
重点:探究亚铁盐和铁盐的性质。
难点:研究物质性质的一般思路和角度
日常生活中含有铁元素的物质
铁锅 粉刷墙壁的红色涂料(Fe2O3)
补铁剂
一、铁元素的存在
Fe3O4
陨铁(Fe)
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
黄铁矿(FeS2)
自然界中含有铁元素的矿石
实验室中含有铁元素的试剂
硫酸铁
氯化亚铁
氢氧化铁
对这些含铁物质,从物质类别和化合价的角度分析,构建”价--类”二维图
联想质疑
二、探究亚铁盐及铁盐的化学性质
实验目的:
以硫酸亚铁、氯化铁为例,通过实验探究亚铁盐、
铁盐的性质
预测性质
设计实验方案
总结结论
实验观察
研究物质性质的基本程序
探究 1 亚铁盐性质
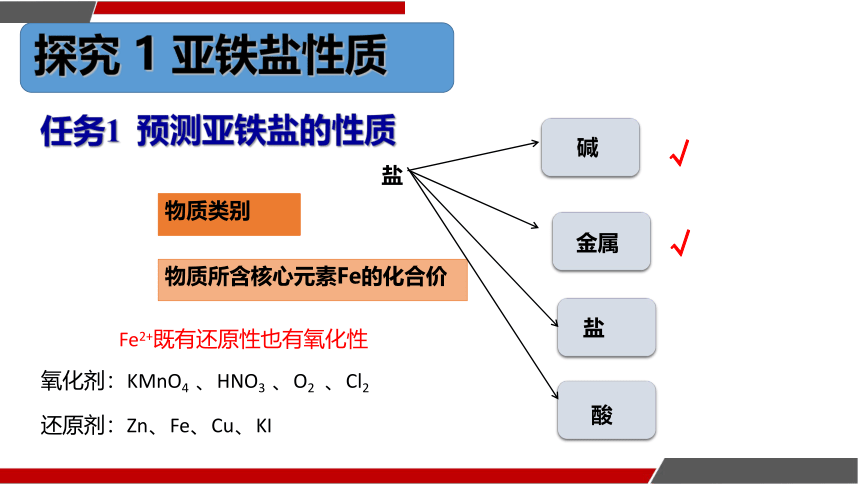
任务1 预测亚铁盐的性质
物质所含核心元素Fe的化合价
物质的类别
盐
碱
盐
金属
物质类别
酸
Fe2+既有还原性也有氧化性
氧化剂:KMnO4 、HNO3 、O2 、Cl2
还原剂:Zn、Fe、Cu、KI
√
√
任务2 设计实验方案
知识贴士:Fe3+和KSCN(硫氰酸钾)溶液发生反应,生成红色溶液。用于 Fe3+检验。
思考
1.说明选取试剂的思路
2.什么样的实验现象可以证明你的预测?
提供试剂:
FeSO4溶液、KMnO4溶液、
NaOH溶液、锌片、KSCN溶液、
氯水
探究 1 亚铁盐性质
汇报方案
探究 1 亚铁盐性质
验证硫酸亚铁与碱反应
试剂:氢氧化钠溶液
验证硫酸亚铁的氧化性
试剂:锌片
验证硫酸亚铁的还原性
试剂:氯水或高锰酸钾溶液
验证与金属反应:
试剂:锌片
任务3 进行实验,观察记录
物质 预测性质 选取试剂 现象及方程式
FeSO4溶液 类
与金属
价
NaOH溶液
与碱反应
还原性
氧化性
加入酸性
KMnO4溶液
加入氯水
加入足量锌粉
加入足量锌粉
物质 预测性质 选取试剂 现象及方程式
FeSO4溶液 类
与金属
价
NaOH溶液
与碱反应
还原性
氧化性
加入酸性
KMnO4溶液
加入氯水
加入足量锌粉
加入足量锌粉
白色沉淀迅速变为灰
绿色,最后变为红褐色
溶液由浅绿色变为黄色
2Fe2++Cl2= 2Fe3++2Cl-
溶液的紫红色褪去
溶液由浅绿色变为无色
Zn + Fe2+ == Zn2+ + Fe
溶液由浅绿色变为无色
Zn + Fe2+ == Zn2+ + Fe
任务4 分享交流 ,得出结论
预测
设计
实验
结论
加入氧化剂,使其化合价升高
加入还原剂,使其化合价降低
探究方法
探究物质具
有还原性
探究物质具有氧化性
设计
研究思路
两个角度
根据通性,分析可能的性质
化合价角度
物质类别
氧化性或还原性
预测
根据亚铁盐的探究过程,思考如何探究铁盐的化学性质?
预测性质
设计实验方案
总结结论
实验观察
探究 2 铁盐性质
任务1 预测铁盐的性质并设计实验方案
汇报方案
验证与碱反应:
试剂:氢氧化钠溶液
验证氯化铁的氧化性
试剂:铁粉、淀粉KI溶液
提供试剂:
氯化铁溶液、铁粉、
NaOH溶液、淀粉-KI溶液
预测:
从物质类别角度分析
从元素价态的角度分析
任务2 根据实验方案,进行实验
物质 预测 性质 选取试剂 现象
FeCl3 溶液 类
价 氧化性 加入足量铁粉
加入淀粉-KI溶液
与碱反应
加入NaOH溶液
物质 预测 性质 选取试剂 现象
FeCl3 溶液 类
价
红褐色沉淀
溶液最终变为蓝色
铁盐性质研究结论
溶液由黄色变为浅色
Fe + 2Fe3+ = 3Fe2+
2Fe3+ +2I- =2Fe2+ +I2
2Fe3+ +3OH-=Fe(OH)3↓
与碱反应
氧化性
加入足量铁粉
加入淀粉-KI溶液
加入NaOH溶液
总结提升
2.Fe3+性质
与碱反应
氧化性
1.Fe2+性质
与碱反应
还原性
氧化性
Zn + Fe2+ == Zn2+ + Fe
2Fe2++Cl2= 2Fe3++2Cl-
Fe2+ +2OH- =Fe(OH)2↓
Fe3+ +3OH- =Fe(OH)3↓
2Fe3+ +2I- =2Fe2+ +I2
Fe + 2Fe3+ = 3Fe2+
研究物质性质的基本思路
“价-类”二维图的作用
总结提升
学以致用
1.为什么切开的苹果过一段时间像生锈了一样?
柠檬中富含维生素C,维生素C具有还原性
2.硫酸亚铁溶液如何保存?
3.榨桃汁加柠檬的原因?
加入铁粉
苹果中的Fe2+被空气中的氧气氧化成了Fe3+
1.下列关于Fe2+和Fe3+的叙述中,错误的是( )
A.Fe2+的水溶液为浅绿色
B.Fe3+的水溶液为棕黄色
C.Fe3+具有氧化性,Fe2+具有还原性
D.Fe3+溶液中滴入含SCN-的溶液,立即
出现红色沉淀
D
牛刀小试
2.欲除去FeSO4溶液中含有的CuSO4和Fe2(SO4)3等少量杂质,应选用的试剂是( )
A.氨水 B.铝粉 C.铁粉 D.NaOH溶液
3.下列物质能将将Fe2+氧化为Fe3+的试剂且使单质铁由0价变为+3价的是( )
A氢气 B氯气 C浓盐酸D稀硫酸
C
B
4.向硫酸中加入铁粉,待铁粉全部溶解后,再加入酸性高锰酸钾溶液,高锰酸钾紫红色褪去的原因是( )
A Fe具有还原性
B FeSO4中Fe2+具有还原性
C KMnO4具有氧化性
D硫酸具有还原性
B
【本节小结】
一、铁元素的存在
二、亚铁盐和铁盐
1. Fe2+ :氧化性、还原性
2.Fe3+ :氧化性
第一节 铁的多样性
—亚铁盐和铁盐
山东科学技术出版社 化学1(必修) 第3章
学习目标
学习目标
1.聚焦铁元素,初步认识典型的含铁物质,建立以铁元素为核心的
物质家族(价类二维图),初步建立含铁物质与应用的关系,培养宏观辨识与微观探析的学科核心素养。
2.通过探究硫酸亚铁、氯化铁性质,掌握其性质以及典型的实验现象,能书写主要的化学方程式和离子方程式,培养科学探究与创新意识的学科核心素养。
3.通过探究铁盐和亚铁盐性质,建立研究物质性质的两个基本角度--物质类别和元素化合价,逐步提升证据推理和模型认知能力。
重点:探究亚铁盐和铁盐的性质。
难点:研究物质性质的一般思路和角度
日常生活中含有铁元素的物质
铁锅 粉刷墙壁的红色涂料(Fe2O3)
补铁剂
一、铁元素的存在
Fe3O4
陨铁(Fe)
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
黄铁矿(FeS2)
自然界中含有铁元素的矿石
实验室中含有铁元素的试剂
硫酸铁
氯化亚铁
氢氧化铁
对这些含铁物质,从物质类别和化合价的角度分析,构建”价--类”二维图
联想质疑
二、探究亚铁盐及铁盐的化学性质
实验目的:
以硫酸亚铁、氯化铁为例,通过实验探究亚铁盐、
铁盐的性质
预测性质
设计实验方案
总结结论
实验观察
研究物质性质的基本程序
探究 1 亚铁盐性质
任务1 预测亚铁盐的性质
物质所含核心元素Fe的化合价
物质的类别
盐
碱
盐
金属
物质类别
酸
Fe2+既有还原性也有氧化性
氧化剂:KMnO4 、HNO3 、O2 、Cl2
还原剂:Zn、Fe、Cu、KI
√
√
任务2 设计实验方案
知识贴士:Fe3+和KSCN(硫氰酸钾)溶液发生反应,生成红色溶液。用于 Fe3+检验。
思考
1.说明选取试剂的思路
2.什么样的实验现象可以证明你的预测?
提供试剂:
FeSO4溶液、KMnO4溶液、
NaOH溶液、锌片、KSCN溶液、
氯水
探究 1 亚铁盐性质
汇报方案
探究 1 亚铁盐性质
验证硫酸亚铁与碱反应
试剂:氢氧化钠溶液
验证硫酸亚铁的氧化性
试剂:锌片
验证硫酸亚铁的还原性
试剂:氯水或高锰酸钾溶液
验证与金属反应:
试剂:锌片
任务3 进行实验,观察记录
物质 预测性质 选取试剂 现象及方程式
FeSO4溶液 类
与金属
价
NaOH溶液
与碱反应
还原性
氧化性
加入酸性
KMnO4溶液
加入氯水
加入足量锌粉
加入足量锌粉
物质 预测性质 选取试剂 现象及方程式
FeSO4溶液 类
与金属
价
NaOH溶液
与碱反应
还原性
氧化性
加入酸性
KMnO4溶液
加入氯水
加入足量锌粉
加入足量锌粉
白色沉淀迅速变为灰
绿色,最后变为红褐色
溶液由浅绿色变为黄色
2Fe2++Cl2= 2Fe3++2Cl-
溶液的紫红色褪去
溶液由浅绿色变为无色
Zn + Fe2+ == Zn2+ + Fe
溶液由浅绿色变为无色
Zn + Fe2+ == Zn2+ + Fe
任务4 分享交流 ,得出结论
预测
设计
实验
结论
加入氧化剂,使其化合价升高
加入还原剂,使其化合价降低
探究方法
探究物质具
有还原性
探究物质具有氧化性
设计
研究思路
两个角度
根据通性,分析可能的性质
化合价角度
物质类别
氧化性或还原性
预测
根据亚铁盐的探究过程,思考如何探究铁盐的化学性质?
预测性质
设计实验方案
总结结论
实验观察
探究 2 铁盐性质
任务1 预测铁盐的性质并设计实验方案
汇报方案
验证与碱反应:
试剂:氢氧化钠溶液
验证氯化铁的氧化性
试剂:铁粉、淀粉KI溶液
提供试剂:
氯化铁溶液、铁粉、
NaOH溶液、淀粉-KI溶液
预测:
从物质类别角度分析
从元素价态的角度分析
任务2 根据实验方案,进行实验
物质 预测 性质 选取试剂 现象
FeCl3 溶液 类
价 氧化性 加入足量铁粉
加入淀粉-KI溶液
与碱反应
加入NaOH溶液
物质 预测 性质 选取试剂 现象
FeCl3 溶液 类
价
红褐色沉淀
溶液最终变为蓝色
铁盐性质研究结论
溶液由黄色变为浅色
Fe + 2Fe3+ = 3Fe2+
2Fe3+ +2I- =2Fe2+ +I2
2Fe3+ +3OH-=Fe(OH)3↓
与碱反应
氧化性
加入足量铁粉
加入淀粉-KI溶液
加入NaOH溶液
总结提升
2.Fe3+性质
与碱反应
氧化性
1.Fe2+性质
与碱反应
还原性
氧化性
Zn + Fe2+ == Zn2+ + Fe
2Fe2++Cl2= 2Fe3++2Cl-
Fe2+ +2OH- =Fe(OH)2↓
Fe3+ +3OH- =Fe(OH)3↓
2Fe3+ +2I- =2Fe2+ +I2
Fe + 2Fe3+ = 3Fe2+
研究物质性质的基本思路
“价-类”二维图的作用
总结提升
学以致用
1.为什么切开的苹果过一段时间像生锈了一样?
柠檬中富含维生素C,维生素C具有还原性
2.硫酸亚铁溶液如何保存?
3.榨桃汁加柠檬的原因?
加入铁粉
苹果中的Fe2+被空气中的氧气氧化成了Fe3+
1.下列关于Fe2+和Fe3+的叙述中,错误的是( )
A.Fe2+的水溶液为浅绿色
B.Fe3+的水溶液为棕黄色
C.Fe3+具有氧化性,Fe2+具有还原性
D.Fe3+溶液中滴入含SCN-的溶液,立即
出现红色沉淀
D
牛刀小试
2.欲除去FeSO4溶液中含有的CuSO4和Fe2(SO4)3等少量杂质,应选用的试剂是( )
A.氨水 B.铝粉 C.铁粉 D.NaOH溶液
3.下列物质能将将Fe2+氧化为Fe3+的试剂且使单质铁由0价变为+3价的是( )
A氢气 B氯气 C浓盐酸D稀硫酸
C
B
4.向硫酸中加入铁粉,待铁粉全部溶解后,再加入酸性高锰酸钾溶液,高锰酸钾紫红色褪去的原因是( )
A Fe具有还原性
B FeSO4中Fe2+具有还原性
C KMnO4具有氧化性
D硫酸具有还原性
B
【本节小结】
一、铁元素的存在
二、亚铁盐和铁盐
1. Fe2+ :氧化性、还原性
2.Fe3+ :氧化性
