化学人教版(2019)选择性必修1 3.4.1沉淀溶解平衡(共38张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.4.1沉淀溶解平衡(共38张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-07 21:41:08 | ||
图片预览










文档简介
(共38张PPT)
新
教
材
第四节 沉淀溶解平衡
第1课时 沉淀溶解平衡的基本概念
能继续溶解溶质的溶液叫不饱和溶液。
一定温度下,不能再溶解溶质的溶液叫饱和溶液。
[知识回顾]
1、什么叫饱和溶液?什么叫不饱和溶液?
①溶解性:
一种物质溶解在另一种物质中的能力。
2、什么是溶解性?什么是溶解度?
粗略地表示物质的溶解能力
:易溶、可溶、微溶、难溶等。
②固体物质的溶解度
定义:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。叫做这种物质在这种溶剂里的溶解度。
条件
标准
单位:克
符号:S
从量上精确地表示物质的溶解能力
[知识回顾]
(1)20℃时100克水里,溶解了36克NaCl达到饱和状态,
20℃时NaCl的溶解度是多少?
(2) 20℃时,KClO3在水里的溶解度是7.4g,这表示什么含义?
此时,溶液中溶质、溶剂、溶液的质量比是 。
S(NaCl)=36克
20℃时,100克水中最多溶解7.4 克KClO3
7.4 : 100 : 107.4
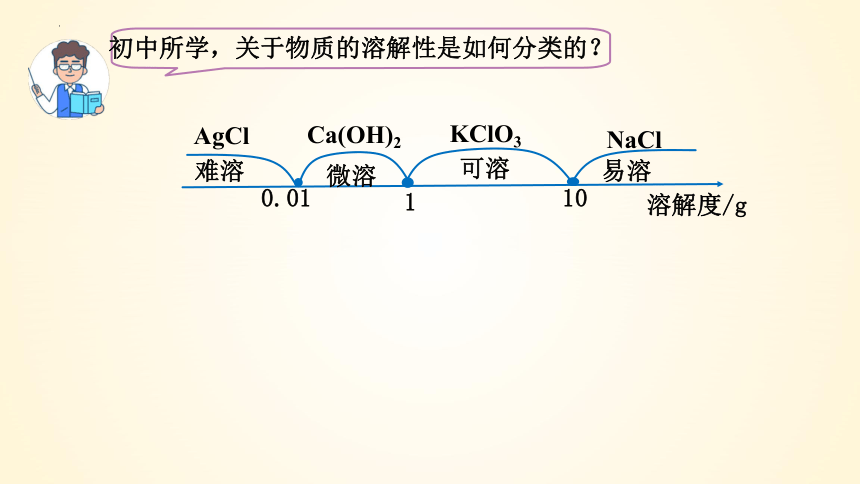
初中所学,关于物质的溶解性是如何分类的?
溶解度/g
难溶
微溶
可溶
易溶
0.01
1
10
AgCl
Ca(OH)2
KClO3
NaCl
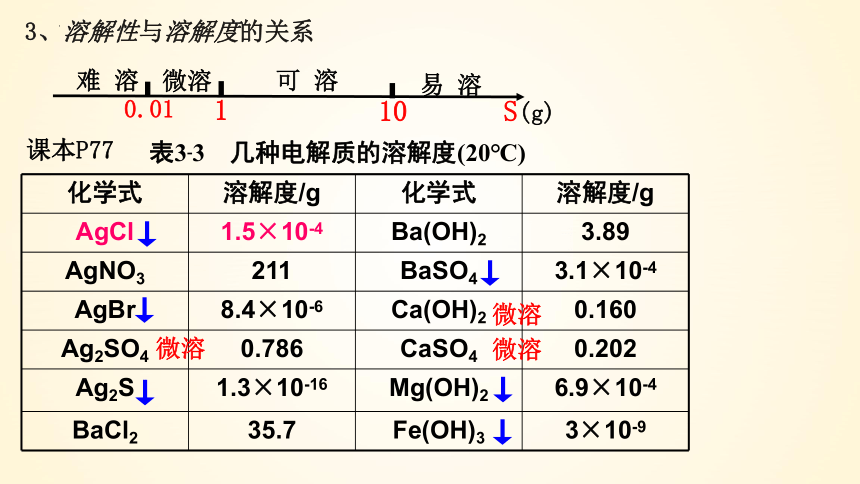
3、溶解性与溶解度的关系
0.01
S(g)
微溶
易 溶
可 溶
1
难 溶
10
课本P77
化学式 溶解度/g 化学式 溶解度/g
AgCl 1.5×10-4 Ba(OH)2 3.89
AgNO3 211 BaSO4 3.1×10-4
AgBr 8.4×10-6 Ca(OH)2 0.160
Ag2SO4 0.786 CaSO4 0.202
Ag2S 1.3×10-16 Mg(OH)2 6.9×10-4
BaCl2 35.7 Fe(OH)3 3×10-9
表3-3 几种电解质的溶解度(20℃)
微溶
微溶
微溶
↓
↓
↓
↓
↓
↓
如何理解溶解性表中说“溶”与“不溶”呢
OH- NO3- Cl- SO42- CO32-
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ca2+ 微 溶 溶 微 不
Ag+ — 溶 不 微 不
Fe3+ 不 溶 溶 溶 —
难溶物不溶于水吗?
德国化学家维特在1905年就提出:“从严格的科学意义上来说,不溶物是不存在的,即使最顽固抗水的物质也不是不溶的。
“溶”是绝对的,
“不溶”是相对的
1.要使NaCl饱和溶液中析出NaCl固体,可采取什么措施?
加热浓缩
降温
加入浓盐酸
思考与交流:
现象:
①在饱和NaCl溶液中加入浓盐酸
科学事实:
1.要使NaCl饱和溶液中析出NaCl固体,可采取什么措施?
加热浓缩
降温
加入浓盐酸
思考与交流:
现象:
①在饱和NaCl溶液中加入浓盐酸
科学事实:
②将一块形状不规则食盐晶体放入NaCl饱和溶液中,一昼夜后观察发现:不规则晶体变为规则的立方体,而质量却未发生改变。
以上事实说明了什么问题?
→在NaCl的饱和溶液中,存在溶解平衡
NaCl(s) Na+(aq)+ Cl-(aq)
→加浓盐酸,c(Cl-)增加,平衡向左移, NaCl(s)析出
析出大量白色沉淀。
NaCl 饱和溶液存在溶解平衡,那难溶的电解质在水中是否也存在溶解平衡呢?
沉淀是难溶物,但不是绝对不溶,只不过溶解度很小,难溶物在水中也存在溶解平衡
2.当AgNO3与NaCl恰好完全反应生成难溶AgCl时,溶液中是否含有Ag+和Cl-?Why
3.如何理解难溶电解质(如AgCl)在水中存在溶解平衡呢?
含有。
难溶电解质的溶解度尽管很小,但不会等于0
Ag+
Cl-
AgCl(s) Ag+(aq) + Cl-(aq)
AgCl(s)
如何表示?
溶解
沉淀
水分子
负电荷吸引
正电荷吸引
当v(溶解)=v(沉淀),得到饱和AgCl(aq),建立溶解平衡
思考与交流:
一. 沉淀溶解平衡
1、定义:
一定条件下,难溶电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态
-----也称为沉淀溶解平衡
注 意:达到溶解平衡状态时,沉淀为最大溶解量,形成电解质的饱和溶液。
V沉淀
V溶解
t
V溶解= V沉淀
0
沉淀溶解平衡
v
易溶电解质与难溶电解质只是溶解度不同,
其沉淀溶解平衡的建立过程并没有本质区别。
2、过程表示:
例如:AgCl(s) AgCl(aq)
练习:书写碘化银、氢氧化镁溶解平衡的表达式
AgI(s) I-(aq)+ Ag+(aq)
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
注意:沉淀溶解平衡与弱电解质电离方程式的区别
Ag+(aq) + Cl-(aq)
简写:
AgCl(s)
Ag+(aq) + Cl-(aq)
沉淀溶解平衡方程式中各物质要标明聚集状态 → “s” “aq”
逆
难溶物的溶解与沉淀是一个可逆反应
等
平衡时,溶液中各离子浓度保持不变
动
v溶解 = v沉淀 ≠ 0,是一个动态平衡
定
变
条件改变时,溶解平衡发生移动
一. 沉淀溶解平衡
3. 沉淀溶解平衡的特征
4、影响沉淀溶解平衡的因素:
a、绝对不溶的电解质是没有的。
b、同是难溶电解质,溶解度差别也很大。
c、易溶电解质做溶质时,只要是饱和溶液也可存在溶解平衡。
①内因:
②外因:
电解质本身的性质
a、浓度:
b、温度:
c、同离子效应:
遵循勒夏特列原理
加入相同离子,平衡向 的方向移动。
特例:
Ca(OH)2
加水,平衡向 方向移动。
溶解
升温,多数平衡向 方向移动。
溶解
生成沉淀
问题:在以前的学习中,我们会认为等物质的量的Cl-和Ag+会反应完全,那么通过今天的学习,你对该反应有新的认识吗?
认知提升:
1.有难溶电解质生成的离子反应不可能进行完全,
离子之间恰好完全反应是一种近似的认为。
残留在溶液中的离子浓度小于10-5mol/L时,认为反应完全,但溶液中还有相应的离子。
2. 生成沉淀的离子反应的限度
1、下列说法中正确的是( )
A、不溶于水的物质溶解度为0
B、绝对不溶解的物质是不存在的
C、某离子被沉淀完全是指该离子在溶液中的浓度为0
D、物质的溶解性为难溶,则该物质不溶于水
B
2、石灰乳中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),加入下列溶液,可使Ca(OH)2减少的是( )
A.Na2CO3溶液 B.AlCl3溶液
C.NaOH溶液 D.CaCl2溶液
AB
3、解释下列事实的原因:
①FeS不溶于水,但能溶于稀盐酸。
②用0.1mol/L硫酸洗涤BaSO4沉淀比用水洗涤造成BaSO4沉淀的损失量小。
P78页
1、定义:
二. 沉淀溶解平衡常数
3、表达式
平衡时:Ksp (AnBm)= cm(Mn+) · cn(Am-)
MmAn(s) mMn+(aq)+ nAm-(aq)
平衡时:Ksp(AgCl)=c(Ag+) · c(Cl-)
例:AgCl(s) Ag+(aq) + Cl-(aq)
练习:书写Ag2CrO4、Mg(OH)2及CaCO3的溶度积常数的表达式
——简称“溶度积”
沉淀溶解平衡中,各离子浓度幂的乘积称为
难溶电解质的溶度积常数
2、符号: Ksp
②升温,多数平衡向溶解方向移动,Ksp 。
增大
①对于同一难溶物质,Ksp只与温度有关
4、影响Ksp的因素:
难溶电解质本身的性质和温度
但Ca(OH)2相反。
P78页
二. 沉淀溶解平衡常数
常见难溶电解质的溶度积常数(25℃)
化学式 Ksp 化学式 Ksp
AgCl 1.8×10-10 CuS 6.3×10-36
AgBr 5.4×10-13 ZnS 1.6×10-24
AgI 8.5×10-17 PbS 8.0×10-28
Ag2S 6.3×10-50 FeS 6.3×10-18
Ag2SO4 1.2×10-5 HgS 1.6×10-52
溶解度(g)
1.5×10-4
8.4×10-6
2.1×10-7
问题:是不是Ksp越小的物质,其溶解度就越小呢?
5、溶度积Ksp的物理意义:
反映了难溶电解质在水溶液中的溶解能力.
否。
平衡浓度关系且与指数有关。
与物质质量有关
P122页
附录Ⅲ
但是:一定温度下,对同种类型的难溶电解质,Ksp越小,其溶解度(S)越小
说 明:
(1)一定温度下,对同种类型的难溶电解质,Ksp越小,其溶解度(S)越小;
(2)对于不同类型的难溶电解质,不能直接比较Ksp的大小来确定其溶解能力的大小,常转化为溶解度来计算。
化学式中阴阳离子个数比相同
:AB型、AB2型、A2B型等
如:Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI)
则溶解度:S (AgCl) > S (AgBr) > S (AgI)
& 离子积——Q c
任意时刻:
Qc> Ksp
Qc=Ksp
Qc< Ksp
Qc = cm(Mn+) · cn(Am-)
MmAn(s) mMn+(aq)+ nAm-(aq)
:溶液过饱和,有沉淀析出。
:溶液饱和,沉淀与溶解平衡。
:溶液未饱和,无沉淀析出,若加入过量难溶电解质,可以继续溶解直至饱和。
讨论:在AgCl饱和溶液中,尚有AgCl固体存在,当分别向溶液中加入下列物质,将如何变化?
改变条件 平衡移动方向 c(Ag+) c(Cl-) Ksp AgCl溶解度
升 温
加 水
加AgCl(s)
加NaCl(s)
加NaI(s)
加AgNO3(s)
↑
不移动
←
↓
←
AgCl(s) Ag+(aq) + Cl-(aq)
→
↑
不变
不变
不变
不变
不变
不变
不变
不变
不变
→
→
↑
↑
↑
↓
↓
↑
↑
不变
不变
↓
↓
↑
生成AgI↓
注意:溶液中各离子浓度的变化只能使沉淀溶解平衡移动,并不改变溶度积[∵Ksp只与温度有关],但物质溶解度(S)可能会发生改变。
1.难溶电解质在水中达到沉淀溶解平衡时,下列说法中错误的是
A.沉淀的速率和溶解的速率相等
B.难溶电解质在水中形成饱和溶液
C.再加入难溶电解质,溶液中各离子的浓度不变
D.难溶电解质溶解形成的阴、阳离子的浓度相等
D
2、下列说法正确的是( )
A.一定温度下的AgCl水溶液中,c(Ag+)·c(Cl-)是一个常数
B.AgCl的KSP=1.8×10-10,在任何含AgCl固体的溶液中
c(Ag+)=c(Cl-)且c(Ag+)·c(Cl-)=1.8×10-10
C.温度一定时,当溶液中c(Ag+)·c(Cl-)等于KSP值时,此溶液为AgCl的饱和溶液
D.向饱和AgCl水溶液中加入盐酸,KSP值变大
C
饱和
不变
3.在下列溶液中,BaSO4的溶解度最大的是 ;溶解度最小的是 .
A. 5ml 1mol/LH2SO4溶液 B.10ml 2mol/LH2SO4溶液
C. 30ml纯 水 D. 25ml 0.1mol/LNa2SO4溶液
C
B
E. 50mL 0.01mol/L BaCl2溶液
4.25℃,在含有大量PbI2的饱和溶液中存在平衡
PbI2(s) Pb2+(aq)+2I-(aq),加入KI溶液正确
A.溶液中Pb2+和I-浓度都增大
B.Ksp增大
C.沉淀溶解平衡向左移动
D.溶液中Pb2+浓度减小
C D
5.常温下,CaF2的Ksp=5.3×10-9,在c(F-)=3.0mol/L
的溶液中,Ca2+的最大浓度( )mol/L
A. 1.8×10-9 B. 1.8×10-10
C. 5.9×10-10 D. 5.9×10-9
C
Ca2+浓度最大,即CaF2此时达饱和状态,Qc=Ksp
6、不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量。下列说法正确的是
A.T1>T2
B.加入BaCl2固体,可使溶液由a点变到c点
C.c点时,在T1、T2两个温度下均没有固体析出
D.图中c点对应的是T1时硫酸钡的过饱和溶液
D
7. 硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
A.温度一定时,Ksp(SrSO4)随c(SO42-)增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最小
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温
到363K后变为不饱和溶液
C
总结:
⑴在温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线外的点
⑵溶液在蒸发时,离子浓度的变化分两种情况:
ⅰ.原溶液不饱和时,离子浓度要增大都增大;
ⅱ.原溶液饱和时,离子浓度都不变。
⑶溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同。
1.已知常温下,AgCl的Ksp=1.80×10-10,
将0.001mol/LNaCl和0.001mol/LAgNO3 溶液等体积混合,是否有AgCl沉淀生成.
Qc>Ksp,所以有AgCl 沉淀生成.
解:两溶液等体积混合后, Ag+ 和Cl-浓度都减小到原浓度的1/2.
c(Ag+)=c(Cl-)=1/2×0.001=0.0005(mol.L-1)
在混合溶液中
=(0.0005)2 = 2.5 ×10-7
>1.80 ×10-10
c(Ag+)·c(Cl-)
Qc =
产生沉淀的唯一条件是Qc﹥Ksp
热点精讲
解:设AgCl的溶解度为S(mol/L)
可见,AgCl在盐酸溶液中溶解度比在水中的小。
2.已知常温下,AgCl的Ksp=1.80×10-10,
把足量的AgCl放入1L 1 .0 mol/L的盐酸溶液中溶解度是多少?(单位:mol/L)
AgCl(s) Ag+(aq) + Cl-(aq)
S
(S+1)
饱和溶液:
1
Ksp=c(Ag+)·c(Cl-)
= S×1
=1.80×10-10
∴溶解度:S =1.80×10-10 mol/L
问 题:若要求溶解度的单位为 g/L,怎样计算?
×143.5g/mol
热点精讲
3、 1 mL 0.012 mol/L NaCl溶液与1 mL 0.010 mol/L AgNO3溶液充分反应后剩余Ag+的浓度为多少?(忽略溶液体积变化)
c(Cl-)剩余 =
1 mL×0.012 mol/L-1 — 1mL×0.010 mol/L
1 mL+1 mL
=
0.001 mol/L
c(Ag+) =
Ksp
c(Cl-)
=
1.8×10-7 mol/L
=
0.001
1.8×10-10
根据:
Ksp = c(Ag+)·c(Cl-) = 1.8×10-10
问题:是否沉淀完全?
一般情况,当溶液中剩余离子的浓度小于1×10-5 mol/L时,化学上通常认为生成沉淀的反应就进行完全了
热点精讲
热点精讲
4.溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时(c=0.01 mol·L-1)的pH 7.2 3.7 2.2 7.5
沉淀完全时(c=1.0×10-5 mol·L-1)的pH 8.7 4.7 3.2 9.0
利用上述表格数据,计算Ni(OH)2的Ksp=___________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L-1,则“调pH”应控制的pH范围是___________。
【答案】0.01×(107.2-14)2[或10-5×(108.7-14)2] 3.2~6.2
新
教
材
第四节 沉淀溶解平衡
第1课时 沉淀溶解平衡的基本概念
能继续溶解溶质的溶液叫不饱和溶液。
一定温度下,不能再溶解溶质的溶液叫饱和溶液。
[知识回顾]
1、什么叫饱和溶液?什么叫不饱和溶液?
①溶解性:
一种物质溶解在另一种物质中的能力。
2、什么是溶解性?什么是溶解度?
粗略地表示物质的溶解能力
:易溶、可溶、微溶、难溶等。
②固体物质的溶解度
定义:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。叫做这种物质在这种溶剂里的溶解度。
条件
标准
单位:克
符号:S
从量上精确地表示物质的溶解能力
[知识回顾]
(1)20℃时100克水里,溶解了36克NaCl达到饱和状态,
20℃时NaCl的溶解度是多少?
(2) 20℃时,KClO3在水里的溶解度是7.4g,这表示什么含义?
此时,溶液中溶质、溶剂、溶液的质量比是 。
S(NaCl)=36克
20℃时,100克水中最多溶解7.4 克KClO3
7.4 : 100 : 107.4
初中所学,关于物质的溶解性是如何分类的?
溶解度/g
难溶
微溶
可溶
易溶
0.01
1
10
AgCl
Ca(OH)2
KClO3
NaCl
3、溶解性与溶解度的关系
0.01
S(g)
微溶
易 溶
可 溶
1
难 溶
10
课本P77
化学式 溶解度/g 化学式 溶解度/g
AgCl 1.5×10-4 Ba(OH)2 3.89
AgNO3 211 BaSO4 3.1×10-4
AgBr 8.4×10-6 Ca(OH)2 0.160
Ag2SO4 0.786 CaSO4 0.202
Ag2S 1.3×10-16 Mg(OH)2 6.9×10-4
BaCl2 35.7 Fe(OH)3 3×10-9
表3-3 几种电解质的溶解度(20℃)
微溶
微溶
微溶
↓
↓
↓
↓
↓
↓
如何理解溶解性表中说“溶”与“不溶”呢
OH- NO3- Cl- SO42- CO32-
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ca2+ 微 溶 溶 微 不
Ag+ — 溶 不 微 不
Fe3+ 不 溶 溶 溶 —
难溶物不溶于水吗?
德国化学家维特在1905年就提出:“从严格的科学意义上来说,不溶物是不存在的,即使最顽固抗水的物质也不是不溶的。
“溶”是绝对的,
“不溶”是相对的
1.要使NaCl饱和溶液中析出NaCl固体,可采取什么措施?
加热浓缩
降温
加入浓盐酸
思考与交流:
现象:
①在饱和NaCl溶液中加入浓盐酸
科学事实:
1.要使NaCl饱和溶液中析出NaCl固体,可采取什么措施?
加热浓缩
降温
加入浓盐酸
思考与交流:
现象:
①在饱和NaCl溶液中加入浓盐酸
科学事实:
②将一块形状不规则食盐晶体放入NaCl饱和溶液中,一昼夜后观察发现:不规则晶体变为规则的立方体,而质量却未发生改变。
以上事实说明了什么问题?
→在NaCl的饱和溶液中,存在溶解平衡
NaCl(s) Na+(aq)+ Cl-(aq)
→加浓盐酸,c(Cl-)增加,平衡向左移, NaCl(s)析出
析出大量白色沉淀。
NaCl 饱和溶液存在溶解平衡,那难溶的电解质在水中是否也存在溶解平衡呢?
沉淀是难溶物,但不是绝对不溶,只不过溶解度很小,难溶物在水中也存在溶解平衡
2.当AgNO3与NaCl恰好完全反应生成难溶AgCl时,溶液中是否含有Ag+和Cl-?Why
3.如何理解难溶电解质(如AgCl)在水中存在溶解平衡呢?
含有。
难溶电解质的溶解度尽管很小,但不会等于0
Ag+
Cl-
AgCl(s) Ag+(aq) + Cl-(aq)
AgCl(s)
如何表示?
溶解
沉淀
水分子
负电荷吸引
正电荷吸引
当v(溶解)=v(沉淀),得到饱和AgCl(aq),建立溶解平衡
思考与交流:
一. 沉淀溶解平衡
1、定义:
一定条件下,难溶电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态
-----也称为沉淀溶解平衡
注 意:达到溶解平衡状态时,沉淀为最大溶解量,形成电解质的饱和溶液。
V沉淀
V溶解
t
V溶解= V沉淀
0
沉淀溶解平衡
v
易溶电解质与难溶电解质只是溶解度不同,
其沉淀溶解平衡的建立过程并没有本质区别。
2、过程表示:
例如:AgCl(s) AgCl(aq)
练习:书写碘化银、氢氧化镁溶解平衡的表达式
AgI(s) I-(aq)+ Ag+(aq)
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
注意:沉淀溶解平衡与弱电解质电离方程式的区别
Ag+(aq) + Cl-(aq)
简写:
AgCl(s)
Ag+(aq) + Cl-(aq)
沉淀溶解平衡方程式中各物质要标明聚集状态 → “s” “aq”
逆
难溶物的溶解与沉淀是一个可逆反应
等
平衡时,溶液中各离子浓度保持不变
动
v溶解 = v沉淀 ≠ 0,是一个动态平衡
定
变
条件改变时,溶解平衡发生移动
一. 沉淀溶解平衡
3. 沉淀溶解平衡的特征
4、影响沉淀溶解平衡的因素:
a、绝对不溶的电解质是没有的。
b、同是难溶电解质,溶解度差别也很大。
c、易溶电解质做溶质时,只要是饱和溶液也可存在溶解平衡。
①内因:
②外因:
电解质本身的性质
a、浓度:
b、温度:
c、同离子效应:
遵循勒夏特列原理
加入相同离子,平衡向 的方向移动。
特例:
Ca(OH)2
加水,平衡向 方向移动。
溶解
升温,多数平衡向 方向移动。
溶解
生成沉淀
问题:在以前的学习中,我们会认为等物质的量的Cl-和Ag+会反应完全,那么通过今天的学习,你对该反应有新的认识吗?
认知提升:
1.有难溶电解质生成的离子反应不可能进行完全,
离子之间恰好完全反应是一种近似的认为。
残留在溶液中的离子浓度小于10-5mol/L时,认为反应完全,但溶液中还有相应的离子。
2. 生成沉淀的离子反应的限度
1、下列说法中正确的是( )
A、不溶于水的物质溶解度为0
B、绝对不溶解的物质是不存在的
C、某离子被沉淀完全是指该离子在溶液中的浓度为0
D、物质的溶解性为难溶,则该物质不溶于水
B
2、石灰乳中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),加入下列溶液,可使Ca(OH)2减少的是( )
A.Na2CO3溶液 B.AlCl3溶液
C.NaOH溶液 D.CaCl2溶液
AB
3、解释下列事实的原因:
①FeS不溶于水,但能溶于稀盐酸。
②用0.1mol/L硫酸洗涤BaSO4沉淀比用水洗涤造成BaSO4沉淀的损失量小。
P78页
1、定义:
二. 沉淀溶解平衡常数
3、表达式
平衡时:Ksp (AnBm)= cm(Mn+) · cn(Am-)
MmAn(s) mMn+(aq)+ nAm-(aq)
平衡时:Ksp(AgCl)=c(Ag+) · c(Cl-)
例:AgCl(s) Ag+(aq) + Cl-(aq)
练习:书写Ag2CrO4、Mg(OH)2及CaCO3的溶度积常数的表达式
——简称“溶度积”
沉淀溶解平衡中,各离子浓度幂的乘积称为
难溶电解质的溶度积常数
2、符号: Ksp
②升温,多数平衡向溶解方向移动,Ksp 。
增大
①对于同一难溶物质,Ksp只与温度有关
4、影响Ksp的因素:
难溶电解质本身的性质和温度
但Ca(OH)2相反。
P78页
二. 沉淀溶解平衡常数
常见难溶电解质的溶度积常数(25℃)
化学式 Ksp 化学式 Ksp
AgCl 1.8×10-10 CuS 6.3×10-36
AgBr 5.4×10-13 ZnS 1.6×10-24
AgI 8.5×10-17 PbS 8.0×10-28
Ag2S 6.3×10-50 FeS 6.3×10-18
Ag2SO4 1.2×10-5 HgS 1.6×10-52
溶解度(g)
1.5×10-4
8.4×10-6
2.1×10-7
问题:是不是Ksp越小的物质,其溶解度就越小呢?
5、溶度积Ksp的物理意义:
反映了难溶电解质在水溶液中的溶解能力.
否。
平衡浓度关系且与指数有关。
与物质质量有关
P122页
附录Ⅲ
但是:一定温度下,对同种类型的难溶电解质,Ksp越小,其溶解度(S)越小
说 明:
(1)一定温度下,对同种类型的难溶电解质,Ksp越小,其溶解度(S)越小;
(2)对于不同类型的难溶电解质,不能直接比较Ksp的大小来确定其溶解能力的大小,常转化为溶解度来计算。
化学式中阴阳离子个数比相同
:AB型、AB2型、A2B型等
如:Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI)
则溶解度:S (AgCl) > S (AgBr) > S (AgI)
& 离子积——Q c
任意时刻:
Qc> Ksp
Qc=Ksp
Qc< Ksp
Qc = cm(Mn+) · cn(Am-)
MmAn(s) mMn+(aq)+ nAm-(aq)
:溶液过饱和,有沉淀析出。
:溶液饱和,沉淀与溶解平衡。
:溶液未饱和,无沉淀析出,若加入过量难溶电解质,可以继续溶解直至饱和。
讨论:在AgCl饱和溶液中,尚有AgCl固体存在,当分别向溶液中加入下列物质,将如何变化?
改变条件 平衡移动方向 c(Ag+) c(Cl-) Ksp AgCl溶解度
升 温
加 水
加AgCl(s)
加NaCl(s)
加NaI(s)
加AgNO3(s)
↑
不移动
←
↓
←
AgCl(s) Ag+(aq) + Cl-(aq)
→
↑
不变
不变
不变
不变
不变
不变
不变
不变
不变
→
→
↑
↑
↑
↓
↓
↑
↑
不变
不变
↓
↓
↑
生成AgI↓
注意:溶液中各离子浓度的变化只能使沉淀溶解平衡移动,并不改变溶度积[∵Ksp只与温度有关],但物质溶解度(S)可能会发生改变。
1.难溶电解质在水中达到沉淀溶解平衡时,下列说法中错误的是
A.沉淀的速率和溶解的速率相等
B.难溶电解质在水中形成饱和溶液
C.再加入难溶电解质,溶液中各离子的浓度不变
D.难溶电解质溶解形成的阴、阳离子的浓度相等
D
2、下列说法正确的是( )
A.一定温度下的AgCl水溶液中,c(Ag+)·c(Cl-)是一个常数
B.AgCl的KSP=1.8×10-10,在任何含AgCl固体的溶液中
c(Ag+)=c(Cl-)且c(Ag+)·c(Cl-)=1.8×10-10
C.温度一定时,当溶液中c(Ag+)·c(Cl-)等于KSP值时,此溶液为AgCl的饱和溶液
D.向饱和AgCl水溶液中加入盐酸,KSP值变大
C
饱和
不变
3.在下列溶液中,BaSO4的溶解度最大的是 ;溶解度最小的是 .
A. 5ml 1mol/LH2SO4溶液 B.10ml 2mol/LH2SO4溶液
C. 30ml纯 水 D. 25ml 0.1mol/LNa2SO4溶液
C
B
E. 50mL 0.01mol/L BaCl2溶液
4.25℃,在含有大量PbI2的饱和溶液中存在平衡
PbI2(s) Pb2+(aq)+2I-(aq),加入KI溶液正确
A.溶液中Pb2+和I-浓度都增大
B.Ksp增大
C.沉淀溶解平衡向左移动
D.溶液中Pb2+浓度减小
C D
5.常温下,CaF2的Ksp=5.3×10-9,在c(F-)=3.0mol/L
的溶液中,Ca2+的最大浓度( )mol/L
A. 1.8×10-9 B. 1.8×10-10
C. 5.9×10-10 D. 5.9×10-9
C
Ca2+浓度最大,即CaF2此时达饱和状态,Qc=Ksp
6、不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量。下列说法正确的是
A.T1>T2
B.加入BaCl2固体,可使溶液由a点变到c点
C.c点时,在T1、T2两个温度下均没有固体析出
D.图中c点对应的是T1时硫酸钡的过饱和溶液
D
7. 硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
A.温度一定时,Ksp(SrSO4)随c(SO42-)增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最小
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温
到363K后变为不饱和溶液
C
总结:
⑴在温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线外的点
⑵溶液在蒸发时,离子浓度的变化分两种情况:
ⅰ.原溶液不饱和时,离子浓度要增大都增大;
ⅱ.原溶液饱和时,离子浓度都不变。
⑶溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同。
1.已知常温下,AgCl的Ksp=1.80×10-10,
将0.001mol/LNaCl和0.001mol/LAgNO3 溶液等体积混合,是否有AgCl沉淀生成.
Qc>Ksp,所以有AgCl 沉淀生成.
解:两溶液等体积混合后, Ag+ 和Cl-浓度都减小到原浓度的1/2.
c(Ag+)=c(Cl-)=1/2×0.001=0.0005(mol.L-1)
在混合溶液中
=(0.0005)2 = 2.5 ×10-7
>1.80 ×10-10
c(Ag+)·c(Cl-)
Qc =
产生沉淀的唯一条件是Qc﹥Ksp
热点精讲
解:设AgCl的溶解度为S(mol/L)
可见,AgCl在盐酸溶液中溶解度比在水中的小。
2.已知常温下,AgCl的Ksp=1.80×10-10,
把足量的AgCl放入1L 1 .0 mol/L的盐酸溶液中溶解度是多少?(单位:mol/L)
AgCl(s) Ag+(aq) + Cl-(aq)
S
(S+1)
饱和溶液:
1
Ksp=c(Ag+)·c(Cl-)
= S×1
=1.80×10-10
∴溶解度:S =1.80×10-10 mol/L
问 题:若要求溶解度的单位为 g/L,怎样计算?
×143.5g/mol
热点精讲
3、 1 mL 0.012 mol/L NaCl溶液与1 mL 0.010 mol/L AgNO3溶液充分反应后剩余Ag+的浓度为多少?(忽略溶液体积变化)
c(Cl-)剩余 =
1 mL×0.012 mol/L-1 — 1mL×0.010 mol/L
1 mL+1 mL
=
0.001 mol/L
c(Ag+) =
Ksp
c(Cl-)
=
1.8×10-7 mol/L
=
0.001
1.8×10-10
根据:
Ksp = c(Ag+)·c(Cl-) = 1.8×10-10
问题:是否沉淀完全?
一般情况,当溶液中剩余离子的浓度小于1×10-5 mol/L时,化学上通常认为生成沉淀的反应就进行完全了
热点精讲
热点精讲
4.溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时(c=0.01 mol·L-1)的pH 7.2 3.7 2.2 7.5
沉淀完全时(c=1.0×10-5 mol·L-1)的pH 8.7 4.7 3.2 9.0
利用上述表格数据,计算Ni(OH)2的Ksp=___________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L-1,则“调pH”应控制的pH范围是___________。
【答案】0.01×(107.2-14)2[或10-5×(108.7-14)2] 3.2~6.2
