3.3.1盐类的水解 课件(共36张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.3.1盐类的水解 课件(共36张ppt)化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 63.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-07 23:31:21 | ||
图片预览











文档简介
(共36张PPT)
新
教
材
第一课时 盐类水解的概念
第三节 盐类的水解
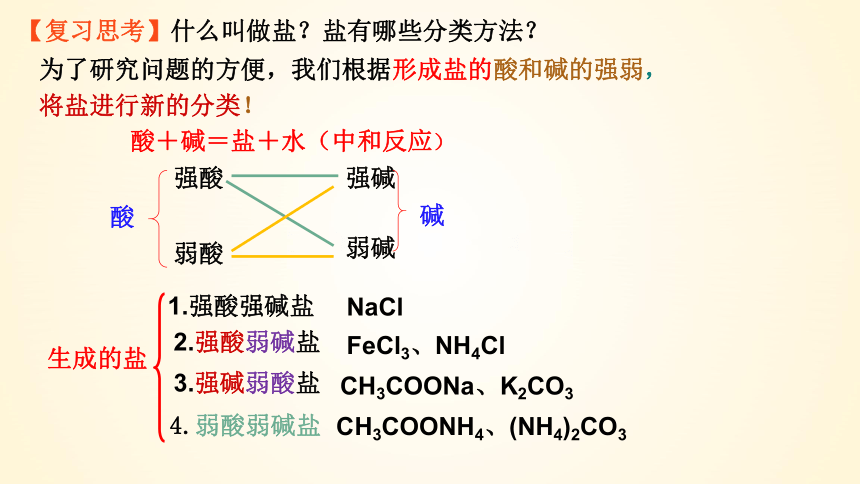
【复习思考】什么叫做盐?盐有哪些分类方法?
酸+碱=盐+水(中和反应)
酸
强酸
弱酸
弱碱
强碱
碱
生成的盐
1.强酸强碱盐
2.强酸弱碱盐
3.强碱弱酸盐
4.弱酸弱碱盐
NaCl
FeCl3、NH4Cl
CH3COONa、K2CO3
CH3COONH4、(NH4)2CO3
为了研究问题的方便,我们根据形成盐的酸和碱的强弱,将盐进行新的分类!
【问题】
到底是酸性还是碱性呢?
1.Na2CO3俗称“纯碱”,但它明明属于盐类,为什么叫它“纯碱”?
盐溶液的酸性、碱性是怎样形成的呢?
2.酸溶液呈酸性,碱溶液呈碱性,那么,盐溶解于水后所形成的溶液,是否一定呈中性?
【思考】常见的盐有NaCl、Na2CO3、NaHCO3等,用什么方法可以测得它们水溶液的酸碱性?
一 探究盐溶液的酸碱性
pH试纸
1.实验探究P69
盐溶液 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
PH
酸碱性
(1)用合适的方法测试下表所列盐溶液的酸碱性。
一 探究盐溶液的酸碱性
盐的类型
1.实验探究P69
盐溶液 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
PH
酸碱性
碱性
酸性
酸性
中性
中性
7.0
10.5
6.4
7.0
7.6
5.9
碱性
可见,盐溶液可以是中性、也可以是酸性或碱性。有什么规律吗?
盐的类型
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
分析实验结果,归纳盐溶液酸碱性与盐的类型间的关系
Na2CO3
CH3COONa
NH4Cl
(NH4)2SO4
(1)用合适的方法测试下表所列盐溶液的酸碱性。
一 探究盐溶液的酸碱性
2.归纳盐溶液酸碱性与盐的类型间的关系
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
溶液的酸碱性
碱性
酸性
中性
谁强显谁性
规律:
都强显中性
弱弱具体定
推测下列溶液的酸碱性:
Al2(SO4)3、FeCl3、Cu(NO3)2
KNO3、BaCl2、CaCl2
CH3COONH4
中性
NH4CN
碱性
(NH4)2SO3
酸性
Na2SO3、K2S
碱性
酸性
中性
前面实验所用的盐,既不会电离出H+,也不会电离出OH-,为什么也会显示出酸碱性?
附:交流问题如下:
(1)盐溶液中存在哪些微粒?
(2)哪些微粒间可能结合?
(3)溶液中c(H+)与c(OH-)的相对大小?
(4)相关的电离方程式、化学方程式?
二 探究盐溶液呈不同酸碱性的原因
以CH3COONa(aq)、NH4Cl(aq)、NaCl(aq)为例,
(不要忘记水及其电离)
思考与交流:
分析盐溶液呈不同酸碱性的原因
CH3COONa= Na++CH3COO-
H2O OH-+ H+
+
CH3COOH
所以:水的电离平衡发生移动,结果是:溶液中c(OH-)>c(H+)
从而使溶液呈碱性。
1、强碱弱酸盐
例如,CH3COONa(aq)
CH3COONa + H2O CH3COOH+NaOH
CH3COO- +H2O CH3COOH+OH-
化学方程式:
离子方程式 :
c(H+)水 =c(OH-)水
醋酸钠电离出的CH3COO-和水电离出的H+结合生成弱电解质醋酸。
反应的实质是:
二 探究盐溶液呈不同酸碱性的原因
例如,NH4Cl溶液
NH4Cl= NH4++Cl-
H2O OH- + H+
+
NH3·H2O
水的电离平衡右移,结果是:溶液中c(H+)>c(OH-)
从而使溶液呈酸性。
2、强酸弱碱盐
化学方程式:
离子方程式 :
NH4Cl + H2O NH3·H2O + HCl
NH4+ +H2O NH3·H2O + H+
氯化铵电离出的NH4+和水电离出的OH-结合生成弱电解质NH3·H2O 。
反应的实质是:
二 探究盐溶液呈不同酸碱性的原因
如,NaCl溶液:
NaCl= Cl- + Na+
H2O H++OH-
3、强酸强碱盐
Cl-、Na+对水的电离平衡无影响,溶液中始终有C(H+)=C(OH-)
所以溶液呈中性。
呈中性
[思考总结]盐电离出来的哪一类离子能使水的电离平衡发生移动?
弱酸阴离子
弱碱阳离子
CH3COO-
CO32-
HCO3-
SO32-
HSO3-
S2-
HPO42-
HS-
H2PO4-
PO43-
F-
ClO-
NH4+
Fe2+
Al3+
Fe3+
Cu2+
Mg2+
Ag+
化学上,将盐电离出的弱离子与水发生的反应叫做“盐类的水解”
2.水解的实质:
三、盐类的水解
1、定义:在水溶液中,盐所电离出来的弱离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
酸、碱抑制水的电离
对比
破坏了水的电离平衡, 促进了水的电离。
要有“弱离子”
3.水解的条件:
即:有弱才水解,无弱不水解。
弱酸或弱碱
P71
4.水解的特点:
⑵盐类水解是吸热反应:
⑶盐类水解一般很微弱
⑷ 存在着水解平衡(动态)
△H>0
(1)盐类水解是酸碱中和反应的逆反应:
酸+碱 盐+水
中和
水解
可逆、吸热、微弱、动态
酸碱中和反应进行程度很大,且是放热反应
5. 盐类水解的规律
无弱不水解,
有弱才水解,
越弱越水解,
谁强显谁性,
都强显中性,
弱弱具体定。
—条件
—结果
1.相同温度、相同物质的量浓度的四种溶液:①Na2CO3 ②NaHSO4③NaCl④NH4Cl,按pH值由大到小的顺序排列是: .
①>③>④>②
2.在下列各微粒中,能使水的电离平衡向电离的方向移动,且使溶液的pH>7的是( )
A. B. HCO3— C. HSO4— D.
B D
Al3+
F-
3.在常温下,纯水中存在电离平衡H2O H++OH—,如要使水的电离程度增大,并使c(H+)增大,应加入的物质是( )
A.NaHSO4 B.KAl(SO4)2 C.NaHCO3 D.CH3COONa
B
4.1mol·L-1NaHCO3溶液的pH最接近于 ( )
A.5.6 B.7.0 C.8.4 D.13.0
C
5.在下面列出的事实中,能证实甲酸(HCOOH)不是强酸的是 ( )
A.1 mo1/L的甲酸溶液的pH约为2.0
B.甲酸能跟Na2CO3溶液反应放出二氧化碳
C.甲酸能发生银镜反应
D.1 mo1/L甲酸钠溶液的pH约为9
A D
6.NH4Cl溶于重水后,产生的一水合氨和水合氢离子均正确的是( )
A.NH2D·H2O和D3O+ B.NH3·D2O和HD2O+
C.NH3·DHO和D3O+ D.NH2D·HDO和H2DO+
7.在氯化铵溶液中,下列关系式正确的是( )
A.c(Cl-) >c(NH4+) >c(H+) >c(OH-)
B.c(NH4+)>c(Cl-) >c(H+) >c(OH-)
C.c(NH4+)=c(Cl-) >c(H+) =c(OH-)
D.c(NH4+)=c(Cl-) >c(H+) >c(OH-)
C
A
1.室温下,pH=10的醋酸钠溶液中由水电离出的OH- 的浓度
2.室温下,pH=4的氯化铵溶液中由水电离出的H+的浓度
分析计算
NH4+ +H2O NH3·H2O + H+
CH3COO- +H2O CH3COOH+OH-
c(OH-)水= c(OH-)溶液
c(H+)水 = c(H+)溶液
= 1×10-4mol/L
=1×10-4mol/L
可见,
可见,
结论:盐类的水解促进了水的电离
> 1×10-7mol/L
> 1×10-7mol/L
问题:水电离出的H+以什么微粒形式存在?
H+、CH3COOH
问题:水电离出的OH-以什么微粒形式存在?
OH-、NH3·H2O
2.常温下,pH=6盐酸和NH4Cl溶液,其中水电离出的c(H+)值分别是xmol/L、ymol/L。两者关系是 ( )
A.相等 B.x>y C.x=10-2y D.x=102y
C
1.常温下,一定浓度的某溶液中由水电离出的c(OH-)为1.0×10—5 mo1/L,则该溶液中的溶质可能是( )
A.Al2(SO4)3 B.CH3COONa C.NaOH D.KHSO4
A B
水的电离被促进
pH=5
pH=9
3.常温下,pH=3的H2SO4和Al2(SO4)3溶液中,水电离出来的c(H+)之比为__ __.
10-11:10-3
三、盐类水解离子方程式的书写规则
⒉当水解反应生成气体或沉淀时,需要标“↓”“↑”符号?
4.K2CO3溶液中CO32-分步水解,还是一步到位生成H2CO3。
5.AlCl3溶液中,Al3+分步水解,还是一步到位生成Al(OH)3 。
6.难溶盐如BaCO3在水中要不要考虑CO32-水解。
3.当水解产物为H2CO3时,要写成CO2+H2O吗?
生成NH3·H2O时,要写成NH3 + H2O 。
思考与交流
不需要
不把易分解的产物(如H2CO3、NH3·H2O等)写成分解的形式。
分步水解
分步水解,但写成一步
不要
⒉盐类水解是微弱的,水解产物很少,通常不标“↓”“↑”符号,
也不把易分解的产物(如H2CO3、NH3·H2O等)写成分解的形式。
3.多元弱酸的盐分步水解,但以第一步水解为主。
例:K2CO3的水解
CO32- + H2O HCO3- +OH-
HCO3- + H2O H2CO3 +OH-
第一步
第二步
主要
次要
4.多元弱碱阳离子的水解是分步进行的(过程复杂),常写作一步水解。
5.难溶盐不考虑水解。
例:FeCl3的水解
Fe3+ + 3H2O Fe(OH)3 + 3H+
以第一步为主,不可合并
三、盐类水解离子方程式的书写规则
基本形式:
弱酸阴离子 + H2O 弱酸 + OH-
弱碱阳离子 + H2O 弱碱 + H+
阳离子水解生成H+ ,阴离子水解生成OH-。
谁弱写谁,都弱都写。
关 键: 找“弱”离子
Ⅰ.书写规则
三、盐类水解离子方程式的书写规则
⑴强酸弱碱盐水解
如:NH4Cl、CuSO4、AlCl3
NH4+ + H2O NH3·H2O + H+
Cu2+ + 2H2O Cu(OH)2 + 2H+
Al 3+ + 3H2O Al(OH)3 + 3H+
NH4Cl + H2O NH3·H2O + HCl
CuSO4 + 2H2O Cu(OH)2 + H2SO4
Al Cl3 + 3H2O Al(OH)3 + 3HCl
Ⅱ. 类型
NH4Cl
CuSO4
AlCl3
⑵ 强碱一元弱酸盐
如:CH3COONa、NaClO
CH3COONa + H2O CH3COOH + NaOH
CH3COO– + H2O CH3COOH + OH–
NaClO + H2O HClO + NaOH
ClO– + H2O HClO + OH–
⑶强碱多元弱酸盐
如:Na2CO3、 Na3PO4
HCO3 – + H2O H2CO3 + OH –
CO3 2– + H2O HCO3 – + OH –
(主)
(次)
Na2CO3溶液中含有哪些微粒?
5种离子,2种分子。
①PO43-+ H2O HPO42- + OH -
②HPO42-+ H2O H2PO4- + OH -
③ H2PO4- + H2O H3PO4 + OH -
K3PO4溶液中粒子浓度大小为:
K+﹥PO43- ﹥OH -﹥HPO42- ﹥H2PO4-﹥H3PO4﹥H+
写出K3PO4水解离子方程式;
分析其溶液中含有哪些微粒?并比较其微粒浓度大小
⑷ 弱酸弱碱盐水解
(比较复杂)
①有些弱酸弱碱盐阴、阳离子都水解,且相互促进,但程度不大。
仍用“ ”连接
如: CH3COONH4、NH4F、(NH4)2CO3
CH3COONH4+ H2O NH3·H2O+ CH3COOH
CH3COO- + NH4+ + H2O NH3·H2O + CH3COOH
NH4+ + F- + H2O NH3 · H2O + HF
称为“双水解”
②有些弱酸弱碱盐阴、阳离子都水解,相互促进,且水解程度较大。
⑷ 弱酸弱碱盐水解
(比较复杂)
称为“双水解”
注意:“双水解”要用“ =”、“↑”、“↓”。
②有些弱酸弱碱盐阴、阳离子都水解,相互促进,且水解程度较大。
如:书写Al2S3的水解方程式
Al2S3 + 6H2O 2Al(OH)3 + 3H2S
2Al3+ + 3S2- + 6H2O = 2Al(OH)3 + 3H2S
所以,Al2S3在水溶液中不存在
⑷ 弱酸弱碱盐水解
(比较复杂)
①Al3+ :
常见“双水解”的组合:
与AlO2–、HCO3–、CO32–、S2–、HS– 、HSO3–、SO32–、ClO-等
②Fe3+ :
④NH4+与SiO32-
Fe3+与S2–、HS– 、HSO3–、SO32–发生氧化还原反应,则不考虑水解
③AlO2-与所有的弱碱阳离子
NH4+
Fe2+
Al3+
Fe3+
Cu2+
Mg2+
Ag+
与AlO2-、 HCO3–、CO32–、ClO-等
2NH4+ + SiO32- = 2 NH3 ↑ + H2SiO3↓
⑷ 弱酸弱碱盐水解
(比较复杂)
当两种离子发生双水解时,往往不能大量共存
练1:下列各组离子中,能大量共存的是( )
A.Ag+、NO3-、Cl-、K+
B.Al3+、Cl-、HCO3-、Na+
C.Fe2+、NO3-、SO42-、H+
D.Fe3+、Na+、Cl-、HSO3-
E.Ca2+、HCO3—、C1—、K+
F.Al3+、A1O2—、HCO3—、Na+
G.Fe3+、SCN—、Na+、CO32—
E
Al 3+ + 3HCO3– Al(OH)3 + 3CO2
如:
产生沉淀
发生双水解
发生氧化还原反应
发生氧化还原反应
发生双水解
发生络合反应和双水解
发生化学反应
练习2:判断下列盐溶液的酸碱性,若能水解的,
写出水解反应的离子方程式:
①(NH4)2SO4
②Cu(NO3)2
③Na2S
④NaClO
⑤BaCl2
⑥K2SO3
⑦KAl(SO4)2
⑧KF
ClO-+H2O HClO+OH-
Cu2++2H2O Cu(OH)2+2H+
Al3++3H2O Al(OH)3 + 3H+
SO32- + H2O HSO3- + OH-
HSO3- + H2O H2SO3 + OH-
S2- + H2O HS- + OH-
HS- + H2O H2S+ OH-
NH4+ +H2O NH3·H2O + H+
酸性
酸性
酸性
碱性
碱性
碱性
碱性
中性
F-+H2O HF+OH-
注意:①多元弱酸根分步水解;
②水解程度是微弱的,不写 、 等
练3:下列各变化的表达式中,属于水解反应且正确的是( )
5.H2O + H2O == H3O+ + OH—
Fe(OH)3↓+3H+
2.Fe3++3H2O
H2CO3+OH-
1.CO32-+H2O
3.CH3COO-+H2O
CH3COOH+OH—
4.CH3COOH+H2O
CH3COO —+ H3O+
H2CO3+OH-
6.HCO3-+H2O
CO32-+H3O+
7.HCO3-+H2O
CO32-+H2O
8.HCO3-+ OH-
9.H2PO4- +H2O H3PO4 + OH-
×
√
×
×
×
×
√
√
分步水解
醋酸分子的电离
水分子的电离
HCO3-的电离
HCO3-与强碱的反应离子方程式
10.HPO42-+H2O H2PO4-+OH-
√
HPO42-水解的第一步
注意:①电离以水为载体;
②水解反应中,水是反应物之一。
练习4:写出下列离子组在水溶液中相遇时的离子反应方程式:(1)Fe3+与CO32- (2)Al3+与AlO2-
(3)Fe3+与HCO3- (4) NH4+与AlO2-
(5)Al3+与S2-
(1)2Fe3+ + 3CO32- + 3H2O = 2Fe(OH)3↓+ 3CO2↑
(2)Al3+ + 3AlO2- + 6H2O = 4Al(OH)3 ↓
(3)Fe3+ + 3HCO3- = Fe(OH)3↓ + 3CO2↑
(4) NH4+ + AlO2- + H2O = NH3↑ + Al(OH)3 ↓
(5)2Al3+ + 3S2- + 6H2O = 2Al(OH)3 ↓+ 3H2S ↑
答 案:
注意:“双水解”要用“ =”、“↑”、“↓”。
新
教
材
第一课时 盐类水解的概念
第三节 盐类的水解
【复习思考】什么叫做盐?盐有哪些分类方法?
酸+碱=盐+水(中和反应)
酸
强酸
弱酸
弱碱
强碱
碱
生成的盐
1.强酸强碱盐
2.强酸弱碱盐
3.强碱弱酸盐
4.弱酸弱碱盐
NaCl
FeCl3、NH4Cl
CH3COONa、K2CO3
CH3COONH4、(NH4)2CO3
为了研究问题的方便,我们根据形成盐的酸和碱的强弱,将盐进行新的分类!
【问题】
到底是酸性还是碱性呢?
1.Na2CO3俗称“纯碱”,但它明明属于盐类,为什么叫它“纯碱”?
盐溶液的酸性、碱性是怎样形成的呢?
2.酸溶液呈酸性,碱溶液呈碱性,那么,盐溶解于水后所形成的溶液,是否一定呈中性?
【思考】常见的盐有NaCl、Na2CO3、NaHCO3等,用什么方法可以测得它们水溶液的酸碱性?
一 探究盐溶液的酸碱性
pH试纸
1.实验探究P69
盐溶液 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
PH
酸碱性
(1)用合适的方法测试下表所列盐溶液的酸碱性。
一 探究盐溶液的酸碱性
盐的类型
1.实验探究P69
盐溶液 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
PH
酸碱性
碱性
酸性
酸性
中性
中性
7.0
10.5
6.4
7.0
7.6
5.9
碱性
可见,盐溶液可以是中性、也可以是酸性或碱性。有什么规律吗?
盐的类型
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
分析实验结果,归纳盐溶液酸碱性与盐的类型间的关系
Na2CO3
CH3COONa
NH4Cl
(NH4)2SO4
(1)用合适的方法测试下表所列盐溶液的酸碱性。
一 探究盐溶液的酸碱性
2.归纳盐溶液酸碱性与盐的类型间的关系
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
溶液的酸碱性
碱性
酸性
中性
谁强显谁性
规律:
都强显中性
弱弱具体定
推测下列溶液的酸碱性:
Al2(SO4)3、FeCl3、Cu(NO3)2
KNO3、BaCl2、CaCl2
CH3COONH4
中性
NH4CN
碱性
(NH4)2SO3
酸性
Na2SO3、K2S
碱性
酸性
中性
前面实验所用的盐,既不会电离出H+,也不会电离出OH-,为什么也会显示出酸碱性?
附:交流问题如下:
(1)盐溶液中存在哪些微粒?
(2)哪些微粒间可能结合?
(3)溶液中c(H+)与c(OH-)的相对大小?
(4)相关的电离方程式、化学方程式?
二 探究盐溶液呈不同酸碱性的原因
以CH3COONa(aq)、NH4Cl(aq)、NaCl(aq)为例,
(不要忘记水及其电离)
思考与交流:
分析盐溶液呈不同酸碱性的原因
CH3COONa= Na++CH3COO-
H2O OH-+ H+
+
CH3COOH
所以:水的电离平衡发生移动,结果是:溶液中c(OH-)>c(H+)
从而使溶液呈碱性。
1、强碱弱酸盐
例如,CH3COONa(aq)
CH3COONa + H2O CH3COOH+NaOH
CH3COO- +H2O CH3COOH+OH-
化学方程式:
离子方程式 :
c(H+)水 =c(OH-)水
醋酸钠电离出的CH3COO-和水电离出的H+结合生成弱电解质醋酸。
反应的实质是:
二 探究盐溶液呈不同酸碱性的原因
例如,NH4Cl溶液
NH4Cl= NH4++Cl-
H2O OH- + H+
+
NH3·H2O
水的电离平衡右移,结果是:溶液中c(H+)>c(OH-)
从而使溶液呈酸性。
2、强酸弱碱盐
化学方程式:
离子方程式 :
NH4Cl + H2O NH3·H2O + HCl
NH4+ +H2O NH3·H2O + H+
氯化铵电离出的NH4+和水电离出的OH-结合生成弱电解质NH3·H2O 。
反应的实质是:
二 探究盐溶液呈不同酸碱性的原因
如,NaCl溶液:
NaCl= Cl- + Na+
H2O H++OH-
3、强酸强碱盐
Cl-、Na+对水的电离平衡无影响,溶液中始终有C(H+)=C(OH-)
所以溶液呈中性。
呈中性
[思考总结]盐电离出来的哪一类离子能使水的电离平衡发生移动?
弱酸阴离子
弱碱阳离子
CH3COO-
CO32-
HCO3-
SO32-
HSO3-
S2-
HPO42-
HS-
H2PO4-
PO43-
F-
ClO-
NH4+
Fe2+
Al3+
Fe3+
Cu2+
Mg2+
Ag+
化学上,将盐电离出的弱离子与水发生的反应叫做“盐类的水解”
2.水解的实质:
三、盐类的水解
1、定义:在水溶液中,盐所电离出来的弱离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
酸、碱抑制水的电离
对比
破坏了水的电离平衡, 促进了水的电离。
要有“弱离子”
3.水解的条件:
即:有弱才水解,无弱不水解。
弱酸或弱碱
P71
4.水解的特点:
⑵盐类水解是吸热反应:
⑶盐类水解一般很微弱
⑷ 存在着水解平衡(动态)
△H>0
(1)盐类水解是酸碱中和反应的逆反应:
酸+碱 盐+水
中和
水解
可逆、吸热、微弱、动态
酸碱中和反应进行程度很大,且是放热反应
5. 盐类水解的规律
无弱不水解,
有弱才水解,
越弱越水解,
谁强显谁性,
都强显中性,
弱弱具体定。
—条件
—结果
1.相同温度、相同物质的量浓度的四种溶液:①Na2CO3 ②NaHSO4③NaCl④NH4Cl,按pH值由大到小的顺序排列是: .
①>③>④>②
2.在下列各微粒中,能使水的电离平衡向电离的方向移动,且使溶液的pH>7的是( )
A. B. HCO3— C. HSO4— D.
B D
Al3+
F-
3.在常温下,纯水中存在电离平衡H2O H++OH—,如要使水的电离程度增大,并使c(H+)增大,应加入的物质是( )
A.NaHSO4 B.KAl(SO4)2 C.NaHCO3 D.CH3COONa
B
4.1mol·L-1NaHCO3溶液的pH最接近于 ( )
A.5.6 B.7.0 C.8.4 D.13.0
C
5.在下面列出的事实中,能证实甲酸(HCOOH)不是强酸的是 ( )
A.1 mo1/L的甲酸溶液的pH约为2.0
B.甲酸能跟Na2CO3溶液反应放出二氧化碳
C.甲酸能发生银镜反应
D.1 mo1/L甲酸钠溶液的pH约为9
A D
6.NH4Cl溶于重水后,产生的一水合氨和水合氢离子均正确的是( )
A.NH2D·H2O和D3O+ B.NH3·D2O和HD2O+
C.NH3·DHO和D3O+ D.NH2D·HDO和H2DO+
7.在氯化铵溶液中,下列关系式正确的是( )
A.c(Cl-) >c(NH4+) >c(H+) >c(OH-)
B.c(NH4+)>c(Cl-) >c(H+) >c(OH-)
C.c(NH4+)=c(Cl-) >c(H+) =c(OH-)
D.c(NH4+)=c(Cl-) >c(H+) >c(OH-)
C
A
1.室温下,pH=10的醋酸钠溶液中由水电离出的OH- 的浓度
2.室温下,pH=4的氯化铵溶液中由水电离出的H+的浓度
分析计算
NH4+ +H2O NH3·H2O + H+
CH3COO- +H2O CH3COOH+OH-
c(OH-)水= c(OH-)溶液
c(H+)水 = c(H+)溶液
= 1×10-4mol/L
=1×10-4mol/L
可见,
可见,
结论:盐类的水解促进了水的电离
> 1×10-7mol/L
> 1×10-7mol/L
问题:水电离出的H+以什么微粒形式存在?
H+、CH3COOH
问题:水电离出的OH-以什么微粒形式存在?
OH-、NH3·H2O
2.常温下,pH=6盐酸和NH4Cl溶液,其中水电离出的c(H+)值分别是xmol/L、ymol/L。两者关系是 ( )
A.相等 B.x>y C.x=10-2y D.x=102y
C
1.常温下,一定浓度的某溶液中由水电离出的c(OH-)为1.0×10—5 mo1/L,则该溶液中的溶质可能是( )
A.Al2(SO4)3 B.CH3COONa C.NaOH D.KHSO4
A B
水的电离被促进
pH=5
pH=9
3.常温下,pH=3的H2SO4和Al2(SO4)3溶液中,水电离出来的c(H+)之比为__ __.
10-11:10-3
三、盐类水解离子方程式的书写规则
⒉当水解反应生成气体或沉淀时,需要标“↓”“↑”符号?
4.K2CO3溶液中CO32-分步水解,还是一步到位生成H2CO3。
5.AlCl3溶液中,Al3+分步水解,还是一步到位生成Al(OH)3 。
6.难溶盐如BaCO3在水中要不要考虑CO32-水解。
3.当水解产物为H2CO3时,要写成CO2+H2O吗?
生成NH3·H2O时,要写成NH3 + H2O 。
思考与交流
不需要
不把易分解的产物(如H2CO3、NH3·H2O等)写成分解的形式。
分步水解
分步水解,但写成一步
不要
⒉盐类水解是微弱的,水解产物很少,通常不标“↓”“↑”符号,
也不把易分解的产物(如H2CO3、NH3·H2O等)写成分解的形式。
3.多元弱酸的盐分步水解,但以第一步水解为主。
例:K2CO3的水解
CO32- + H2O HCO3- +OH-
HCO3- + H2O H2CO3 +OH-
第一步
第二步
主要
次要
4.多元弱碱阳离子的水解是分步进行的(过程复杂),常写作一步水解。
5.难溶盐不考虑水解。
例:FeCl3的水解
Fe3+ + 3H2O Fe(OH)3 + 3H+
以第一步为主,不可合并
三、盐类水解离子方程式的书写规则
基本形式:
弱酸阴离子 + H2O 弱酸 + OH-
弱碱阳离子 + H2O 弱碱 + H+
阳离子水解生成H+ ,阴离子水解生成OH-。
谁弱写谁,都弱都写。
关 键: 找“弱”离子
Ⅰ.书写规则
三、盐类水解离子方程式的书写规则
⑴强酸弱碱盐水解
如:NH4Cl、CuSO4、AlCl3
NH4+ + H2O NH3·H2O + H+
Cu2+ + 2H2O Cu(OH)2 + 2H+
Al 3+ + 3H2O Al(OH)3 + 3H+
NH4Cl + H2O NH3·H2O + HCl
CuSO4 + 2H2O Cu(OH)2 + H2SO4
Al Cl3 + 3H2O Al(OH)3 + 3HCl
Ⅱ. 类型
NH4Cl
CuSO4
AlCl3
⑵ 强碱一元弱酸盐
如:CH3COONa、NaClO
CH3COONa + H2O CH3COOH + NaOH
CH3COO– + H2O CH3COOH + OH–
NaClO + H2O HClO + NaOH
ClO– + H2O HClO + OH–
⑶强碱多元弱酸盐
如:Na2CO3、 Na3PO4
HCO3 – + H2O H2CO3 + OH –
CO3 2– + H2O HCO3 – + OH –
(主)
(次)
Na2CO3溶液中含有哪些微粒?
5种离子,2种分子。
①PO43-+ H2O HPO42- + OH -
②HPO42-+ H2O H2PO4- + OH -
③ H2PO4- + H2O H3PO4 + OH -
K3PO4溶液中粒子浓度大小为:
K+﹥PO43- ﹥OH -﹥HPO42- ﹥H2PO4-﹥H3PO4﹥H+
写出K3PO4水解离子方程式;
分析其溶液中含有哪些微粒?并比较其微粒浓度大小
⑷ 弱酸弱碱盐水解
(比较复杂)
①有些弱酸弱碱盐阴、阳离子都水解,且相互促进,但程度不大。
仍用“ ”连接
如: CH3COONH4、NH4F、(NH4)2CO3
CH3COONH4+ H2O NH3·H2O+ CH3COOH
CH3COO- + NH4+ + H2O NH3·H2O + CH3COOH
NH4+ + F- + H2O NH3 · H2O + HF
称为“双水解”
②有些弱酸弱碱盐阴、阳离子都水解,相互促进,且水解程度较大。
⑷ 弱酸弱碱盐水解
(比较复杂)
称为“双水解”
注意:“双水解”要用“ =”、“↑”、“↓”。
②有些弱酸弱碱盐阴、阳离子都水解,相互促进,且水解程度较大。
如:书写Al2S3的水解方程式
Al2S3 + 6H2O 2Al(OH)3 + 3H2S
2Al3+ + 3S2- + 6H2O = 2Al(OH)3 + 3H2S
所以,Al2S3在水溶液中不存在
⑷ 弱酸弱碱盐水解
(比较复杂)
①Al3+ :
常见“双水解”的组合:
与AlO2–、HCO3–、CO32–、S2–、HS– 、HSO3–、SO32–、ClO-等
②Fe3+ :
④NH4+与SiO32-
Fe3+与S2–、HS– 、HSO3–、SO32–发生氧化还原反应,则不考虑水解
③AlO2-与所有的弱碱阳离子
NH4+
Fe2+
Al3+
Fe3+
Cu2+
Mg2+
Ag+
与AlO2-、 HCO3–、CO32–、ClO-等
2NH4+ + SiO32- = 2 NH3 ↑ + H2SiO3↓
⑷ 弱酸弱碱盐水解
(比较复杂)
当两种离子发生双水解时,往往不能大量共存
练1:下列各组离子中,能大量共存的是( )
A.Ag+、NO3-、Cl-、K+
B.Al3+、Cl-、HCO3-、Na+
C.Fe2+、NO3-、SO42-、H+
D.Fe3+、Na+、Cl-、HSO3-
E.Ca2+、HCO3—、C1—、K+
F.Al3+、A1O2—、HCO3—、Na+
G.Fe3+、SCN—、Na+、CO32—
E
Al 3+ + 3HCO3– Al(OH)3 + 3CO2
如:
产生沉淀
发生双水解
发生氧化还原反应
发生氧化还原反应
发生双水解
发生络合反应和双水解
发生化学反应
练习2:判断下列盐溶液的酸碱性,若能水解的,
写出水解反应的离子方程式:
①(NH4)2SO4
②Cu(NO3)2
③Na2S
④NaClO
⑤BaCl2
⑥K2SO3
⑦KAl(SO4)2
⑧KF
ClO-+H2O HClO+OH-
Cu2++2H2O Cu(OH)2+2H+
Al3++3H2O Al(OH)3 + 3H+
SO32- + H2O HSO3- + OH-
HSO3- + H2O H2SO3 + OH-
S2- + H2O HS- + OH-
HS- + H2O H2S+ OH-
NH4+ +H2O NH3·H2O + H+
酸性
酸性
酸性
碱性
碱性
碱性
碱性
中性
F-+H2O HF+OH-
注意:①多元弱酸根分步水解;
②水解程度是微弱的,不写 、 等
练3:下列各变化的表达式中,属于水解反应且正确的是( )
5.H2O + H2O == H3O+ + OH—
Fe(OH)3↓+3H+
2.Fe3++3H2O
H2CO3+OH-
1.CO32-+H2O
3.CH3COO-+H2O
CH3COOH+OH—
4.CH3COOH+H2O
CH3COO —+ H3O+
H2CO3+OH-
6.HCO3-+H2O
CO32-+H3O+
7.HCO3-+H2O
CO32-+H2O
8.HCO3-+ OH-
9.H2PO4- +H2O H3PO4 + OH-
×
√
×
×
×
×
√
√
分步水解
醋酸分子的电离
水分子的电离
HCO3-的电离
HCO3-与强碱的反应离子方程式
10.HPO42-+H2O H2PO4-+OH-
√
HPO42-水解的第一步
注意:①电离以水为载体;
②水解反应中,水是反应物之一。
练习4:写出下列离子组在水溶液中相遇时的离子反应方程式:(1)Fe3+与CO32- (2)Al3+与AlO2-
(3)Fe3+与HCO3- (4) NH4+与AlO2-
(5)Al3+与S2-
(1)2Fe3+ + 3CO32- + 3H2O = 2Fe(OH)3↓+ 3CO2↑
(2)Al3+ + 3AlO2- + 6H2O = 4Al(OH)3 ↓
(3)Fe3+ + 3HCO3- = Fe(OH)3↓ + 3CO2↑
(4) NH4+ + AlO2- + H2O = NH3↑ + Al(OH)3 ↓
(5)2Al3+ + 3S2- + 6H2O = 2Al(OH)3 ↓+ 3H2S ↑
答 案:
注意:“双水解”要用“ =”、“↑”、“↓”。
