化学人教版(2019)必修1 2.3.2气体摩尔体积(共33张ppt)
文档属性
| 名称 | 化学人教版(2019)必修1 2.3.2气体摩尔体积(共33张ppt) | 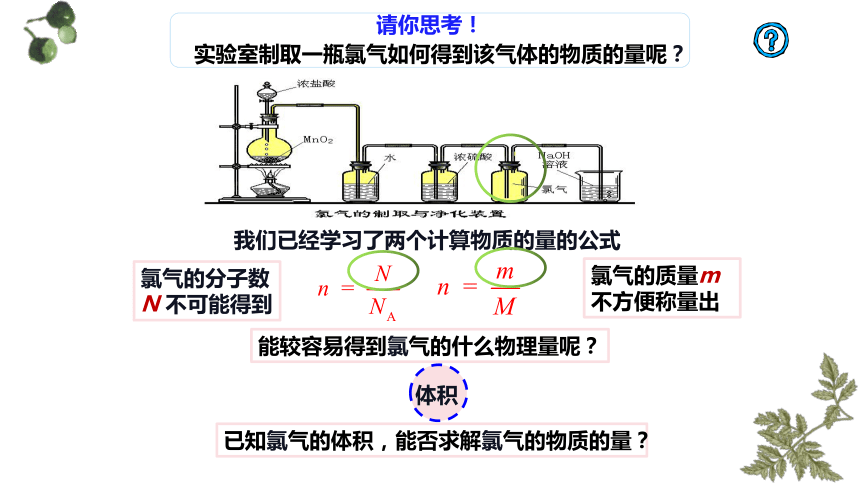 | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-07 17:21:42 | ||
图片预览







文档简介
(共33张PPT)
请你思考!
实验室制取一瓶氯气如何得到该气体的物质的量呢?
我们已经学习了两个计算物质的量的公式
氯气的分子数N 不可能得到
氯气的质量m不方便称量出
能较容易得到氯气的什么物理量呢?
已知氯气的体积,能否求解氯气的物质的量?
体积
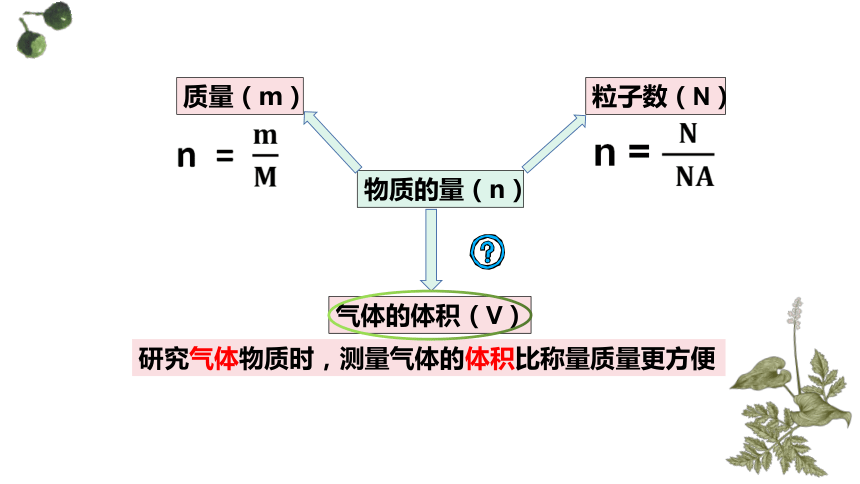
物质的量(n)
质量(m)
粒子数(N)
气体的体积(V)
n =
n =
研究气体物质时,测量气体的体积比称量质量更方便
第三节
物质的量
第二章 海水中的重要元素——钠和氯
第2课时 气体摩尔体积
请你观察!
观察并分析下列表格的数据,你能得到哪些结论?
体积相同
粒子数相同
体积不同
体积不同
课本P56
(1)相同温度和压强下,1mol不同液体或固体体积不相同。
(2)相同温度和压强下,1mol不同气体体积相同。
01
影响物质体积大小的因素
影响物质体积大小的因素
1个乒乓球所占的体积和1个篮球所占的体积哪个大?
影响物质体积大小的因素:①粒子本身的大小
影响物质体积大小的因素
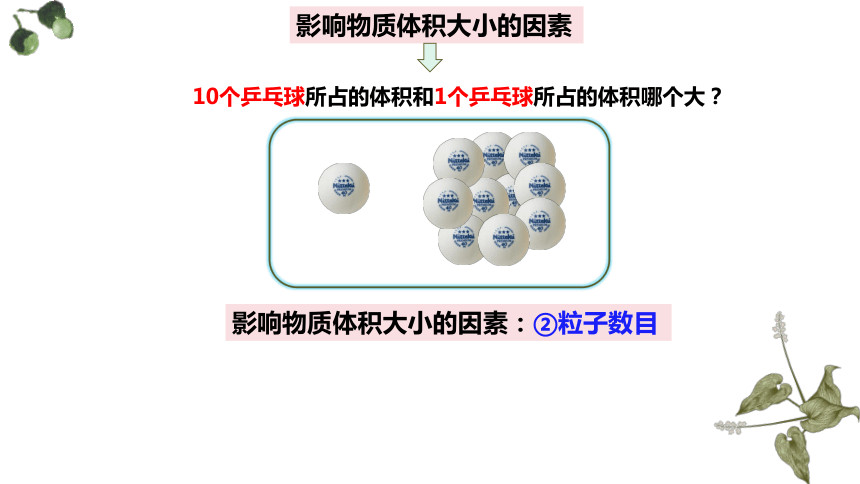
10个乒乓球所占的体积和1个乒乓球所占的体积哪个大?
影响物质体积大小的因素:②粒子数目
影响物质体积大小的因素
10个紧密排列在一起的乒乓球所占的体积和10个松散排列在一起的乒乓球所占的体积哪个大?
影响物质体积大小的因素:③粒子之间的距离
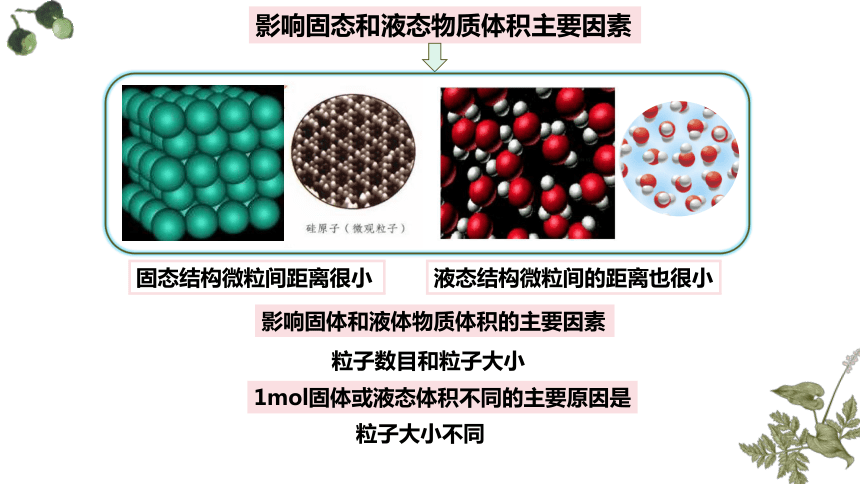
影响固态和液态物质体积主要因素
固态结构微粒间距离很小
液态结构微粒间的距离也很小
粒子数目和粒子大小
1mol固体或液态体积不同的主要原因是
粒子大小不同
影响固体和液体物质体积的主要因素
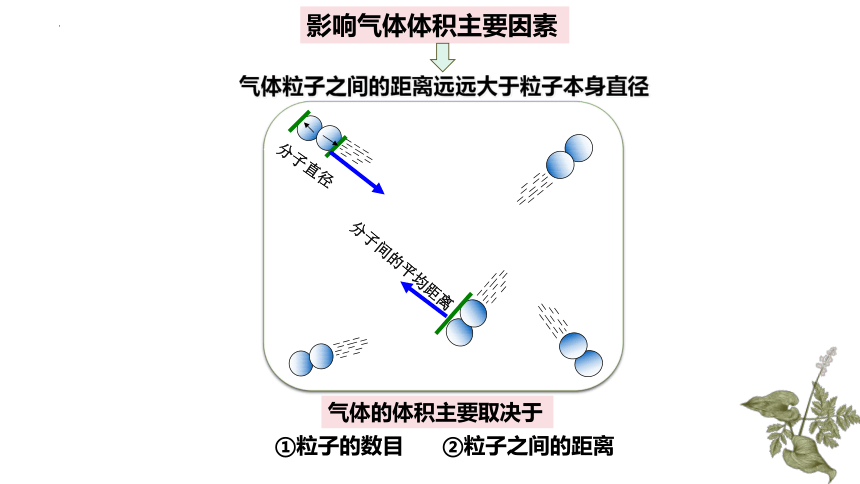
影响气体体积主要因素
分子直径
分子间的平均距离
气体粒子之间的距离远远大于粒子本身直径
气体的体积主要取决于
①粒子的数目 ②粒子之间的距离
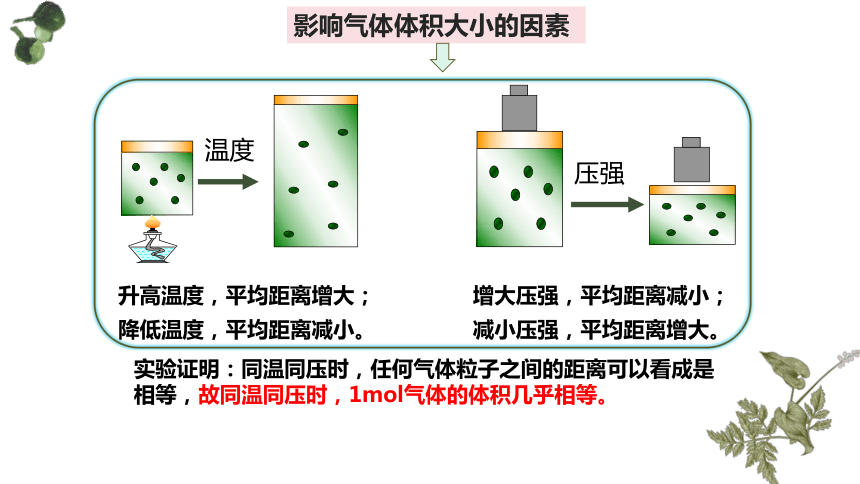
影响气体体积大小的因素
升高温度,平均距离增大;
降低温度,平均距离减小。
增大压强,平均距离减小;
减小压强,平均距离增大。
温度
压强
实验证明:同温同压时,任何气体粒子之间的距离可以看成是相等,故同温同压时,1mol气体的体积几乎相等。
状态 粒子个数 粒子大小 粒子间距 结论
1mol固体或液体 6.02×1023
1mol气体 6.02×1023
主要因素
忽略
忽略
决定因素
同温同压下,气体粒子间的距离相等
构成不同固体、液体的粒子大小是不同的
体积不同
体积相同
从微观角度分析,决定物质体积的三个因素
1 mol不同气体的体积相同
02
气体摩尔体积
气体摩尔体积
单位物质的量的气体所占的体积
符号:
单位:L/mol或 L·mol-1
Vm
V= n × Vm
Vm
n =
V
在给定温度和压强的条件下, Vm是常数。
(若条件改变时,Vm也随之改变;也就是说要指明Vm的数值,必须指明温度和压强)
化学式条件1 mol气体体积/L气体摩尔体积/L·mol-1H20℃,101 kPa22.422.4O20℃,101 kPa22.422.4CO0℃,101 kPa22.422.4H20℃,202 kPa11.211.2CO20℃,202 kPa11.211.2N2273℃,202 kPa22.422.4NH3273℃,202 kPa22.422.4已知1 mol不同气体在不同条件下的体积“0 ℃,101 kPa”通常称为标准状况,简称“标况”1mol任何气体的体积约为22.4L气体摩尔体积是22.4L/mol
在标准状况(0℃,101KPa)下, 1mol任何气体的体积约为22.4L。
标准状况下气体摩尔体积是22.4L/mol
(1)条件:标准状况(0℃,101KPa)
(2)对象:任何气体(单一气体或混合不反应的气体)
(3)数值:Vm≈22.4L/mol
是否只有在标准状况下气体摩尔体积才是22.4L/mol?
化学式 条件 1 mol气体体积/L 气体摩尔体积/L·mol-1
H2 0 ℃,101 kPa 22.4 22.4
O2 0 ℃,101 kPa 22.4 22.4
CO 0 ℃,101 kPa 22.4 22.4
H2 0 ℃,202 kPa 11.2 11.2
CO2 0 ℃,202 kPa 11.2 11.2
N2 273 ℃,202 kPa 22.4 22.4
NH3 273 ℃,202 kPa 22.4 22.4
已知1 mol不同气体在不同条件下的体积
从上表分析得出结论:
①1 mol任何气体,在标准状况下的体积都约为 。
②1 mol不同的气体,在不同的条件下,体积 (填“一定”“一定不”或“不一定”)相等。
③ 只有在标准状况下气体摩尔体积才是22.4L/mol。
22.4 L
不一定
不是
已知1 mol不同气体在不同条件下的体积
1.气体摩尔体积的数值不是固定不变的,它取决于气体所处的温度和压强。
2.在非标准状况下不能随意使用22.4 L·mol-1(如25 C、101 kPa下的气体摩尔体积约为24.5 L·mol-1)。22.4L是1 mol 任何气体在标准状况下的体积,
3.气体摩尔体积只适用于气体,此处的“气体”可以是纯净物,也可以是混合物。
4.标准状况下不是气体的有SO3、苯、CCl4、Br2、H2O、HF等。
气体摩尔体积
特别注意
练习
(错,物质应是气体)
(错,应标明条件-标准状况)
(对,气体体积与分子种类无关)
(错,未指明气体体积是否在相同条件下测定)
1,标准状况下,1mol任何物质的体积都约是22.4L。
2,1mol气体的体积约为22.4L。
3,标准状况下,1molO2和N2混合气体的体积约为22.4L。
4,22.4L气体所含分子数一定大于11.2L气体所含的分子数。
5,只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
练习
B
n
m
V
÷ NA
× NA
× M
÷ M
÷ Vm
× Vm
N
V
以物质的量(n)为中心构建质量(m)、体积(V)、粒子数(N)之间的认知模型:
例1、标准状况下,67.2L的O2物质的量是多少?
【解】标准状况下,1moLO2的体积约为22.4L
已知V(O2)=67.2L
n(O2)=
V(O2)
Vm
=
67.2L
22.4L/mol
=3mol
答:67.2L的O2物质的量为3mol。
计算
以物质的量(n)为中心构建质量(m)、体积(V)、粒子数(N)之间的认知模型:
练习
1、标准状况下,11.2L的O2质量是多少g?
2、标准状况下,5.6升O2中有多少个O2分子?
V(已知)
N(?)
n(?)
V(已知)
m(?)
n(?)
n(O2)=V(O2)/Vm=11.2L/22.4L mol-1=0.5mol
m(O2)=n(O2) M(O2)=0.5mol×32g/mol=16g
n(O2)=V(O2)/Vm=5.6L/22.4L mol-1=0.25mol
N(O2)=n(O2) NA=0.25mol×6.02×1023mol-1=1.505×1023
练习
D
相同体积的两个容器,一个盛放氧气,一个盛放氢气,在同温、同压下,两容器中气体分子的数目有何关系?
氢气
氧气
相等
在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
03
阿伏加德罗定律及其推论
阿伏伽德罗定律
在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
推论:(1) 同温同压时(T 、P一定时)
n1
=
V1
-
V2
-
n2
=
N1
-
N2
例题1:在相同条件下,物质的量之比为1:4的H2与O2所含的分子个数比为_________,体积之比为__________。
1:4
1:4
练习
B
阿伏伽德罗定律
阿伏加德罗定律的推论
相同条件 结论 公式 语言叙述
同温同压 同温同压下,体积比等于物质的量之比,等于粒子数之比
同温同容 同温同容下,压强比等于物质的量之比,等于粒子数之比
同温同物 质的量 同温同物质的量下,压强比等于体积的反比
同温同压 同温同压下,密度比等于摩尔质量之比
同温同压 同体积 同温同压下,体积相同的气体,其摩尔质量与质量成正比
大家可以自己试着推导一下
练习
B
请你总结!
化学方程式表示哪些含义?
质量(宏观):
粒子数(微观):
12g 32g 44g
1个 1个 1个
C + O2 CO2
点燃
NA
NA
NA
同时扩大NA倍:
物质的量:
1mol 1mol 1mol
化学方程式中,物质的物质的量之比等于其计量数之比
请你思考!
化学方程式中,气体的体积之比与其计量数之比是否相等?
谢谢观看
请你思考!
实验室制取一瓶氯气如何得到该气体的物质的量呢?
我们已经学习了两个计算物质的量的公式
氯气的分子数N 不可能得到
氯气的质量m不方便称量出
能较容易得到氯气的什么物理量呢?
已知氯气的体积,能否求解氯气的物质的量?
体积
物质的量(n)
质量(m)
粒子数(N)
气体的体积(V)
n =
n =
研究气体物质时,测量气体的体积比称量质量更方便
第三节
物质的量
第二章 海水中的重要元素——钠和氯
第2课时 气体摩尔体积
请你观察!
观察并分析下列表格的数据,你能得到哪些结论?
体积相同
粒子数相同
体积不同
体积不同
课本P56
(1)相同温度和压强下,1mol不同液体或固体体积不相同。
(2)相同温度和压强下,1mol不同气体体积相同。
01
影响物质体积大小的因素
影响物质体积大小的因素
1个乒乓球所占的体积和1个篮球所占的体积哪个大?
影响物质体积大小的因素:①粒子本身的大小
影响物质体积大小的因素
10个乒乓球所占的体积和1个乒乓球所占的体积哪个大?
影响物质体积大小的因素:②粒子数目
影响物质体积大小的因素
10个紧密排列在一起的乒乓球所占的体积和10个松散排列在一起的乒乓球所占的体积哪个大?
影响物质体积大小的因素:③粒子之间的距离
影响固态和液态物质体积主要因素
固态结构微粒间距离很小
液态结构微粒间的距离也很小
粒子数目和粒子大小
1mol固体或液态体积不同的主要原因是
粒子大小不同
影响固体和液体物质体积的主要因素
影响气体体积主要因素
分子直径
分子间的平均距离
气体粒子之间的距离远远大于粒子本身直径
气体的体积主要取决于
①粒子的数目 ②粒子之间的距离
影响气体体积大小的因素
升高温度,平均距离增大;
降低温度,平均距离减小。
增大压强,平均距离减小;
减小压强,平均距离增大。
温度
压强
实验证明:同温同压时,任何气体粒子之间的距离可以看成是相等,故同温同压时,1mol气体的体积几乎相等。
状态 粒子个数 粒子大小 粒子间距 结论
1mol固体或液体 6.02×1023
1mol气体 6.02×1023
主要因素
忽略
忽略
决定因素
同温同压下,气体粒子间的距离相等
构成不同固体、液体的粒子大小是不同的
体积不同
体积相同
从微观角度分析,决定物质体积的三个因素
1 mol不同气体的体积相同
02
气体摩尔体积
气体摩尔体积
单位物质的量的气体所占的体积
符号:
单位:L/mol或 L·mol-1
Vm
V= n × Vm
Vm
n =
V
在给定温度和压强的条件下, Vm是常数。
(若条件改变时,Vm也随之改变;也就是说要指明Vm的数值,必须指明温度和压强)
化学式条件1 mol气体体积/L气体摩尔体积/L·mol-1H20℃,101 kPa22.422.4O20℃,101 kPa22.422.4CO0℃,101 kPa22.422.4H20℃,202 kPa11.211.2CO20℃,202 kPa11.211.2N2273℃,202 kPa22.422.4NH3273℃,202 kPa22.422.4已知1 mol不同气体在不同条件下的体积“0 ℃,101 kPa”通常称为标准状况,简称“标况”1mol任何气体的体积约为22.4L气体摩尔体积是22.4L/mol
在标准状况(0℃,101KPa)下, 1mol任何气体的体积约为22.4L。
标准状况下气体摩尔体积是22.4L/mol
(1)条件:标准状况(0℃,101KPa)
(2)对象:任何气体(单一气体或混合不反应的气体)
(3)数值:Vm≈22.4L/mol
是否只有在标准状况下气体摩尔体积才是22.4L/mol?
化学式 条件 1 mol气体体积/L 气体摩尔体积/L·mol-1
H2 0 ℃,101 kPa 22.4 22.4
O2 0 ℃,101 kPa 22.4 22.4
CO 0 ℃,101 kPa 22.4 22.4
H2 0 ℃,202 kPa 11.2 11.2
CO2 0 ℃,202 kPa 11.2 11.2
N2 273 ℃,202 kPa 22.4 22.4
NH3 273 ℃,202 kPa 22.4 22.4
已知1 mol不同气体在不同条件下的体积
从上表分析得出结论:
①1 mol任何气体,在标准状况下的体积都约为 。
②1 mol不同的气体,在不同的条件下,体积 (填“一定”“一定不”或“不一定”)相等。
③ 只有在标准状况下气体摩尔体积才是22.4L/mol。
22.4 L
不一定
不是
已知1 mol不同气体在不同条件下的体积
1.气体摩尔体积的数值不是固定不变的,它取决于气体所处的温度和压强。
2.在非标准状况下不能随意使用22.4 L·mol-1(如25 C、101 kPa下的气体摩尔体积约为24.5 L·mol-1)。22.4L是1 mol 任何气体在标准状况下的体积,
3.气体摩尔体积只适用于气体,此处的“气体”可以是纯净物,也可以是混合物。
4.标准状况下不是气体的有SO3、苯、CCl4、Br2、H2O、HF等。
气体摩尔体积
特别注意
练习
(错,物质应是气体)
(错,应标明条件-标准状况)
(对,气体体积与分子种类无关)
(错,未指明气体体积是否在相同条件下测定)
1,标准状况下,1mol任何物质的体积都约是22.4L。
2,1mol气体的体积约为22.4L。
3,标准状况下,1molO2和N2混合气体的体积约为22.4L。
4,22.4L气体所含分子数一定大于11.2L气体所含的分子数。
5,只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
练习
B
n
m
V
÷ NA
× NA
× M
÷ M
÷ Vm
× Vm
N
V
以物质的量(n)为中心构建质量(m)、体积(V)、粒子数(N)之间的认知模型:
例1、标准状况下,67.2L的O2物质的量是多少?
【解】标准状况下,1moLO2的体积约为22.4L
已知V(O2)=67.2L
n(O2)=
V(O2)
Vm
=
67.2L
22.4L/mol
=3mol
答:67.2L的O2物质的量为3mol。
计算
以物质的量(n)为中心构建质量(m)、体积(V)、粒子数(N)之间的认知模型:
练习
1、标准状况下,11.2L的O2质量是多少g?
2、标准状况下,5.6升O2中有多少个O2分子?
V(已知)
N(?)
n(?)
V(已知)
m(?)
n(?)
n(O2)=V(O2)/Vm=11.2L/22.4L mol-1=0.5mol
m(O2)=n(O2) M(O2)=0.5mol×32g/mol=16g
n(O2)=V(O2)/Vm=5.6L/22.4L mol-1=0.25mol
N(O2)=n(O2) NA=0.25mol×6.02×1023mol-1=1.505×1023
练习
D
相同体积的两个容器,一个盛放氧气,一个盛放氢气,在同温、同压下,两容器中气体分子的数目有何关系?
氢气
氧气
相等
在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
03
阿伏加德罗定律及其推论
阿伏伽德罗定律
在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
推论:(1) 同温同压时(T 、P一定时)
n1
=
V1
-
V2
-
n2
=
N1
-
N2
例题1:在相同条件下,物质的量之比为1:4的H2与O2所含的分子个数比为_________,体积之比为__________。
1:4
1:4
练习
B
阿伏伽德罗定律
阿伏加德罗定律的推论
相同条件 结论 公式 语言叙述
同温同压 同温同压下,体积比等于物质的量之比,等于粒子数之比
同温同容 同温同容下,压强比等于物质的量之比,等于粒子数之比
同温同物 质的量 同温同物质的量下,压强比等于体积的反比
同温同压 同温同压下,密度比等于摩尔质量之比
同温同压 同体积 同温同压下,体积相同的气体,其摩尔质量与质量成正比
大家可以自己试着推导一下
练习
B
请你总结!
化学方程式表示哪些含义?
质量(宏观):
粒子数(微观):
12g 32g 44g
1个 1个 1个
C + O2 CO2
点燃
NA
NA
NA
同时扩大NA倍:
物质的量:
1mol 1mol 1mol
化学方程式中,物质的物质的量之比等于其计量数之比
请你思考!
化学方程式中,气体的体积之比与其计量数之比是否相等?
谢谢观看
