化学人教版(2019)选择性必修1 3.3.2影响盐类水解的因素(共32张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.3.2影响盐类水解的因素(共32张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 79.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-07 21:44:03 | ||
图片预览









文档简介
(共32张PPT)
新
教
材
第2课时 影响盐类水解的因素
第三节 盐类的水解
Na2CO3和NaHCO3都呈碱性,为何碳酸钠可用于去除油污,而碳酸氢钠很少这样应用?为何碳酸氢钠可以用作胃药,而碳酸钠不可以?
【情境引入 】
→同浓度下,碳酸钠碱性大于碳酸氢钠,
碳酸钠去污效果更好,但对胃的腐蚀也更强。
为什么“同浓度下,碳酸钠碱性大于碳酸氢钠”?
→影响盐类水解程度大小的因素是什么?有什么规律吗?
二、影响盐类水解的主要因素
1、内因(盐本身的性质):
即:越弱越水解。
盐所对应的酸越弱,其阴离子越易发生水解,盐的碱性越强
盐所对应的碱越弱,其阳离子越易发生水解,盐的酸性越强
【例1】已知酸性强弱:CH3OOH > H2CO3
则同温时水解程度:CH3COONa Na2CO3,
同浓度溶液碱性:CH3COONa Na2CO3
<
<
[例2]已知碱性:NH3·H2O > Mg(OH)2 > Al(OH)3
则同浓度溶液酸性:NH4Cl MgCl2 AlCl3
< <
1. 比较同浓度Na2CO3、NaHCO3溶液的pH大小?
对应的酸
H2CO3
水解的程度:
碱 性:
Na2CO3 > NaHCO3
pH:
<
HCO3-
酸性:
越弱越水解
Na2CO3> NaHCO3
∴ 碱 性: 正盐 > 酸式盐
Na2CO3 > NaHCO3
∵正盐的水解程度 > 酸式盐的水解程度
结 论:
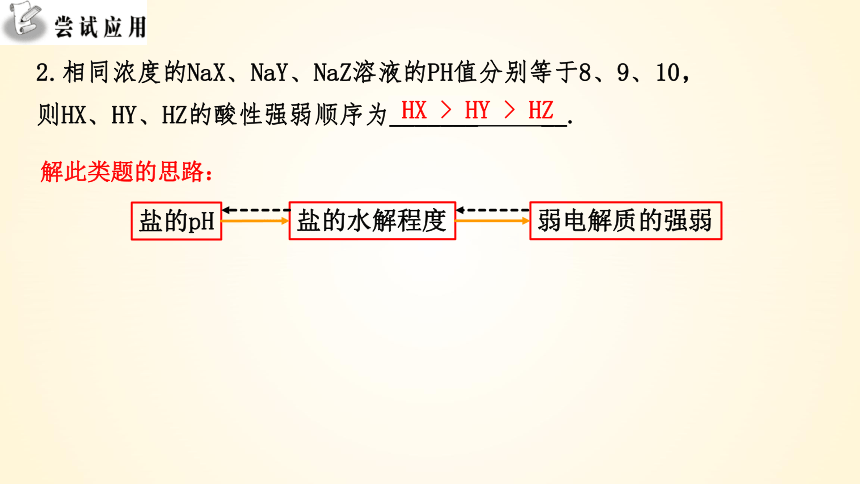
2.相同浓度的NaX、NaY、NaZ溶液的PH值分别等于8、9、10,则HX、HY、HZ的酸性强弱顺序为_______ __.
HX > HY > HZ
解此类题的思路:
盐的pH
盐的水解程度
弱电解质的强弱
③加入酸、碱、盐等物质:
课本P73--探究
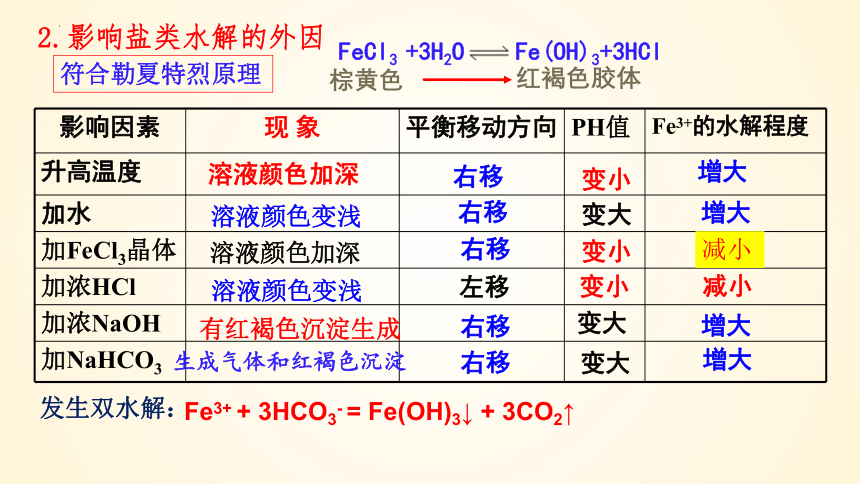
FeCl3 + 3H2O Fe(OH)3 + 3HCl
①浓度
②温度
你认为有哪些因素会影响该水解平衡?
2.影响盐类水解的外因
影响因素 现 象 平衡移动方向 PH值 Fe3+的水解程度
升高温度
加水
加FeCl3晶体
加浓HCl
加浓NaOH
加NaHCO3
溶液颜色加深
溶液颜色加深
溶液颜色变浅
溶液颜色变浅
有红褐色沉淀生成
生成气体和红褐色沉淀
右移
变小
减小
右移
变大
增大
左移
变小
减小
右移
变小
增大
右移
变大
增大
右移
变大
增大
FeCl3 +3H2O Fe(OH)3+3HCl
棕黄色
红褐色胶体
Fe3+ + 3HCO3- = Fe(OH)3↓ + 3CO2↑
发生双水解:
符合勒夏特烈原理
2.影响盐类水解的外因
归纳总结:
2、外因
③加入酸、碱等物质:
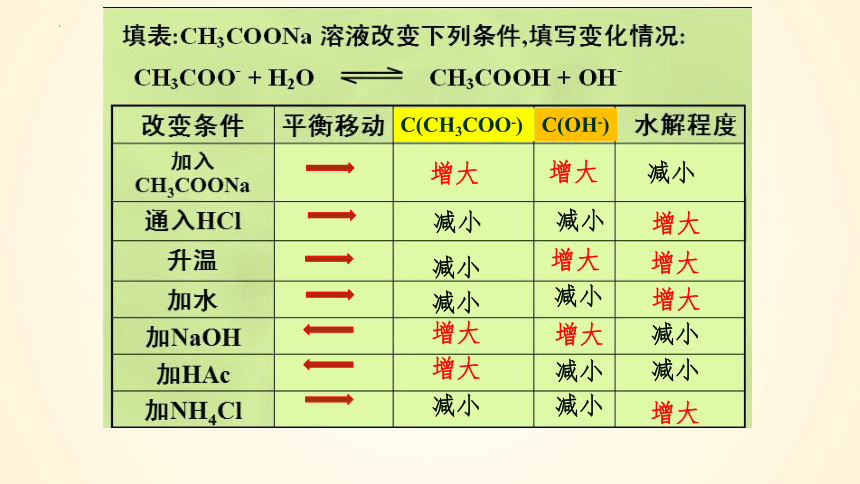
①温度:升高温度, 盐类的水解
促进
②浓度:
(1)增大C(盐):
(2)加水稀释:
平衡朝水解方向移动,但盐的水解程度减小。
平衡朝水解方向移动,且盐的水解程度增大。
可能促进,也可能抑制盐的水解。
CH3COO- + H2O CH3COOH + OH-
加盐酸:
加NaOH:
促进
抑制
结论:
越弱越水解;越热越水解;越稀越水解;
加酸、碱可抑制或促进水解!
增大
增大
减小
减小
减小
增大
减小
增大
增大
减小
减小
增大
增大
增大
减小
增大
减小
减小
减小
减小
增大
C(CH3COO-)
C(OH-)
1.溶液浓度均为0.1mol/L的10种溶液:① HNO3 ② H2SO4 ③ CH3COOH
④Ba(OH)2 ⑤ NH3·H2O ⑥ CH3COONa ⑦ NaCl ⑧ NH4Cl ⑨ Na2CO3,
其pH由大到小顺序_ ____________
④⑤⑨⑥⑦⑧③①②
思路:
1)按酸性、碱性分类
酸性
中性
碱性
①②③⑧
⑦
④⑤⑥⑨
2)水解造成的酸性没有弱酸的酸性强:
酸性③>⑧
3)水解造成的碱性没有弱碱的碱性强:
碱性⑤>⑨>⑥
pH:⑧>③>①>②
pH:④>⑤>⑨>⑥
2.在25℃时,在1mol/L的①(NH4)2SO4 ②(NH4)2CO3 ③NH4Cl ④NH3·H2O
⑤(NH4)2Fe(SO4)2溶液中,C(NH4+)由大到小的顺序为 。
3.在Al3+ + 3H2O Al(OH)3 +3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的PH值增大,应采取的措施是( )
A.加热 B.通入HCl
C.加入适量的NaOH D.加入NaCl溶液
CD
⑤ > ① > ② > ③ >④
4、为了使Na2CO3溶液中C(Na+):C (CO32-)接近2:1,应加入( )
A.NaOH B.K2CO3 C.KOH D.H2O
BC
5、物质的量相同的下列溶液中含微粒种类最多的是( )
A.CaCl2 B.CH3COONa C.NH3 D.K2S
D
盐类的水解往往使得溶液中微粒种类增多!
6.向盛有Na2CO3溶液的试管中滴入2滴酚酞试液振荡, 现象是 ,
原因用离子方程式表示是 。
然后对溶液加热,现象是: 。最后向溶液中再滴入过量的BaCl2溶液, 现象为 ,
原因用离子方程式表示是 。
溶液变红
CO32-+H2O HCO3- +OH-
产生白色沉淀,且红色褪去
Ba2++CO32-=BaCO3↓
溶液红色变深
请设计一个简单的实验:证明Na2CO3溶液呈碱性是由于CO32-水解的原因.
2.然后逐滴加入BaCl2溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点。
1.向Na2CO3溶液中滴加几点酚酞试液后,溶液显红色;
盐的水解常数Kh
[课本P75---资料卡片]
A- + H2O HA + OH-
∴
HA表示酸,MOH表示碱,MA表示盐
若MA为强碱弱酸盐,则:
HA A- + H+
又:
Ka=
c(H+)
c(HA)
c(A- )
两式相乘
Ka
Kh
×
= Kw
同理:
得到:
小结
1.弱酸或弱碱的电离常数越小(越弱),其所生成的盐水解程度越大
2.盐类水解常数只与温度有关。
水解常数Kh与弱酸(弱碱)的电离常数Ka、Kb关系
——越弱越水解。
盐的水解常数的应用
例1、已知25℃时,K(CH3COOH)=10-5,则CH3COONa的水解常数为多少?0.1mol/L的醋酸钠溶液的PH值是多少?
(一)K值间的运算
=
10-14
10-5
=
10-9
CH3COO- + H2O CH3COOH + OH-
0.1
x
x
Kh=
c(CH3COOH)
c(CH3COO- )
c(OH- )
≈
x2
0.1-x
=
x2
0.1
=
10-9
x
=
10-5
即c(OH- )=10-5 ,PH为9
解:
解得:
对点训练1、已知25℃时,0.1mol/L的氯化铵溶液的PH=5,则其水解平衡常数是多少?K(NH3.H2O)=?
10-9
10-5
盐的水解常数的应用
(二)判断溶液的酸碱性
例2、已知25℃时,K(CH3COOH)=10-5,则0.1mol/L 20ml CH3COONa中加入0.1mol/L 10ml的盐酸后PH 7(填大于、小于、等于)
CH3COONa + HCl = NaCl + CH3COOH
0.002
0.001
0.001
0.001
CH3COONa
CH3COOH
等量
NaCl
K(CH3COOH)=10-5
Kh=
10-9
水解
电离
<
(溶液显酸性)
余0.001
小于
盐的水解常数的应用
2、已知25℃时,碳酸的K1=10-7 K2=10-11,则0.1mol/L NaHCO3中PH 7(填大于、小于、等于)
对点练习2:已知25℃时,亚硫酸的K1=10-2 K2=10-8,则0.1mol/L NaHSO3中PH 7(填大于、小于、等于)
HCO3 – CO32- + H+
HCO3 – + H2O H2CO3 + OH –
K2=10-11
Kh=
Kw
K1
=10-7
水解
电离
<
大于
小于
(二)判断溶液的酸碱性
盐的水解常数的应用
对于二元弱酸及其盐,Ka与 Kh的关系如下
归纳整理1:
: 酸和碱完全中和得到的盐叫正盐。
如,Na2CO3、Na2S、Na2SO4、 Na3PO4
强酸强碱
强酸弱碱
正盐
弱酸弱碱
强碱弱酸
中性
C(H+)=C(OH-)
碱性
C(H+)酸性
C(H+)>C(OH-)
取决于电离常数
归纳整理2:
盐溶液的酸碱性
1.正盐
谁强显谁性,
都强显中性,
弱弱具体定。
2.同一弱酸对应的盐
>
∴正盐的水解程度 酸式盐的水解程度
>
比较碱性:Na2CO3 NaHCO3
<
对应的酸:HCO3- H2CO3
再如:
碱性:Na2S NaHS
>
碱性:Na2SO3 NaHSO3
>
归纳整理2:
盐溶液的酸碱性
1.正盐
谁强显谁性,
都强显中性,
弱弱具体定。
3.酸式盐
1)NaHSO4溶液
NaHSO4 =Na+ +H+ + SO42—
只电离,呈强酸性
2)多元弱酸的酸式酸根离子,既有水解,又有电离。
类似的:NaHS、Na2HPO4等
如NaHCO3溶液
HCO3 – + H2O H2CO3 + OH –
①水解:
②电离:
HCO3– CO32– + H+
水解>电离
∴溶液呈 性
NaHSO3溶液
HSO3 – + H2O H2SO3 + OH –
①水解:
HSO3 – SO32– + H +
②电离:
电离>水解
∴溶液呈 性
酸
碱
类似的:NaH2PO4
溶液呈酸性:NaHSO4、NaHSO3、NaH2PO4
√
主
√
主
酸式盐
溶液呈碱性: NaHCO3 、NaHS、Na2HPO4等
记住
比较下列溶液的pH的大小
(1) Na2SO3 、 NaHSO3 、 Na2SO4 、 NaHSO4
(2) Na3PO4 、 NaH2PO4 、 Na2HPO4 、 H3PO4
pH: Na2SO3 > Na2SO4>NaHSO3 > NaHSO4
pH: Na3PO4 > Na2HPO4 > NaH2PO4 > H3PO4
4.同浓度的弱酸与弱酸盐的混合液
CH3COONa(aq)
CH3COOH(aq)
+
√
主
混合液呈 性。
酸
5.同浓度的弱碱与弱碱盐的混合液
NH4Cl(aq)
NH3·H2O(aq)
+
NH4+ +H2O NH3·H2O + H+
√
主
混合液呈 性。
碱
记住
记住
6.HCN + NaCN的混合液
CN-水解 >HCN 电离
(溶液显碱性)
D
2、能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡事实的是( )
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
D.滴入酚酞溶液变红,再加入NaHSO4溶液后红色褪去
C
3、常温下,0.010mol/L的二元酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH变化如图所示:下列说法正确的是
A.NaHA溶液显酸性
B.H2A的第一步电离平衡常数Ka1=10-10
C.Na2A溶液中离子浓度大小关系为:
c(Na+)>c(A2-)>c(OH-)>c(HA-)>>c(H+)
D.向H2A溶液中滴加相同浓度的NaOH溶液,滴加过程中离子浓度始终满足:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
C D
(2)室温下,已知弱酸H2B的电离常数Ka1=2.3╳10-4,
Ka2=5.8╳10-7,则NaHB的水溶液呈 性。
4、(1)已知H2A == H+ + HA—,HA— H+ + A2—,
则NaHA的水溶液呈 性。
酸
酸
5.在25mLNaOH溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示。
(1)写出NaOH溶液与醋酸溶液反应的离子方程式:
_____________________________。
(2)该NaOH溶液的物质的量浓度为__ mol/L 。
OH-+CH3COOH=CH3COO-+H2O
0.1
(3)在B点,a___12.5 mL(填“>”、“<”或“=”,下同)。若由体积相等的NaOH和醋酸溶液混合而且恰好呈中性,
则混合前c(NaOH)___c(CH3COOH),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)___c(OH-)。
(4)在D点,溶液中离子浓度大小关系为:__________________。
<
>
<
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
5.在25mLNaOH溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示。
新
教
材
第2课时 影响盐类水解的因素
第三节 盐类的水解
Na2CO3和NaHCO3都呈碱性,为何碳酸钠可用于去除油污,而碳酸氢钠很少这样应用?为何碳酸氢钠可以用作胃药,而碳酸钠不可以?
【情境引入 】
→同浓度下,碳酸钠碱性大于碳酸氢钠,
碳酸钠去污效果更好,但对胃的腐蚀也更强。
为什么“同浓度下,碳酸钠碱性大于碳酸氢钠”?
→影响盐类水解程度大小的因素是什么?有什么规律吗?
二、影响盐类水解的主要因素
1、内因(盐本身的性质):
即:越弱越水解。
盐所对应的酸越弱,其阴离子越易发生水解,盐的碱性越强
盐所对应的碱越弱,其阳离子越易发生水解,盐的酸性越强
【例1】已知酸性强弱:CH3OOH > H2CO3
则同温时水解程度:CH3COONa Na2CO3,
同浓度溶液碱性:CH3COONa Na2CO3
<
<
[例2]已知碱性:NH3·H2O > Mg(OH)2 > Al(OH)3
则同浓度溶液酸性:NH4Cl MgCl2 AlCl3
< <
1. 比较同浓度Na2CO3、NaHCO3溶液的pH大小?
对应的酸
H2CO3
水解的程度:
碱 性:
Na2CO3 > NaHCO3
pH:
<
HCO3-
酸性:
越弱越水解
Na2CO3> NaHCO3
∴ 碱 性: 正盐 > 酸式盐
Na2CO3 > NaHCO3
∵正盐的水解程度 > 酸式盐的水解程度
结 论:
2.相同浓度的NaX、NaY、NaZ溶液的PH值分别等于8、9、10,则HX、HY、HZ的酸性强弱顺序为_______ __.
HX > HY > HZ
解此类题的思路:
盐的pH
盐的水解程度
弱电解质的强弱
③加入酸、碱、盐等物质:
课本P73--探究
FeCl3 + 3H2O Fe(OH)3 + 3HCl
①浓度
②温度
你认为有哪些因素会影响该水解平衡?
2.影响盐类水解的外因
影响因素 现 象 平衡移动方向 PH值 Fe3+的水解程度
升高温度
加水
加FeCl3晶体
加浓HCl
加浓NaOH
加NaHCO3
溶液颜色加深
溶液颜色加深
溶液颜色变浅
溶液颜色变浅
有红褐色沉淀生成
生成气体和红褐色沉淀
右移
变小
减小
右移
变大
增大
左移
变小
减小
右移
变小
增大
右移
变大
增大
右移
变大
增大
FeCl3 +3H2O Fe(OH)3+3HCl
棕黄色
红褐色胶体
Fe3+ + 3HCO3- = Fe(OH)3↓ + 3CO2↑
发生双水解:
符合勒夏特烈原理
2.影响盐类水解的外因
归纳总结:
2、外因
③加入酸、碱等物质:
①温度:升高温度, 盐类的水解
促进
②浓度:
(1)增大C(盐):
(2)加水稀释:
平衡朝水解方向移动,但盐的水解程度减小。
平衡朝水解方向移动,且盐的水解程度增大。
可能促进,也可能抑制盐的水解。
CH3COO- + H2O CH3COOH + OH-
加盐酸:
加NaOH:
促进
抑制
结论:
越弱越水解;越热越水解;越稀越水解;
加酸、碱可抑制或促进水解!
增大
增大
减小
减小
减小
增大
减小
增大
增大
减小
减小
增大
增大
增大
减小
增大
减小
减小
减小
减小
增大
C(CH3COO-)
C(OH-)
1.溶液浓度均为0.1mol/L的10种溶液:① HNO3 ② H2SO4 ③ CH3COOH
④Ba(OH)2 ⑤ NH3·H2O ⑥ CH3COONa ⑦ NaCl ⑧ NH4Cl ⑨ Na2CO3,
其pH由大到小顺序_ ____________
④⑤⑨⑥⑦⑧③①②
思路:
1)按酸性、碱性分类
酸性
中性
碱性
①②③⑧
⑦
④⑤⑥⑨
2)水解造成的酸性没有弱酸的酸性强:
酸性③>⑧
3)水解造成的碱性没有弱碱的碱性强:
碱性⑤>⑨>⑥
pH:⑧>③>①>②
pH:④>⑤>⑨>⑥
2.在25℃时,在1mol/L的①(NH4)2SO4 ②(NH4)2CO3 ③NH4Cl ④NH3·H2O
⑤(NH4)2Fe(SO4)2溶液中,C(NH4+)由大到小的顺序为 。
3.在Al3+ + 3H2O Al(OH)3 +3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的PH值增大,应采取的措施是( )
A.加热 B.通入HCl
C.加入适量的NaOH D.加入NaCl溶液
CD
⑤ > ① > ② > ③ >④
4、为了使Na2CO3溶液中C(Na+):C (CO32-)接近2:1,应加入( )
A.NaOH B.K2CO3 C.KOH D.H2O
BC
5、物质的量相同的下列溶液中含微粒种类最多的是( )
A.CaCl2 B.CH3COONa C.NH3 D.K2S
D
盐类的水解往往使得溶液中微粒种类增多!
6.向盛有Na2CO3溶液的试管中滴入2滴酚酞试液振荡, 现象是 ,
原因用离子方程式表示是 。
然后对溶液加热,现象是: 。最后向溶液中再滴入过量的BaCl2溶液, 现象为 ,
原因用离子方程式表示是 。
溶液变红
CO32-+H2O HCO3- +OH-
产生白色沉淀,且红色褪去
Ba2++CO32-=BaCO3↓
溶液红色变深
请设计一个简单的实验:证明Na2CO3溶液呈碱性是由于CO32-水解的原因.
2.然后逐滴加入BaCl2溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点。
1.向Na2CO3溶液中滴加几点酚酞试液后,溶液显红色;
盐的水解常数Kh
[课本P75---资料卡片]
A- + H2O HA + OH-
∴
HA表示酸,MOH表示碱,MA表示盐
若MA为强碱弱酸盐,则:
HA A- + H+
又:
Ka=
c(H+)
c(HA)
c(A- )
两式相乘
Ka
Kh
×
= Kw
同理:
得到:
小结
1.弱酸或弱碱的电离常数越小(越弱),其所生成的盐水解程度越大
2.盐类水解常数只与温度有关。
水解常数Kh与弱酸(弱碱)的电离常数Ka、Kb关系
——越弱越水解。
盐的水解常数的应用
例1、已知25℃时,K(CH3COOH)=10-5,则CH3COONa的水解常数为多少?0.1mol/L的醋酸钠溶液的PH值是多少?
(一)K值间的运算
=
10-14
10-5
=
10-9
CH3COO- + H2O CH3COOH + OH-
0.1
x
x
Kh=
c(CH3COOH)
c(CH3COO- )
c(OH- )
≈
x2
0.1-x
=
x2
0.1
=
10-9
x
=
10-5
即c(OH- )=10-5 ,PH为9
解:
解得:
对点训练1、已知25℃时,0.1mol/L的氯化铵溶液的PH=5,则其水解平衡常数是多少?K(NH3.H2O)=?
10-9
10-5
盐的水解常数的应用
(二)判断溶液的酸碱性
例2、已知25℃时,K(CH3COOH)=10-5,则0.1mol/L 20ml CH3COONa中加入0.1mol/L 10ml的盐酸后PH 7(填大于、小于、等于)
CH3COONa + HCl = NaCl + CH3COOH
0.002
0.001
0.001
0.001
CH3COONa
CH3COOH
等量
NaCl
K(CH3COOH)=10-5
Kh=
10-9
水解
电离
<
(溶液显酸性)
余0.001
小于
盐的水解常数的应用
2、已知25℃时,碳酸的K1=10-7 K2=10-11,则0.1mol/L NaHCO3中PH 7(填大于、小于、等于)
对点练习2:已知25℃时,亚硫酸的K1=10-2 K2=10-8,则0.1mol/L NaHSO3中PH 7(填大于、小于、等于)
HCO3 – CO32- + H+
HCO3 – + H2O H2CO3 + OH –
K2=10-11
Kh=
Kw
K1
=10-7
水解
电离
<
大于
小于
(二)判断溶液的酸碱性
盐的水解常数的应用
对于二元弱酸及其盐,Ka与 Kh的关系如下
归纳整理1:
: 酸和碱完全中和得到的盐叫正盐。
如,Na2CO3、Na2S、Na2SO4、 Na3PO4
强酸强碱
强酸弱碱
正盐
弱酸弱碱
强碱弱酸
中性
C(H+)=C(OH-)
碱性
C(H+)
C(H+)>C(OH-)
取决于电离常数
归纳整理2:
盐溶液的酸碱性
1.正盐
谁强显谁性,
都强显中性,
弱弱具体定。
2.同一弱酸对应的盐
>
∴正盐的水解程度 酸式盐的水解程度
>
比较碱性:Na2CO3 NaHCO3
<
对应的酸:HCO3- H2CO3
再如:
碱性:Na2S NaHS
>
碱性:Na2SO3 NaHSO3
>
归纳整理2:
盐溶液的酸碱性
1.正盐
谁强显谁性,
都强显中性,
弱弱具体定。
3.酸式盐
1)NaHSO4溶液
NaHSO4 =Na+ +H+ + SO42—
只电离,呈强酸性
2)多元弱酸的酸式酸根离子,既有水解,又有电离。
类似的:NaHS、Na2HPO4等
如NaHCO3溶液
HCO3 – + H2O H2CO3 + OH –
①水解:
②电离:
HCO3– CO32– + H+
水解>电离
∴溶液呈 性
NaHSO3溶液
HSO3 – + H2O H2SO3 + OH –
①水解:
HSO3 – SO32– + H +
②电离:
电离>水解
∴溶液呈 性
酸
碱
类似的:NaH2PO4
溶液呈酸性:NaHSO4、NaHSO3、NaH2PO4
√
主
√
主
酸式盐
溶液呈碱性: NaHCO3 、NaHS、Na2HPO4等
记住
比较下列溶液的pH的大小
(1) Na2SO3 、 NaHSO3 、 Na2SO4 、 NaHSO4
(2) Na3PO4 、 NaH2PO4 、 Na2HPO4 、 H3PO4
pH: Na2SO3 > Na2SO4>NaHSO3 > NaHSO4
pH: Na3PO4 > Na2HPO4 > NaH2PO4 > H3PO4
4.同浓度的弱酸与弱酸盐的混合液
CH3COONa(aq)
CH3COOH(aq)
+
√
主
混合液呈 性。
酸
5.同浓度的弱碱与弱碱盐的混合液
NH4Cl(aq)
NH3·H2O(aq)
+
NH4+ +H2O NH3·H2O + H+
√
主
混合液呈 性。
碱
记住
记住
6.HCN + NaCN的混合液
CN-水解 >HCN 电离
(溶液显碱性)
D
2、能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡事实的是( )
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
D.滴入酚酞溶液变红,再加入NaHSO4溶液后红色褪去
C
3、常温下,0.010mol/L的二元酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH变化如图所示:下列说法正确的是
A.NaHA溶液显酸性
B.H2A的第一步电离平衡常数Ka1=10-10
C.Na2A溶液中离子浓度大小关系为:
c(Na+)>c(A2-)>c(OH-)>c(HA-)>>c(H+)
D.向H2A溶液中滴加相同浓度的NaOH溶液,滴加过程中离子浓度始终满足:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
C D
(2)室温下,已知弱酸H2B的电离常数Ka1=2.3╳10-4,
Ka2=5.8╳10-7,则NaHB的水溶液呈 性。
4、(1)已知H2A == H+ + HA—,HA— H+ + A2—,
则NaHA的水溶液呈 性。
酸
酸
5.在25mLNaOH溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示。
(1)写出NaOH溶液与醋酸溶液反应的离子方程式:
_____________________________。
(2)该NaOH溶液的物质的量浓度为__ mol/L 。
OH-+CH3COOH=CH3COO-+H2O
0.1
(3)在B点,a___12.5 mL(填“>”、“<”或“=”,下同)。若由体积相等的NaOH和醋酸溶液混合而且恰好呈中性,
则混合前c(NaOH)___c(CH3COOH),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)___c(OH-)。
(4)在D点,溶液中离子浓度大小关系为:__________________。
<
>
<
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
5.在25mLNaOH溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示。
