青海省西宁市2022-2023学年高一下学期期末调研测试化学试题(含答案)
文档属性
| 名称 | 青海省西宁市2022-2023学年高一下学期期末调研测试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 608.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-07 19:16:47 | ||
图片预览




文档简介
西宁市2022-2023学年高一下学期期末调研测试
化学
注意事项:
1.本试卷满分100分,考试时间120分钟。
2.本试卷为试题卷,不允许作为答题卷使用,答题部分请在答题卡上作答,否则无效。
3.答题前,考生务必将自己的姓名、准考证号、考场、座位号填写在答题卡上,同时将学校、姓名、准考证号、考场填写在试卷上。
4.选择题用2B铅笔把答题卡上对应题目的答案标号涂黑(如需改动,用橡皮擦干净后,再选涂其它答案标号)。非选择题用0.5毫米的黑色签字笔答在答题卡相应的位置,书写工整,字迹清晰。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 S-32 Cu-64
第一部分 选择题(共46分)
(本部分共23小题,每小题2分,共46分。在每小题列出的四个选项中,选出符合题目要求的一项。)
1.“碳中和”是指确定时间内排放的碳总量与吸取的碳总量相互抵消,实现二氧化碳相对“零排放”。下列措施对推进碳中和最有效的是( )
A.用汽油代替柴油 B.使用无磷洗衣粉
C.用二氧化碳合成淀粉 D.推行生活垃圾分类
2.下列不属于传统硅酸盐产品的是( )
A.玻璃 B.水泥 C.石墨烯 D.陶瓷
3.《黄帝内经》有如下叙述:“五谷为养,五果为助,五畜为益,五菜为充”。下列有关营养物质的说法错误的是( )
A.葡萄糖和果糖互为同分异构体 B.淀粉和纤维素都能为人体提供能量
C.蛋白质在人体内最终水解为氨基酸 D.油脂能促进脂溶性维生素的吸收
4.下列有关化学用语叙述正确的是( )
A.中子数为10的氧原子: B.乙烯的结构简式
C.氧原子的结构示意图: D.氨的电子式:
5.下列有关硅及其化合物的说法正确的是( )
A.硅酸盐化学性质稳定,是由于其结构中存在硅氧四面体
B.实验室用带玻璃塞的试剂瓶保存溶液
C.是酸性氧化物,能够与水反应生成
D.硅的化学性质稳定,在自然界中大部分以游离态存在
6.金属冶炼通常有热分解法、热还原法和电解法。下列金属中,需要用电解法冶炼的是( )
A. B. C. D.
7.用下列仪器或装置进行相应实验,可以达到实验目的的是( )
A.证明是分解的催经剂 B.制备并收集乙酸乙酯 C.收集气体 D.实验室制
8.下列物质的用途错误的是( )
A.液氨可用作制冷剂 B.可用作纸浆的漂白
C.浓硝酸可用作干燥剂 D.单质硅可作半导体材料
9.利用氮元素价类二维图可以从不同角度研究含氮物质的性质及其转化关系。下列说法错误的是( )
A.既有氧化性又有还原性
B.通过转化①②③可实现工业制备硝酸
C.自然界可实现上述转化④,这是一种氮的固定
D.受热分解生成、和,氧化产物和还原产物的物质的量之比为
10.工业生产中为了盛装大量浓硝酸,可作为罐体材料的是( )
A.锌 B.铝 C.铜 D.铂
11.下列反应属于放热反应的是( )
A.一氧化碳在空气中的燃烧反应 B.与氯化铵固体的反应
C.干冰升华 D.盐酸与碳酸氢钠的反应
12.下列物质不能用作食品添加剂的是( )
A.氯化镁 B.亚硝酸钠 C.山梨酸钾 D.三聚氰胺
13.含4个碳原子的烃分子结构中,碳原子相互结合的几种方式如下图,下列说法错误的是
A.①②⑧均为饱和烃 B.③④互为同系物
C.⑥⑦属于炔烃 D.⑤⑨互为同分异构体
14.设为阿伏加德罗常数的值。下列叙述正确的是( )
A.甲基中所含有的电子数为
B.与反应生成的分子数少于
C.灼热的铜丝在足量硫蒸气里完全燃烧,转移电子总数为
D.将与混合光照,充分反应后,生成分子数为
15.在某一化学反应中,生成物的浓度在内从变成,则内用生成物表示的化学反应速率是( )
A. B.
C. D.
16.在一定条件下,容器内某一反应中参加反应的气体和气体的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
A.反应的化学方程式为
B.时,正、逆反应速率相等,达到平衡
C.时,的浓度是的浓度的2倍
D.时,正反应速率小于逆反应速率
17.下列解释事实的方程式错误的是( )
A.丙烯制备聚丙烯塑料:
B.铁粉与硫粉共热生成黑色物质:
C.食醋清除水壶中的水垢:
D.铝热反应原理:
18.一定温度下,在恒容密闭容器中发生反应:。当、的浓度不再变化时,下列说法正确的是( )
A.全部转化为 B.该反应达到化学平衡状态
C.、的浓度一定相等 D.消耗的同时消耗
19.对于下列事实的解释正确的是( )
A.金属钠放入无水乙醇中产生大量气体,说明乙醇是一种酸
B.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
C.向某溶液中插入铜丝,在试管口观察到红棕色气体,说明该溶液一定是浓硝酸
D.向某溶液中加入浓溶液,加热,产生能使湿润的红色石 试纸变蓝的气体,说明溶液中一定含有
20.下列关于煤和石油的叙述正确的是( )
A.煤和石油均属于可再生矿物能源 B.煤的干馏和石油的分馏都是化学变化
C.石油产品裂解能生产乙烯 D.石油分馏的各馏分均是纯净物
21.工业上常用下图所示的方法从海水中提溴,下列有关说法错误的是( )
A.物质为
B.步骤①的主要反应为:
C.步骤②利用了溴易挥发的性质
D.步骤②③的目的是富集溴元素
22.为了除去粗盐中的、、,可将粗盐溶于水,然后进行下列操作①过滤②加过量溶液③加适量稀盐酸④加过量溶液⑤加过量溶液。其中操作顺序正确的是( )
A.⑤②④①③ B.①④②⑤③ C.②④⑤①③ D.④①②⑤③
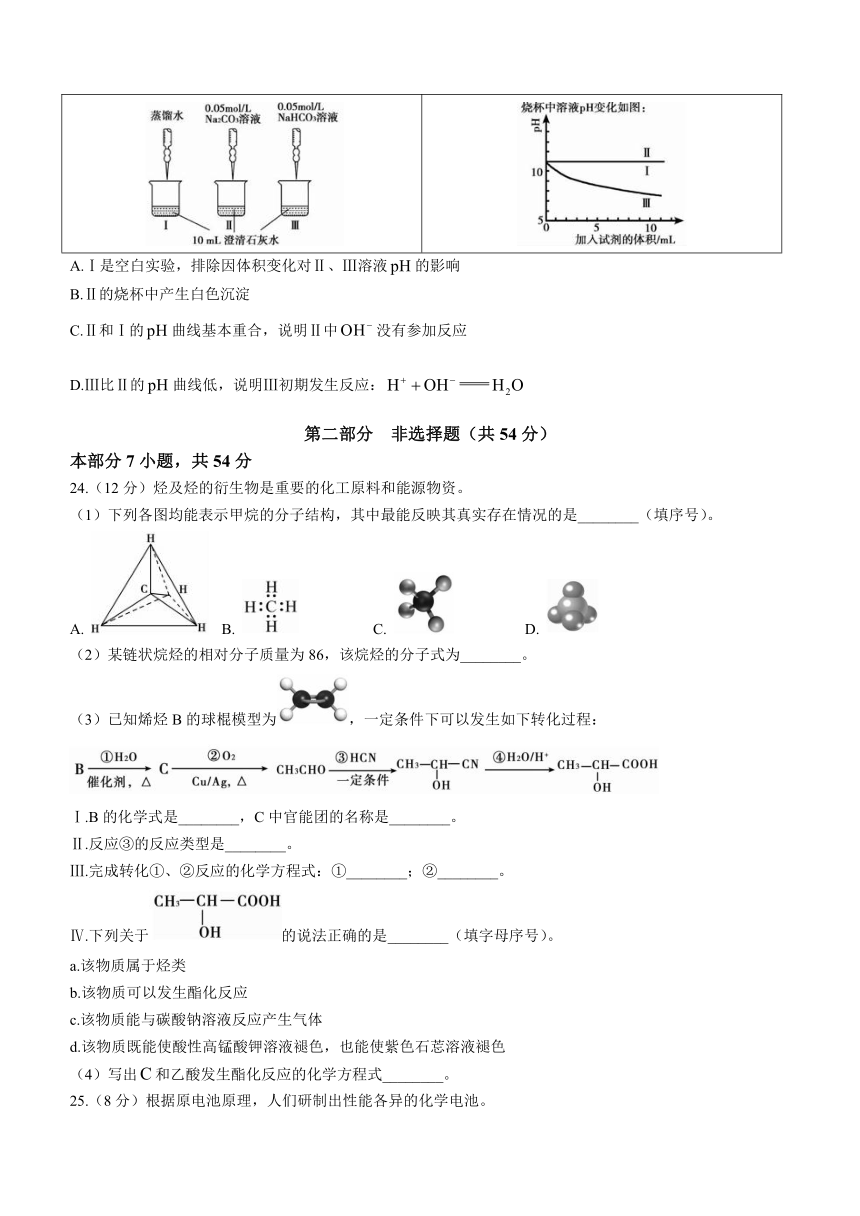
23.某实验小组用传感器探究、与澄清石灰水的反应。根据下表中的实验过程及数据,判断下列说法错误的是( )
实验过程 实验数据
A.Ⅰ是空白实验,排除因体积变化对Ⅱ、Ⅲ溶液的影响
B.Ⅱ的烧杯中产生白色沉淀
C.Ⅱ和Ⅰ的曲线基本重合,说明Ⅱ中没有参加反应
D.Ⅲ比Ⅱ的曲线低,说明Ⅲ初期发生反应:
第二部分 非选择题(共54分)
本部分7小题,共54分
24.(12分)烃及烃的衍生物是重要的化工原料和能源物资。
(1)下列各图均能表示甲烷的分子结构,其中最能反映其真实存在情况的是________(填序号)。
A. B. C. D.
(2)某链状烷烃的相对分子质量为86,该烷烃的分子式为________。
(3)已知烯烃B的球棍模型为,一定条件下可以发生如下转化过程:
Ⅰ.B的化学式是________,C中官能团的名称是________。
Ⅱ.反应③的反应类型是________。
Ⅲ.完成转化①、②反应的化学方程式:①________;②________。
Ⅳ.下列关于的说法正确的是________(填字母序号)。
a.该物质属于烃类
b.该物质可以发生酯化反应
c.该物质能与碳酸钠溶液反应产生气体
d.该物质既能使酸性高锰酸钾溶液褪色,也能使紫色石莣溶液褪色
(4)写出和乙酸发生酯化反应的化学方程式________。
25.(8分)根据原电池原理,人们研制出性能各异的化学电池。
(1)锌铜原电池装置示意图如右图所示,Zn片作________(填“正极”或“负极”)。
(2)铜片上观察到的实验现象是________,锌片上的电极反应式为________。
(3)电流表指针发生偏转,说明该装置实现了化学能向________的转化。
(4)若把反应仿照上图设计成原电池,则两个电极分别为铜、________(填材料名称),电解质溶液为________(填化学式)。
(5)镁、海水、溶解氧可构成原电池,为水下小功率设备长时间供电,结构示意图如图所示,其总反应为:。下列说法正确的是________(填字母序号)。
a.Mg作电池的负极 b.发生氧化反应
26.(6分)A、B、C、D四种物质的相互转化关系如图(部分反应条件及产物略去)。
(1)若A是黄色固体单质,则B为________,D的浓溶液与铜反应的化学方程式是________。
(2)若A是空气中的主要成分,C是红棕色气体,则A的化学式为________,D的浓溶液需保存在棕色试剂瓶中,并放置在阴凉处,原因是________(用化学方程式表示)。
27.(6分)化学反应发生物质变化的同时伴随着能量的变化。回答下列问题:
(1)汽车尾气中NO生成过程的能量变化如图所示。和完全反应生成NO会________(填“吸收”或“放出”)________能量。
和反应生成过程中的能量变化
(2)一种新型催化剂能使和发生反应:。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
实验编号 T/℃ NO初始浓度 CO初始浓度 催化剂的比表面积
Ⅰ 280 82
Ⅱ 280 124
Ⅲ 350 82
(1)表中________;能验证温度对化学反应速率影响规律的是________(填实验编号)。
(2)实验Ⅰ和实验Ⅱ中,NO的物质的量浓度随时间的变化曲线如图所示,其中表示实验Ⅱ的是曲线________(填“甲”或“乙”)。
28.(4分)某课外活动小组利用如图所示装置探究甲烷和氯气的反应。
(1)实验中可观察到的现象有________(填字母)。
A.试管内液面上升,最终充满试管
B.试管内气体颜色逐渐变深
C.试管内壁出现油状液滴
D.试管内有少量白雾生成
(2)实验中,用饱和食盐水而不用水的原因是________。
(3)写出生成一氯甲烷的化学反应方程式:________。
29.(10分)某小组同学利用下图所示装置探究性质。回答下列问题:
(1)实验室常用亚硫酸钠与浓硫酸共热制取二氧化硫,反应的化学方程式为________。
(2)试管②溶液的作用是________(用化学方程式解释)。
(3)若X为品红溶液,可观察到试管①中溶液________(填实验现象,下同),反应后取下试管①并加热,观察到的现象是________。
(4)若为酸性溶液,可观察到试管①中溶液由紫色变为无色,由此可知具有________(填“氧化性”或“还原性”);推断无色溶液中所含的离子是、、和________。
(5)若为溶液,写出试管①中反应的化学方程式________。
30.(8分)镁及其合金是用途很广的金属材料。工业上冶炼镁的方法有两种,电解法和皮江法。电解法是电解熔融的,皮江法是在高温下还原。
已知:相关各物质熔点见下表:
物质
熔点 2852 714 649 1410
Ⅰ.电解法冶炼镁。
化工厂利用卤水(主要成分为和)生产金属镁的一种工艺流程如图所示:
(1)与反应后的产物溶于水可得溶液,从而实现了的再利用,则的化学式为________。
(2)“沉淀”中除了外,还可能含有的杂质是________(填化学式)。
(3)工业上不采用电解制金属镁的原因:________。
Ⅱ.皮江法冶炼锌,工业流程如下:
(4)气体为________(填化学式)。
(5)白云石缎烧前粉碎的目的是________。
(6)还原炉需控制温度为1200℃左右,并抽空气到近似真空。还原炉中发生的主要反应有________、。
西宁市2022-2023学年高一下学期期末调研测试
化学参考答案及评分意见
说明:本答案供阅卷评分时使用,考生若写出其它合理答案,均可参照评分意见给分
第一部分 选择题
(本部分共23个小题,每小题2分,共46分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23
答案 C C B A A D D C D B A D B B B C A B D C A A D
第二部分 非选择题
(本部分共7个小题,没有特别注明化学方程式或离子方程式每空2分,其余每空1分,共54分)
24.(12分)
(1)D
(2)
(3)Ⅰ 羟基
Ⅱ.加成反应
Ⅲ.
Ⅳ.b c
(4)
25.(8分)
(1)负极
(2)有气泡产生
(3)电能
(4)银(或铂、石墨等其它合理答案);(或)
(5)a
26.(6分)
(1)(或二氧化硫);
(2);
27.(1)吸收;180
(2)① Ⅰ和Ⅲ(2分);
②乙
28.(4分)
(1)CD
(2)降低在水中的溶解度
(3)
29.(10分)
(1)
(2)
(3)品红溶液褪色(或溶液由红色变为无色);溶液由无色变为红色
(4)还原性;
(5)
30.(8分)
(1)
(2)
(3)熔点很高(2852℃),而熔点相对较低(714℃),熔融时会耗费大量的能量而增加生产成本(2分)
(4)
(5)增大固体表面积,提高化学反应速率
(6)
化学
注意事项:
1.本试卷满分100分,考试时间120分钟。
2.本试卷为试题卷,不允许作为答题卷使用,答题部分请在答题卡上作答,否则无效。
3.答题前,考生务必将自己的姓名、准考证号、考场、座位号填写在答题卡上,同时将学校、姓名、准考证号、考场填写在试卷上。
4.选择题用2B铅笔把答题卡上对应题目的答案标号涂黑(如需改动,用橡皮擦干净后,再选涂其它答案标号)。非选择题用0.5毫米的黑色签字笔答在答题卡相应的位置,书写工整,字迹清晰。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 S-32 Cu-64
第一部分 选择题(共46分)
(本部分共23小题,每小题2分,共46分。在每小题列出的四个选项中,选出符合题目要求的一项。)
1.“碳中和”是指确定时间内排放的碳总量与吸取的碳总量相互抵消,实现二氧化碳相对“零排放”。下列措施对推进碳中和最有效的是( )
A.用汽油代替柴油 B.使用无磷洗衣粉
C.用二氧化碳合成淀粉 D.推行生活垃圾分类
2.下列不属于传统硅酸盐产品的是( )
A.玻璃 B.水泥 C.石墨烯 D.陶瓷
3.《黄帝内经》有如下叙述:“五谷为养,五果为助,五畜为益,五菜为充”。下列有关营养物质的说法错误的是( )
A.葡萄糖和果糖互为同分异构体 B.淀粉和纤维素都能为人体提供能量
C.蛋白质在人体内最终水解为氨基酸 D.油脂能促进脂溶性维生素的吸收
4.下列有关化学用语叙述正确的是( )
A.中子数为10的氧原子: B.乙烯的结构简式
C.氧原子的结构示意图: D.氨的电子式:
5.下列有关硅及其化合物的说法正确的是( )
A.硅酸盐化学性质稳定,是由于其结构中存在硅氧四面体
B.实验室用带玻璃塞的试剂瓶保存溶液
C.是酸性氧化物,能够与水反应生成
D.硅的化学性质稳定,在自然界中大部分以游离态存在
6.金属冶炼通常有热分解法、热还原法和电解法。下列金属中,需要用电解法冶炼的是( )
A. B. C. D.
7.用下列仪器或装置进行相应实验,可以达到实验目的的是( )
A.证明是分解的催经剂 B.制备并收集乙酸乙酯 C.收集气体 D.实验室制
8.下列物质的用途错误的是( )
A.液氨可用作制冷剂 B.可用作纸浆的漂白
C.浓硝酸可用作干燥剂 D.单质硅可作半导体材料
9.利用氮元素价类二维图可以从不同角度研究含氮物质的性质及其转化关系。下列说法错误的是( )
A.既有氧化性又有还原性
B.通过转化①②③可实现工业制备硝酸
C.自然界可实现上述转化④,这是一种氮的固定
D.受热分解生成、和,氧化产物和还原产物的物质的量之比为
10.工业生产中为了盛装大量浓硝酸,可作为罐体材料的是( )
A.锌 B.铝 C.铜 D.铂
11.下列反应属于放热反应的是( )
A.一氧化碳在空气中的燃烧反应 B.与氯化铵固体的反应
C.干冰升华 D.盐酸与碳酸氢钠的反应
12.下列物质不能用作食品添加剂的是( )
A.氯化镁 B.亚硝酸钠 C.山梨酸钾 D.三聚氰胺
13.含4个碳原子的烃分子结构中,碳原子相互结合的几种方式如下图,下列说法错误的是
A.①②⑧均为饱和烃 B.③④互为同系物
C.⑥⑦属于炔烃 D.⑤⑨互为同分异构体
14.设为阿伏加德罗常数的值。下列叙述正确的是( )
A.甲基中所含有的电子数为
B.与反应生成的分子数少于
C.灼热的铜丝在足量硫蒸气里完全燃烧,转移电子总数为
D.将与混合光照,充分反应后,生成分子数为
15.在某一化学反应中,生成物的浓度在内从变成,则内用生成物表示的化学反应速率是( )
A. B.
C. D.
16.在一定条件下,容器内某一反应中参加反应的气体和气体的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
A.反应的化学方程式为
B.时,正、逆反应速率相等,达到平衡
C.时,的浓度是的浓度的2倍
D.时,正反应速率小于逆反应速率
17.下列解释事实的方程式错误的是( )
A.丙烯制备聚丙烯塑料:
B.铁粉与硫粉共热生成黑色物质:
C.食醋清除水壶中的水垢:
D.铝热反应原理:
18.一定温度下,在恒容密闭容器中发生反应:。当、的浓度不再变化时,下列说法正确的是( )
A.全部转化为 B.该反应达到化学平衡状态
C.、的浓度一定相等 D.消耗的同时消耗
19.对于下列事实的解释正确的是( )
A.金属钠放入无水乙醇中产生大量气体,说明乙醇是一种酸
B.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
C.向某溶液中插入铜丝,在试管口观察到红棕色气体,说明该溶液一定是浓硝酸
D.向某溶液中加入浓溶液,加热,产生能使湿润的红色石 试纸变蓝的气体,说明溶液中一定含有
20.下列关于煤和石油的叙述正确的是( )
A.煤和石油均属于可再生矿物能源 B.煤的干馏和石油的分馏都是化学变化
C.石油产品裂解能生产乙烯 D.石油分馏的各馏分均是纯净物
21.工业上常用下图所示的方法从海水中提溴,下列有关说法错误的是( )
A.物质为
B.步骤①的主要反应为:
C.步骤②利用了溴易挥发的性质
D.步骤②③的目的是富集溴元素
22.为了除去粗盐中的、、,可将粗盐溶于水,然后进行下列操作①过滤②加过量溶液③加适量稀盐酸④加过量溶液⑤加过量溶液。其中操作顺序正确的是( )
A.⑤②④①③ B.①④②⑤③ C.②④⑤①③ D.④①②⑤③
23.某实验小组用传感器探究、与澄清石灰水的反应。根据下表中的实验过程及数据,判断下列说法错误的是( )
实验过程 实验数据
A.Ⅰ是空白实验,排除因体积变化对Ⅱ、Ⅲ溶液的影响
B.Ⅱ的烧杯中产生白色沉淀
C.Ⅱ和Ⅰ的曲线基本重合,说明Ⅱ中没有参加反应
D.Ⅲ比Ⅱ的曲线低,说明Ⅲ初期发生反应:
第二部分 非选择题(共54分)
本部分7小题,共54分
24.(12分)烃及烃的衍生物是重要的化工原料和能源物资。
(1)下列各图均能表示甲烷的分子结构,其中最能反映其真实存在情况的是________(填序号)。
A. B. C. D.
(2)某链状烷烃的相对分子质量为86,该烷烃的分子式为________。
(3)已知烯烃B的球棍模型为,一定条件下可以发生如下转化过程:
Ⅰ.B的化学式是________,C中官能团的名称是________。
Ⅱ.反应③的反应类型是________。
Ⅲ.完成转化①、②反应的化学方程式:①________;②________。
Ⅳ.下列关于的说法正确的是________(填字母序号)。
a.该物质属于烃类
b.该物质可以发生酯化反应
c.该物质能与碳酸钠溶液反应产生气体
d.该物质既能使酸性高锰酸钾溶液褪色,也能使紫色石莣溶液褪色
(4)写出和乙酸发生酯化反应的化学方程式________。
25.(8分)根据原电池原理,人们研制出性能各异的化学电池。
(1)锌铜原电池装置示意图如右图所示,Zn片作________(填“正极”或“负极”)。
(2)铜片上观察到的实验现象是________,锌片上的电极反应式为________。
(3)电流表指针发生偏转,说明该装置实现了化学能向________的转化。
(4)若把反应仿照上图设计成原电池,则两个电极分别为铜、________(填材料名称),电解质溶液为________(填化学式)。
(5)镁、海水、溶解氧可构成原电池,为水下小功率设备长时间供电,结构示意图如图所示,其总反应为:。下列说法正确的是________(填字母序号)。
a.Mg作电池的负极 b.发生氧化反应
26.(6分)A、B、C、D四种物质的相互转化关系如图(部分反应条件及产物略去)。
(1)若A是黄色固体单质,则B为________,D的浓溶液与铜反应的化学方程式是________。
(2)若A是空气中的主要成分,C是红棕色气体,则A的化学式为________,D的浓溶液需保存在棕色试剂瓶中,并放置在阴凉处,原因是________(用化学方程式表示)。
27.(6分)化学反应发生物质变化的同时伴随着能量的变化。回答下列问题:
(1)汽车尾气中NO生成过程的能量变化如图所示。和完全反应生成NO会________(填“吸收”或“放出”)________能量。
和反应生成过程中的能量变化
(2)一种新型催化剂能使和发生反应:。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
实验编号 T/℃ NO初始浓度 CO初始浓度 催化剂的比表面积
Ⅰ 280 82
Ⅱ 280 124
Ⅲ 350 82
(1)表中________;能验证温度对化学反应速率影响规律的是________(填实验编号)。
(2)实验Ⅰ和实验Ⅱ中,NO的物质的量浓度随时间的变化曲线如图所示,其中表示实验Ⅱ的是曲线________(填“甲”或“乙”)。
28.(4分)某课外活动小组利用如图所示装置探究甲烷和氯气的反应。
(1)实验中可观察到的现象有________(填字母)。
A.试管内液面上升,最终充满试管
B.试管内气体颜色逐渐变深
C.试管内壁出现油状液滴
D.试管内有少量白雾生成
(2)实验中,用饱和食盐水而不用水的原因是________。
(3)写出生成一氯甲烷的化学反应方程式:________。
29.(10分)某小组同学利用下图所示装置探究性质。回答下列问题:
(1)实验室常用亚硫酸钠与浓硫酸共热制取二氧化硫,反应的化学方程式为________。
(2)试管②溶液的作用是________(用化学方程式解释)。
(3)若X为品红溶液,可观察到试管①中溶液________(填实验现象,下同),反应后取下试管①并加热,观察到的现象是________。
(4)若为酸性溶液,可观察到试管①中溶液由紫色变为无色,由此可知具有________(填“氧化性”或“还原性”);推断无色溶液中所含的离子是、、和________。
(5)若为溶液,写出试管①中反应的化学方程式________。
30.(8分)镁及其合金是用途很广的金属材料。工业上冶炼镁的方法有两种,电解法和皮江法。电解法是电解熔融的,皮江法是在高温下还原。
已知:相关各物质熔点见下表:
物质
熔点 2852 714 649 1410
Ⅰ.电解法冶炼镁。
化工厂利用卤水(主要成分为和)生产金属镁的一种工艺流程如图所示:
(1)与反应后的产物溶于水可得溶液,从而实现了的再利用,则的化学式为________。
(2)“沉淀”中除了外,还可能含有的杂质是________(填化学式)。
(3)工业上不采用电解制金属镁的原因:________。
Ⅱ.皮江法冶炼锌,工业流程如下:
(4)气体为________(填化学式)。
(5)白云石缎烧前粉碎的目的是________。
(6)还原炉需控制温度为1200℃左右,并抽空气到近似真空。还原炉中发生的主要反应有________、。
西宁市2022-2023学年高一下学期期末调研测试
化学参考答案及评分意见
说明:本答案供阅卷评分时使用,考生若写出其它合理答案,均可参照评分意见给分
第一部分 选择题
(本部分共23个小题,每小题2分,共46分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23
答案 C C B A A D D C D B A D B B B C A B D C A A D
第二部分 非选择题
(本部分共7个小题,没有特别注明化学方程式或离子方程式每空2分,其余每空1分,共54分)
24.(12分)
(1)D
(2)
(3)Ⅰ 羟基
Ⅱ.加成反应
Ⅲ.
Ⅳ.b c
(4)
25.(8分)
(1)负极
(2)有气泡产生
(3)电能
(4)银(或铂、石墨等其它合理答案);(或)
(5)a
26.(6分)
(1)(或二氧化硫);
(2);
27.(1)吸收;180
(2)① Ⅰ和Ⅲ(2分);
②乙
28.(4分)
(1)CD
(2)降低在水中的溶解度
(3)
29.(10分)
(1)
(2)
(3)品红溶液褪色(或溶液由红色变为无色);溶液由无色变为红色
(4)还原性;
(5)
30.(8分)
(1)
(2)
(3)熔点很高(2852℃),而熔点相对较低(714℃),熔融时会耗费大量的能量而增加生产成本(2分)
(4)
(5)增大固体表面积,提高化学反应速率
(6)
同课章节目录
