化学人教版(2019)必修第一册1.1.2物质的转化 课件(共30张PPT,含内嵌视频)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.1.2物质的转化 课件(共30张PPT,含内嵌视频) |  | |
| 格式 | pptx | ||
| 文件大小 | 56.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-07 21:31:26 | ||
图片预览










文档简介
(共30张PPT)
第一节 物质的分类及转化
第一章 物质及其变化
第2课时:物质的转化
目 录
CONTENTS
01
酸、碱、盐的性质
02
物质的转化
学习目标
1.熟知酸、碱、盐的性质,会写相关反应的化学方程式,并判断其反应类型。
2.认识同类物质具有相似的化学性质,熟悉单质、酸、碱、盐、氧化物等之间的转化关系。
(本页可根据需要自行删除)
①由于ppt含较多高质量素材和视频,故资源比较大。
②所用视频均内嵌在ppt中,不需要另外下载。本节共有2个视频,根据需要选择即时播放。
视频清单
①酸碱盐的性质
②四大反应类型
致老师和同学们
美丽的溶洞——自然界中物质的转化
自然界中的溶洞景观,千奇百怪,引人入胜,在惊叹自然界美丽之余,你是否想过,如此坚硬的石头怎么会溶成一个大洞呢?
石灰石的主要成分与溶有CO2的水发生了化学反应而被溶解:
CaCO3+CO2+H2O=Ca(HCO3)2
生成的Ca(HCO3)2在受热时又分解,
Ca(HCO3)2 = CaCO3↓+CO2↑+H2O
又沉降出CaCO3,如此一来就形成了溶洞景观
新课导入
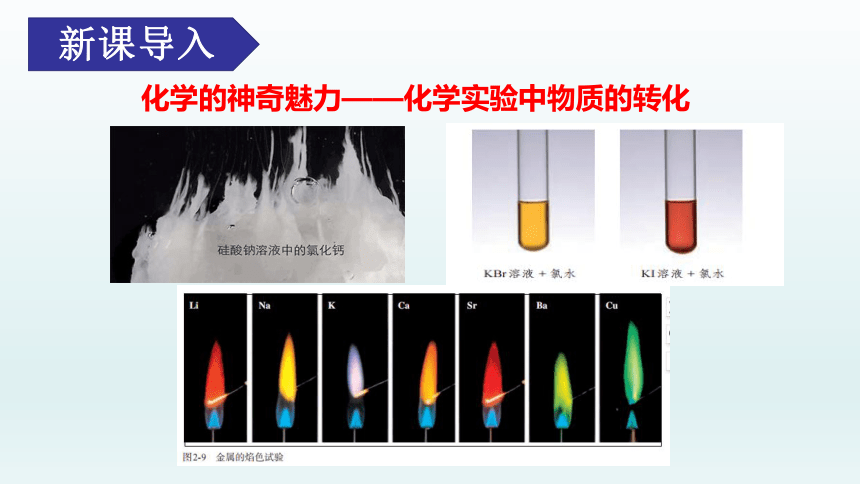
化学的神奇魅力——化学实验中物质的转化
新课导入
通过对物质进行分类,我们可以更好地认识某类物质的性质,以及不同类别物质之间的转化关系,进而利用物质的性质和物质之间的转化关系,制备人类生活和生产所需要的新物质。
新课导入
1
酸、碱、盐的化学性质
以盐酸、氢氧化钠、碳酸钠和氯化镁为例,联系初中所学知识回答酸、碱、盐有哪些主要化学性质,完成教材P10页“思考与讨论”。
01 酸碱盐的化学性质
一、酸、碱、盐的化学性质
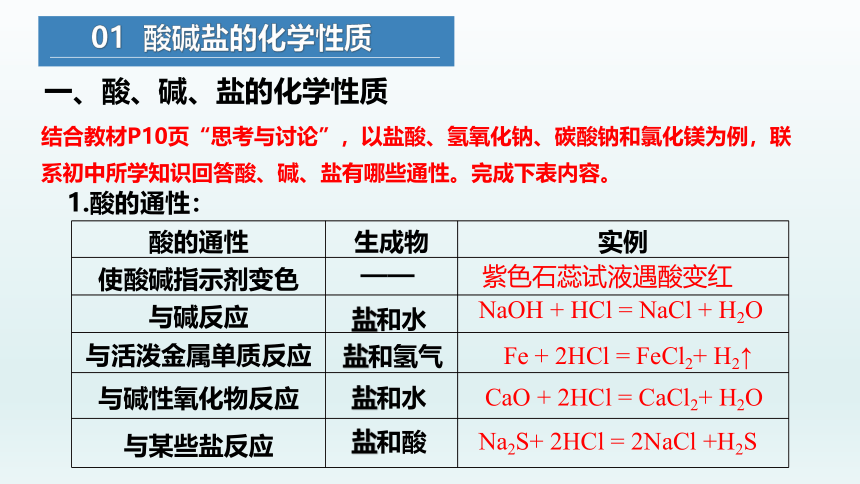
结合教材P10页“思考与讨论”,以盐酸、氢氧化钠、碳酸钠和氯化镁为例,联系初中所学知识回答酸、碱、盐有哪些通性。完成下表内容。
酸的通性 生成物 实例
使酸碱指示剂变色
与碱反应
与活泼金属单质反应
与碱性氧化物反应
与某些盐反应
盐和水
盐和氢气
盐和水
盐和酸
NaOH + HCl = NaCl + H2O
Fe + 2HCl = FeCl2+ H2↑
CaO + 2HCl = CaCl2+ H2O
Na2S+ 2HCl = 2NaCl +H2S
1.酸的通性:
01 酸碱盐的化学性质
一、酸、碱、盐的化学性质
紫色石蕊试液遇酸变红
——
2.碱的通性:
碱的通性 生成物 实例
使酸碱指示剂变色
与酸反应
与酸性氧化物反应
与某些盐反应
盐和水
盐和水
盐和碱
NaOH + HCl = NaCl + H2O
2NaOH + CO2= Na2CO3+ H2O
2NaOH + MgCl2= Mg(OH)2↓ + 2NaCl
01 酸碱盐的化学性质
无色酚酞试液遇碱变红,紫色石蕊试液遇碱变蓝
——
(1)酸的通性
01 酸碱盐的化学性质
小结
(2)碱的通性
3.盐的通性:
盐的通性 生成物 实例
某些盐与酸反应
某些盐与碱反应
某些盐与某些盐反应
盐和碱
盐和酸
盐和盐
Na2CO3+ 2HCl = 2NaCl + CO2↑ + H2O
MgCl2+ 2NaOH = Mg(OH)2↓ + 2NaCl
Na2CO3+ CaCl2= 2NaCl + CaCO3↓
01 酸碱盐的化学性质
酸碱盐的性质视频
01 酸碱盐的化学性质
为什么不同的酸或碱或盐具有相似的化学性质
宏观辨识
组成相似
微观探析
H+
HCl
H2SO4
HNO3
NaOH
KOH
Ba(OH)2
Na2CO3
K2CO3
(NH4)2CO3
OH-
CO32—
结构
决定
性质(四大反应类型)
01 酸碱盐的化学性质
思考?
四大反应类型视频
(化合反应 、分解反应、置换反应 复分解反应)
01 酸碱盐的化学性质
2
物质的转化
根据物质的组成和性质,通过化学变化可以实现物质之间的转化。请同学们完成P11思考与讨论。
二、物质的转化
02 单质、氧化物、酸、碱、盐间的转化关系
根据物质的组成和性质,通过化学变化可以实现物质
之间的转化。
非金属单质 酸性氧化物 酸 盐
金属单质 碱性氧化物 碱 盐
① 2Ca+O2 = 2CaO
② CaO+H2O = Ca(OH)2
③ Ca(OH)2+SO3 =CaSO4↓+H2O
④C+O2 = CO2
⑤CO2+H2O = H2CO3
⑥Ca(OH)2+H2CO3 = CaCO3↓+2H2O
Ca CaO Ca(OH)2 CaSO4
C CO2 H2CO3 CaCO3
02 单质、氧化物、酸、碱、盐间的转化关系
小结
1.单质、氧化物、酸、碱和盐之间的转化关系
二、物质的转化
02 单质、氧化物、酸、碱、盐间的转化关系
2.物质转化应注意的问题
二、物质的转化
02 单质、氧化物、酸、碱、盐间的转化关系
(1)化学变化过程中,元素是不会改变的。即化学反应中的质量守恒。
(2)物质间发生转化往往需要一定的条件,如光照、加热(或高温)、催化剂、高压、点燃等。(3)学习物质的通性不仅要注意一般情况,也要注意特殊情况。如金属+酸→盐+氢气,但铜与盐酸就不反应,与其他酸反应不产生氢气。(4)工业上生产某种物质还要考虑原料、成本及设备等因素。
——化学科研工作者
化学与职业
化学科研工作者是指从事与化学有关的基础研究和应用研究的专业技术人员。其主要工作是:在原子、分子水平上研究物质的组成、结构、性质及相互关系;研究物质转化的规律和控制手段;在此基础上,研究如何实现物质的人工转化以及如何对生活、生产和生命中的化学过程实现按需调控等等。
例如,具有特定功能(如催化作用)的新分子的合成、
安全高效和节能环保物质转化工艺的研发等。这些
工作不仅与经济发展、社会进步关系密切,而且是
材料、生命、环境、能源和信息等现代科学技术发
展的重要基础。
02 单质、氧化物、酸、碱、盐间的转化关系
知识点一 酸、碱、盐的性质
[典例1] 下列有关物质的分类及反应均正确的是( )
A.碳酸钙属于盐,可用于实验室制CO2:
CaCO3+H2SO4===CaSO4+H2O+CO2↑
B.铁属于较活泼金属,可用于实验室制H2:
2Fe+6HCl===2FeCl3+3H2↑
C.纯碱属于碱,可与稀盐酸发生反应:
Na2CO3+2HCl===2NaCl+H2O+CO2↑
D.烧碱属于碱,可与稀硫酸反应:
2NaOH+H2SO4===Na2SO4+2H2O
【答案】答案 D
解析 A项,实验室制CO2是利用碳酸钙与盐酸反应;B项,铁与盐酸反应的化学方程式为Fe+2HCl===FeCl2+H2↑;C项,纯碱属于盐。
03 对 点 训 练
知识点二 物质的转化
[典例2] 如图,“——”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下通过置换反应可以转化为乙。下面四组选项中,符合图示要求的是( )
【答案】C
【解析】A项,H2SO4和Na2SO4、Na2SO4和NaOH、NaOH和NaCl、NaCl和H2SO4不反应;B项,BaCl2和KOH不反应;D项,Cu与HCl不发生反应;C项,C+H2OCO+H2。
03 对 点 训 练
选项 甲 乙 丙 丁
A H2SO4 Na2SO4 NaOH NaCl
B BaCl2 K2CO3 HCl KOH
C O2 CO CuO C
D Fe CuCl2 Zn HCl
1.判断正误,正确的打“√”,错误的打“×”。
(1)Cu可与AgNO3溶液发生置换反应。( )
(2)由H2SO4可以与BaCl2反应,可类推HCl也可以与BaCl2反应。( )
(3)利用稀硫酸或盐酸与块状石灰石反应,都可制取CO2。( )
(4)Na2CO3溶液遇酚酞变红,所以Na2CO3是碱。( )
(5)只有利用酸碱中和反应才能生成盐。( )
(6)可用Fe2O3与H2O反应制取Fe(OH)3。( )
答案 (1)√ (2)× (3)× (4)× (5)× (6)×
04 课堂效果达标
2.下列物质间的转化能一步实现的是( )
A.Na2CO3→NaOH B.CaCO3→Ca(OH)2
C.NaNO3→NaCl D.FeSO4→CuSO4
【答案】A
【详解】Na2CO3+Ca(OH)2===CaCO3↓+2NaOH;CaCO3不溶于水,故不能与可溶性碱反应得到Ca(OH)2;NaNO3无论与哪种物质反应均无法得到NaCl;FeSO4与金属铜、Cu(OH)2及可溶性铜盐都不能反应,故不能得到CuSO4。
04 课堂效果达标
3.下列有关酸和碱的说法错误的是( )
A.用稀盐酸能鉴别氯化钠与碳酸钠
B.锌和稀硫酸反应生成硫酸锌和氢气
C.食盐可以用来改良酸性土壤
D.常温下测得某溶液的pH=0,则该溶液一定显酸性
【答案】C
【详解】食盐主要成分是NaCl,NaCl不显碱性,不能用来改良酸性土壤,C错误。
04 课堂效果达标
4.现有A、B、C、D四种物质,它们分别是Fe、HCl(稀)、NaOH(溶液)、AgNO3(溶液)四种物质中的一种,它们之间的反应关系及所发生反应的反应类型如图:则物质B为( )
A.Fe B.HCl(稀)
C.NaOH(溶液) D.AgNO3(溶液)
【答案】B
【详解】物质B与A发生中和反应,则B为酸或碱,又由于B与C可发生置换反应,可判断B为HCl(稀)。
04 课堂效果达标
5.下表所列各组物质中,物质之间按箭头方向不能通过一步反应实现如图所示转化的是( )
【答案】C
【详解】A.CuO与CO反应生成铜和CO2,CO2与碱反应生成水,氧化铜与氢气反应能生成水;B.碳不完全燃烧生成一氧化碳,一氧化碳继续燃烧生成二氧化碳,碳完全燃烧生成二氧化碳;C.CaCO3难溶于水,不与碱溶液发生反应,不能生成氢氧化钙;D.硫酸与碱反应可以生成水,与活泼金属反应生成氢气,电解水生成氢气。
04 课堂效果达标
选项物质 甲 乙 丙
A CuO CO2 H2O
B C CO CO2
C CaCO3 CaO Ca(OH)2
D H2SO4 H2O H2
谢谢观赏
第一节 物质的分类及转化
第一章 物质及其变化
第2课时:物质的转化
目 录
CONTENTS
01
酸、碱、盐的性质
02
物质的转化
学习目标
1.熟知酸、碱、盐的性质,会写相关反应的化学方程式,并判断其反应类型。
2.认识同类物质具有相似的化学性质,熟悉单质、酸、碱、盐、氧化物等之间的转化关系。
(本页可根据需要自行删除)
①由于ppt含较多高质量素材和视频,故资源比较大。
②所用视频均内嵌在ppt中,不需要另外下载。本节共有2个视频,根据需要选择即时播放。
视频清单
①酸碱盐的性质
②四大反应类型
致老师和同学们
美丽的溶洞——自然界中物质的转化
自然界中的溶洞景观,千奇百怪,引人入胜,在惊叹自然界美丽之余,你是否想过,如此坚硬的石头怎么会溶成一个大洞呢?
石灰石的主要成分与溶有CO2的水发生了化学反应而被溶解:
CaCO3+CO2+H2O=Ca(HCO3)2
生成的Ca(HCO3)2在受热时又分解,
Ca(HCO3)2 = CaCO3↓+CO2↑+H2O
又沉降出CaCO3,如此一来就形成了溶洞景观
新课导入
化学的神奇魅力——化学实验中物质的转化
新课导入
通过对物质进行分类,我们可以更好地认识某类物质的性质,以及不同类别物质之间的转化关系,进而利用物质的性质和物质之间的转化关系,制备人类生活和生产所需要的新物质。
新课导入
1
酸、碱、盐的化学性质
以盐酸、氢氧化钠、碳酸钠和氯化镁为例,联系初中所学知识回答酸、碱、盐有哪些主要化学性质,完成教材P10页“思考与讨论”。
01 酸碱盐的化学性质
一、酸、碱、盐的化学性质
结合教材P10页“思考与讨论”,以盐酸、氢氧化钠、碳酸钠和氯化镁为例,联系初中所学知识回答酸、碱、盐有哪些通性。完成下表内容。
酸的通性 生成物 实例
使酸碱指示剂变色
与碱反应
与活泼金属单质反应
与碱性氧化物反应
与某些盐反应
盐和水
盐和氢气
盐和水
盐和酸
NaOH + HCl = NaCl + H2O
Fe + 2HCl = FeCl2+ H2↑
CaO + 2HCl = CaCl2+ H2O
Na2S+ 2HCl = 2NaCl +H2S
1.酸的通性:
01 酸碱盐的化学性质
一、酸、碱、盐的化学性质
紫色石蕊试液遇酸变红
——
2.碱的通性:
碱的通性 生成物 实例
使酸碱指示剂变色
与酸反应
与酸性氧化物反应
与某些盐反应
盐和水
盐和水
盐和碱
NaOH + HCl = NaCl + H2O
2NaOH + CO2= Na2CO3+ H2O
2NaOH + MgCl2= Mg(OH)2↓ + 2NaCl
01 酸碱盐的化学性质
无色酚酞试液遇碱变红,紫色石蕊试液遇碱变蓝
——
(1)酸的通性
01 酸碱盐的化学性质
小结
(2)碱的通性
3.盐的通性:
盐的通性 生成物 实例
某些盐与酸反应
某些盐与碱反应
某些盐与某些盐反应
盐和碱
盐和酸
盐和盐
Na2CO3+ 2HCl = 2NaCl + CO2↑ + H2O
MgCl2+ 2NaOH = Mg(OH)2↓ + 2NaCl
Na2CO3+ CaCl2= 2NaCl + CaCO3↓
01 酸碱盐的化学性质
酸碱盐的性质视频
01 酸碱盐的化学性质
为什么不同的酸或碱或盐具有相似的化学性质
宏观辨识
组成相似
微观探析
H+
HCl
H2SO4
HNO3
NaOH
KOH
Ba(OH)2
Na2CO3
K2CO3
(NH4)2CO3
OH-
CO32—
结构
决定
性质(四大反应类型)
01 酸碱盐的化学性质
思考?
四大反应类型视频
(化合反应 、分解反应、置换反应 复分解反应)
01 酸碱盐的化学性质
2
物质的转化
根据物质的组成和性质,通过化学变化可以实现物质之间的转化。请同学们完成P11思考与讨论。
二、物质的转化
02 单质、氧化物、酸、碱、盐间的转化关系
根据物质的组成和性质,通过化学变化可以实现物质
之间的转化。
非金属单质 酸性氧化物 酸 盐
金属单质 碱性氧化物 碱 盐
① 2Ca+O2 = 2CaO
② CaO+H2O = Ca(OH)2
③ Ca(OH)2+SO3 =CaSO4↓+H2O
④C+O2 = CO2
⑤CO2+H2O = H2CO3
⑥Ca(OH)2+H2CO3 = CaCO3↓+2H2O
Ca CaO Ca(OH)2 CaSO4
C CO2 H2CO3 CaCO3
02 单质、氧化物、酸、碱、盐间的转化关系
小结
1.单质、氧化物、酸、碱和盐之间的转化关系
二、物质的转化
02 单质、氧化物、酸、碱、盐间的转化关系
2.物质转化应注意的问题
二、物质的转化
02 单质、氧化物、酸、碱、盐间的转化关系
(1)化学变化过程中,元素是不会改变的。即化学反应中的质量守恒。
(2)物质间发生转化往往需要一定的条件,如光照、加热(或高温)、催化剂、高压、点燃等。(3)学习物质的通性不仅要注意一般情况,也要注意特殊情况。如金属+酸→盐+氢气,但铜与盐酸就不反应,与其他酸反应不产生氢气。(4)工业上生产某种物质还要考虑原料、成本及设备等因素。
——化学科研工作者
化学与职业
化学科研工作者是指从事与化学有关的基础研究和应用研究的专业技术人员。其主要工作是:在原子、分子水平上研究物质的组成、结构、性质及相互关系;研究物质转化的规律和控制手段;在此基础上,研究如何实现物质的人工转化以及如何对生活、生产和生命中的化学过程实现按需调控等等。
例如,具有特定功能(如催化作用)的新分子的合成、
安全高效和节能环保物质转化工艺的研发等。这些
工作不仅与经济发展、社会进步关系密切,而且是
材料、生命、环境、能源和信息等现代科学技术发
展的重要基础。
02 单质、氧化物、酸、碱、盐间的转化关系
知识点一 酸、碱、盐的性质
[典例1] 下列有关物质的分类及反应均正确的是( )
A.碳酸钙属于盐,可用于实验室制CO2:
CaCO3+H2SO4===CaSO4+H2O+CO2↑
B.铁属于较活泼金属,可用于实验室制H2:
2Fe+6HCl===2FeCl3+3H2↑
C.纯碱属于碱,可与稀盐酸发生反应:
Na2CO3+2HCl===2NaCl+H2O+CO2↑
D.烧碱属于碱,可与稀硫酸反应:
2NaOH+H2SO4===Na2SO4+2H2O
【答案】答案 D
解析 A项,实验室制CO2是利用碳酸钙与盐酸反应;B项,铁与盐酸反应的化学方程式为Fe+2HCl===FeCl2+H2↑;C项,纯碱属于盐。
03 对 点 训 练
知识点二 物质的转化
[典例2] 如图,“——”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下通过置换反应可以转化为乙。下面四组选项中,符合图示要求的是( )
【答案】C
【解析】A项,H2SO4和Na2SO4、Na2SO4和NaOH、NaOH和NaCl、NaCl和H2SO4不反应;B项,BaCl2和KOH不反应;D项,Cu与HCl不发生反应;C项,C+H2OCO+H2。
03 对 点 训 练
选项 甲 乙 丙 丁
A H2SO4 Na2SO4 NaOH NaCl
B BaCl2 K2CO3 HCl KOH
C O2 CO CuO C
D Fe CuCl2 Zn HCl
1.判断正误,正确的打“√”,错误的打“×”。
(1)Cu可与AgNO3溶液发生置换反应。( )
(2)由H2SO4可以与BaCl2反应,可类推HCl也可以与BaCl2反应。( )
(3)利用稀硫酸或盐酸与块状石灰石反应,都可制取CO2。( )
(4)Na2CO3溶液遇酚酞变红,所以Na2CO3是碱。( )
(5)只有利用酸碱中和反应才能生成盐。( )
(6)可用Fe2O3与H2O反应制取Fe(OH)3。( )
答案 (1)√ (2)× (3)× (4)× (5)× (6)×
04 课堂效果达标
2.下列物质间的转化能一步实现的是( )
A.Na2CO3→NaOH B.CaCO3→Ca(OH)2
C.NaNO3→NaCl D.FeSO4→CuSO4
【答案】A
【详解】Na2CO3+Ca(OH)2===CaCO3↓+2NaOH;CaCO3不溶于水,故不能与可溶性碱反应得到Ca(OH)2;NaNO3无论与哪种物质反应均无法得到NaCl;FeSO4与金属铜、Cu(OH)2及可溶性铜盐都不能反应,故不能得到CuSO4。
04 课堂效果达标
3.下列有关酸和碱的说法错误的是( )
A.用稀盐酸能鉴别氯化钠与碳酸钠
B.锌和稀硫酸反应生成硫酸锌和氢气
C.食盐可以用来改良酸性土壤
D.常温下测得某溶液的pH=0,则该溶液一定显酸性
【答案】C
【详解】食盐主要成分是NaCl,NaCl不显碱性,不能用来改良酸性土壤,C错误。
04 课堂效果达标
4.现有A、B、C、D四种物质,它们分别是Fe、HCl(稀)、NaOH(溶液)、AgNO3(溶液)四种物质中的一种,它们之间的反应关系及所发生反应的反应类型如图:则物质B为( )
A.Fe B.HCl(稀)
C.NaOH(溶液) D.AgNO3(溶液)
【答案】B
【详解】物质B与A发生中和反应,则B为酸或碱,又由于B与C可发生置换反应,可判断B为HCl(稀)。
04 课堂效果达标
5.下表所列各组物质中,物质之间按箭头方向不能通过一步反应实现如图所示转化的是( )
【答案】C
【详解】A.CuO与CO反应生成铜和CO2,CO2与碱反应生成水,氧化铜与氢气反应能生成水;B.碳不完全燃烧生成一氧化碳,一氧化碳继续燃烧生成二氧化碳,碳完全燃烧生成二氧化碳;C.CaCO3难溶于水,不与碱溶液发生反应,不能生成氢氧化钙;D.硫酸与碱反应可以生成水,与活泼金属反应生成氢气,电解水生成氢气。
04 课堂效果达标
选项物质 甲 乙 丙
A CuO CO2 H2O
B C CO CO2
C CaCO3 CaO Ca(OH)2
D H2SO4 H2O H2
谢谢观赏
