第四章 第二节 第1课时 元素性质的周期性变化规律 课时练 (含答案)—2023-2024学年(人教版2019)高中化学必修1
文档属性
| 名称 | 第四章 第二节 第1课时 元素性质的周期性变化规律 课时练 (含答案)—2023-2024学年(人教版2019)高中化学必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 172.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-07 22:43:56 | ||
图片预览


文档简介
第二节 元素周期律
第1课时 元素性质的周期性变化规律
题组一 1~18号元素性质的周期性变化规律
1.下列说法正确的是( )
A.随着元素原子序数的递增,P、S、Cl、Ar的最高正化合价依次升高
B.随着元素原子序数的递增,Na、Mg、Al、Si的最低负化合价依次降低
C.原子序数为15的元素最高化合价为+3
D.随着原子序数的递增,第三周期主族元素的最高正化合价依次升高
2.第三周期主族元素中原子半径最大的是( )
A.Na B.Si C.S D.Cl
3.下列各组元素中,按从左到右的顺序,原子序数递增,元素的最高正化合价也递增的是( )
A.C、N、O、F B.Na、Be、B、C
C.P、S、Cl、Ar D.Na、Mg、Al、Si
题组二 元素周期律
4.元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次增大
C.元素原子核外电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
5.下列关于元素周期律的叙述正确的是( )
A.随着元素原子序数的递增,原子最外层电子数总是从1→8重复出现
B.元素的性质随着原子序数的递增而呈周期性变化
C.随着元素原子序数的递增,元素的最高化合价从+1→+7(O、F除外),最低化合价从-7→-1重复出现
D.元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化及元素主要化合价的周期性变化
6.(2022·威海高一期末)比较镁和铝金属性强弱的方法正确的是( )
A.将空气中放置已久的两种元素的单质分别与热水作用,比较产生气泡的快慢
B.比较两种金属的熔点
C.氢氧化镁的碱性比氢氧化铝强
D.将形状、大小相同的两种金属单质和足量盐酸反应,比较产生气体的量
7.(2023·温州高一期中)硫的非金属性不如氧强,下列叙述不能说明这一事实的是( )
A.S+O2SO2,O2是氧化剂,S是还原剂
B.硫是淡黄色固体,氧气是无色气体
C.H2SH2+S、2H2O2H2↑+O2↑
D.硫化氢露置在空气中易变浑浊
8.几种短周期元素的原子半径及主要化合价如下表:
元素代号 X Y Z W
原子半径/pm 160 143 70 66
主要化合价 +2 +3 +5、+3、-3 -2
下列叙述正确的是( )
A.X、Y元素的金属性:XB.Z元素的气态氢化物是弱碱
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
9.五种短周期元素X、Y、Z、M、W的原子序数与其常见化合价的关系如图所示,下列叙述正确的是( )
A.元素X可能为氢或锂
B.原子半径:r(Y)>r(M)
C.Z的最高价氧化物对应的水化物不能溶解在氢氧化钾溶液中
D.H3MO4的酸性比HWO4的强
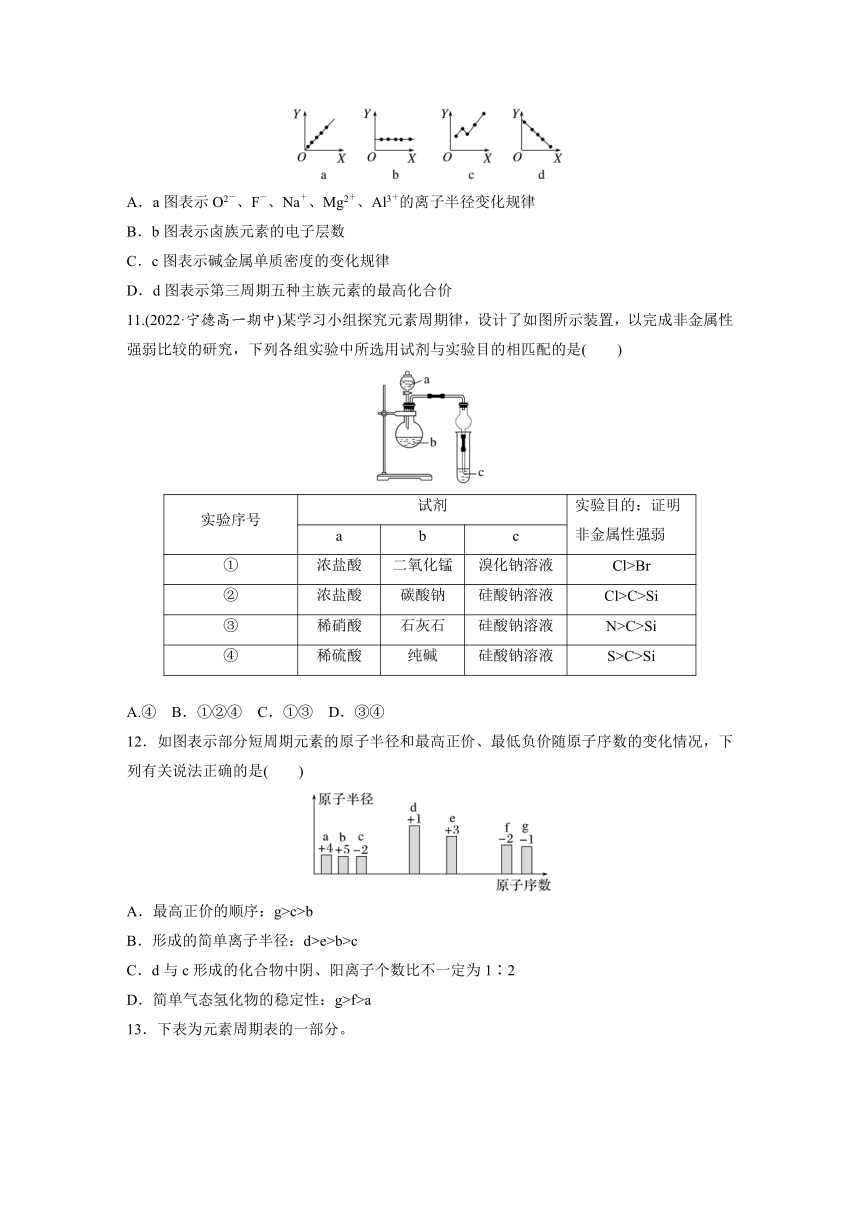
10.(2022·湖南岳阳高一月考)下图分别表示元素的某种性质与核电荷数的关系(X为核电荷数,Y为元素的有关结构或性质),下列说法正确的是( )
A.a图表示O2-、F-、Na+、Mg2+、Al3+的离子半径变化规律
B.b图表示卤族元素的电子层数
C.c图表示碱金属单质密度的变化规律
D.d图表示第三周期五种主族元素的最高化合价
11.(2022·宁德高一期中)某学习小组探究元素周期律,设计了如图所示装置,以完成非金属性强弱比较的研究,下列各组实验中所选用试剂与实验目的相匹配的是( )
实验序号 试剂 实验目的:证明非金属性强弱
a b c
① 浓盐酸 二氧化锰 溴化钠溶液 Cl>Br
② 浓盐酸 碳酸钠 硅酸钠溶液 Cl>C>Si
③ 稀硝酸 石灰石 硅酸钠溶液 N>C>Si
④ 稀硫酸 纯碱 硅酸钠溶液 S>C>Si
A.④ B.①②④ C.①③ D.③④
12.如图表示部分短周期元素的原子半径和最高正价、最低负价随原子序数的变化情况,下列有关说法正确的是( )
A.最高正价的顺序:g>c>b
B.形成的简单离子半径:d>e>b>c
C.d与c形成的化合物中阴、阳离子个数比不一定为1∶2
D.简单气态氢化物的稳定性:g>f>a
13.下表为元素周期表的一部分。
请回答下列问题:
(1)⑦⑧⑨三种元素最高价氧化物对应的水化物中酸性最强的是________________(填化学式)。
(2)③⑥⑨三种元素的简单离子半径由大到小排序为_______________________(填离子符号)。
(3)元素④和⑥的最高价氧化物对应的水化物反应的离子方程式为______________________。
(4)从原子结构的角度分析④与⑤的金属性强弱:_____________________________________。
(5)②、⑦的简单气态氢化物中较稳定的是___________________________________________
(填化学式),判断依据是__________________________________________________________
_______________________________________________________________________________。
14.(2022·广州真光中学高一期末)为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:
(1)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断正确的是____________(填字母)。
A.硒元素的最低负化合价为-2
B.硒的氧化物对应的水化物属于强酸
C.稳定性:H2Se>H2O
D.二氧化硒(SeO2)既有氧化性也有还原性
(2)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是75As,它的中子数比质子数多________。
②下列关于第ⅤA族元素及其化合物的说法正确的是________(填字母)。
A.热稳定性:NH3>PH3
B.酸性:HNO3>H3AsO4
C.As的氧化物的水化物是强碱
D.形成的简单离子半径随着原子序数递增而减小
15.(2022·河南新乡高一期末)某同学为了验证元素周期律相关的结论,自己设计了一套实验方案,并记录了有关实验现象。
实验方案 实验现象
①将氯气通入Na2S溶液中 有淡黄色固体(S)生成
②取一小块金属镁,用砂纸磨去表面的氧化膜后,放入试管中,加入2 mL水,观察现象,记录为现象Ⅰ,过一会儿,加热试管至液体沸腾,观察现象,记录为现象Ⅱ 现象Ⅰ:无明显变化 现象Ⅱ:金属镁逐渐溶解,有气体生成
③将溴水滴入NaI溶液中,充分反应后加入淀粉溶液 溶液变蓝
④将一小块金属钠放入冷水中 钠浮在水面上,熔成小球,四处游动,逐渐消失
回答下列问题:
(1)实验①相关反应的离子方程式为__________________________________________
________________________________________________________________________。
由实验①可知,Cl、S的非金属性由强到弱的顺序为____________________(用元素符号表示,下同)。由实验③可知,Br、I的非金属性由强到弱的顺序为____________________。
(2)由实验②和实验④知,碱性:NaOH________(填“>”或“<”)Mg(OH)2。
(3)实验结论:同主族元素自上而下,元素的非金属性逐渐__________(填“增强”或“减弱”,下同);同周期元素,原子序数逐渐增大,金属性逐渐____________,非金属性逐渐__________。由此可知,H2SiO3、H3PO4、H2SO4、HClO4的酸性由强到弱的顺序为____________________(填化学式,下同),常见简单气态氢化物NH3、H2O、HF、H2S中稳定性最强的是______________。
第二节 元素周期律
第1课时 元素性质的周期性变化规律
1.D 2.A 3.D 4.C 5.B
6.C [将空气中久置的镁带和铝片分别置于热水中,由于二者表面有氧化膜,所以不与水反应,均无现象,故A错误;熔点属于物理性质,不能用于比较金属性,故B错误;最高价氧化物对应水化物的碱性越强,则对应元素的金属性越强,因为碱性:Mg(OH)2>Al(OH)3,可说明镁、铝金属性依次减弱,故C正确;比较产生气体的量,不能判断金属性强弱,应比较金属和酸反应的剧烈程度,故D错误。]
7.B [S+O2SO2,O2是氧化剂,S是还原剂,说明氧气的氧化性强于S,而单质的氧化性越强,元素的非金属性越强,即能说明S的非金属性不如O强,故A不选;硫是淡黄色固体、氧气是无色气体与元素的非金属性强弱无关,不能说明S的非金属性不如O强,故B选;H2SH2+S、2H2O2H2↑+O2↑,说明水比硫化氢更稳定,而氢化物的稳定性越强,元素的非金属性越强,即能说明S的非金属性不如O强,故C不选;硫化氢在空气中变浑浊,是由于氧气将硫化氢氧化为硫单质,氧气做氧化剂,S为氧化产物,氧气的氧化性强于S,而单质的氧化性越强,元素的非金属性越强,即能说明S的非金属性不如O强,故D不选。]
8.D
9.A [X的常见化合价为+1,其原子序数小于其他四种元素,则元素X可能为H或Li;Z的常见化合价为+3,M的常见化合价为-3,原子序数:M>Z,则M为P,Z为Al;W的常见化合价为-1,其原子序数最大,则W为Cl。元素X可能为H或Li,A项正确;N和P为同主族元素,电子层数越多,原子半径越大,则原子半径:r(N)<r(P),B项错误;Al(OH)3为两性氢氧化物,能溶解在KOH溶液中,C项错误;非金属性:P<Cl,故它们的最高价氧化物对应的水化物的酸性:H3PO4<HClO4,D项错误。]
10.C 11.A
12.D [由原子半径大小可知,a、b、c位于第二周期,d、e、f、g位于第三周期,结合化合价可知,a为C,b为N,c为O,d为Na,e为Al,f为S,g为Cl,以此分析解答。Cl的最高正价为+7价,N的最高正价为+5价,O没有最高正价,故A错误;核外电子层数相同时,核电荷数越大离子半径越小,则简单离子半径:b>c>d>e,故B错误;钠元素与氧元素可以形成氧化钠和过氧化钠,阴、阳离子个数比均为1∶2,故C错误;非金属性越强,简单氢化物越稳定,非金属性:Cl>S>C,因此简单气态氢化物的稳定性:g>f>a,故D正确。]
13.(1)HClO4 (2)Cl->O2->Al3+ (3)OH-+Al(OH)3===[Al(OH)4]- (4)Na原子半径比Mg大,Na的核电荷数比Mg小,Na原子核对最外层电子的吸引力较弱,更易失电子,故Na的金属性比Mg强 (5)NH3 N元素的非金属性比P元素强
解析 (1)元素的非金属性越强,其最高价氧化物对应的水化物酸性越强,P、S、Cl三种元素的非金属性依次增强,故三种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4。(2)O2-、Al3+具有相同的电子层结构,Al3+的核电荷数更大,原子核对核外电子吸引更强,故离子半径:O2->Al3+,Cl-比O2-多一个电子层,则离子半径:Cl->O2-,故离子半径由大到小的顺序为Cl->O2->Al3+。(3)元素④和⑥的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成Na[Al(OH)4],反应的离子方程式为OH-+Al(OH)3===[Al(OH)4]-。(5)非金属性越强,则相应的简单气态氢化物越稳定,非金属性:N>P,则简单气态氢化物中较稳定的是NH3。
14.(1)AD (2)①9 ②AB
15.(1)S2-+Cl2===2Cl-+S↓ Cl>S Br>I
(2)> (3)减弱 减弱 增强 HClO4>H2SO4>H3PO4>H2SiO3 HF
解析 (1)将氯气通入Na2S溶液中,氯气将S2-氧化成S单质,反应的离子方程式为S2-+Cl2===2Cl-+S↓,单质氧化性越强,元素非金属性越强,故非金属性:Cl>S;实验③中将溴水滴入NaI溶液中,充分反应后加入淀粉溶液,溶液变蓝,说明Br2将I-氧化成I2,非金属性:Br>I。(2)实验②现象可以表明Mg与冷水不反应,与热水反应,实验④中Na与冷水剧烈反应,由实验②和实验④中反应的剧烈程度可知,Na与水反应比Mg与水反应更剧烈,则金属性:MgMg(OH)2。(3)由实验分析可知,非金属性:Br>I,由此得出实验结论:同主族元素自上而下,元素的非金属性逐渐减弱;金属性:MgH2SO4>H3PO4>H2SiO3;非金属性:F>O>N>S,元素非金属性越强,简单气态氢化物越稳定,稳定性最强的是HF。
第1课时 元素性质的周期性变化规律
题组一 1~18号元素性质的周期性变化规律
1.下列说法正确的是( )
A.随着元素原子序数的递增,P、S、Cl、Ar的最高正化合价依次升高
B.随着元素原子序数的递增,Na、Mg、Al、Si的最低负化合价依次降低
C.原子序数为15的元素最高化合价为+3
D.随着原子序数的递增,第三周期主族元素的最高正化合价依次升高
2.第三周期主族元素中原子半径最大的是( )
A.Na B.Si C.S D.Cl
3.下列各组元素中,按从左到右的顺序,原子序数递增,元素的最高正化合价也递增的是( )
A.C、N、O、F B.Na、Be、B、C
C.P、S、Cl、Ar D.Na、Mg、Al、Si
题组二 元素周期律
4.元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次增大
C.元素原子核外电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
5.下列关于元素周期律的叙述正确的是( )
A.随着元素原子序数的递增,原子最外层电子数总是从1→8重复出现
B.元素的性质随着原子序数的递增而呈周期性变化
C.随着元素原子序数的递增,元素的最高化合价从+1→+7(O、F除外),最低化合价从-7→-1重复出现
D.元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化及元素主要化合价的周期性变化
6.(2022·威海高一期末)比较镁和铝金属性强弱的方法正确的是( )
A.将空气中放置已久的两种元素的单质分别与热水作用,比较产生气泡的快慢
B.比较两种金属的熔点
C.氢氧化镁的碱性比氢氧化铝强
D.将形状、大小相同的两种金属单质和足量盐酸反应,比较产生气体的量
7.(2023·温州高一期中)硫的非金属性不如氧强,下列叙述不能说明这一事实的是( )
A.S+O2SO2,O2是氧化剂,S是还原剂
B.硫是淡黄色固体,氧气是无色气体
C.H2SH2+S、2H2O2H2↑+O2↑
D.硫化氢露置在空气中易变浑浊
8.几种短周期元素的原子半径及主要化合价如下表:
元素代号 X Y Z W
原子半径/pm 160 143 70 66
主要化合价 +2 +3 +5、+3、-3 -2
下列叙述正确的是( )
A.X、Y元素的金属性:X
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
9.五种短周期元素X、Y、Z、M、W的原子序数与其常见化合价的关系如图所示,下列叙述正确的是( )
A.元素X可能为氢或锂
B.原子半径:r(Y)>r(M)
C.Z的最高价氧化物对应的水化物不能溶解在氢氧化钾溶液中
D.H3MO4的酸性比HWO4的强
10.(2022·湖南岳阳高一月考)下图分别表示元素的某种性质与核电荷数的关系(X为核电荷数,Y为元素的有关结构或性质),下列说法正确的是( )
A.a图表示O2-、F-、Na+、Mg2+、Al3+的离子半径变化规律
B.b图表示卤族元素的电子层数
C.c图表示碱金属单质密度的变化规律
D.d图表示第三周期五种主族元素的最高化合价
11.(2022·宁德高一期中)某学习小组探究元素周期律,设计了如图所示装置,以完成非金属性强弱比较的研究,下列各组实验中所选用试剂与实验目的相匹配的是( )
实验序号 试剂 实验目的:证明非金属性强弱
a b c
① 浓盐酸 二氧化锰 溴化钠溶液 Cl>Br
② 浓盐酸 碳酸钠 硅酸钠溶液 Cl>C>Si
③ 稀硝酸 石灰石 硅酸钠溶液 N>C>Si
④ 稀硫酸 纯碱 硅酸钠溶液 S>C>Si
A.④ B.①②④ C.①③ D.③④
12.如图表示部分短周期元素的原子半径和最高正价、最低负价随原子序数的变化情况,下列有关说法正确的是( )
A.最高正价的顺序:g>c>b
B.形成的简单离子半径:d>e>b>c
C.d与c形成的化合物中阴、阳离子个数比不一定为1∶2
D.简单气态氢化物的稳定性:g>f>a
13.下表为元素周期表的一部分。
请回答下列问题:
(1)⑦⑧⑨三种元素最高价氧化物对应的水化物中酸性最强的是________________(填化学式)。
(2)③⑥⑨三种元素的简单离子半径由大到小排序为_______________________(填离子符号)。
(3)元素④和⑥的最高价氧化物对应的水化物反应的离子方程式为______________________。
(4)从原子结构的角度分析④与⑤的金属性强弱:_____________________________________。
(5)②、⑦的简单气态氢化物中较稳定的是___________________________________________
(填化学式),判断依据是__________________________________________________________
_______________________________________________________________________________。
14.(2022·广州真光中学高一期末)为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:
(1)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断正确的是____________(填字母)。
A.硒元素的最低负化合价为-2
B.硒的氧化物对应的水化物属于强酸
C.稳定性:H2Se>H2O
D.二氧化硒(SeO2)既有氧化性也有还原性
(2)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是75As,它的中子数比质子数多________。
②下列关于第ⅤA族元素及其化合物的说法正确的是________(填字母)。
A.热稳定性:NH3>PH3
B.酸性:HNO3>H3AsO4
C.As的氧化物的水化物是强碱
D.形成的简单离子半径随着原子序数递增而减小
15.(2022·河南新乡高一期末)某同学为了验证元素周期律相关的结论,自己设计了一套实验方案,并记录了有关实验现象。
实验方案 实验现象
①将氯气通入Na2S溶液中 有淡黄色固体(S)生成
②取一小块金属镁,用砂纸磨去表面的氧化膜后,放入试管中,加入2 mL水,观察现象,记录为现象Ⅰ,过一会儿,加热试管至液体沸腾,观察现象,记录为现象Ⅱ 现象Ⅰ:无明显变化 现象Ⅱ:金属镁逐渐溶解,有气体生成
③将溴水滴入NaI溶液中,充分反应后加入淀粉溶液 溶液变蓝
④将一小块金属钠放入冷水中 钠浮在水面上,熔成小球,四处游动,逐渐消失
回答下列问题:
(1)实验①相关反应的离子方程式为__________________________________________
________________________________________________________________________。
由实验①可知,Cl、S的非金属性由强到弱的顺序为____________________(用元素符号表示,下同)。由实验③可知,Br、I的非金属性由强到弱的顺序为____________________。
(2)由实验②和实验④知,碱性:NaOH________(填“>”或“<”)Mg(OH)2。
(3)实验结论:同主族元素自上而下,元素的非金属性逐渐__________(填“增强”或“减弱”,下同);同周期元素,原子序数逐渐增大,金属性逐渐____________,非金属性逐渐__________。由此可知,H2SiO3、H3PO4、H2SO4、HClO4的酸性由强到弱的顺序为____________________(填化学式,下同),常见简单气态氢化物NH3、H2O、HF、H2S中稳定性最强的是______________。
第二节 元素周期律
第1课时 元素性质的周期性变化规律
1.D 2.A 3.D 4.C 5.B
6.C [将空气中久置的镁带和铝片分别置于热水中,由于二者表面有氧化膜,所以不与水反应,均无现象,故A错误;熔点属于物理性质,不能用于比较金属性,故B错误;最高价氧化物对应水化物的碱性越强,则对应元素的金属性越强,因为碱性:Mg(OH)2>Al(OH)3,可说明镁、铝金属性依次减弱,故C正确;比较产生气体的量,不能判断金属性强弱,应比较金属和酸反应的剧烈程度,故D错误。]
7.B [S+O2SO2,O2是氧化剂,S是还原剂,说明氧气的氧化性强于S,而单质的氧化性越强,元素的非金属性越强,即能说明S的非金属性不如O强,故A不选;硫是淡黄色固体、氧气是无色气体与元素的非金属性强弱无关,不能说明S的非金属性不如O强,故B选;H2SH2+S、2H2O2H2↑+O2↑,说明水比硫化氢更稳定,而氢化物的稳定性越强,元素的非金属性越强,即能说明S的非金属性不如O强,故C不选;硫化氢在空气中变浑浊,是由于氧气将硫化氢氧化为硫单质,氧气做氧化剂,S为氧化产物,氧气的氧化性强于S,而单质的氧化性越强,元素的非金属性越强,即能说明S的非金属性不如O强,故D不选。]
8.D
9.A [X的常见化合价为+1,其原子序数小于其他四种元素,则元素X可能为H或Li;Z的常见化合价为+3,M的常见化合价为-3,原子序数:M>Z,则M为P,Z为Al;W的常见化合价为-1,其原子序数最大,则W为Cl。元素X可能为H或Li,A项正确;N和P为同主族元素,电子层数越多,原子半径越大,则原子半径:r(N)<r(P),B项错误;Al(OH)3为两性氢氧化物,能溶解在KOH溶液中,C项错误;非金属性:P<Cl,故它们的最高价氧化物对应的水化物的酸性:H3PO4<HClO4,D项错误。]
10.C 11.A
12.D [由原子半径大小可知,a、b、c位于第二周期,d、e、f、g位于第三周期,结合化合价可知,a为C,b为N,c为O,d为Na,e为Al,f为S,g为Cl,以此分析解答。Cl的最高正价为+7价,N的最高正价为+5价,O没有最高正价,故A错误;核外电子层数相同时,核电荷数越大离子半径越小,则简单离子半径:b>c>d>e,故B错误;钠元素与氧元素可以形成氧化钠和过氧化钠,阴、阳离子个数比均为1∶2,故C错误;非金属性越强,简单氢化物越稳定,非金属性:Cl>S>C,因此简单气态氢化物的稳定性:g>f>a,故D正确。]
13.(1)HClO4 (2)Cl->O2->Al3+ (3)OH-+Al(OH)3===[Al(OH)4]- (4)Na原子半径比Mg大,Na的核电荷数比Mg小,Na原子核对最外层电子的吸引力较弱,更易失电子,故Na的金属性比Mg强 (5)NH3 N元素的非金属性比P元素强
解析 (1)元素的非金属性越强,其最高价氧化物对应的水化物酸性越强,P、S、Cl三种元素的非金属性依次增强,故三种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4。(2)O2-、Al3+具有相同的电子层结构,Al3+的核电荷数更大,原子核对核外电子吸引更强,故离子半径:O2->Al3+,Cl-比O2-多一个电子层,则离子半径:Cl->O2-,故离子半径由大到小的顺序为Cl->O2->Al3+。(3)元素④和⑥的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成Na[Al(OH)4],反应的离子方程式为OH-+Al(OH)3===[Al(OH)4]-。(5)非金属性越强,则相应的简单气态氢化物越稳定,非金属性:N>P,则简单气态氢化物中较稳定的是NH3。
14.(1)AD (2)①9 ②AB
15.(1)S2-+Cl2===2Cl-+S↓ Cl>S Br>I
(2)> (3)减弱 减弱 增强 HClO4>H2SO4>H3PO4>H2SiO3 HF
解析 (1)将氯气通入Na2S溶液中,氯气将S2-氧化成S单质,反应的离子方程式为S2-+Cl2===2Cl-+S↓,单质氧化性越强,元素非金属性越强,故非金属性:Cl>S;实验③中将溴水滴入NaI溶液中,充分反应后加入淀粉溶液,溶液变蓝,说明Br2将I-氧化成I2,非金属性:Br>I。(2)实验②现象可以表明Mg与冷水不反应,与热水反应,实验④中Na与冷水剧烈反应,由实验②和实验④中反应的剧烈程度可知,Na与水反应比Mg与水反应更剧烈,则金属性:Mg
