化学人教版(2019)必修1 2.1.1活泼的金属单质——钠(共89张ppt)
文档属性
| 名称 | 化学人教版(2019)必修1 2.1.1活泼的金属单质——钠(共89张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 165.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-09 12:06:36 | ||
图片预览










文档简介
(共89张PPT)
离开化学实验室,
我的心脏就无法跳动。
戴维
第一个制备钠的人
宏光五菱mini
五菱宏光mini用锂离子电池
由于锂的消费量越来越大,且锂矿贮存量有限,保守估计,到2031年会出现锂矿枯竭现象,如何解决供需矛盾?
将金属锂回收再利用
开发新的金属电池
问题解决
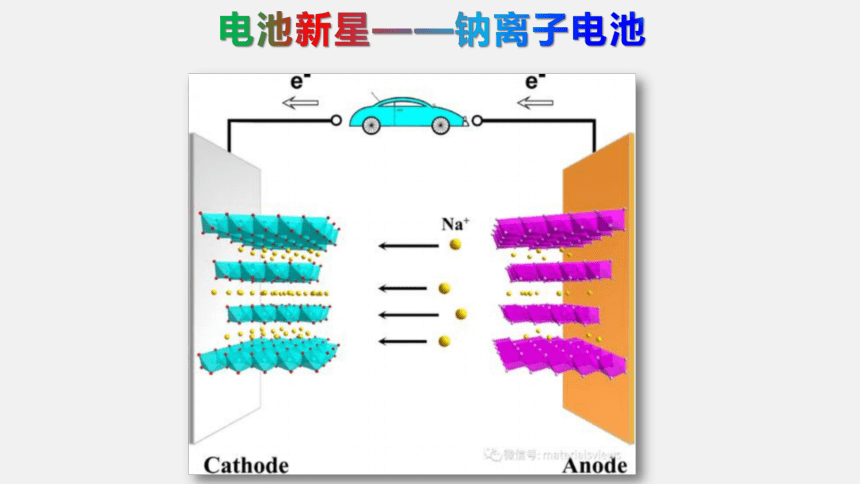
电池新星——钠离子电池
2018年7月7日,中科院物理所研发的全球首辆使用钠离子电池驱动的低速电动汽车。
科学家们为什么
能从锂电池联想到开发钠电池?
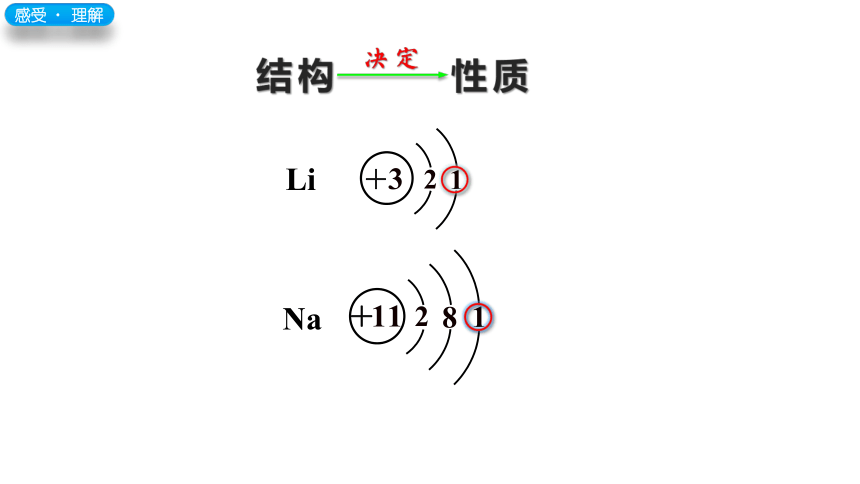
结构
性质
决定
感受﹒ 理解
Li
Na
如果要研制钠电池
我们要从哪里入手
浮水上 可刀切 藏煤油
活泼的金属单质——钠
学习目标
根据钠的原子结构特点,推理其具有强还原性,并通过实验证明之。
化学性质
与O2在不同温度下反应
与H2O的反应
电解熔融的氯化钠
工业制备
通过实验归纳其性质
物理性质
硬度
颜色
密度
熔点
保存:依据钠的性质,知道两种保存方法
保存与应用
应用:依据钠的性质,知道其用途
钠可能与哪些物质反应?
1
第一个制备钠的人
戴维
1807年10月的一天,戴维将一块苛性钠放在白金勺里用高温酒精灯将它熔化,然后立即用一根导线接在白金勺上,再将另一根导线插入熔化物中,在一电极上出现了具有金属光泽的、类似水银的银白色小珠。
一些小珠不燃烧,只是表面变暗,覆盖着一层白膜
化学趣史
你有没有注意到,切割后,钠的表面有什么变化?
观察与思考
观察与思考
露置空气中的钠切面的颜色变化
切割
切面
片刻后
断面呈银白色
迅速变暗
从钠原子的结构分析,钠为什么极易和空气中的氧气发生反应?
极易失e-
Na
Na+
钠在反应中容易失一个电子,表现出强还原性
思考﹒ 讨论
2.1 与非金属单质反应
化学性质
2
01 与氧反应
常温
白色
4Na+O2=2Na2O
若加热钠有何现象?
能否用加热法来获得氧化钠?
实验探究
黄色火焰
1
2
淡黄色固体
淡黄色固体是氧化钠吗?
氧化钠白色
交流讨论
2.1 与非金属单质反应
化学性质
2
01 与氧反应
常温
白色
4Na+O2=2Na2O
加热
用单线桥表示电子转移方向和数目
2Na+O2
Na2O2
Δ
条件不同,钠与氧气反应的产物不同!
第一个制备钠的人
戴维
1807年10月的一天,戴维将一块苛性钠放在白金勺里用高温酒精灯将它熔化,然后立即用一根导线接在白金勺上,再将另一根导线插入熔化物中,在一电极上出现了具有金属光泽的、类似水银的银白色小珠。
一些小珠不燃烧,只是表面变暗,覆盖着一层白膜
另一些小珠立即燃烧,形成黄色火焰
化学趣史
工业上制备过氧化钠的方法是将钠加热至熔化,通入一定量的除去二氧化碳的干燥空气,维持温度在453~473K,钠即被氧化为氧化钠,进而增加空气流量并迅速提高温度至573~673K,即可制得过氧化钠。
请写出有关转化的化学方程式。
资料在线
4Na+O2 2Na2O
453~473K
573~673K
2Na2O+O2 2Na2O2
过氧化钠可吸收二氧化碳、产生氧气,保证艇员正常呼吸。
写出钠分别与下列物质发生反应的化学方程式。
S (常温)
2Na+S==Na2S
小试身手
写出钠分别与下列物质发生反应的化学方程式。
S (常温)
H2 (加热)
小试身手
2.1 与非金属单质反应
化学性质
2
01 与氧反应
常温
白色
4Na+O2=2Na2O
02 与其它非金属单质反应
加热
2Na+O2
Na2O2
Δ
2Na+H2
2NaH
Δ
钠与水的反应
Na+H2O →
0
Na
+1
+1
-2
H2
0
OH-
问题解决
据氧化还原反应分析
钠
水
在水面急速奔跃
发出刺刺的声音,接着声音越来越小
体积越来越小,慢慢消失在水里,无影无踪
化学趣史
戴维把这种小小的金属颗粒投入水中
戴维的实验记录
钠
水
观察要点:
1 .钠是浮在水面上,还是沉于水底?
2 .钠块的状态是否改变?
3.钠在水中是运动还是静止?
4.有无声响?
5.溶液颜色的变化?
实验探究
我来说
浮
球
游
红
响
钠密度比水小
反应放热 熔点低
有气体产生
反应剧烈
有碱生成
你观到哪些现象?
钠与水反应三变化
物质状态变化
固体→液体
钠块熔化为银白色小球,后消失
溶液→红色
产生气体
推小球向不同方向游动
小球发出嘶嘶响声
能量变化
反应放热
其他变化
燃烧
Na+H2O→NaOH+X↑
由原子观点,可能是什么气体?
O2 H2
依原子个数比观点,是何气体?
Na+H2O→Na O H+X↑
2∶1
1∶1
问题探究
钠与水的反应
据物质的组成分析
01
02
2.2 与水反应
化学性质
2
2Na+2H2O=2NaOH+H2↑
用单线桥表示电子转移方向和数目
将该化学方程式改写为离子方程式
2Na+2H2O=2Na++2OH-+H2↑
钠用作强除水剂(深度除水剂)
无水乙醚的制备
实质:钠与水电离出的少量H+生成H2
氢离子浓度越大,反应速率越快,如把水换为盐酸,反应更剧烈。
写出钠与盐酸反应的化学及离子方程式。
钠与水反应的实质是什么?
魔术中,奇妙现象的产生其实是灯芯中藏有的钠的功劳。
滴水点灯
学以致用
如果储存金属钠的仓库着火了,该怎么办?
能否用水去呢?
你认为可用什么物质?
洛阳金属钠仓库失火 消防紧急调100吨水泥扑灭
化工厂非法储存金属钠引发火灾
消防官兵奋战9小时灭火
干沙
西汉时期,我国就掌握了湿法炼铜技术,其原理是用铁与CuSO4反应转换出铜。
知识回顾
钠能否把不活泼金属从其盐溶液中置换出来?
金属钠与硫酸铜溶液反结果如何呢?
CuSO4
H2O
反应竞争
与CuSO4置换
与H2O置换
实验探究
请你预测,并简要说明理由。
2.3 与盐反应
化学性质
2
2Na+2H2O=2NaOH+H2↑
2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑
2NaOH+CuSO4=Na2SO4+Cu(OH)2 ↓
01 水溶液
Cu2+在水溶液中
资料在线
问题探究
为什么钠不能直接与Cu2+反应?
Cu2+在水溶液中
Na
Na
Na
Na
你认为应采取什么措施?:
要实现反应:
2Na+CuSO4=Na2SO4+Cu
减少水的量,增加钠的量
不用水,用无水CuSO4
溶剂水的量,改用其他溶剂
考考你的智慧
如何实现反应:
硫酸铜的丙酮溶液
2Na+CuSO4=Na2SO4+Cu
实验探究
01
钠与酸溶液反应时,首先与H+反应,后再与水反应
钠与水溶液反应的规律
02
K、Ca、Na等活泼金属不能从盐溶液中置换出其他金属
归纳与整理
将一小块金属钠,投入到下列饱和溶液中,有气体和白色沉淀的是
A.氯化镁
B.硫酸铁
C.硝酸铜
D.氯化钠
牛刀小试
工业上用钠与四氯化钛来制备钛,请写出化学方程式。
你认为反应条件是什么?
生活中的化学
2.3 与盐反应
化学性质
2
2Na+2H2O=2NaOH+H2↑
2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑
2NaOH+CuSO4=Na2SO4+Cu(OH)2 ↓
01 水溶液
02 熔融液
4Na+TiCl4 Ti+4NaCl
高温
Na+KCl K↑+NaCl
高温
钠与熔融盐反应不能证明金属活动性的强弱!
可呼吸的“钠—二氧化碳电池”
请写出电池反应的化学方程式。
感受﹒ 理解
金属钠
Na+
C
CO32-
2.4 与二氧化碳反应
化学性质
2
4Na+CO2=2Na2O+C
4Na+3CO2=2Na2CO3+C
为什么说钠电池未来将取代锂电池,其优势是什么?
NaCl的总储量可达4亿亿吨
海洋储盐量多达5亿亿吨
若提出平铺于陆地,地面会加高150 m
资料在线
NaCl的总储量可达4亿亿吨
海洋储盐量多达5亿亿吨
若提出平铺于陆地,地面会加高150 m
资料在线
钠的工业制备
2
电解法制取金属钠
NaCl
铁电极
石墨电极
Na
Cl2
工业制备
2
原料
NaCl
原理
2NaCl
通电
2Na+Cl2↑
我国每年工业上通过电解熔融NaCl制备金属钠单质(3.5万吨)。
钠的保存与应用
3
问题探究
你认为应如何金属钠?
性质
决定
保存
易与空气中的
氧气、水反应
隔绝空气
沉入与之不反应的液体中
真空包装
供应高纯金属钠
产地:俄国;品位:99.95%
规格:100公斤/桶
价格:2 5000元/公斤
工业金属钠的外包装采用铁桶,内包装为双层聚乙烯塑料袋。
资料在线
3.1 保存
保存与应用
3
投资者对项目或公司进行无偿捐赠,即我给你钱,你什么都不用给我,实际就是做公益。
工业
大量的钠要用石蜡或者其他物质封存,保存于铁桶内,充氩气密封
实验室
煤油
3.2 应用
保存与应用
3
1
制过氧化钠
和O2反应
3.2 应用
保存与应用
3
1
制过氧化钠
和O2反应
2
冶炼某些金属
钠强还原性
3.2 应用
保存与应用
3
1
制过氧化钠
和O2反应
2
冶炼某些金属
钠强还原性
3
制作钠灯
黄光射程远 透雾力强
4
用作强除水剂
和水剧烈反应
钠的新应用
美国卡内基·梅隆大学日前宣布,该校的研究人员研制出了一种可以服食的钠电池电子药丸,这种电子药丸能在患者体内检测体征情况这项技术的出现预计将大大改变癌症、胃病等一系列慢性病症的治疗方案。
钠具有怎样的物理性质?
4
实验探究
切割
切面
断面呈银白色
物理性质
4
固体
颜色
状态
硬度
银白色
质软
钠浮在水面上
熔化成一个闪亮的小球
水温升高
实验探究
钠
水
较低
物理性质
4
颜色
状态
硬度
密度
熔点
固体
银白色
质软
较小
剩余的钠要放回试试瓶中!
金属钠与水反应的现象,与钠的下列性质无关的是
A.钠的熔点低
B.钠的密度小
C.钠的硬度小
D.钠是活泼金属
钠投入到饱和的石灰水中,有何现象?
考考你的智慧
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
钠化学性质
强还原性
4Na+O2=2Na2O
2Na+2H2O=2NaOH+H2↑
水溶液
熔融液
请你为钠设计一张简历
姓名 钠
种类
出生地
外貌特征
住地
特性
金属钠长时间暴露在空气中,请猜想会发生哪些变化?最终产物为何物?
银白色
变暗
变潮湿
白色固体
白色粉末
Na
Na2O
NaOH
Na2CO3
Na2CO3·10H2O
O2
H2O
CO2
风化
思考﹒ 运用
在烧杯中加入水和苯(密度:0.88 g·cm-3)各50 mL。将一小粒金属钠(密度:0.97 g·cm-3)投入烧杯中。观察到的现象可能是
A.钠在水层中反应并四处游动
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处反应并可能作上、下跳动
考考你的智慧
謝謝您的聆聽
祝你有个美好的一天
离开化学实验室,
我的心脏就无法跳动。
戴维
第一个制备钠的人
宏光五菱mini
五菱宏光mini用锂离子电池
由于锂的消费量越来越大,且锂矿贮存量有限,保守估计,到2031年会出现锂矿枯竭现象,如何解决供需矛盾?
将金属锂回收再利用
开发新的金属电池
问题解决
电池新星——钠离子电池
2018年7月7日,中科院物理所研发的全球首辆使用钠离子电池驱动的低速电动汽车。
科学家们为什么
能从锂电池联想到开发钠电池?
结构
性质
决定
感受﹒ 理解
Li
Na
如果要研制钠电池
我们要从哪里入手
浮水上 可刀切 藏煤油
活泼的金属单质——钠
学习目标
根据钠的原子结构特点,推理其具有强还原性,并通过实验证明之。
化学性质
与O2在不同温度下反应
与H2O的反应
电解熔融的氯化钠
工业制备
通过实验归纳其性质
物理性质
硬度
颜色
密度
熔点
保存:依据钠的性质,知道两种保存方法
保存与应用
应用:依据钠的性质,知道其用途
钠可能与哪些物质反应?
1
第一个制备钠的人
戴维
1807年10月的一天,戴维将一块苛性钠放在白金勺里用高温酒精灯将它熔化,然后立即用一根导线接在白金勺上,再将另一根导线插入熔化物中,在一电极上出现了具有金属光泽的、类似水银的银白色小珠。
一些小珠不燃烧,只是表面变暗,覆盖着一层白膜
化学趣史
你有没有注意到,切割后,钠的表面有什么变化?
观察与思考
观察与思考
露置空气中的钠切面的颜色变化
切割
切面
片刻后
断面呈银白色
迅速变暗
从钠原子的结构分析,钠为什么极易和空气中的氧气发生反应?
极易失e-
Na
Na+
钠在反应中容易失一个电子,表现出强还原性
思考﹒ 讨论
2.1 与非金属单质反应
化学性质
2
01 与氧反应
常温
白色
4Na+O2=2Na2O
若加热钠有何现象?
能否用加热法来获得氧化钠?
实验探究
黄色火焰
1
2
淡黄色固体
淡黄色固体是氧化钠吗?
氧化钠白色
交流讨论
2.1 与非金属单质反应
化学性质
2
01 与氧反应
常温
白色
4Na+O2=2Na2O
加热
用单线桥表示电子转移方向和数目
2Na+O2
Na2O2
Δ
条件不同,钠与氧气反应的产物不同!
第一个制备钠的人
戴维
1807年10月的一天,戴维将一块苛性钠放在白金勺里用高温酒精灯将它熔化,然后立即用一根导线接在白金勺上,再将另一根导线插入熔化物中,在一电极上出现了具有金属光泽的、类似水银的银白色小珠。
一些小珠不燃烧,只是表面变暗,覆盖着一层白膜
另一些小珠立即燃烧,形成黄色火焰
化学趣史
工业上制备过氧化钠的方法是将钠加热至熔化,通入一定量的除去二氧化碳的干燥空气,维持温度在453~473K,钠即被氧化为氧化钠,进而增加空气流量并迅速提高温度至573~673K,即可制得过氧化钠。
请写出有关转化的化学方程式。
资料在线
4Na+O2 2Na2O
453~473K
573~673K
2Na2O+O2 2Na2O2
过氧化钠可吸收二氧化碳、产生氧气,保证艇员正常呼吸。
写出钠分别与下列物质发生反应的化学方程式。
S (常温)
2Na+S==Na2S
小试身手
写出钠分别与下列物质发生反应的化学方程式。
S (常温)
H2 (加热)
小试身手
2.1 与非金属单质反应
化学性质
2
01 与氧反应
常温
白色
4Na+O2=2Na2O
02 与其它非金属单质反应
加热
2Na+O2
Na2O2
Δ
2Na+H2
2NaH
Δ
钠与水的反应
Na+H2O →
0
Na
+1
+1
-2
H2
0
OH-
问题解决
据氧化还原反应分析
钠
水
在水面急速奔跃
发出刺刺的声音,接着声音越来越小
体积越来越小,慢慢消失在水里,无影无踪
化学趣史
戴维把这种小小的金属颗粒投入水中
戴维的实验记录
钠
水
观察要点:
1 .钠是浮在水面上,还是沉于水底?
2 .钠块的状态是否改变?
3.钠在水中是运动还是静止?
4.有无声响?
5.溶液颜色的变化?
实验探究
我来说
浮
球
游
红
响
钠密度比水小
反应放热 熔点低
有气体产生
反应剧烈
有碱生成
你观到哪些现象?
钠与水反应三变化
物质状态变化
固体→液体
钠块熔化为银白色小球,后消失
溶液→红色
产生气体
推小球向不同方向游动
小球发出嘶嘶响声
能量变化
反应放热
其他变化
燃烧
Na+H2O→NaOH+X↑
由原子观点,可能是什么气体?
O2 H2
依原子个数比观点,是何气体?
Na+H2O→Na O H+X↑
2∶1
1∶1
问题探究
钠与水的反应
据物质的组成分析
01
02
2.2 与水反应
化学性质
2
2Na+2H2O=2NaOH+H2↑
用单线桥表示电子转移方向和数目
将该化学方程式改写为离子方程式
2Na+2H2O=2Na++2OH-+H2↑
钠用作强除水剂(深度除水剂)
无水乙醚的制备
实质:钠与水电离出的少量H+生成H2
氢离子浓度越大,反应速率越快,如把水换为盐酸,反应更剧烈。
写出钠与盐酸反应的化学及离子方程式。
钠与水反应的实质是什么?
魔术中,奇妙现象的产生其实是灯芯中藏有的钠的功劳。
滴水点灯
学以致用
如果储存金属钠的仓库着火了,该怎么办?
能否用水去呢?
你认为可用什么物质?
洛阳金属钠仓库失火 消防紧急调100吨水泥扑灭
化工厂非法储存金属钠引发火灾
消防官兵奋战9小时灭火
干沙
西汉时期,我国就掌握了湿法炼铜技术,其原理是用铁与CuSO4反应转换出铜。
知识回顾
钠能否把不活泼金属从其盐溶液中置换出来?
金属钠与硫酸铜溶液反结果如何呢?
CuSO4
H2O
反应竞争
与CuSO4置换
与H2O置换
实验探究
请你预测,并简要说明理由。
2.3 与盐反应
化学性质
2
2Na+2H2O=2NaOH+H2↑
2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑
2NaOH+CuSO4=Na2SO4+Cu(OH)2 ↓
01 水溶液
Cu2+在水溶液中
资料在线
问题探究
为什么钠不能直接与Cu2+反应?
Cu2+在水溶液中
Na
Na
Na
Na
你认为应采取什么措施?:
要实现反应:
2Na+CuSO4=Na2SO4+Cu
减少水的量,增加钠的量
不用水,用无水CuSO4
溶剂水的量,改用其他溶剂
考考你的智慧
如何实现反应:
硫酸铜的丙酮溶液
2Na+CuSO4=Na2SO4+Cu
实验探究
01
钠与酸溶液反应时,首先与H+反应,后再与水反应
钠与水溶液反应的规律
02
K、Ca、Na等活泼金属不能从盐溶液中置换出其他金属
归纳与整理
将一小块金属钠,投入到下列饱和溶液中,有气体和白色沉淀的是
A.氯化镁
B.硫酸铁
C.硝酸铜
D.氯化钠
牛刀小试
工业上用钠与四氯化钛来制备钛,请写出化学方程式。
你认为反应条件是什么?
生活中的化学
2.3 与盐反应
化学性质
2
2Na+2H2O=2NaOH+H2↑
2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑
2NaOH+CuSO4=Na2SO4+Cu(OH)2 ↓
01 水溶液
02 熔融液
4Na+TiCl4 Ti+4NaCl
高温
Na+KCl K↑+NaCl
高温
钠与熔融盐反应不能证明金属活动性的强弱!
可呼吸的“钠—二氧化碳电池”
请写出电池反应的化学方程式。
感受﹒ 理解
金属钠
Na+
C
CO32-
2.4 与二氧化碳反应
化学性质
2
4Na+CO2=2Na2O+C
4Na+3CO2=2Na2CO3+C
为什么说钠电池未来将取代锂电池,其优势是什么?
NaCl的总储量可达4亿亿吨
海洋储盐量多达5亿亿吨
若提出平铺于陆地,地面会加高150 m
资料在线
NaCl的总储量可达4亿亿吨
海洋储盐量多达5亿亿吨
若提出平铺于陆地,地面会加高150 m
资料在线
钠的工业制备
2
电解法制取金属钠
NaCl
铁电极
石墨电极
Na
Cl2
工业制备
2
原料
NaCl
原理
2NaCl
通电
2Na+Cl2↑
我国每年工业上通过电解熔融NaCl制备金属钠单质(3.5万吨)。
钠的保存与应用
3
问题探究
你认为应如何金属钠?
性质
决定
保存
易与空气中的
氧气、水反应
隔绝空气
沉入与之不反应的液体中
真空包装
供应高纯金属钠
产地:俄国;品位:99.95%
规格:100公斤/桶
价格:2 5000元/公斤
工业金属钠的外包装采用铁桶,内包装为双层聚乙烯塑料袋。
资料在线
3.1 保存
保存与应用
3
投资者对项目或公司进行无偿捐赠,即我给你钱,你什么都不用给我,实际就是做公益。
工业
大量的钠要用石蜡或者其他物质封存,保存于铁桶内,充氩气密封
实验室
煤油
3.2 应用
保存与应用
3
1
制过氧化钠
和O2反应
3.2 应用
保存与应用
3
1
制过氧化钠
和O2反应
2
冶炼某些金属
钠强还原性
3.2 应用
保存与应用
3
1
制过氧化钠
和O2反应
2
冶炼某些金属
钠强还原性
3
制作钠灯
黄光射程远 透雾力强
4
用作强除水剂
和水剧烈反应
钠的新应用
美国卡内基·梅隆大学日前宣布,该校的研究人员研制出了一种可以服食的钠电池电子药丸,这种电子药丸能在患者体内检测体征情况这项技术的出现预计将大大改变癌症、胃病等一系列慢性病症的治疗方案。
钠具有怎样的物理性质?
4
实验探究
切割
切面
断面呈银白色
物理性质
4
固体
颜色
状态
硬度
银白色
质软
钠浮在水面上
熔化成一个闪亮的小球
水温升高
实验探究
钠
水
较低
物理性质
4
颜色
状态
硬度
密度
熔点
固体
银白色
质软
较小
剩余的钠要放回试试瓶中!
金属钠与水反应的现象,与钠的下列性质无关的是
A.钠的熔点低
B.钠的密度小
C.钠的硬度小
D.钠是活泼金属
钠投入到饱和的石灰水中,有何现象?
考考你的智慧
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
钠化学性质
强还原性
4Na+O2=2Na2O
2Na+2H2O=2NaOH+H2↑
水溶液
熔融液
请你为钠设计一张简历
姓名 钠
种类
出生地
外貌特征
住地
特性
金属钠长时间暴露在空气中,请猜想会发生哪些变化?最终产物为何物?
银白色
变暗
变潮湿
白色固体
白色粉末
Na
Na2O
NaOH
Na2CO3
Na2CO3·10H2O
O2
H2O
CO2
风化
思考﹒ 运用
在烧杯中加入水和苯(密度:0.88 g·cm-3)各50 mL。将一小粒金属钠(密度:0.97 g·cm-3)投入烧杯中。观察到的现象可能是
A.钠在水层中反应并四处游动
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处反应并可能作上、下跳动
考考你的智慧
謝謝您的聆聽
祝你有个美好的一天
