化学人教版(2019)选择性必修2 2.3分子的性质(共49张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.3分子的性质(共49张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-09 13:53:27 | ||
图片预览






文档简介
(共49张PPT)
2、如何判断键的极性
1、什么是共价键的极性?
3、什么是极性分子?什么是非极性分子?
4、如何判断一个分子的极性?
一、键的极性和分子的极性
阅读教材p52-53顶部,思考并回答下列问题:
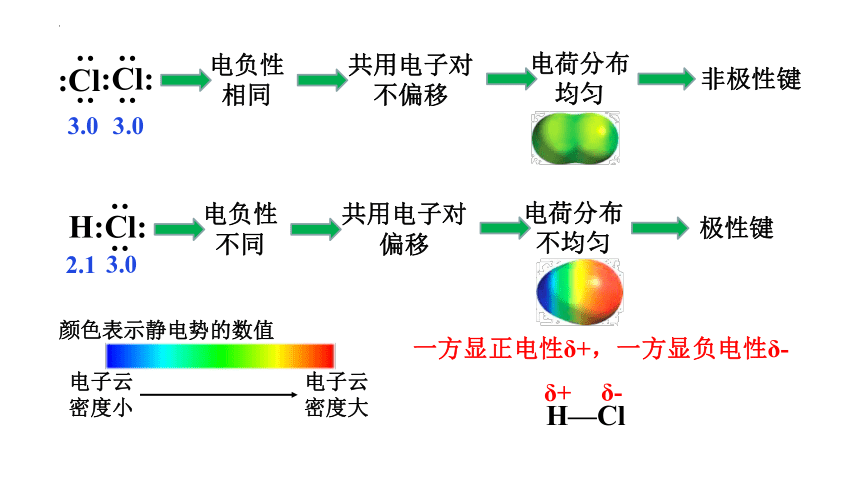
2.1
3.0
3.0
3.0
H:Cl:
: :
:Cl:
: :
:Cl
: :
电负性相同
共用电子对不偏移
电荷分布均匀
非极性键
电负性不同
共用电子对偏移
电荷分布不均匀
极性键
电子云
密度大
电子云
密度小
颜色表示静电势的数值
一方显正电性δ+,一方显负电性δ-
H—Cl
δ+
δ-
练习:指出下列微粒中的共价键类型
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键 非极性键
非极性键
极性键
2、分子的极性
①非极性分子
定义:正负电荷中心重合的分子
② 极性分子
定义:正负电荷中心不重合的分子
(1)下列物质中正电荷和负电荷的中心是否重合?
√
√
√
√
3、分子极性的判断方法
3、分子极性的判断方法
只含非极性键的分子一定是非极性分子
如: H2、O2 P4、C60、S8、Cl2 等单质(O3例外)
(2)化学键的极性的向量和是否等于零
CO2是非极性分子
180
F1
F2
F合=0
O
O
C
H
O
H
105
F1
F2
F合≠0
H2O是极性分子
BF3
NH3
120
三角锥型, 不对称,键的极性不能抵消,是极性分子
F1
F2
F3
F’
平面三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子
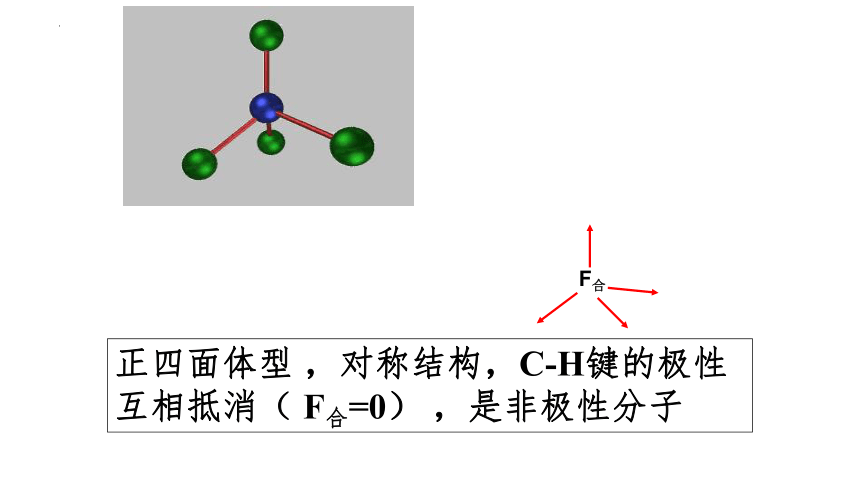
正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子
F合
思考与讨论P52
根据图2-18,思考和回答下列问题:
1、以下双原子分子中,哪些是极性分子,哪些是非极性分子?
H2 O2 Cl2 HCl
2、P4和C60是极性分子,还是非极性分子?
3、以下化合物分子中,哪些是极性分子,哪些是非极性分子?
CS2 HCN H2S PH3 BF3 SiH4 CHCl3
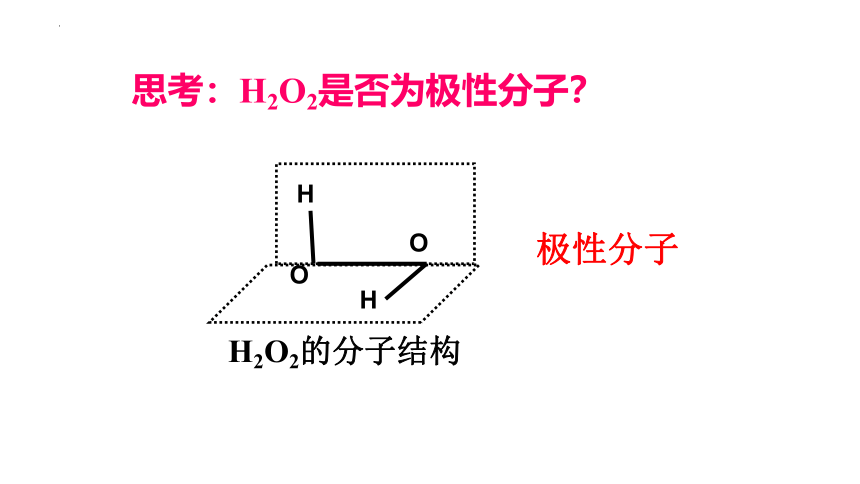
思考:H2O2是否为极性分子?
H2O2的分子结构
H
H
O
O
极性分子
补充:诱导效应(inductive effect)(1)涵义:由于电负性不同的原子或取代基的影响,使整个分子中成键电子云按取代基的电负性所决定的方向而偏移的效应。(2)特征:静电诱导,沿碳链传递,随链增长迅速减弱或消失,经过3个原子后,影响极弱,5个原子以上便消失(3) 分类:C——X C——H(饱和) C——Y
σ+
σ-
σ-
σ+
吸电子基 0 推电子基
(4) 吸电子基相对强度:
同族元素:-F > -Cl > -Br > -I
同周期:-F > -OR > -NR2
-O+R2 > -N+R3
带电荷: -N+R3 > -NR2
不同杂化态:sp > sp2 > sp3
(5) 推电子基相对强度:
a. 不饱和碳
b.烷基
(CH3)3C- > (CH3)2CH- > CH3CH2- > -CH3
1、根据下表,分析总结羧酸的酸性大小与其分子的组成和结构的关系。(规律?原因?)
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
pKa越小,
酸性越强
二、键的极性对物质性质的影响
δ+
δ-
δ+
δ-
H
O
H
O
C
甲酸
δ+
δ-
CH3
O
H
O
C
乙酸
C2H5
O
H
O
C
丙酸
不容易电离出H+
烷基是推电子基团
推电子效应沿着共价键传递
共用电子对向O原子偏移的程度减小
烷基越长,推电子效应越大
O-H键的极性减小
O不容易夺去H的电子
酸性减弱
O-H键的极性越大,酸性越强
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
卤素原子
是吸电子基团
共用电子对偏移的程度增大
O-H键的极性增大
酸性增强
一氯乙酸、二氯乙酸、三氯乙酸的表面静电势图
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
电负性:F > Cl
三氟乙酸中的
O-H键极性更大
三氟乙酸的酸性更强
(1)烷基是推电子基团,烷基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
小结:
随着烷基加长,酸性的差异越来越小。
(2)卤素原子是吸电子基团,卤素原子越多,吸电子效应越大,使羧基中的羟基的极性越大,羧酸的酸性越强。
2Na+2H-O-H=2NaOH+H2↑
2Na+2CH3CH2-O-H→2CH3CH2ONa+H2↑
水与钠反应更剧烈,由于烷基是推电子基团,使醇分子中的O-H键的极性小于水分子中的氢氧键的极性,相较于水,乙醇分子中的O-H键不容易断裂。
练习1:CH3CH2OH、H2O分别与钠反应,哪个反应更剧烈?试从键的极性角度解释原因。
练习2:CH3COOH是一种弱酸,而氯乙酸(ClCH2COOH)的酸性强于CH3COOH,这是因为—Cl是一种强吸电子基团,能使—OH上的H原子具有更大的活泼性,有的基团属于推电子基团,能减弱—OH上H原子的活泼性。试依据上述规律填空:
(1)HCOOH显酸性,而H2O显中性,这是由于HCOOH分子中存在____(填“吸”或“推”)电子基团,这种基团是________。
吸
—CHO
(2)CH3COOH的酸性弱于HCOOH,这是由于CH3COOH分子中存在______(填“吸”或“推”)电子基团,这种基团是_______。
推
—CH3
规律:
2、根据下表,分析总结无机含氧酸酸性大小与其分子结构的关系。
原因:
(HO)mROn,非羟基氧原子数n值越大,酸性越强。
氧原子是吸电子基团,氧原子越多,中心原子带正电荷越多,O-H键极性越大,更易电离出H+。
练习
(1)判断HClO、HClO3、HClO4酸性由弱到强的顺序为________。
(2)判断H3AsO4、H2CrO4、HMnO4酸性由弱到强的顺序为________。
(3)已知H3PO3为二元中强酸,H3AsO3为弱酸。试推断H3PO3和H3AsO3的分子结构__________。
(4)判断碳酸应属于__________酸,与通常认为的碳酸的强度是否一致?
其可能的原因是__________________________。
(4)H2CO3中非羟基氧数目为1,应为中强酸,与通常认为碳酸是弱酸不一致。其可能原因是由于溶于水的那部分CO2并不能完全转化为H2CO3。
专题研讨:磷酸及磷的其他含氧酸
亚磷酸
分子的极性
分子的空间结构
键的极性
决定
小结:
思考:
1、水分子中氢氧原子之间存在相互作用,那么水分子之间呢?
2、为什么水较容易气化(100℃)而水却很难分解( 1000℃也仅有极少量分解 )?
3、Cl2、Br2、I2单质都是由分子组成的物质,而它们的状态却不同,原因是什么?
二、范德华力及其对物质性质的影响
1. 定义:
3. 特点:
4. 影响范德华力大小的因素:
5.范德华力对物质性质的影响:
(1)作用力的范围很小(气态时可忽略)。
(2)很弱、比化学键的键能小约10—100倍。
分子的极性和质量(相对分子量)
影响由分子组成的物质的熔沸点
2. 本质:分子间较弱的电性作用
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸
点
/℃
周期
一些氢化物的沸点
同主族非金属元素的简单氢化物,从上到下,分子量逐渐增大,沸点应逐渐升高。而HF、H2O、NH3却出现反常,为什么?
有何规律?
三、氢键及其对物质性质的影响
1. 氢键概念:
(1)不属于化学键。
(2)一般表示为: X—H---Y(其中X、Y为F、O、N)
表示式中的实线表示共价键,虚线表示氢键。
(3)形成的两个条件:
①与电负性大且半径小的原子(F、 O、 N)相连的 H 。
② H附近有电负性大, 半径小的原子(F、 O、 N)。
2. 氢键的存在
(1)分子间氢键
氢键普遍存在于已经与N、O、F形成共价键的氢原子与另外的N、O、F原子之间。
如:HF、H2O、NH3 相互之间
C2H5OH、CH3COOH、H2O相互之间
(2)分子内氢键
(2)分子内氢键:
(1)分子间氢键:
3. 氢键的特点
(1)氢键强度介于范德华力和化学键之间(P58)
F—H---F O—H--- O N—H--- N
氢键键能 (kJ/mol) 28.1 18.8 5.4
范德华力(kJ/mol) 13.4 16.4 12.1
共价键键能(kJ/mol) 568 462.8 390.8
甲醇
(2)有一定的方向性,饱和性
(1)分子间氢键使物质熔沸点升高
(2)分子内氢键使物质熔沸点降低
(3)增大物质在水中的溶解性
4. 氢键对物质物理性质的影响:
(4)HF是弱酸--形成 (HF)n分子,电离不彻底
(5)在生物中的应用
(6)讨论水的特殊性(p57、p79)
a.水的熔沸点比较高?
b.接近沸点的水蒸气水分子相对分子量测定值偏大?
c.为什么水结冰后体积膨胀?
d.为什么水在4℃时密度最大?
随温度升高,同时发生两种相反的过程:一是冰晶结构受热不断崩溃,缔合分子减少;另一是水分子间距因热运动不断增大。0~4℃间,前者占优势;4℃以上,后者占优势。 4℃时,两者互不相让,招致水的密度最大。
补充:非常规氢键
HCl和NH3易溶于水,难溶于四氯化碳;而苯和碘(溴)却易溶于四氯化碳,难溶于水。
现象:
“相似相溶”的规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
四、溶解性
1.影响物质溶解性的因素
⑴影响固体溶解度的主要因素是___________。
⑵影响气体溶解度的主要因素是_________和_________。
2.相似相溶规律:______________________________
_______________________________。
⑴如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越____。相反,无氢键相互作用的溶质在有氢键的水中的溶解度就比较_______。
⑵“相似相溶”还适用于分子结构________。
3.如果溶质与水发生化学反应可_________其溶解度。
温度
温度 压强
非极性溶质一般能溶于非极性溶剂,
极性溶质一般能溶于极性溶剂。
好
小
相似
增大
P59思考与讨论:(1)NH3为什么极易溶于水?
试一试:是否重合
物体与其镜像不能重合
1. 手性:
A、B互为镜像对称,但在三维空间里不能重叠。
A与B互为手性异构体。
2. 手性异构体:
3. 手性分子:
有手性异构体的分子叫做手性分子,如A、B;
手性分子无对称中心和对称面。
五. 手性
4. 手性碳原子:
当碳原子结合的四个原子或原子团各不相同时,该碳原子是手性碳原子。
大部分手性分子含有手性碳原子。
5. 手性分子的应用:
(1)医药领域和生命科学领域;
(2)手性催化与合成。(学科前沿)
1.下列化合物中含有手性碳原子的是( )
A.CCl2F2 B.CH3—CH—COOH
C.CH3CH2OH D.CH—OH
练习:
CHO
CH2—OH
OH
B D
2、如何判断键的极性
1、什么是共价键的极性?
3、什么是极性分子?什么是非极性分子?
4、如何判断一个分子的极性?
一、键的极性和分子的极性
阅读教材p52-53顶部,思考并回答下列问题:
2.1
3.0
3.0
3.0
H:Cl:
: :
:Cl:
: :
:Cl
: :
电负性相同
共用电子对不偏移
电荷分布均匀
非极性键
电负性不同
共用电子对偏移
电荷分布不均匀
极性键
电子云
密度大
电子云
密度小
颜色表示静电势的数值
一方显正电性δ+,一方显负电性δ-
H—Cl
δ+
δ-
练习:指出下列微粒中的共价键类型
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键 非极性键
非极性键
极性键
2、分子的极性
①非极性分子
定义:正负电荷中心重合的分子
② 极性分子
定义:正负电荷中心不重合的分子
(1)下列物质中正电荷和负电荷的中心是否重合?
√
√
√
√
3、分子极性的判断方法
3、分子极性的判断方法
只含非极性键的分子一定是非极性分子
如: H2、O2 P4、C60、S8、Cl2 等单质(O3例外)
(2)化学键的极性的向量和是否等于零
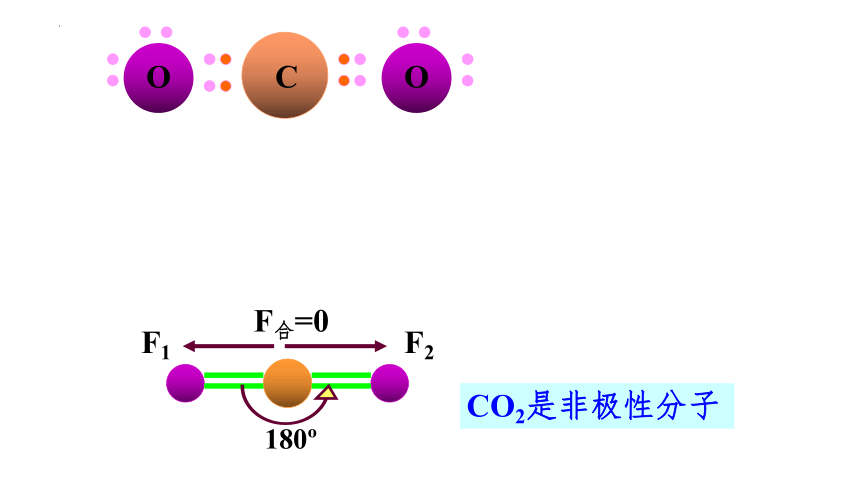
CO2是非极性分子
180
F1
F2
F合=0
O
O
C
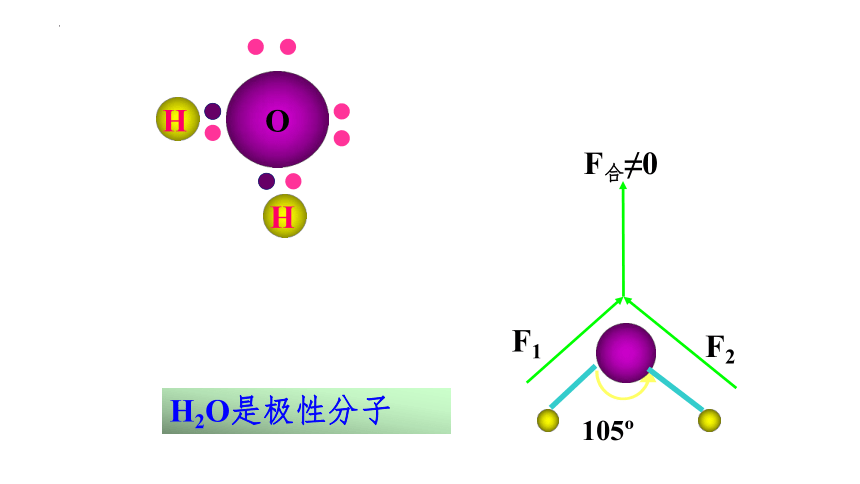
H
O
H
105
F1
F2
F合≠0
H2O是极性分子
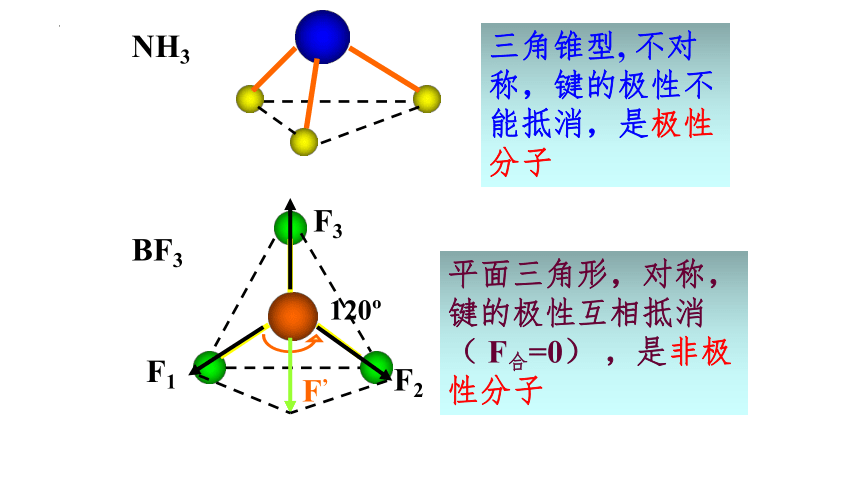
BF3
NH3
120
三角锥型, 不对称,键的极性不能抵消,是极性分子
F1
F2
F3
F’
平面三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子
正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子
F合
思考与讨论P52
根据图2-18,思考和回答下列问题:
1、以下双原子分子中,哪些是极性分子,哪些是非极性分子?
H2 O2 Cl2 HCl
2、P4和C60是极性分子,还是非极性分子?
3、以下化合物分子中,哪些是极性分子,哪些是非极性分子?
CS2 HCN H2S PH3 BF3 SiH4 CHCl3
思考:H2O2是否为极性分子?
H2O2的分子结构
H
H
O
O
极性分子
补充:诱导效应(inductive effect)(1)涵义:由于电负性不同的原子或取代基的影响,使整个分子中成键电子云按取代基的电负性所决定的方向而偏移的效应。(2)特征:静电诱导,沿碳链传递,随链增长迅速减弱或消失,经过3个原子后,影响极弱,5个原子以上便消失(3) 分类:C——X C——H(饱和) C——Y
σ+
σ-
σ-
σ+
吸电子基 0 推电子基
(4) 吸电子基相对强度:
同族元素:-F > -Cl > -Br > -I
同周期:-F > -OR > -NR2
-O+R2 > -N+R3
带电荷: -N+R3 > -NR2
不同杂化态:sp > sp2 > sp3
(5) 推电子基相对强度:
a. 不饱和碳
b.烷基
(CH3)3C- > (CH3)2CH- > CH3CH2- > -CH3
1、根据下表,分析总结羧酸的酸性大小与其分子的组成和结构的关系。(规律?原因?)
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
pKa越小,
酸性越强
二、键的极性对物质性质的影响
δ+
δ-
δ+
δ-
H
O
H
O
C
甲酸
δ+
δ-
CH3
O
H
O
C
乙酸
C2H5
O
H
O
C
丙酸
不容易电离出H+
烷基是推电子基团
推电子效应沿着共价键传递
共用电子对向O原子偏移的程度减小
烷基越长,推电子效应越大
O-H键的极性减小
O不容易夺去H的电子
酸性减弱
O-H键的极性越大,酸性越强
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
卤素原子
是吸电子基团
共用电子对偏移的程度增大
O-H键的极性增大
酸性增强
一氯乙酸、二氯乙酸、三氯乙酸的表面静电势图
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
电负性:F > Cl
三氟乙酸中的
O-H键极性更大
三氟乙酸的酸性更强
(1)烷基是推电子基团,烷基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
小结:
随着烷基加长,酸性的差异越来越小。
(2)卤素原子是吸电子基团,卤素原子越多,吸电子效应越大,使羧基中的羟基的极性越大,羧酸的酸性越强。
2Na+2H-O-H=2NaOH+H2↑
2Na+2CH3CH2-O-H→2CH3CH2ONa+H2↑
水与钠反应更剧烈,由于烷基是推电子基团,使醇分子中的O-H键的极性小于水分子中的氢氧键的极性,相较于水,乙醇分子中的O-H键不容易断裂。
练习1:CH3CH2OH、H2O分别与钠反应,哪个反应更剧烈?试从键的极性角度解释原因。
练习2:CH3COOH是一种弱酸,而氯乙酸(ClCH2COOH)的酸性强于CH3COOH,这是因为—Cl是一种强吸电子基团,能使—OH上的H原子具有更大的活泼性,有的基团属于推电子基团,能减弱—OH上H原子的活泼性。试依据上述规律填空:
(1)HCOOH显酸性,而H2O显中性,这是由于HCOOH分子中存在____(填“吸”或“推”)电子基团,这种基团是________。
吸
—CHO
(2)CH3COOH的酸性弱于HCOOH,这是由于CH3COOH分子中存在______(填“吸”或“推”)电子基团,这种基团是_______。
推
—CH3
规律:
2、根据下表,分析总结无机含氧酸酸性大小与其分子结构的关系。
原因:
(HO)mROn,非羟基氧原子数n值越大,酸性越强。
氧原子是吸电子基团,氧原子越多,中心原子带正电荷越多,O-H键极性越大,更易电离出H+。
练习
(1)判断HClO、HClO3、HClO4酸性由弱到强的顺序为________。
(2)判断H3AsO4、H2CrO4、HMnO4酸性由弱到强的顺序为________。
(3)已知H3PO3为二元中强酸,H3AsO3为弱酸。试推断H3PO3和H3AsO3的分子结构__________。
(4)判断碳酸应属于__________酸,与通常认为的碳酸的强度是否一致?
其可能的原因是__________________________。
(4)H2CO3中非羟基氧数目为1,应为中强酸,与通常认为碳酸是弱酸不一致。其可能原因是由于溶于水的那部分CO2并不能完全转化为H2CO3。
专题研讨:磷酸及磷的其他含氧酸
亚磷酸
分子的极性
分子的空间结构
键的极性
决定
小结:
思考:
1、水分子中氢氧原子之间存在相互作用,那么水分子之间呢?
2、为什么水较容易气化(100℃)而水却很难分解( 1000℃也仅有极少量分解 )?
3、Cl2、Br2、I2单质都是由分子组成的物质,而它们的状态却不同,原因是什么?
二、范德华力及其对物质性质的影响
1. 定义:
3. 特点:
4. 影响范德华力大小的因素:
5.范德华力对物质性质的影响:
(1)作用力的范围很小(气态时可忽略)。
(2)很弱、比化学键的键能小约10—100倍。
分子的极性和质量(相对分子量)
影响由分子组成的物质的熔沸点
2. 本质:分子间较弱的电性作用
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸
点
/℃
周期
一些氢化物的沸点
同主族非金属元素的简单氢化物,从上到下,分子量逐渐增大,沸点应逐渐升高。而HF、H2O、NH3却出现反常,为什么?
有何规律?
三、氢键及其对物质性质的影响
1. 氢键概念:
(1)不属于化学键。
(2)一般表示为: X—H---Y(其中X、Y为F、O、N)
表示式中的实线表示共价键,虚线表示氢键。
(3)形成的两个条件:
①与电负性大且半径小的原子(F、 O、 N)相连的 H 。
② H附近有电负性大, 半径小的原子(F、 O、 N)。
2. 氢键的存在
(1)分子间氢键
氢键普遍存在于已经与N、O、F形成共价键的氢原子与另外的N、O、F原子之间。
如:HF、H2O、NH3 相互之间
C2H5OH、CH3COOH、H2O相互之间
(2)分子内氢键
(2)分子内氢键:
(1)分子间氢键:
3. 氢键的特点
(1)氢键强度介于范德华力和化学键之间(P58)
F—H---F O—H--- O N—H--- N
氢键键能 (kJ/mol) 28.1 18.8 5.4
范德华力(kJ/mol) 13.4 16.4 12.1
共价键键能(kJ/mol) 568 462.8 390.8
甲醇
(2)有一定的方向性,饱和性
(1)分子间氢键使物质熔沸点升高
(2)分子内氢键使物质熔沸点降低
(3)增大物质在水中的溶解性
4. 氢键对物质物理性质的影响:
(4)HF是弱酸--形成 (HF)n分子,电离不彻底
(5)在生物中的应用
(6)讨论水的特殊性(p57、p79)
a.水的熔沸点比较高?
b.接近沸点的水蒸气水分子相对分子量测定值偏大?
c.为什么水结冰后体积膨胀?
d.为什么水在4℃时密度最大?
随温度升高,同时发生两种相反的过程:一是冰晶结构受热不断崩溃,缔合分子减少;另一是水分子间距因热运动不断增大。0~4℃间,前者占优势;4℃以上,后者占优势。 4℃时,两者互不相让,招致水的密度最大。
补充:非常规氢键
HCl和NH3易溶于水,难溶于四氯化碳;而苯和碘(溴)却易溶于四氯化碳,难溶于水。
现象:
“相似相溶”的规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
四、溶解性
1.影响物质溶解性的因素
⑴影响固体溶解度的主要因素是___________。
⑵影响气体溶解度的主要因素是_________和_________。
2.相似相溶规律:______________________________
_______________________________。
⑴如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越____。相反,无氢键相互作用的溶质在有氢键的水中的溶解度就比较_______。
⑵“相似相溶”还适用于分子结构________。
3.如果溶质与水发生化学反应可_________其溶解度。
温度
温度 压强
非极性溶质一般能溶于非极性溶剂,
极性溶质一般能溶于极性溶剂。
好
小
相似
增大
P59思考与讨论:(1)NH3为什么极易溶于水?
试一试:是否重合
物体与其镜像不能重合
1. 手性:
A、B互为镜像对称,但在三维空间里不能重叠。
A与B互为手性异构体。
2. 手性异构体:
3. 手性分子:
有手性异构体的分子叫做手性分子,如A、B;
手性分子无对称中心和对称面。
五. 手性
4. 手性碳原子:
当碳原子结合的四个原子或原子团各不相同时,该碳原子是手性碳原子。
大部分手性分子含有手性碳原子。
5. 手性分子的应用:
(1)医药领域和生命科学领域;
(2)手性催化与合成。(学科前沿)
1.下列化合物中含有手性碳原子的是( )
A.CCl2F2 B.CH3—CH—COOH
C.CH3CH2OH D.CH—OH
练习:
CHO
CH2—OH
OH
B D
