1.1原子结构 课件 2022-2023学年高二化学人教版(2019)选择性必修2(共33页)
文档属性
| 名称 | 1.1原子结构 课件 2022-2023学年高二化学人教版(2019)选择性必修2(共33页) | 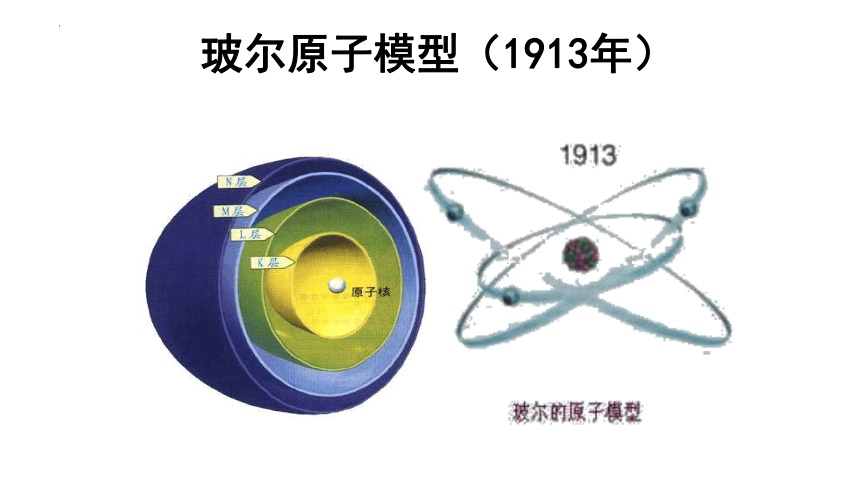 | |
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-09 13:55:58 | ||
图片预览






文档简介
(共33张PPT)
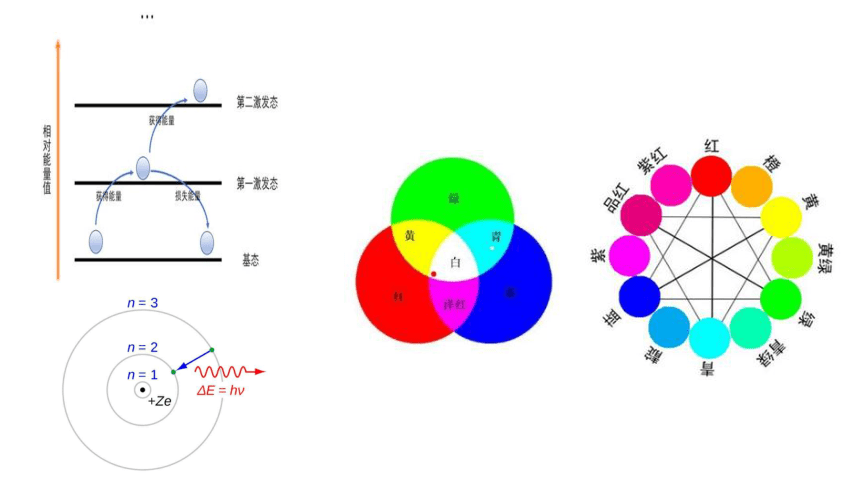
玻尔原子模型(1913年)
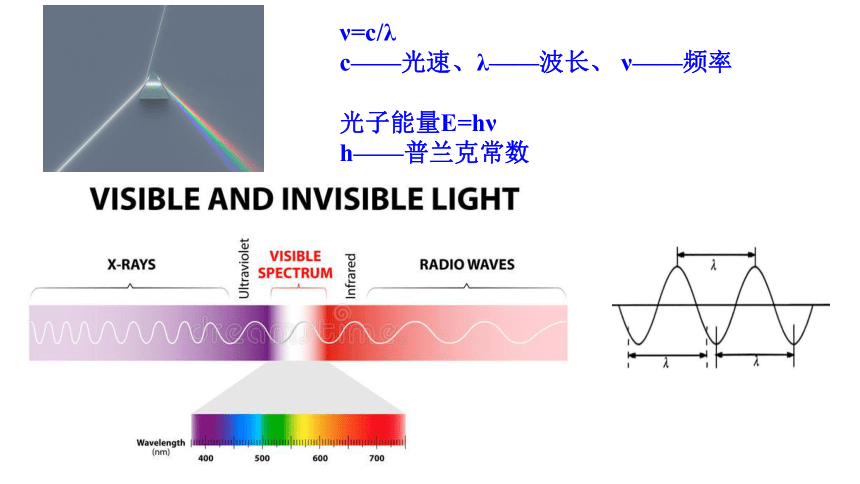
ν=c/λ
c——光速、λ——波长、 ν——频率
光子能量E=hν
h——普兰克常数
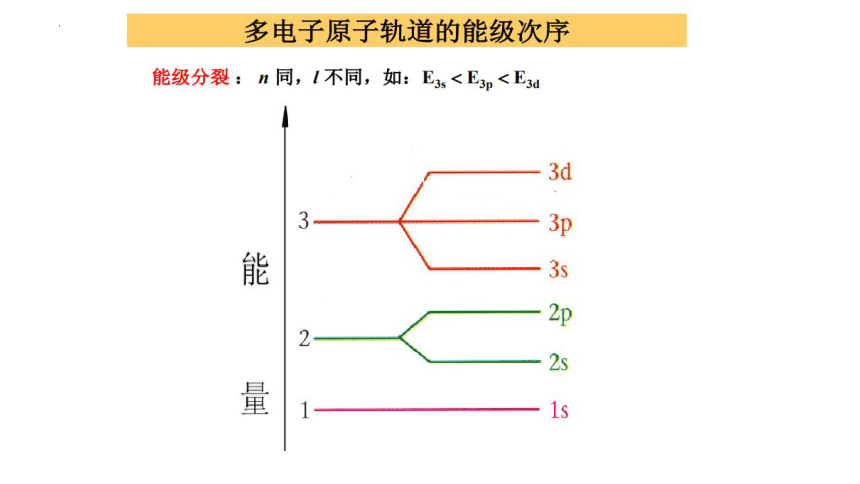
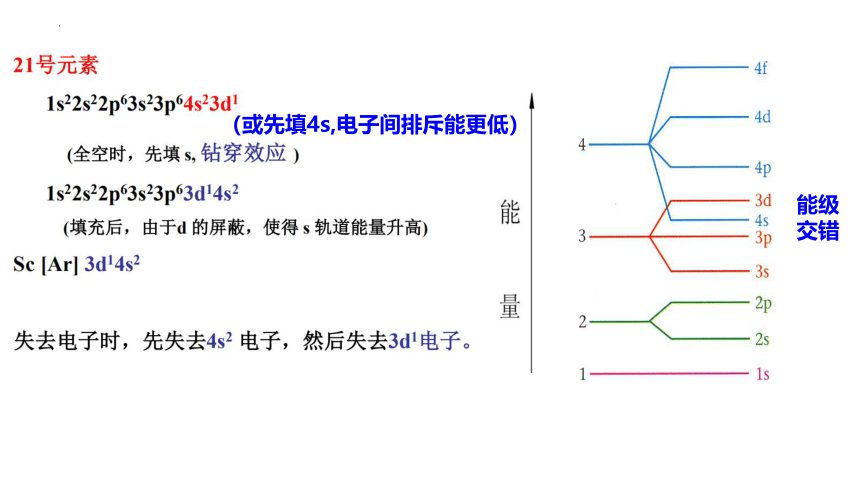
能级
交错
(或先填4s,电子间排斥能更低)
4 铍Be
5 硼B
6 碳C
7 氮N
8 氧O
9 氟F
10 氖Ne
1s2 2s2
1s2 2s22p1
1s2 2s22p2
1s2 2s22p3
1s2 2s22p4
1s2 2s22p5
1s2 2s22p6
21钪Sc:
钛Ti:
钒V:
铬Cr:
锰Mn:
铁Fe:
钴Co:
镍Ni:
1s22s22p63s23p63d14s2
1s22s22p63s23p63d24s2
1s22s22p63s23p63d34s2
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s2
1s22s22p63s23p63d64s2
1s22s22p63s23p63d74s2
1s22s22p63s23p63d84s2
铜Cu:
锌Zn:
镓Ga:
锗Ge:
砷As:
硒Se:
溴Br:
36氪Kr:
1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s2
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p2
1s22s22p63s23p63d104s24p3
1s22s22p63s23p63d104s24p4
1s22s22p63s23p63d104s24p5
1s22s22p63s23p63d104s24p6
电子云模型(1935年)
几率波
或
概率波
无轨迹
有规律
形状与颜色深浅
电子云轮廓图的制作
常把电子出现的概率约为90%的空间圈出来,得到电子云轮廓图
S能级的电子云轮廓图
* S能级的电子轮廓图是球形对称的
* 能层序数n越大,电子轮廓图半径越大
P能级的电子云轮廓图
d能级的电子云轮廓图
f能级的电子云轮廓图
波函数本身意义不明确,但包含的内容丰富,将各种物理算符作用于波函数可得到对应的物理量。
+
原子轨道轮廓图
形状、取向与电子云轮廓图相似、稍胖、有正、负号。
中学阶段不考虑符号时二者可不区别!
电子的自旋
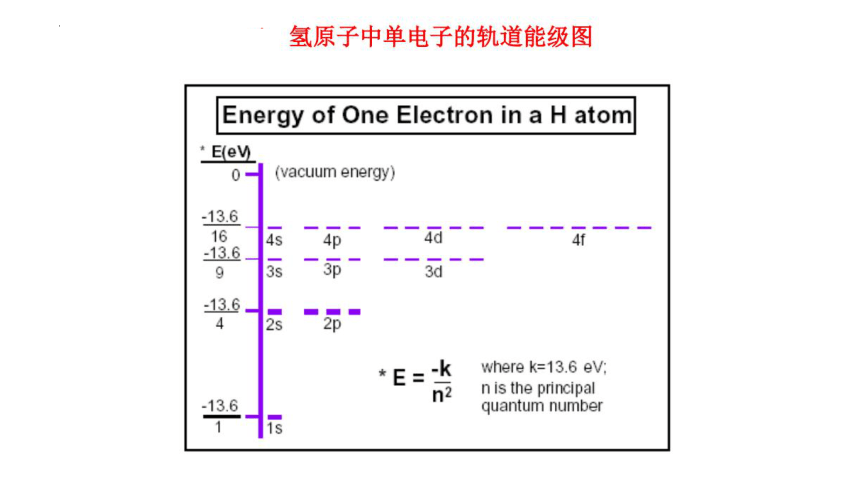
1、能层:
一、核外电子的运动状态
2、能级:
3、电子云与电子云轮廓图:
4、原子轨道与电子云轮廓图:
5、电子的自旋:
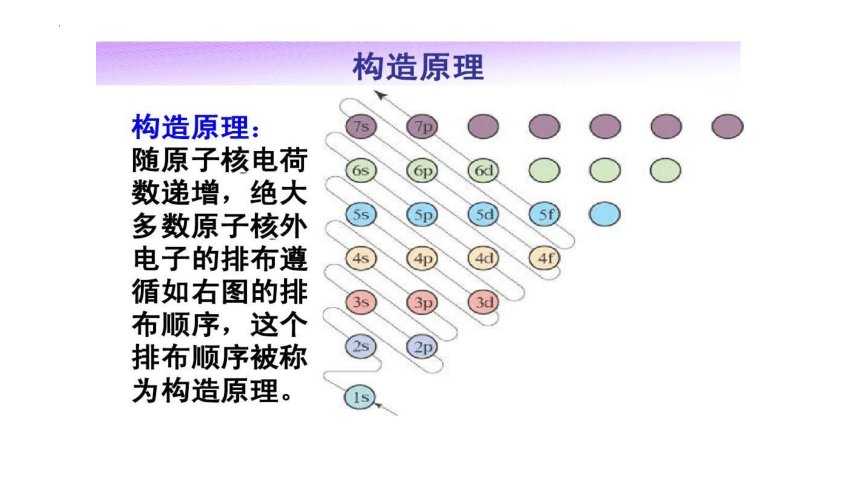
1、构造原理:
二、核外电子排布规律
2、泡利原理:
3、洪特规则:
4、半满、全满规则:(教师讲)
5、能量最低原理:核外电子排布总是尽可能使体系(整个原子)能量处于最低状态(基态)
原子(简单离子)结构的表示方法
1、电子排布式:
2、简化电子排布式:
3、轨道表示式(电子排布图):
4、价电子排布式和排布图:
5、有多少单电子?多少成对电子?多少对?
6、有多少种能量?有多少种空间运动状态和运动状态?
7、结构示意图:
26Fe
4、范德华半径
(稀有气体分子间距一半,比一般原子半径大很多)
玻尔原子模型(1913年)
ν=c/λ
c——光速、λ——波长、 ν——频率
光子能量E=hν
h——普兰克常数
能级
交错
(或先填4s,电子间排斥能更低)
4 铍Be
5 硼B
6 碳C
7 氮N
8 氧O
9 氟F
10 氖Ne
1s2 2s2
1s2 2s22p1
1s2 2s22p2
1s2 2s22p3
1s2 2s22p4
1s2 2s22p5
1s2 2s22p6
21钪Sc:
钛Ti:
钒V:
铬Cr:
锰Mn:
铁Fe:
钴Co:
镍Ni:
1s22s22p63s23p63d14s2
1s22s22p63s23p63d24s2
1s22s22p63s23p63d34s2
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s2
1s22s22p63s23p63d64s2
1s22s22p63s23p63d74s2
1s22s22p63s23p63d84s2
铜Cu:
锌Zn:
镓Ga:
锗Ge:
砷As:
硒Se:
溴Br:
36氪Kr:
1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s2
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p2
1s22s22p63s23p63d104s24p3
1s22s22p63s23p63d104s24p4
1s22s22p63s23p63d104s24p5
1s22s22p63s23p63d104s24p6
电子云模型(1935年)
几率波
或
概率波
无轨迹
有规律
形状与颜色深浅
电子云轮廓图的制作
常把电子出现的概率约为90%的空间圈出来,得到电子云轮廓图
S能级的电子云轮廓图
* S能级的电子轮廓图是球形对称的
* 能层序数n越大,电子轮廓图半径越大
P能级的电子云轮廓图
d能级的电子云轮廓图
f能级的电子云轮廓图
波函数本身意义不明确,但包含的内容丰富,将各种物理算符作用于波函数可得到对应的物理量。
+
原子轨道轮廓图
形状、取向与电子云轮廓图相似、稍胖、有正、负号。
中学阶段不考虑符号时二者可不区别!
电子的自旋
1、能层:
一、核外电子的运动状态
2、能级:
3、电子云与电子云轮廓图:
4、原子轨道与电子云轮廓图:
5、电子的自旋:
1、构造原理:
二、核外电子排布规律
2、泡利原理:
3、洪特规则:
4、半满、全满规则:(教师讲)
5、能量最低原理:核外电子排布总是尽可能使体系(整个原子)能量处于最低状态(基态)
原子(简单离子)结构的表示方法
1、电子排布式:
2、简化电子排布式:
3、轨道表示式(电子排布图):
4、价电子排布式和排布图:
5、有多少单电子?多少成对电子?多少对?
6、有多少种能量?有多少种空间运动状态和运动状态?
7、结构示意图:
26Fe
4、范德华半径
(稀有气体分子间距一半,比一般原子半径大很多)
