鲁科版 化学 选择性必修1 2.1 化学反应的方向 课件(共21张PPT)
文档属性
| 名称 | 鲁科版 化学 选择性必修1 2.1 化学反应的方向 课件(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-10 08:50:22 | ||
图片预览








文档简介
(共21张PPT)
鲁科版 《 化学反应原理 》
第2章 化学反应的方向、限度与速率
第 1 节 化学反应的方向
核心素养发展目标
HEXINSUYANGFAZHANMUBIAO
证据推理与模型认知
1.通过分析反应的焓变与反应的方向,了解反应焓变与反应方向有关,但不是唯一的影响因素;
2.通过分析反应的熵变与反应的方向,了解反应熵变与反应方向有关,但也不是唯一的影响因素;
3.通过分析关系式△H-T△S,分析反应焓变和反应熵变对反应方向的综合影响。
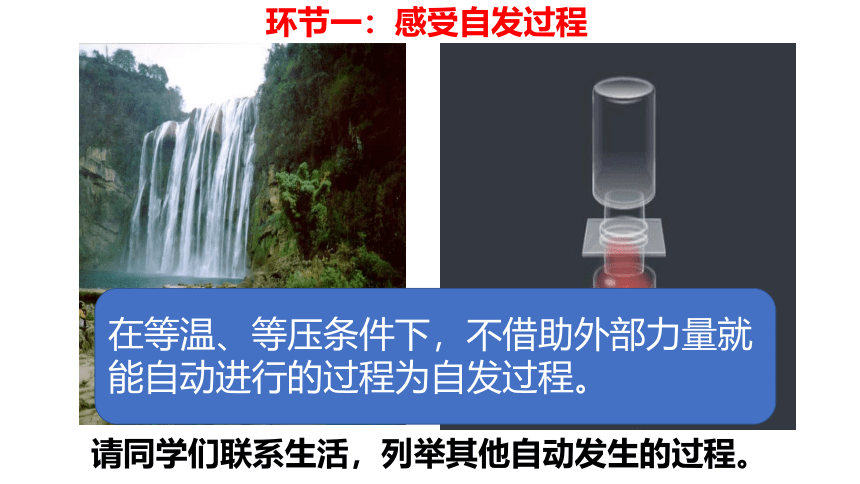
环节一:感受自发过程
在等温、等压条件下,不借助外部力量就能自动进行的过程为自发过程。
请同学们联系生活,列举其他自动发生的过程。
能量角度:体系趋向于从高能量状态转换为低能量状态
生活中的自发过程
任务一:反应焓变与反应方向
交流 研讨
观察以下能自发进行的化学反应的热化学方程式,总结这些自发反应的共同点是什么
(2) CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ/mol
(3) 4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s) ΔH=-444.3 kJ/mol
(4) 2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
共同点: ΔH<0,放热反应
(5) 2Na(s)+Cl2(g)=2NaCl(s) ΔH=-822.3 kJ/mol
(1) H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
据此得出什么结论?
环节二:化学反应的方向
任务一:反应焓变与反应方向
19世纪的化学家曾认为:
ΔH<0,反应自发进行
ΔH>0,反应不能自发进行
”证明“:科学研究中,要证明一个假设成立,就是证明凡符合假设的所有情况都能得出结论,即列举大量支持假设的实例。
”证伪“:要证明一个假设不成立,只需举出一个反例就可。
任务一:反应焓变与反应方向
动手动脑
实验内容:
实验现象:
实验结论:
NH4Cl和Ba(OH)2·8H2O的反应
产生刺激性气味的物质,烧杯壁变凉
NH4Cl和Ba(OH)2·8H2O的反应为可自发进行的吸热反应
△H<0,利于反应自发进行,但不绝对,吸热反应也有能自发进行的。
实验小贴士
注意规范操作
小结
(2) 2N2O5(g)=4NO2(g)+O2(g) ΔH>0
(3) (NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ΔH>0
(4)
(1) Ba(OH)2·8H2O(s)+2NH4Cl (s) = BaCl2(aq) +2NH3(g) +10H2O(l) ΔH>0
思考
根据下列自发吸热反应的共同特点判断是什么“推动”了反应的进行?
任务二:反应熵变与反应方向
一个新的物理量——熵
1.定义:描述体系无序程度的一个物理量。
——符号S,单位是J·mol-1·K-1
2.大小判据:
无序程度越高,熵值越大。
纯物质的熵值的大小与物质的种类、数量、聚集状态以及温度、压强等因素有关。
例如,同一条件下,不同物质,熵值不同;
同一物质,S(g)>S(l)>S(s);
物质的量越大,熵值越大。
类比 归纳
常见熵 ΔS>0 增加的物理过程
固体的溶解 水的汽化 墨水在水中的扩散 气体的扩散
化学反应存在着熵变(ΔS)
ΔS =反应产物的总熵—反应物的总熵
对于确定的化学反应,在一定条件下具有确定的熵变。
ΔS>0 反应体系混乱度增大
ΔS<0 反应体系混乱度减小
判断下列过程的熵变是大于零还是小于零?
(1) 2H2O2(aq) = 2H2O(l)+O2(g)
(2) NH3(g) +HCl(g) = NH4Cl(s)
(3) 2NaHCO3(s)= Na2CO3(s)+CO2(g)+H2O(l)
(4) N2(g)+3H2(g) 2NH3(g)
(5) Ag+(aq)+Cl-(aq) =AgCl(s)
ΔS>0
ΔS<0
【针对训练】
ΔS>0
ΔS<0
ΔS<0
(2) 2N2O5(g)=4NO2(g)+O2(g) ΔH>0
(3) (NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ΔH>0
(4)
(1) Ba(OH)2·8H2O(s)+2NH4Cl (s) = BaCl2(aq) +2NH3(g) +10H2O(l) ΔH>0
任务二:反应熵变与反应方向
ΔS>0,利于反应自发进行
思考下述过程的方向性,体会熵变与反应的自发性有何关系
交流 研讨
熵减少的反应,在一定条件下也可以自发进行
是不是只有熵增(ΔS>0)的反应才能自发进行?
不是
ΔS>0的反应,利于反应自发进行,但不绝对,熵减小的反应也有能自发进行的。
小结
任务二:反应熵变与反应方向
任务三:用焓变与熵变综合判断反应方向
焓变 熵变 反应的自发性
ΔS<0
ΔS<0
ΔS>0
ΔS>0
ΔH<0
ΔH<0
ΔH>0
ΔH>0
?
反应能够自发进行
反应不能自发进行
拓展 视野
吉布斯自由能(符号G)的定义式为G=H-TS。
△G为反应的吉布斯自由能变△G=△H-T△S,表示的是一个封闭体系在等温、等压条件下做最大非体积功的能力。在等温、等压及除了体积功以外不做其他功的条件下,反应的方向可依据△G来判断。
△ G=△H-T△S<0,反应正向能自发进行
△ G=△H-T△S=0,反应到达平衡状态
△ G=△H-T△S>0,反应正向不能自发进行
判断下列反应进行的趋势。
(1) NH3(g) +HCl(g) = NH4Cl(s)
(2) NH4Cl(s) = NH3(g) +HCl(g)
ΔH<0
ΔS<0
△G=△H-T△S
低温自发进行
ΔH>0
ΔS>0
△G=△H-T△S
高温自发进行
Δ
任务三:用焓变与熵变综合判断反应方向
任务三:用焓变与熵变综合判断反应方向
焓变 熵变 反应的自发性
反应能够自发进行
反应不能自发进行
ΔS<0
ΔS<0
ΔS>0
ΔS>0
ΔH<0
ΔH<0
ΔH>0
ΔH>0
与温度
有关
低温利于自发进行
高温利于自发进行
说明小贴士
1
反应可行性和反应现实性的区别
反应方向的判据只能用于确定反应是否有自发进行的趋势,不能确定反应是否一定会发生。
2
以上反应的讨论,仅限于等温等压及除了体积功以外不做其他功条件下,人为的干预可以改变反应的方向。
迁移应用
汽车尾气中主要污染物是一氧化氮和一氧化碳,它们是现代城市中的重要大气污染物,依据所学知识提出治理的办法并说明理论依据。
NO(g) + CO(g) =??
2NO(g) + 2CO(g) = N2(g) +2CO2(g)
在298 K、100 kPa下,ΔH=-746.8 kJ·mol-1,
ΔS=-197.5 J·mol-1·K-1。
ΔH-TΔS=-746.8 kJ·mol-1-298 K×(-197.5×10-3 kJ·mol-1·K-1)
= - 687.9kJ·mol-1<0
因此,室温下反应能正向进行。
治理的办法之一:汽车排气管安装催化转化器。
科学改善生活
化学反应的方向
反应焓变
反应熵变
共同 影响
吸热
放热
熵增
熵减
能量判据
熵判据
ΔH - TΔS < 0 反应正向能自发进行。
ΔH - TΔS = 0 反应达到平衡状态。
ΔH - TΔS > 0 反应正向不能自发进行。
模型建构
思维建模
本节收获
鲁科版 《 化学反应原理 》
第2章 化学反应的方向、限度与速率
第 1 节 化学反应的方向
核心素养发展目标
HEXINSUYANGFAZHANMUBIAO
证据推理与模型认知
1.通过分析反应的焓变与反应的方向,了解反应焓变与反应方向有关,但不是唯一的影响因素;
2.通过分析反应的熵变与反应的方向,了解反应熵变与反应方向有关,但也不是唯一的影响因素;
3.通过分析关系式△H-T△S,分析反应焓变和反应熵变对反应方向的综合影响。
环节一:感受自发过程
在等温、等压条件下,不借助外部力量就能自动进行的过程为自发过程。
请同学们联系生活,列举其他自动发生的过程。
能量角度:体系趋向于从高能量状态转换为低能量状态
生活中的自发过程
任务一:反应焓变与反应方向
交流 研讨
观察以下能自发进行的化学反应的热化学方程式,总结这些自发反应的共同点是什么
(2) CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ/mol
(3) 4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s) ΔH=-444.3 kJ/mol
(4) 2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
共同点: ΔH<0,放热反应
(5) 2Na(s)+Cl2(g)=2NaCl(s) ΔH=-822.3 kJ/mol
(1) H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
据此得出什么结论?
环节二:化学反应的方向
任务一:反应焓变与反应方向
19世纪的化学家曾认为:
ΔH<0,反应自发进行
ΔH>0,反应不能自发进行
”证明“:科学研究中,要证明一个假设成立,就是证明凡符合假设的所有情况都能得出结论,即列举大量支持假设的实例。
”证伪“:要证明一个假设不成立,只需举出一个反例就可。
任务一:反应焓变与反应方向
动手动脑
实验内容:
实验现象:
实验结论:
NH4Cl和Ba(OH)2·8H2O的反应
产生刺激性气味的物质,烧杯壁变凉
NH4Cl和Ba(OH)2·8H2O的反应为可自发进行的吸热反应
△H<0,利于反应自发进行,但不绝对,吸热反应也有能自发进行的。
实验小贴士
注意规范操作
小结
(2) 2N2O5(g)=4NO2(g)+O2(g) ΔH>0
(3) (NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ΔH>0
(4)
(1) Ba(OH)2·8H2O(s)+2NH4Cl (s) = BaCl2(aq) +2NH3(g) +10H2O(l) ΔH>0
思考
根据下列自发吸热反应的共同特点判断是什么“推动”了反应的进行?
任务二:反应熵变与反应方向
一个新的物理量——熵
1.定义:描述体系无序程度的一个物理量。
——符号S,单位是J·mol-1·K-1
2.大小判据:
无序程度越高,熵值越大。
纯物质的熵值的大小与物质的种类、数量、聚集状态以及温度、压强等因素有关。
例如,同一条件下,不同物质,熵值不同;
同一物质,S(g)>S(l)>S(s);
物质的量越大,熵值越大。
类比 归纳
常见熵 ΔS>0 增加的物理过程
固体的溶解 水的汽化 墨水在水中的扩散 气体的扩散
化学反应存在着熵变(ΔS)
ΔS =反应产物的总熵—反应物的总熵
对于确定的化学反应,在一定条件下具有确定的熵变。
ΔS>0 反应体系混乱度增大
ΔS<0 反应体系混乱度减小
判断下列过程的熵变是大于零还是小于零?
(1) 2H2O2(aq) = 2H2O(l)+O2(g)
(2) NH3(g) +HCl(g) = NH4Cl(s)
(3) 2NaHCO3(s)= Na2CO3(s)+CO2(g)+H2O(l)
(4) N2(g)+3H2(g) 2NH3(g)
(5) Ag+(aq)+Cl-(aq) =AgCl(s)
ΔS>0
ΔS<0
【针对训练】
ΔS>0
ΔS<0
ΔS<0
(2) 2N2O5(g)=4NO2(g)+O2(g) ΔH>0
(3) (NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ΔH>0
(4)
(1) Ba(OH)2·8H2O(s)+2NH4Cl (s) = BaCl2(aq) +2NH3(g) +10H2O(l) ΔH>0
任务二:反应熵变与反应方向
ΔS>0,利于反应自发进行
思考下述过程的方向性,体会熵变与反应的自发性有何关系
交流 研讨
熵减少的反应,在一定条件下也可以自发进行
是不是只有熵增(ΔS>0)的反应才能自发进行?
不是
ΔS>0的反应,利于反应自发进行,但不绝对,熵减小的反应也有能自发进行的。
小结
任务二:反应熵变与反应方向
任务三:用焓变与熵变综合判断反应方向
焓变 熵变 反应的自发性
ΔS<0
ΔS<0
ΔS>0
ΔS>0
ΔH<0
ΔH<0
ΔH>0
ΔH>0
?
反应能够自发进行
反应不能自发进行
拓展 视野
吉布斯自由能(符号G)的定义式为G=H-TS。
△G为反应的吉布斯自由能变△G=△H-T△S,表示的是一个封闭体系在等温、等压条件下做最大非体积功的能力。在等温、等压及除了体积功以外不做其他功的条件下,反应的方向可依据△G来判断。
△ G=△H-T△S<0,反应正向能自发进行
△ G=△H-T△S=0,反应到达平衡状态
△ G=△H-T△S>0,反应正向不能自发进行
判断下列反应进行的趋势。
(1) NH3(g) +HCl(g) = NH4Cl(s)
(2) NH4Cl(s) = NH3(g) +HCl(g)
ΔH<0
ΔS<0
△G=△H-T△S
低温自发进行
ΔH>0
ΔS>0
△G=△H-T△S
高温自发进行
Δ
任务三:用焓变与熵变综合判断反应方向
任务三:用焓变与熵变综合判断反应方向
焓变 熵变 反应的自发性
反应能够自发进行
反应不能自发进行
ΔS<0
ΔS<0
ΔS>0
ΔS>0
ΔH<0
ΔH<0
ΔH>0
ΔH>0
与温度
有关
低温利于自发进行
高温利于自发进行
说明小贴士
1
反应可行性和反应现实性的区别
反应方向的判据只能用于确定反应是否有自发进行的趋势,不能确定反应是否一定会发生。
2
以上反应的讨论,仅限于等温等压及除了体积功以外不做其他功条件下,人为的干预可以改变反应的方向。
迁移应用
汽车尾气中主要污染物是一氧化氮和一氧化碳,它们是现代城市中的重要大气污染物,依据所学知识提出治理的办法并说明理论依据。
NO(g) + CO(g) =??
2NO(g) + 2CO(g) = N2(g) +2CO2(g)
在298 K、100 kPa下,ΔH=-746.8 kJ·mol-1,
ΔS=-197.5 J·mol-1·K-1。
ΔH-TΔS=-746.8 kJ·mol-1-298 K×(-197.5×10-3 kJ·mol-1·K-1)
= - 687.9kJ·mol-1<0
因此,室温下反应能正向进行。
治理的办法之一:汽车排气管安装催化转化器。
科学改善生活
化学反应的方向
反应焓变
反应熵变
共同 影响
吸热
放热
熵增
熵减
能量判据
熵判据
ΔH - TΔS < 0 反应正向能自发进行。
ΔH - TΔS = 0 反应达到平衡状态。
ΔH - TΔS > 0 反应正向不能自发进行。
模型建构
思维建模
本节收获
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
