1.2 化学能转化为电能——电池 课件(共24张PPT)鲁科版 化学 选择性必修1
文档属性
| 名称 | 1.2 化学能转化为电能——电池 课件(共24张PPT)鲁科版 化学 选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-10 10:58:51 | ||
图片预览







文档简介
(共24张PPT)
第1章 化学反应与能量转化
第2节 化学能转化为电能——电池
第1课时 原电池的工作原理
教材分析
人教版
苏教版
鲁科版
教学目标
1、通过对铜锌原电池的分析,理解铜锌原电池的工作原理,形成原电池认识模型,并能利用模型解释陌生原电池的工作原理,设计简单的原电池,将化学能转化为电能。
2、了解3种重要的化学电源,能列举常见的化学电源,并能利用相关信息分析化学电源的工作原理。
3、通过本节内容的学习,进一步从能量的角度理解化学科学对人类生产、生活的重要贡献。
教法教学
教法:问题驱动法、讲授法、科学探究法
学法:实验探究、组内交流讨论、合作学习、归纳总结
重点难点
原电池工作原理的分析
体系结构
知识回顾
化学
电
1.原电池的概念:将 能转化为 能的装置。
2.电池构成四要素:
(1)电极反应物
(2)电极材料
(3)离子导体
(4)电子导体
联想质疑
汽车等机动车往往需要配备电池,人造卫星、宇宙飞船等必须携带电池,人们在日常生活中也经常要使用电池……这些足以说明电池的重要作用。
现在,为满足人们生产和生活水平不断提高的需要,性能优异的新型电池相继出现,如锌银电池、锂电池、燃料电池等。那么,电池究竟是一种什么样的装置?他们在工作时,装置中发生了什么变化?
活动探究
一.原电池的工作原理
探秘铜锌原电池
预测
你认为图1—2—2所示装置是否能够构成原电池,将化学能转化为电能?请说明理由。
盐桥
盐桥中通常装有琼脂凝胶,内含氯化钾或硝酸铵。盐桥中的离子能够定向移动。通过盐桥可将两个相互隔离的电解质溶液连接起来,传导电流。
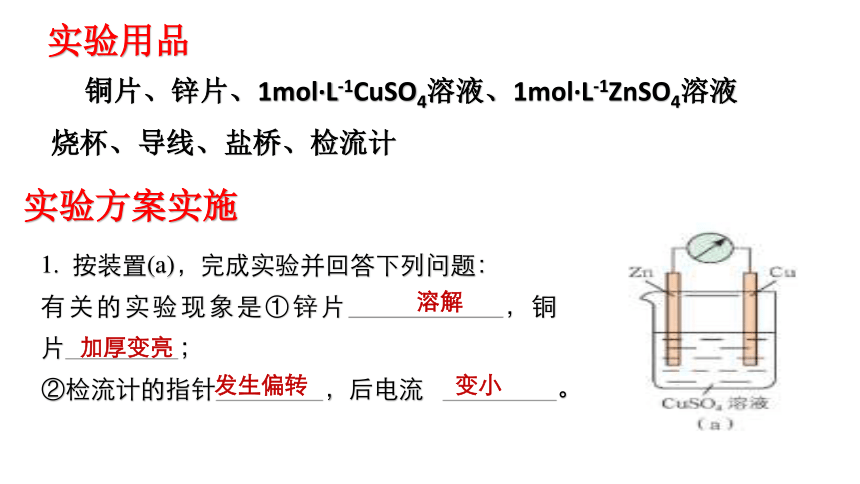
实验用品
铜片、锌片、1mol·L-1CuSO4溶液、1mol·L-1ZnSO4溶液
烧杯、导线、盐桥、检流计
实验方案实施
1. 按装置(a),完成实验并回答下列问题:
有关的实验现象是①锌片 ,铜片 ;
②检流计的指针 ,后电流 。
溶解
加厚变亮
发生偏转
变小
实验方案实施
2.按装置(b),完成实验,并回答下列问题:
(1)实验过程中,能观察到的
实验现象是①锌片 ,
铜片 ;
②检流计指针 , 电流
。
溶解
加厚变亮
发生偏转
持续而稳定
实验装置编号 实验现象
a
b
实验现象
实验结论
两套装置,检流计指针均发生偏转,说明均有电流产生,即发生了化学能转化为电能的过程,都形成了原电池。
锌片溶解,质量减轻;铜片加厚变亮,检流计指针发生偏转,后电流变小。
未插盐桥,无明显现象;插入盐桥,锌片溶解,铜片加厚变亮,检流计指针发生偏转,电流持续稳定。
讨论
1.分析(a)(b)两个原电池各部分的作用,确定其电极反应物、电极材料和离子导体。
2.分析(a)(b)两个原电池的工作原理,写出电极反应式。
3.分析(a)(b)两个原电池,说明各自的优缺点。
电极反应物
电极材料
离子导体
负极:Zn、正极:Cu
CuSO4溶液ZnSO4溶液、盐桥
负极:Zn、正极:CuSO4
负极:Zn、正极:CuSO4
负极:Zn、正极:Cu
CuSO4溶液
(a)(b)两个原电池各部分的作用
讨论
1.分析(a)(b)两个原电池各部分的作用,确定其电极反应物、电极材料和离子导体。
2.分析(a)(b)两个原电池的工作原理,写出电极反应式。
3.分析(a)(b)两个原电池,说明各自的优缺点。
负极:Zn-2e-=Zn2+
正极:Cu2++2e-=Cu
总反应:Zn+Cu2+=Zn2++Cu
两个原电池的工作原理及电极反应式。
讨论
1.分析(a)(b)两个原电池各部分的作用,确定其电极反应物、电极材料和离子导体。
2.分析(a)(b)两个原电池的工作原理,写出电极反应式。
3.分析(a)(b)两个原电池,说明各自的优缺点。
思考交流
若用温度计测量溶液的温度,发现(a)装置溶液的温度略有升高,而(b)装置溶液的温度不变,试分析原因是什么?
(a)装置中,锌片和硫酸铜溶液直接接触,还有Cu2+直接在锌电极上得电子被还原,部分化学能转化成热能。(b)装置中锌片和CuSO4溶液没有直接接触,CuSO4溶液中的Cu2+不能移向锌片得电子被还原。
对 比
相同点:氧化还原反应原理;两个电极及电极反应;都能产生电流;
外电路均是电子的定向移动, 内电路均是离子的定向移动。
不同点:单液电池Zn和Cu2+直接接触,两个半反应在同一区域进行,
能量转化率低,电流强度弱不稳定,持续时间短。
双液电池Zn和Cu2+不直接接触,两个半反应在不同区域进行,
能量转化率高,电流强度大稳定,持续时间长。
两个原电池异同
电子流动电路
离子移动电路
电子流动电路
离子移动电路
单
液
电
池
双
液
电
池
Zn+Cu2+=Zn2++Cu
Zn-2e-=Zn2+
Cu2++2e-=Cu
失电子氧化反应
得电子还原反应
电池反应
氧化还原反应
阴离子移向
阳离子移向
负极
正极
导
线
电极
反应式
电极反应
(半反应)
离
子
导
体
电子流出
电子流入
Zn
Cu
归纳总结
原电池的工作原理分析
原电池原理是将氧化反应和还原反应分开进行,还原剂在 极上失去电子发生 反应,电子通过导线流向 极,氧化剂在正极上 到电子发生 反应。
正极得电子数目=负极失电子数目
原电池原理
负
氧化
正
得
还原
迁移应用
判断右边原电池的正、负极,并写出电极反应式。
负极: Cu - 2e- = Cu2+
正极: 2Fe3+ + 2e- = 2Fe2+
先写出总反应:
拆成离子方程式:
Cu + 2Fe3+ = Cu2+ + 2Fe2+
根据化合价升降判断正负极
1.简单原电池电极方程式的写法
Cu
C
FeCl3溶液
Cu+2FeCl3 = CuCl2 +2FeCl2
迁移应用
盐桥
Cu
C
CuCl2溶液
FeCl3溶液
G
将反应Cu+2FeCl3=2FeCl2+CuCl2 设计成双液盐桥电池
2.简单盐桥原电池设计
根据氧化还原反应电子转移判断电极反应
根据电极反应确定合适的电极材料和电解质溶液
负极: Cu - 2e- = Cu2+
正极: 2Fe3+ + 2e- = 2Fe2+
能力提升
有一纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O+H2O===2Ag+Zn(OH)2。
(1)Zn发生____反应,是___极,电极反应式是________________________。
(2)Ag2O发生_ __反应,是___极,
电极反应式是____________________ 。
Zn+2OH-2e-===Zn(OH)2
Ag2O+2e-+H2O===2Ag+2OH-
氧化
负
还原
正
已知总反应式,书写电极反应式
(1)分析化合价,确定正极、负极的反应物与反应产物。
(2)在电极反应式的左边写出得失电子数,使得失电子守恒。
(3)根据质量守恒配平电极反应式。
(4)复杂电极反应式=总反应式-简单的电极反应式。
课堂小结
原电池
正极
负极
离子导体
电子沿导线传递产生电流
阴
离
子
移
向
阳
离
子
移
向
为活泼金属且不断溶解
为不活泼金属或导电非金属
发生氧化反应
发生还原反应
第1章 化学反应与能量转化
第2节 化学能转化为电能——电池
第1课时 原电池的工作原理
教材分析
人教版
苏教版
鲁科版
教学目标
1、通过对铜锌原电池的分析,理解铜锌原电池的工作原理,形成原电池认识模型,并能利用模型解释陌生原电池的工作原理,设计简单的原电池,将化学能转化为电能。
2、了解3种重要的化学电源,能列举常见的化学电源,并能利用相关信息分析化学电源的工作原理。
3、通过本节内容的学习,进一步从能量的角度理解化学科学对人类生产、生活的重要贡献。
教法教学
教法:问题驱动法、讲授法、科学探究法
学法:实验探究、组内交流讨论、合作学习、归纳总结
重点难点
原电池工作原理的分析
体系结构
知识回顾
化学
电
1.原电池的概念:将 能转化为 能的装置。
2.电池构成四要素:
(1)电极反应物
(2)电极材料
(3)离子导体
(4)电子导体
联想质疑
汽车等机动车往往需要配备电池,人造卫星、宇宙飞船等必须携带电池,人们在日常生活中也经常要使用电池……这些足以说明电池的重要作用。
现在,为满足人们生产和生活水平不断提高的需要,性能优异的新型电池相继出现,如锌银电池、锂电池、燃料电池等。那么,电池究竟是一种什么样的装置?他们在工作时,装置中发生了什么变化?
活动探究
一.原电池的工作原理
探秘铜锌原电池
预测
你认为图1—2—2所示装置是否能够构成原电池,将化学能转化为电能?请说明理由。
盐桥
盐桥中通常装有琼脂凝胶,内含氯化钾或硝酸铵。盐桥中的离子能够定向移动。通过盐桥可将两个相互隔离的电解质溶液连接起来,传导电流。
实验用品
铜片、锌片、1mol·L-1CuSO4溶液、1mol·L-1ZnSO4溶液
烧杯、导线、盐桥、检流计
实验方案实施
1. 按装置(a),完成实验并回答下列问题:
有关的实验现象是①锌片 ,铜片 ;
②检流计的指针 ,后电流 。
溶解
加厚变亮
发生偏转
变小
实验方案实施
2.按装置(b),完成实验,并回答下列问题:
(1)实验过程中,能观察到的
实验现象是①锌片 ,
铜片 ;
②检流计指针 , 电流
。
溶解
加厚变亮
发生偏转
持续而稳定
实验装置编号 实验现象
a
b
实验现象
实验结论
两套装置,检流计指针均发生偏转,说明均有电流产生,即发生了化学能转化为电能的过程,都形成了原电池。
锌片溶解,质量减轻;铜片加厚变亮,检流计指针发生偏转,后电流变小。
未插盐桥,无明显现象;插入盐桥,锌片溶解,铜片加厚变亮,检流计指针发生偏转,电流持续稳定。
讨论
1.分析(a)(b)两个原电池各部分的作用,确定其电极反应物、电极材料和离子导体。
2.分析(a)(b)两个原电池的工作原理,写出电极反应式。
3.分析(a)(b)两个原电池,说明各自的优缺点。
电极反应物
电极材料
离子导体
负极:Zn、正极:Cu
CuSO4溶液ZnSO4溶液、盐桥
负极:Zn、正极:CuSO4
负极:Zn、正极:CuSO4
负极:Zn、正极:Cu
CuSO4溶液
(a)(b)两个原电池各部分的作用
讨论
1.分析(a)(b)两个原电池各部分的作用,确定其电极反应物、电极材料和离子导体。
2.分析(a)(b)两个原电池的工作原理,写出电极反应式。
3.分析(a)(b)两个原电池,说明各自的优缺点。
负极:Zn-2e-=Zn2+
正极:Cu2++2e-=Cu
总反应:Zn+Cu2+=Zn2++Cu
两个原电池的工作原理及电极反应式。
讨论
1.分析(a)(b)两个原电池各部分的作用,确定其电极反应物、电极材料和离子导体。
2.分析(a)(b)两个原电池的工作原理,写出电极反应式。
3.分析(a)(b)两个原电池,说明各自的优缺点。
思考交流
若用温度计测量溶液的温度,发现(a)装置溶液的温度略有升高,而(b)装置溶液的温度不变,试分析原因是什么?
(a)装置中,锌片和硫酸铜溶液直接接触,还有Cu2+直接在锌电极上得电子被还原,部分化学能转化成热能。(b)装置中锌片和CuSO4溶液没有直接接触,CuSO4溶液中的Cu2+不能移向锌片得电子被还原。
对 比
相同点:氧化还原反应原理;两个电极及电极反应;都能产生电流;
外电路均是电子的定向移动, 内电路均是离子的定向移动。
不同点:单液电池Zn和Cu2+直接接触,两个半反应在同一区域进行,
能量转化率低,电流强度弱不稳定,持续时间短。
双液电池Zn和Cu2+不直接接触,两个半反应在不同区域进行,
能量转化率高,电流强度大稳定,持续时间长。
两个原电池异同
电子流动电路
离子移动电路
电子流动电路
离子移动电路
单
液
电
池
双
液
电
池
Zn+Cu2+=Zn2++Cu
Zn-2e-=Zn2+
Cu2++2e-=Cu
失电子氧化反应
得电子还原反应
电池反应
氧化还原反应
阴离子移向
阳离子移向
负极
正极
导
线
电极
反应式
电极反应
(半反应)
离
子
导
体
电子流出
电子流入
Zn
Cu
归纳总结
原电池的工作原理分析
原电池原理是将氧化反应和还原反应分开进行,还原剂在 极上失去电子发生 反应,电子通过导线流向 极,氧化剂在正极上 到电子发生 反应。
正极得电子数目=负极失电子数目
原电池原理
负
氧化
正
得
还原
迁移应用
判断右边原电池的正、负极,并写出电极反应式。
负极: Cu - 2e- = Cu2+
正极: 2Fe3+ + 2e- = 2Fe2+
先写出总反应:
拆成离子方程式:
Cu + 2Fe3+ = Cu2+ + 2Fe2+
根据化合价升降判断正负极
1.简单原电池电极方程式的写法
Cu
C
FeCl3溶液
Cu+2FeCl3 = CuCl2 +2FeCl2
迁移应用
盐桥
Cu
C
CuCl2溶液
FeCl3溶液
G
将反应Cu+2FeCl3=2FeCl2+CuCl2 设计成双液盐桥电池
2.简单盐桥原电池设计
根据氧化还原反应电子转移判断电极反应
根据电极反应确定合适的电极材料和电解质溶液
负极: Cu - 2e- = Cu2+
正极: 2Fe3+ + 2e- = 2Fe2+
能力提升
有一纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O+H2O===2Ag+Zn(OH)2。
(1)Zn发生____反应,是___极,电极反应式是________________________。
(2)Ag2O发生_ __反应,是___极,
电极反应式是____________________ 。
Zn+2OH-2e-===Zn(OH)2
Ag2O+2e-+H2O===2Ag+2OH-
氧化
负
还原
正
已知总反应式,书写电极反应式
(1)分析化合价,确定正极、负极的反应物与反应产物。
(2)在电极反应式的左边写出得失电子数,使得失电子守恒。
(3)根据质量守恒配平电极反应式。
(4)复杂电极反应式=总反应式-简单的电极反应式。
课堂小结
原电池
正极
负极
离子导体
电子沿导线传递产生电流
阴
离
子
移
向
阳
离
子
移
向
为活泼金属且不断溶解
为不活泼金属或导电非金属
发生氧化反应
发生还原反应
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
