2023-2024学年九年级化学 科粤版上册 4.3 质量守恒定律教案(表格式)
文档属性
| 名称 | 2023-2024学年九年级化学 科粤版上册 4.3 质量守恒定律教案(表格式) |

|
|
| 格式 | docx | ||
| 文件大小 | 176.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-09 00:00:00 | ||
图片预览

文档简介
学科:_________ 教师:________ 班级:________时间:_________
课题 4.3 质量守恒定律 备课教师
课时教学 目标 核心素养目标:通过实验过程推导质量守恒定律定律,形成守恒观这一科学思维,强化化学变化实质及原子、分子的化学观念。
教学目标:1. 通过对几个化学反应的实验测定和实质分析,认识质量守恒定律,了解常见化学反应中的质量关系。 用化学变化实质及原子、分子的知识解释质量守恒定律。 树立用实验方法定量研究问题的意识,提高分析、解决问题的能力。
课时学习 目标 基础目标:我可以通过对几个化学反应的实验测定和实质分析,认识质量守恒定律,了解常见化学反应中的质量关系。
拓展目标:我会用化学变化实质及原子、分子的知识解释质量守恒定律。
挑战目标:我能树立用实验方法定量研究问题的意识,提高分析问题的能力。
课时 重点 难点 重点:质量守恒定律的理解及运用。 突破方法: ①通过学生自己做实验——石灰石与稀盐酸反应、硫酸铜溶液与氢氧化钠溶液反应,分析现象和反应前后体系质量的变化,对比分析推导出质量守恒定律。 ②通过化学反应的微观示意图,从原子、分子微观角度,解释质量守恒定律。
难点:从化学反应的实质上去认识质量守恒定律。
知 识 点 质量守恒定律 1、概念:在化学反应里,参加反应的各物质的质量总和 反应后生成的各物质的质量总和,这就是质量守恒定律。 适用范围: 3、微观解释:化学反应的实质是参加反应的各物质的原子重新组合而生成其他物质的过程,化学反应前后,原子的 均不变,因此化学反应前后各物质的质量总和相等。 4、关于质量守恒定律的理解 六个“不变”:元 不变;元 不变;反应前后物质的总质量不变(宏观) 原子 不变;原子 不变;原子 不变(微观) 两个“一定改变”:物质的种类一定改变(宏观) 构成物质的微粒一定改变(微观) 两个“可能改变”:元素化合价可能改变(宏观) 分子数目可能改变(微观) 质量守恒定律的应用 a.解释生活中的一些化学现象 b.推断物质的元素组成(依据:化学反应前后元素种类不变) c.推断反应物或生成物的化学式(依据:化学反应前后原子种类、数目不变) d.配平化学方程式及化学方程式的正误判断(依据:化学反应前后原子种类、数目不变) e.解释反应前后物质的质量变化及计算某一物质的质量(依据:化学反应前后,反应物和 生成物的质量总和不变)
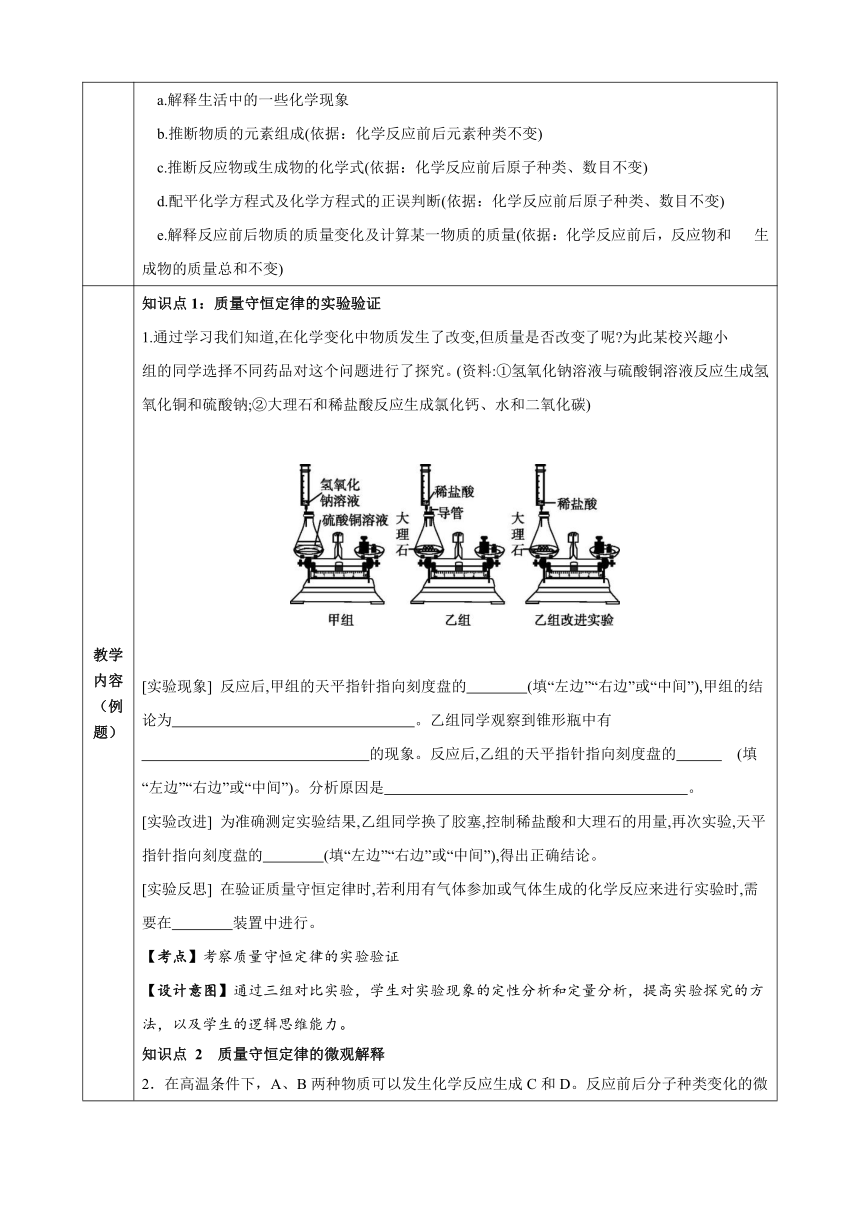
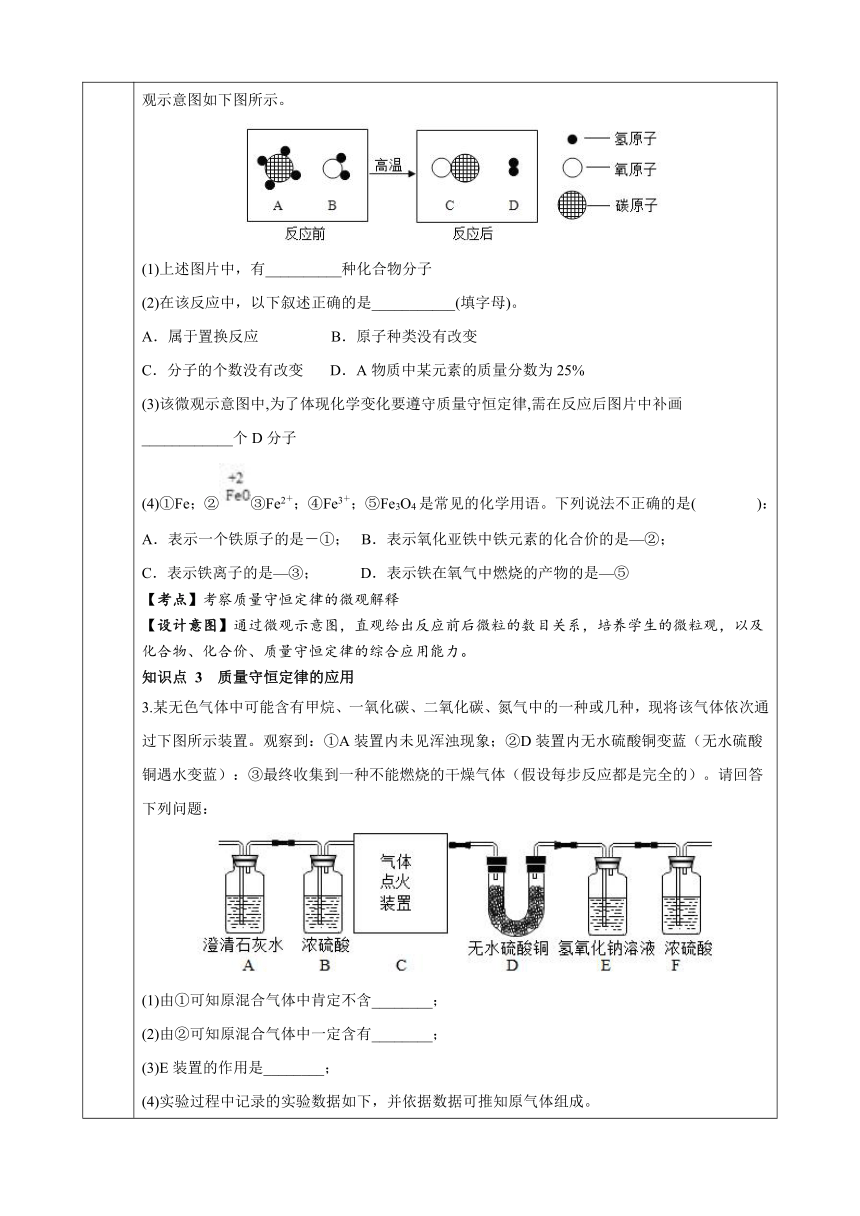
教学 内容 (例题) 知识点1:质量守恒定律的实验验证 1.通过学习我们知道,在化学变化中物质发生了改变,但质量是否改变了呢 为此某校兴趣小 组的同学选择不同药品对这个问题进行了探究。(资料:①氢氧化钠溶液与硫酸铜溶液反应生成氢氧化铜和硫酸钠;②大理石和稀盐酸反应生成氯化钙、水和二氧化碳) [实验现象] 反应后,甲组的天平指针指向刻度盘的 (填“左边”“右边”或“中间”),甲组的结论为 。乙组同学观察到锥形瓶中有 的现象。反应后,乙组的天平指针指向刻度盘的 (填“左边”“右边”或“中间”)。分析原因是 。 [实验改进] 为准确测定实验结果,乙组同学换了胶塞,控制稀盐酸和大理石的用量,再次实验,天平指针指向刻度盘的 (填“左边”“右边”或“中间”),得出正确结论。 [实验反思] 在验证质量守恒定律时,若利用有气体参加或气体生成的化学反应来进行实验时,需要在 装置中进行。 【考点】考察质量守恒定律的实验验证 【设计意图】通过三组对比实验,学生对实验现象的定性分析和定量分析,提高实验探究的方法,以及学生的逻辑思维能力。 知识点 2 质量守恒定律的微观解释 2.在高温条件下,A、B两种物质可以发生化学反应生成C和D。反应前后分子种类变化的微观示意图如下图所示。 (1)上述图片中,有__________种化合物分子 (2)在该反应中,以下叙述正确的是___________(填字母)。 A.属于置换反应 B.原子种类没有改变 C.分子的个数没有改变 D.A物质中某元素的质量分数为25% (3)该微观示意图中,为了体现化学变化要遵守质量守恒定律,需在反应后图片中补画____________个D分子 (4)①Fe;②③Fe2+;④Fe3+;⑤Fe3O4是常见的化学用语。下列说法不正确的是( ): A.表示一个铁原子的是-①; B.表示氧化亚铁中铁元素的化合价的是—②; C.表示铁离子的是—③; D.表示铁在氧气中燃烧的产物的是—⑤ 【考点】考察质量守恒定律的微观解释 【设计意图】通过微观示意图,直观给出反应前后微粒的数目关系,培养学生的微粒观,以及化合物、化合价、质量守恒定律的综合应用能力。 知识点 3 质量守恒定律的应用 3.某无色气体中可能含有甲烷、一氧化碳、二氧化碳、氮气中的一种或几种,现将该气体依次通过下图所示装置。观察到:①A装置内未见浑浊现象;②D装置内无水硫酸铜变蓝(无水硫酸铜遇水变蓝):③最终收集到一种不能燃烧的干燥气体(假设每步反应都是完全的)。请回答下列问题: (1)由①可知原混合气体中肯定不含________; (2)由②可知原混合气体中一定含有________; (3)E装置的作用是________; (4)实验过程中记录的实验数据如下,并依据数据可推知原气体组成。 D装置总质量E、F装置总质量反应前156.6g356.8g反应后158.4g361.2g
则该气体的成分为________。 【考点】考察质量守恒定律的综合应用 【设计意图】以实验探究为载体,通过对现象的定性分析,和对数据的地量分析,体现质量守恒定律的应用,提升学生逻辑推理的能力。
核心 问题 什么是质量守恒定律?
问题串 1.化学反应前后反应物的质量总和与生成物的质量总和相等吗? 2. 什么是质量守恒定律? 3. 在化学反应前后为什么质量守恒?
课堂 导入(设计意图) 情境导入 电解水微观模型探析,根据水通电分解的微观示意图,同学们认为物质质量是否改变与分子还是原子有关?学生答出与原子有关,因为在化学反应前后分子改变,原子不变。为什么质量会相等呢?化学反应前后质量守恒的原因是什么? 设计意图:以学生的旧知为例,引导学生从微观角度思考质量守恒定律的原因,构建用本质解释现象的思维模式。
作业 布置 必做
选做
板 书 设 计(思 维 导 图)
教 学 主 要 过 程
集 体 备 课 二 次 备 课
情境导入 电解水微观模型探析,根据水通电分解的微观示意图,同学们认为物质质量是否改变与分子还是原子有关?学生答出与原子有关,因为在化学反应前后分子改变,原子不变。为什么质量会相等呢?化学反应前后质量守恒的原因是什么? 设计意图:以学生的旧知为例,引导学生从微观角度思考质量守恒定律的原因,构建用本质解释现象的思维模式。 新课讲授 一、实验探究质量守恒定律 [教师活动]我们从微观角度得出了质量守恒定律,此定律是否适用于所有反应?大家分组在6分钟内完成实验验证质量是否守恒。 设计意图:以课本实验为载体,从宏观角度验证物质反应前后质量是否守恒。 [学生活动] 1-2组:锥形瓶中装有0.5g粉末状石灰石(主要成分是碳酸钙),注射器中装有2mL稀盐酸。 第一步:称量反应前物质的总质量,并记录; 第二步:取下锥形瓶,推压注射器活塞,使注射器中的稀盐酸流出,与碳酸钙粉末接触发生反应; 第三步:待反应结束后,将锥形瓶放回天平,观察天平是否平衡,记录实验现象。 3-4组:锥形瓶中装有0.5g粉末状石灰石(主要成分是碳酸钙),注射器中装有2mL稀盐酸。 第一步:称量反应前物质的总质量,并记录; 第二步:取下锥形瓶,推压注射器活塞,使注射器中的稀盐酸流出,与碳酸钙粉末接触发生反应; 第三步:待反应结束后,将锥形瓶放回天平,观察天平是否平衡,记录实验现象。 设计意图:石灰石与稀盐酸的反应是一个能明显观察到有气体生成的反应,同时为第五章实验室制取二氧化碳做铺垫。 5-6组:两支小试管中分别装有5mL硫酸铜溶液和3mL氢氧化钠溶液。 第一步:称量反应前物质的总质量,并记录; 第二步:取下烧杯,将烧杯倾斜,使小试管中的氢氧化钠溶液、硫酸铜溶液流出,接触发生反应; 第三步:待反应结束后,将烧杯放回天平,观察天平是否平衡,记录实验现象。 实验结束后,小组代表回答反应现象、反应后天平是否平衡、反应前后质量是否守恒。 设计意图:硫酸铜与氢氧化钠反应是学生第一次描述生成蓝色沉淀这个现象,也是中考化学实验操作中的必考实验,使学生提前感受生成沉淀的反应,初步锻炼实验操作能力;该反应的颜色好看,深受学生喜爱,能进一步激发学生学习化学的兴趣。 二、质量守恒定律的应用 [教师活动]质量守恒定律能帮助我们解决很多问题。 应用1:进行有关的计算 例1.反应A+B=C+D中,已知2 g A和5 g B参加了反应,生成了4 g C,则有____g D生成。 解题依据:反应前后物质总质量不变。 应用2:推测一些物质的组成 例2.植物进行光合作用可简单表示为 水 + 二氧化碳→淀粉 + 氧气, 由此判断:淀粉中一定含有__________元素,可能含有_________元素。 解题依据:反应前后元素种类不变。 应用3:解释一些实验事实 例3.有人说他能点石(主要成分CaCO3)成金(Au),他的说法是否有科学道理? 解题依据:反应前后元素种类不变。 【巩固提升】讲一个知识点,练习《典中点》上的一道典型题目,讲练结合。 【课堂小结】 1.质量守恒定律的内容:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。 2.质量守恒定律的原因:原子的种类、个数、质量均不变。 3.质量守恒定律的应用:进行有关的计算、推测一些物质的组成、解释一些实验事实。
教 学 反 思
课题 4.3 质量守恒定律 备课教师
课时教学 目标 核心素养目标:通过实验过程推导质量守恒定律定律,形成守恒观这一科学思维,强化化学变化实质及原子、分子的化学观念。
教学目标:1. 通过对几个化学反应的实验测定和实质分析,认识质量守恒定律,了解常见化学反应中的质量关系。 用化学变化实质及原子、分子的知识解释质量守恒定律。 树立用实验方法定量研究问题的意识,提高分析、解决问题的能力。
课时学习 目标 基础目标:我可以通过对几个化学反应的实验测定和实质分析,认识质量守恒定律,了解常见化学反应中的质量关系。
拓展目标:我会用化学变化实质及原子、分子的知识解释质量守恒定律。
挑战目标:我能树立用实验方法定量研究问题的意识,提高分析问题的能力。
课时 重点 难点 重点:质量守恒定律的理解及运用。 突破方法: ①通过学生自己做实验——石灰石与稀盐酸反应、硫酸铜溶液与氢氧化钠溶液反应,分析现象和反应前后体系质量的变化,对比分析推导出质量守恒定律。 ②通过化学反应的微观示意图,从原子、分子微观角度,解释质量守恒定律。
难点:从化学反应的实质上去认识质量守恒定律。
知 识 点 质量守恒定律 1、概念:在化学反应里,参加反应的各物质的质量总和 反应后生成的各物质的质量总和,这就是质量守恒定律。 适用范围: 3、微观解释:化学反应的实质是参加反应的各物质的原子重新组合而生成其他物质的过程,化学反应前后,原子的 均不变,因此化学反应前后各物质的质量总和相等。 4、关于质量守恒定律的理解 六个“不变”:元 不变;元 不变;反应前后物质的总质量不变(宏观) 原子 不变;原子 不变;原子 不变(微观) 两个“一定改变”:物质的种类一定改变(宏观) 构成物质的微粒一定改变(微观) 两个“可能改变”:元素化合价可能改变(宏观) 分子数目可能改变(微观) 质量守恒定律的应用 a.解释生活中的一些化学现象 b.推断物质的元素组成(依据:化学反应前后元素种类不变) c.推断反应物或生成物的化学式(依据:化学反应前后原子种类、数目不变) d.配平化学方程式及化学方程式的正误判断(依据:化学反应前后原子种类、数目不变) e.解释反应前后物质的质量变化及计算某一物质的质量(依据:化学反应前后,反应物和 生成物的质量总和不变)
教学 内容 (例题) 知识点1:质量守恒定律的实验验证 1.通过学习我们知道,在化学变化中物质发生了改变,但质量是否改变了呢 为此某校兴趣小 组的同学选择不同药品对这个问题进行了探究。(资料:①氢氧化钠溶液与硫酸铜溶液反应生成氢氧化铜和硫酸钠;②大理石和稀盐酸反应生成氯化钙、水和二氧化碳) [实验现象] 反应后,甲组的天平指针指向刻度盘的 (填“左边”“右边”或“中间”),甲组的结论为 。乙组同学观察到锥形瓶中有 的现象。反应后,乙组的天平指针指向刻度盘的 (填“左边”“右边”或“中间”)。分析原因是 。 [实验改进] 为准确测定实验结果,乙组同学换了胶塞,控制稀盐酸和大理石的用量,再次实验,天平指针指向刻度盘的 (填“左边”“右边”或“中间”),得出正确结论。 [实验反思] 在验证质量守恒定律时,若利用有气体参加或气体生成的化学反应来进行实验时,需要在 装置中进行。 【考点】考察质量守恒定律的实验验证 【设计意图】通过三组对比实验,学生对实验现象的定性分析和定量分析,提高实验探究的方法,以及学生的逻辑思维能力。 知识点 2 质量守恒定律的微观解释 2.在高温条件下,A、B两种物质可以发生化学反应生成C和D。反应前后分子种类变化的微观示意图如下图所示。 (1)上述图片中,有__________种化合物分子 (2)在该反应中,以下叙述正确的是___________(填字母)。 A.属于置换反应 B.原子种类没有改变 C.分子的个数没有改变 D.A物质中某元素的质量分数为25% (3)该微观示意图中,为了体现化学变化要遵守质量守恒定律,需在反应后图片中补画____________个D分子 (4)①Fe;②③Fe2+;④Fe3+;⑤Fe3O4是常见的化学用语。下列说法不正确的是( ): A.表示一个铁原子的是-①; B.表示氧化亚铁中铁元素的化合价的是—②; C.表示铁离子的是—③; D.表示铁在氧气中燃烧的产物的是—⑤ 【考点】考察质量守恒定律的微观解释 【设计意图】通过微观示意图,直观给出反应前后微粒的数目关系,培养学生的微粒观,以及化合物、化合价、质量守恒定律的综合应用能力。 知识点 3 质量守恒定律的应用 3.某无色气体中可能含有甲烷、一氧化碳、二氧化碳、氮气中的一种或几种,现将该气体依次通过下图所示装置。观察到:①A装置内未见浑浊现象;②D装置内无水硫酸铜变蓝(无水硫酸铜遇水变蓝):③最终收集到一种不能燃烧的干燥气体(假设每步反应都是完全的)。请回答下列问题: (1)由①可知原混合气体中肯定不含________; (2)由②可知原混合气体中一定含有________; (3)E装置的作用是________; (4)实验过程中记录的实验数据如下,并依据数据可推知原气体组成。 D装置总质量E、F装置总质量反应前156.6g356.8g反应后158.4g361.2g
则该气体的成分为________。 【考点】考察质量守恒定律的综合应用 【设计意图】以实验探究为载体,通过对现象的定性分析,和对数据的地量分析,体现质量守恒定律的应用,提升学生逻辑推理的能力。
核心 问题 什么是质量守恒定律?
问题串 1.化学反应前后反应物的质量总和与生成物的质量总和相等吗? 2. 什么是质量守恒定律? 3. 在化学反应前后为什么质量守恒?
课堂 导入(设计意图) 情境导入 电解水微观模型探析,根据水通电分解的微观示意图,同学们认为物质质量是否改变与分子还是原子有关?学生答出与原子有关,因为在化学反应前后分子改变,原子不变。为什么质量会相等呢?化学反应前后质量守恒的原因是什么? 设计意图:以学生的旧知为例,引导学生从微观角度思考质量守恒定律的原因,构建用本质解释现象的思维模式。
作业 布置 必做
选做
板 书 设 计(思 维 导 图)
教 学 主 要 过 程
集 体 备 课 二 次 备 课
情境导入 电解水微观模型探析,根据水通电分解的微观示意图,同学们认为物质质量是否改变与分子还是原子有关?学生答出与原子有关,因为在化学反应前后分子改变,原子不变。为什么质量会相等呢?化学反应前后质量守恒的原因是什么? 设计意图:以学生的旧知为例,引导学生从微观角度思考质量守恒定律的原因,构建用本质解释现象的思维模式。 新课讲授 一、实验探究质量守恒定律 [教师活动]我们从微观角度得出了质量守恒定律,此定律是否适用于所有反应?大家分组在6分钟内完成实验验证质量是否守恒。 设计意图:以课本实验为载体,从宏观角度验证物质反应前后质量是否守恒。 [学生活动] 1-2组:锥形瓶中装有0.5g粉末状石灰石(主要成分是碳酸钙),注射器中装有2mL稀盐酸。 第一步:称量反应前物质的总质量,并记录; 第二步:取下锥形瓶,推压注射器活塞,使注射器中的稀盐酸流出,与碳酸钙粉末接触发生反应; 第三步:待反应结束后,将锥形瓶放回天平,观察天平是否平衡,记录实验现象。 3-4组:锥形瓶中装有0.5g粉末状石灰石(主要成分是碳酸钙),注射器中装有2mL稀盐酸。 第一步:称量反应前物质的总质量,并记录; 第二步:取下锥形瓶,推压注射器活塞,使注射器中的稀盐酸流出,与碳酸钙粉末接触发生反应; 第三步:待反应结束后,将锥形瓶放回天平,观察天平是否平衡,记录实验现象。 设计意图:石灰石与稀盐酸的反应是一个能明显观察到有气体生成的反应,同时为第五章实验室制取二氧化碳做铺垫。 5-6组:两支小试管中分别装有5mL硫酸铜溶液和3mL氢氧化钠溶液。 第一步:称量反应前物质的总质量,并记录; 第二步:取下烧杯,将烧杯倾斜,使小试管中的氢氧化钠溶液、硫酸铜溶液流出,接触发生反应; 第三步:待反应结束后,将烧杯放回天平,观察天平是否平衡,记录实验现象。 实验结束后,小组代表回答反应现象、反应后天平是否平衡、反应前后质量是否守恒。 设计意图:硫酸铜与氢氧化钠反应是学生第一次描述生成蓝色沉淀这个现象,也是中考化学实验操作中的必考实验,使学生提前感受生成沉淀的反应,初步锻炼实验操作能力;该反应的颜色好看,深受学生喜爱,能进一步激发学生学习化学的兴趣。 二、质量守恒定律的应用 [教师活动]质量守恒定律能帮助我们解决很多问题。 应用1:进行有关的计算 例1.反应A+B=C+D中,已知2 g A和5 g B参加了反应,生成了4 g C,则有____g D生成。 解题依据:反应前后物质总质量不变。 应用2:推测一些物质的组成 例2.植物进行光合作用可简单表示为 水 + 二氧化碳→淀粉 + 氧气, 由此判断:淀粉中一定含有__________元素,可能含有_________元素。 解题依据:反应前后元素种类不变。 应用3:解释一些实验事实 例3.有人说他能点石(主要成分CaCO3)成金(Au),他的说法是否有科学道理? 解题依据:反应前后元素种类不变。 【巩固提升】讲一个知识点,练习《典中点》上的一道典型题目,讲练结合。 【课堂小结】 1.质量守恒定律的内容:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。 2.质量守恒定律的原因:原子的种类、个数、质量均不变。 3.质量守恒定律的应用:进行有关的计算、推测一些物质的组成、解释一些实验事实。
教 学 反 思
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
