新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期中考试化学试题(含解析)
文档属性
| 名称 | 新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期中考试化学试题(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 430.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-09 00:00:00 | ||
图片预览




文档简介
第二师八一中学2022-2023学年度第二学期高二化学期中考试卷
可能用到的相对原子量:H-1 C--12 O-16 Na-23 Si--28
一、单选题(共50分)
1.下列关于能层与能级的说法中正确的是
A.气体单质分子中,一定没有π键
B.任一能层的能级总是从s能级开始,而且能级数等于该能层序数
C.同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
D.1个原子轨道里最多只能容纳2个电子,但自旋方向相同
2.下列属于氟原子激发态的电子排布式且能量较高的是
A. B. C. D.
3.下列说法正确的是
A.基态原子的2s电子的能量较高,其一定在比1s电子离核更远的区域运动
B.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的d区
C.处于最低能量的原子叫做基态原子,→过程中形成的是吸收光谱
D.最外层电子数为ns2的元素都在元素周期表第2列或第12列
4.已知元素原子的价电子排布式为,元素位于周期表中第三周期,其原子最外层轨道为半充满状态,下列叙述错误的是( )
A.为金属元素,为非金属元素
B.与为同周期元素
C.的电负性大于
D.的第一电离能大于
5.现有四种元素基态原子的电子排布式如下。则下列有关比较中正确的是
A.第一电离能: B.原子半径:
C.电负性: D.最高正化合价:
6.基态原子的核外电子排布式为[Kr]4d105s1 的元素所属的区、周期和族为
A.p 区、第五周期、第ⅠB 族 B.ds 区、第五周期、第Ⅷ族
C.d 区、第四周期、第ⅠB 族 D.ds 区、第五周期、第ⅠB 族
7.下列说法中正确的是
A.元素周期表每一周期元素原子的最外层电子排布均是从ns1过渡到ns2np6
B.元素周期表中可以把元素分成s、p、d、f四个区
C.最外层电子数为8的都是稀有气体元素的原子
D.元素周期表中IIIB到IIB的10个纵行的元素都是金属,所以称为过渡金属元素
8.关于原子轨道的说法正确的是
A.凡是中心原子采取杂化轨道成键的分子,其空间结构都是正四面体形
B.分子中的杂化轨道是由4个原子的轨道和原子的轨道重新组合形成的
C.sp3杂化轨道是由同一个原子中能量相近的1个轨道和3个轨道重新组合形成的一组新轨道
D.凡型的共价化合物其中心原子均采用杂化轨道成键
9.下列化合物中含有手性碳原子的是
A.CCl2F2 B.CH3—CHCl—COOH C.CH3CH2OH D.CH3—OH
10.在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中的共价键类型是
A.仅有σ键 B.三个σ键,两个π键
C.两个σ键,两个π键 D.三个σ键,一个π键
11.下列微粒的VSEPR模型与空间立体构型一致的是
A.BF3 B.SO2 C.H2O D.SO
12.下列分子中键角最大的是( )
A. B. C. D.
13.关于氢键及范德华力,下列说法正确的是:
A.氢键比范德华力强,所以它属于化学键
B.分子间形成的氢键使物质的熔点和沸点升高
C.沸点HI>HBr>HCl>HF
D.H2O是一种稳定的化合物,这是由于H2O之间形成氢键所致
14.下列各组物质中,都是由极性键构成的极性分子的是
A.和 B.和 C.和 D.和
15.在中,中间的碳原子和两边的碳原子分别采用的杂化方式是
A.、 B.、 C.、 D.、
16.晶体是一类非常重要的材料,在很多领域都有广泛的应用。我国现已能够拉制出直径为300 mm、重量达81 kg的大直径硅单晶,晶体硅大量用于电子产业。下列叙述正确的是( )
A.形成晶体硅的速率越快越好
B.晶体硅没有固定的熔沸点
C.可用X射线衍射实验来鉴别晶体硅和玻璃
D.晶体硅的形成与晶体的自范性有关,而与各向异性无关
17.下列说法中,正确的是
A.冰融化时,分子中H—O发生断裂
B.共价晶体中,共价键越强,熔点越高
C.分子晶体中,共价键键能越大,该分子晶体的熔沸点一定越高
D.分子晶体中,分子间作用力越大,对应的物质越稳定
18.已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表数据判断下列说法中错误的是
元素 I1 I2 I3 I4
X 500 4600 6900 9500
Y 580 1800 2700 11600
A.元素X的常见化合价是+1价 B.元素X与氯形成化合物时,化学式可能是XCl
C.元素Y是第IIIA族元素 D.若元素Y处于第三周期,它可与冷水剧烈反应
19.关于分子的性质,下列说法不正确的是
A.H-Cl的键能比H-I的键能大,故HCl分子比HI分子稳定
B.三氯乙酸酸性大于一氯乙酸,是因为Cl3C-的极性大于ClH2C-
C.乙醇在水中的溶解度小于丁醇(CH3CH2CH2CH2OH),可以用相似相溶解释
D.分子晶体的熔点通常比共价晶体的熔点低得多
20.下列关于分子晶体的说法正确的是
A.分子晶体中的共价键有方向性,而分子间作用力无方向性
B.在分子晶体中一定存在氢键
C.冰和Br2都是分子晶体
D.稀有气体不能形成分子晶体
21.根据下列性质判断,下列中可能属于共价晶体的物质是
A.熔点700℃,质软,导电性好,延展性强
B.无色晶体,熔点3500℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点800℃,熔化时能导电
D.熔点℃,微溶于水,硬度小,固态或液态时不导电
22.下列关于共价晶体和分子晶体的说法中不正确的是
A.金刚石、水晶和干冰都属于共价晶体
B.共价晶体中存在共价键,分子晶体中可能存在共价键
C.共价晶体的硬度通常比分子晶体的大
D.有的分子晶体的水溶液能导电
23.根据下列几种物质的熔点和沸点数据判断,下列有关说法错误的是
物质 单质B
熔点/℃ 190 2300
沸点/℃ 182.7 57.6 2500
注:熔点在条件下测定。
A.是分子晶体 B.单质B是共价晶体
C.加热能升华 D.单质B和晶体类型相同
24.某晶体的粒子结构如下图所示:正六面体的8个顶点上为A粒子,12个棱的中点上为B粒子,6个面的中心上为C粒子,六面体的中心上为D粒子。那么该晶体中A、B、C、D 4种粒子的个数比为( )
A.1∶3∶3∶1 B.3∶1∶3∶1 C.1∶1∶3∶3 D.1∶3∶1∶3
25.金属钠晶体为体心立方晶胞(如图),实验测得钠的密度为。已知钠的相对原子质量为a,阿伏伽德罗常数为,假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切。则钠原子的半径为( )
A. B. C. D.
二、填空题(共50分)
26.(13分)20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力主要顺序为:i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;iv、其他。请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表:
n+m 2 ________
VSEPR理想模型 ________ 正四面体
价层电子对之间的理想键角 ________ 109°28′
(2)请用VSEPR模型解释CO2为直线型分子的原因 ;
(3)H2O分子的立体构型为:___________________,请你预测水分子中∠H-O-H的大小范围并解释原因 _ ;
(4)SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测 SO2Cl2和SO2F2分子的立体构型:_____________________________, SO2Cl2分子中∠Cl-S-Cl________________(选填“<”、“>”或“=”)SO2F2分子中∠F-S-F。
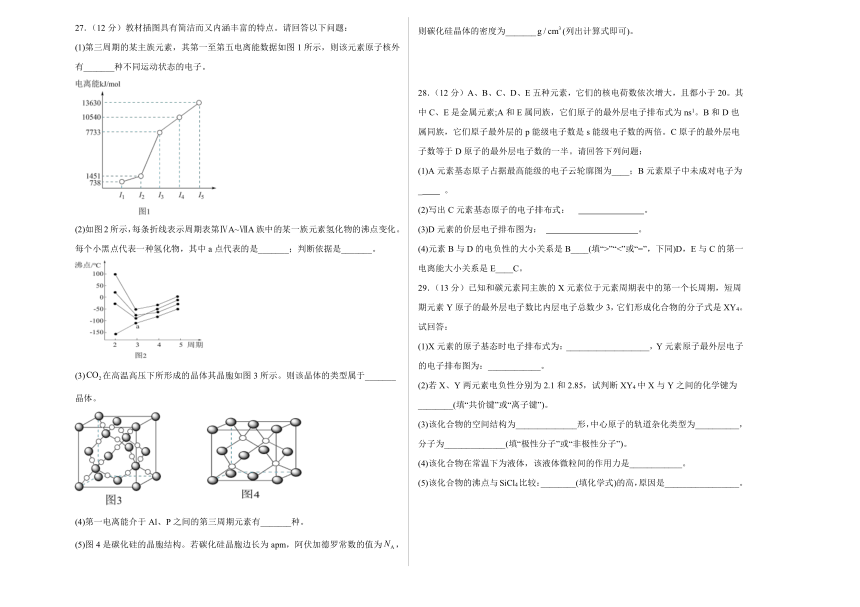
27.(12分)教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素原子核外有_______种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是_______;判断依据是_______。
(3)在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_______晶体。
(4)第一电离能介于Al、P之间的第三周期元素有_______种。
(5)图4是碳化硅的晶胞结构。若碳化硅晶胞边长为apm,阿伏加德罗常数的值为,则碳化硅晶体的密度为_______(列出计算式即可)。
28.(12分)A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1)A元素基态原子占据最高能级的电子云轮廓图为____;B元素原子中未成对电子为_ 。
(2)写出C元素基态原子的电子排布式: 。
(3)D元素的价层电子排布图为: 。
(4)元素B与D的电负性的大小关系是B____(填“>”“<”或“=”,下同)D,E与C的第一电离能大小关系是E____C。
29.(13分)已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为:___________________,Y元素原子最外层电子的电子排布图为:____________。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为________(填“共价键”或“离子键”)。
(3)该化合物的空间结构为______________形,中心原子的轨道杂化类型为__________,分子为______________(填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____________。
(5)该化合物的沸点与SiCl4比较:________(填化学式)的高,原因是_________________。
参考答案:
1.B
【详解】A.气体单质分子中存在π键,故A错误;
B.能层含有的能级数等于能层序数,即第n能层含有n个能级,每一能层总是从s能级开始,同一能层中能级ns、np、nd、nf的能量依次增大,在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态,所以任一能层的能级总是从s能级开始,而且能级数等于该能层序数,故B正确;
C.同是s能级,在不同的能层中所能容纳的最多电子数都是2个,故C错误;
D.泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子,故D错误;
故选B。
2.C
【详解】由题干选项可知,A、C为F原子的激发态,而C为2个2p上的电子激发到3p上,A为1个2p上的电子激发到3s上,故C比A的能量更高,B为Ne原子的激发态,D为B原子的激发态,故答案为:C。
3.B
【详解】A.能级和能层只是表示电子在该处出现的概率大小,并不代表电子运动的位置,故基态原子的2s电子的能量较高,不一定在比1s电子离核更远的区域运动,A错误;
B.某元素+3价离子的电子排布式为1s22s22p63s23p63d5,离子的核外电子数是23,所以原子序数是26,即是铁元素,位于第四周期第Ⅷ族,属于d区,B 正确;
C.1s22s22px1→1s22s22py1,2P轨道上的能量一样,两者之间没有能量变化,也就没有光谱,C错误;
D.最外层电子数为ns2的元素在元素周期表第2列或第12列,还有第18列的He,还有一些过渡元素最外层电子数也为ns2,D错误;
故选B。
4.D
【分析】元素原子的价电子排布式为,则M为Al,元素位于周期表中第三周期,其原子最外层轨道为半充满状态,即3p3,则N为P,据此分析解答。
【详解】A.为Al属于金属元素,为P属于非金属元素,故A正确;
B.M为Al,则N为P ,都在第三周期,故B正确;
C.同周期元素电负性依次增大,的电负性大于,故C正确;
D.M为Al,则N为P,磷元素的p轨道为半充满状态,较稳定,第一电离能P>Al,故D错误;
答案选D。
【点睛】最外层处于全满、半满状态时较稳定,第一电离能偏高。
5.B
【分析】由四种元素基态原子电子排布式可知,①是元素,②是元素,③是元素,④是元素。
【详解】A.同周期自左而右第一电离能增大,由于P为半充满状态,较稳定,所以第一电离能,,同主族自上而下第一电离能降低,所以第一电离能,因此第一电离能:F>N>P>S,即④>③>②>①,故A错误;
B.同一周期从左往右主族元素原子半径依次减小,同一主族从上往下元素原子半径依次增大,故原子半径:P>S>N>F,即②>①>③>④,故B正确;
C.同一周期从左往右元素电负性依次增大,同一主族从上往下元素电负性依次减小,故电负性:F>N>S>P,即④>③>①>②,故C错误;
D.最高正化合价等于最外层电子数,但F元素没有正化合价,所以最高正化合价,即①>②=③,故D错误;
故选B。
6.D
【详解】由该原子电子排布式知,其最高能层为第5层,故位于第五周期,根据其价电子排布特点确定其位于ds区,对应族为IB,故答案选D。
7.D
【详解】A.第一周期元素的最外层电子排布由1s1过渡到1s2,A错误;
B.元素周期表共分成5个区,s区(ⅠA、ⅡA)、p区(ⅢA~ⅦA、0族)、d区(ⅢB~ⅦB、Ⅷ族)、ds区(ⅠB、ⅡB)、f区(镧系、锕系),B错误;
C.最外层电子数为8的粒子可能是稀有气体原子,也可能是离子,比如Na+、F-等,C错误;
D.周期表ⅢB~ⅡB称过渡元素,又这10列均为金属元素,所以又叫过渡金属元素,D正确;
故答案选D。
8.C
【详解】A.中心原子采取杂化的分子, VSEPR模型是正四面体形,但其空间结构不一定是正四面体形,如水和氨分子的中心原子采取杂化,但H2O是V形,是三角锥形,A错误;
B.分子中的杂化轨道是由碳原子的1个轨道和3个轨道重新组合形成的,B错误;
C.杂化轨道是由同一个原子中能量相近的1个轨道和3个轨道重新组合形成的一组新轨道,C正确;
D.型共价化合物,如中心原子没有孤电子对,则为杂化,例如,D错误。
故选:C。
9.B
【分析】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,根据碳原子连接的原子或原子团分析。
【详解】A项、A、CCl2F2分子中碳原子所连接的四个基团中两个是Cl原子,两个是F原子,不是手性碳原子,故A错误;
B项、分子中2号碳原子上连接4个不同的原子或原子团,该碳原子属于手性碳原子,故B正确;
C项、CH3CH2OH分子中两个碳原子所连接的四个基团都有相同的氢原子,不是手性碳原子,故C错误;
D项、CH3—OH分子中碳原子所连接的四个基团有相同的氢原子,不是手性碳原子,故D错误;
故选B。
10.D
【详解】由题所给条件,在N2F2分子中,所有原子均符合8电子稳定结构可知,其结构式应为:F-N=N-F,两个氮之间是氮氮双键,一个为σ键一个为π键,氮氟之间是单键,为σ键,所以该分子中的共价键类型是三个σ键,一个π键。故D正确。
综上所述,本题应选D。
【点睛】原子轨道以“头碰头”方式重叠的称为σ键,原子轨道以“肩并肩”方式重叠称为π键。σ键原子轨道重叠程度比π键原子轨道重叠程度大,所以σ键比π键牢固,在化学反应中π键易断裂。另外σ键只能形成单键,而双键或三键中既有σ键又有π键。
11.A
【分析】如果该微粒中不存在孤电子对,则该微粒的VSEPR模型和其空间立体构型就一致,否则不一致,据此分析解答。
【详解】A.BF3中心B原子的价层电子对数为=3,不含孤对电子对,VSEPR模型和立体构型相同,均为平面三角形,A符合题意;
B.SO2中心S原子的价层电子对数为=3,含一对孤电子对,VSEPR模型为平面三角形,立体构型为V形,B不符合题意;
C.H2O中心O原子的价层电子对数为=4,含两对孤电子对,VSEPR模型为四面体形,立体构型为V形,C不符合题意;
D.SO中心S原子价层电子对数为=4,含有一个孤电子对,VSEPR模型为四面体形,立体构型为三角锥形,D不符合题意;
综上所述答案为A。
12.A
【详解】CO2是直线形结构,键角是180°;是正四面体形结构,键角是109°28′;是三角锥形结构,键角是107°18′;是V型结构,键角是104.5°,则键角最大的是CO2,故选A。
13.B
【详解】A.氢键属于分子间作用力,不属于化学键,故A项错误;
B.物质熔化与沸腾时需要破坏氢键,而破坏氢键需要一定能量,所以分子间形成氢键使物质的熔点和沸点都升高,故B项正确;
C.第VIIA族元素中,只有氟化氢分子间存在氢键,沸点较高,出现反常,因此沸点为HF>HI>HBr>HCl,故C项错误;
D.水之所以化学性质稳定是因为分子内氢氧键比较稳定,与氢键无关,故D项错误。
答案为B。
14.D
【详解】A.CH4和CCl4中的C-H键和C-Cl键均为极性键,CH4和CCl4分子均为正四面体构型,高度对称,分子中正负电荷的中心重合,均为非极性分子,故A不符合题意;
B.NH3含有N-H极性键,分子空间结构为三角锥型,正负电荷中心不重合,为极性分子;CH4含有C-H极性键,为正四面体构型,高度对称,分子中正负电荷的中心重合,为非极性分子,故B不符合题意;
C.CO2含有C=O极性键,空间结构为直线形,正负电荷的中心重合,是非极性分子;CS2含有C=S极性键,空间结构为直线形,正负电荷的中心重合,是非极性分子,故C不符合题意;
D.H2S含有H-S极性键,正负电荷的中心不重合,是极性分子;HCl含有H-Cl极性键,正负电荷的中心不重合,是极性分子,故D符合题意;
答案选D。
15.C
【详解】根据价层电子对互斥理论来分析解答,3个σ键且不含孤电子对采用sp2杂化,含有4个σ键且不含孤电子对采用sp 3杂化。在CH3COCH3(丙酮)分子中,羰基碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,甲基碳原子含有4个σ键且不含孤电子对,所以采用sp3杂化,故C正确。
故选:C。
16.C
【详解】A. 晶体的形成都有一定的形成条件,如温度、压强、结晶速率等,但并不是说结晶速率越快越好,速率太快可能导致晶体质量下降,A错误;
B. 晶体都有固定的熔沸点,则晶体硅一定有固定的熔沸点,B错误;
C. X射线衍射实验能够测出物质的内部结构,根据微粒是否有规则的排列可区分晶体与非晶体,C正确;
D. 晶体的形成与晶体的自范性和各向异性都有密切关系,D错误;
故合理选项是C。
17.B
【详解】A.冰融化时,水分子没有改变,改变的是分子间的距离,所以分子中H-O键没有发生断裂,A错误;
B.共价晶体中,共价键的键能越大,破坏共价键所需的能量越大,该晶体的熔点越高,B正确;
C.分子晶体熔化或沸腾时,只改变分子间的距离,不需要破坏分子内的共价键,所以该晶体的熔沸点高低与键能无关,C错误;
D.分子晶体中,物质的稳定性与分子内原子间的共价键有关,与分子间作用力无关,D错误;
故选:B。
18.D
【详解】A.根据表格可知I1和I2之间差距较大,故X常见化合价为+1价,A正确;
B.X常见化合价为+1价,元素X与氯形成化合物时,化学式可能是XCl,B正确;
C.根据表格,Y的I3和I4差距较大,故Y的常见化合价为+3价,是第IIIA族元素,C正确;
D.若元素Y处于第三周期,则Y为Al,不可与冷水剧烈反应,D错误;
故选D。
19.C
【详解】A.键能的大小决定着物质的化学性质,键能越大,物质越稳定,H—Cl比H—I键能大,HCl比HI稳定,选项A正确;
B.由于Cl3C-比ClH2C-多一个氯原子,使Cl3C-的极性大于ClH2C-的极性,导致三氯乙酸的羧基中的羟基的极性更大,更易电离出氢离子,选项B正确;
C.乙醇在水中的溶解度大于丁醇(CH3CH2CH2CH2OH),是因为CH3CH2CH2CH2OH中烃基较大,其中的-OH占比少,溶解度明显减小,选项C错误;
D.分子晶体熔化时破坏分子间作用力,共价晶体熔化时破坏共价键,分子间作用力比共价键弱的多,所以分子晶体的熔点一般比共价晶体的熔点低,选项D正确;
答案选C。
20.C
【详解】分子晶体中的共价键有方向性,而分子间作用力中的氢键也有方向性,故A错误;在分子晶体中不一定存在氢键,如甲烷分子间及分子内都不存在氢键,故B错误;冰和Br2均由分子构成,均属于分子晶体,故C正确;稀有气体构成微粒是单原子分子,可形成分子晶体,故D错误。
21.B
【详解】A.原子晶体的熔点高,但不能导电,因此熔点700℃,导电性好,延展性强应该是金属晶体,A错误;
B.无色晶体,熔点3500℃,不导电,质硬,难溶于水和有机溶剂,符合原子晶体的性质特点,B正确;
C.无色晶体,能溶于水,质硬而脆,熔点800℃,熔化时能导电,符合离子晶体的性质,属于离子晶体,C错误;
D.熔点-56.6℃,微溶于水,硬度小,固态或液态时不导电,符合分子晶体的性质,属于分子晶体,D错误;
故选B。
22.A
【详解】A.金刚石和水晶是共价晶体,干冰是分子晶体,A错误;
B.共价晶体中存在共价键,故金刚石中存在共价键,分子晶体中可能存在共价键,如水中存在共价键,也可能不存在共价键,如稀有气体中不存在共价键,B正确;
C.共价晶体中共价键的强度强于分子间作用力,故共价晶体的硬度通常比分子晶体的大,C正确;
D.HCl为分子晶体,溶于水后的溶液盐酸可以导电,D正确;
故选A。
23.D
【详解】A.由表中数据可知,四氯化硅是熔、沸点较低的分子晶体,故A正确;
B.由表中数据可知,单质B是熔、沸点很高的共价晶体,故B正确;
C.由表中数据可知,氯化铝的沸点比熔点低,所以氯化铝加热能发生升华,故C正确;
D.由表中数据可知,单质B是熔、沸点很高的共价晶体,氯化铝是熔、沸点较低的分子晶体,两者晶体类型不同,故D错误;
故选D。
24.A
【详解】根据图示可知:在该晶胞中含有A粒子数目为8×=1,含有B粒子为12×=3,含有C粒子数目为6×=3,含有D粒子数目为1,因此该晶体中A、B、C、D 4种粒子的个数比为1∶3∶3∶1,故合理选项是A。
25.C
【详解】因为金属钠晶体为钾型,所以在晶胞中含有钠原子数为1+8×=2,设晶胞边长为x,根据ρ=得,ρ=,所以x=所以晶胞的体对角线长度为×,所以钠原子半径,
故选:C。
4 直线形 180° CO2属AX2E0,n+m=2,故为直线形 折线形(或V形) 水分子属AX2E2,n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′。根据Ⅲ-i,应有∠H-O-H<109°28′ 四面体 >
【分析】(1)当n+m=4时,VSEPR模型为四面体形,当n+m=2时,VSEPR模型为直线形;
(2) 根据 CO2属AX2E0,n+m=2,故为直线形;
(3)根据H2O属AX2E2,n+m=4,VSEPR模型为四面体形,但氧原子有2对孤电子对来判断分子的立体构型;水分子属AX2E2,n+m=4,VSEPR模型为正四面体,价层电子对之间的夹角均为109°28′,根据Ⅲ-i来判断键角;
(4)当n+m=4时,VSEPR模型为四面体形,硫原子无孤电子对来判断分子的立体构型;X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;
【详解】(1)当n+m=4时,VSEPR模型为四面体形,其键角是109°28′,当n+m=2时,VSEPR模型为直线形,其键角是180°;
(2) 根据 CO2属AX2E0,n+m=2,故为直线形;
(3)H2O属AX2E2,n+m=4,VSEPR模型为四面体形,但氧原子有2对孤电子对,所以分子的构型为V形;
水分子属AX2E2,n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′,根据Ⅲ-i,应有∠H-O-H<109°28′,故答案为V形;∠H-O-H<109°28′;
(4)当n+m=4时,VSEPR模型为四面体形,硫原子无孤电子对,所以分子构型为四面体形,F原子的得电子能力大于氯原子,因为X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强,所以SO2Cl2分子中∠Cl-S-Cl>SO2F2分子中∠F-S-F;
【点睛】本题主要考查价层电子对互斥模型判断分子的结构,难度不大,注意概念的把握。
27.(1)12
(2) 第二周期的元素的氢化物没有分子间氢键的是,为第ⅣA族元素,因此a为
(3)共价
(4)三
(5)
【详解】(1)该元素的第二电离能和第三电离能的差距较大,说明能层发生变化,故元素为Mg,最外层有12中运动状态不同的电子,故答案为:12;
(2)如图2所示,每条折线表示周期表第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化中,N、O、F三种氰化物可以形成分子间氢键,会造成熔沸点反常,第二周期的元素的氢化物没有分子间氢键的是CH4,为第ⅣA族元素,因此a为SiH4,故答案为:SiH4;第二周期的元素的氢化物没有分子间氢键的是,为第ⅣA族元素,因此a为;
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示,该晶胞结构与二氧化硅类似,故形成了共价晶体二氧化碳,故答案为:共价;
(4)同周期主族元素第一电离能随原子序数增大呈增大趋势,但IIA族的np为全充满、VA族的np为半充满稳定状态,第一电离能高于同周期相邻元素的,则第一电离能:Al<Mg<Si<S<P,介于Al、P之间的第三周期元素有3种,故答案为:三;
(5)晶胞中,C原子的数目为4,Si原子的数目为8×+6×=4,晶胞质量为m=g,晶胞体积为V=(a×10-10)3cm3,晶胞密度ρ=g/cm3,故答案为:。
28.(1) 球形 2 19
(2)1s22s22p63s23p1
(3)
(4) > <
【分析】A、、C、D、E五种元素,它们的核电荷数依次增大,且都小于;和D也属同一族,它们原子最外层的能级电子数是能级电子数的两倍,故最外层电子排布为,故B为元素,D为元素,和元素原子的最外层电子排布为,处于第Ⅰ族,为金属,的原子序数大于元素,故A为元素,为元素,C原子最外层上电子数等于D原子最外层上电子数的一半,故C原子最外层电子数为,原子序数介于O与之间,故C为元素。
【详解】(1)A为元素,的基态原子中电子占据最高能级为,轨道的电子云轮廓图为球形;为O元素,基态原子核中核外含有8个电子,核外电子排布式为1s22s2sp4,未成对电子为;E为K元素,基态原子核中核外含有19个电子,则有19种运动状态不同的电子;
(2)C为原子,基态原子的电子排布式为;
(3)D为元素,原子价层电子排布为,价电子排布图为
(4)同主族自上而下电负性降低,故电负性,金属性越强,第一电离能越小,故第一电离能。
29. 1s22s22p63s23p63d104s24p2 共价键 正四面体 sp3杂化 非极性分子 范德华力 GeCl4 组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔、沸点越高
【详解】X元素与碳元素同主族且位于周期表中的第一长周期,X为Ge元素,Y原子是短周期元素且最外层电子数比内层电子总数少3,Y为Cl元素,化合物XY4为GeCl4。
(1)Ge元素是32号元素,基态原子核外电子排布式为 [Ar] 3d104s24p2或1s22s22p63s23p63d104s24p2;氯元素原子最外层电子的电子排布图为;
(2)Cl元素与Ge元素的电负性差为2.85-2.1=0.75,小于1.7,所以GeCl4为共价化合物,分子内只含有共价键;
(3)Ge元素与C元素处于相同主族,GeCl4与CCl4具有相似的结构和性质,Ge原子采取sp3杂化,GeCl4为正四面体形,空间对称,是非极性分子;
(4)GeCl4在常温下为液体,熔点低,由分子构成.微粒间作用力为范德华力;
(5)这两种化合物的结构相似,GeCl4相对分子质量大,分子间作用力强,沸点高。
【点睛】本题考查原子、分子以及晶体的结构和性质,注意判断GeCl4的化合物类型时要结合电负性差值进行分析,不能因为Ge为金属就直接判断GeCl4为离子化合物,为易错点。
可能用到的相对原子量:H-1 C--12 O-16 Na-23 Si--28
一、单选题(共50分)
1.下列关于能层与能级的说法中正确的是
A.气体单质分子中,一定没有π键
B.任一能层的能级总是从s能级开始,而且能级数等于该能层序数
C.同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
D.1个原子轨道里最多只能容纳2个电子,但自旋方向相同
2.下列属于氟原子激发态的电子排布式且能量较高的是
A. B. C. D.
3.下列说法正确的是
A.基态原子的2s电子的能量较高,其一定在比1s电子离核更远的区域运动
B.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的d区
C.处于最低能量的原子叫做基态原子,→过程中形成的是吸收光谱
D.最外层电子数为ns2的元素都在元素周期表第2列或第12列
4.已知元素原子的价电子排布式为,元素位于周期表中第三周期,其原子最外层轨道为半充满状态,下列叙述错误的是( )
A.为金属元素,为非金属元素
B.与为同周期元素
C.的电负性大于
D.的第一电离能大于
5.现有四种元素基态原子的电子排布式如下。则下列有关比较中正确的是
A.第一电离能: B.原子半径:
C.电负性: D.最高正化合价:
6.基态原子的核外电子排布式为[Kr]4d105s1 的元素所属的区、周期和族为
A.p 区、第五周期、第ⅠB 族 B.ds 区、第五周期、第Ⅷ族
C.d 区、第四周期、第ⅠB 族 D.ds 区、第五周期、第ⅠB 族
7.下列说法中正确的是
A.元素周期表每一周期元素原子的最外层电子排布均是从ns1过渡到ns2np6
B.元素周期表中可以把元素分成s、p、d、f四个区
C.最外层电子数为8的都是稀有气体元素的原子
D.元素周期表中IIIB到IIB的10个纵行的元素都是金属,所以称为过渡金属元素
8.关于原子轨道的说法正确的是
A.凡是中心原子采取杂化轨道成键的分子,其空间结构都是正四面体形
B.分子中的杂化轨道是由4个原子的轨道和原子的轨道重新组合形成的
C.sp3杂化轨道是由同一个原子中能量相近的1个轨道和3个轨道重新组合形成的一组新轨道
D.凡型的共价化合物其中心原子均采用杂化轨道成键
9.下列化合物中含有手性碳原子的是
A.CCl2F2 B.CH3—CHCl—COOH C.CH3CH2OH D.CH3—OH
10.在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中的共价键类型是
A.仅有σ键 B.三个σ键,两个π键
C.两个σ键,两个π键 D.三个σ键,一个π键
11.下列微粒的VSEPR模型与空间立体构型一致的是
A.BF3 B.SO2 C.H2O D.SO
12.下列分子中键角最大的是( )
A. B. C. D.
13.关于氢键及范德华力,下列说法正确的是:
A.氢键比范德华力强,所以它属于化学键
B.分子间形成的氢键使物质的熔点和沸点升高
C.沸点HI>HBr>HCl>HF
D.H2O是一种稳定的化合物,这是由于H2O之间形成氢键所致
14.下列各组物质中,都是由极性键构成的极性分子的是
A.和 B.和 C.和 D.和
15.在中,中间的碳原子和两边的碳原子分别采用的杂化方式是
A.、 B.、 C.、 D.、
16.晶体是一类非常重要的材料,在很多领域都有广泛的应用。我国现已能够拉制出直径为300 mm、重量达81 kg的大直径硅单晶,晶体硅大量用于电子产业。下列叙述正确的是( )
A.形成晶体硅的速率越快越好
B.晶体硅没有固定的熔沸点
C.可用X射线衍射实验来鉴别晶体硅和玻璃
D.晶体硅的形成与晶体的自范性有关,而与各向异性无关
17.下列说法中,正确的是
A.冰融化时,分子中H—O发生断裂
B.共价晶体中,共价键越强,熔点越高
C.分子晶体中,共价键键能越大,该分子晶体的熔沸点一定越高
D.分子晶体中,分子间作用力越大,对应的物质越稳定
18.已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表数据判断下列说法中错误的是
元素 I1 I2 I3 I4
X 500 4600 6900 9500
Y 580 1800 2700 11600
A.元素X的常见化合价是+1价 B.元素X与氯形成化合物时,化学式可能是XCl
C.元素Y是第IIIA族元素 D.若元素Y处于第三周期,它可与冷水剧烈反应
19.关于分子的性质,下列说法不正确的是
A.H-Cl的键能比H-I的键能大,故HCl分子比HI分子稳定
B.三氯乙酸酸性大于一氯乙酸,是因为Cl3C-的极性大于ClH2C-
C.乙醇在水中的溶解度小于丁醇(CH3CH2CH2CH2OH),可以用相似相溶解释
D.分子晶体的熔点通常比共价晶体的熔点低得多
20.下列关于分子晶体的说法正确的是
A.分子晶体中的共价键有方向性,而分子间作用力无方向性
B.在分子晶体中一定存在氢键
C.冰和Br2都是分子晶体
D.稀有气体不能形成分子晶体
21.根据下列性质判断,下列中可能属于共价晶体的物质是
A.熔点700℃,质软,导电性好,延展性强
B.无色晶体,熔点3500℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点800℃,熔化时能导电
D.熔点℃,微溶于水,硬度小,固态或液态时不导电
22.下列关于共价晶体和分子晶体的说法中不正确的是
A.金刚石、水晶和干冰都属于共价晶体
B.共价晶体中存在共价键,分子晶体中可能存在共价键
C.共价晶体的硬度通常比分子晶体的大
D.有的分子晶体的水溶液能导电
23.根据下列几种物质的熔点和沸点数据判断,下列有关说法错误的是
物质 单质B
熔点/℃ 190 2300
沸点/℃ 182.7 57.6 2500
注:熔点在条件下测定。
A.是分子晶体 B.单质B是共价晶体
C.加热能升华 D.单质B和晶体类型相同
24.某晶体的粒子结构如下图所示:正六面体的8个顶点上为A粒子,12个棱的中点上为B粒子,6个面的中心上为C粒子,六面体的中心上为D粒子。那么该晶体中A、B、C、D 4种粒子的个数比为( )
A.1∶3∶3∶1 B.3∶1∶3∶1 C.1∶1∶3∶3 D.1∶3∶1∶3
25.金属钠晶体为体心立方晶胞(如图),实验测得钠的密度为。已知钠的相对原子质量为a,阿伏伽德罗常数为,假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切。则钠原子的半径为( )
A. B. C. D.
二、填空题(共50分)
26.(13分)20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力主要顺序为:i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;iv、其他。请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表:
n+m 2 ________
VSEPR理想模型 ________ 正四面体
价层电子对之间的理想键角 ________ 109°28′
(2)请用VSEPR模型解释CO2为直线型分子的原因 ;
(3)H2O分子的立体构型为:___________________,请你预测水分子中∠H-O-H的大小范围并解释原因 _ ;
(4)SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测 SO2Cl2和SO2F2分子的立体构型:_____________________________, SO2Cl2分子中∠Cl-S-Cl________________(选填“<”、“>”或“=”)SO2F2分子中∠F-S-F。
27.(12分)教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素原子核外有_______种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是_______;判断依据是_______。
(3)在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_______晶体。
(4)第一电离能介于Al、P之间的第三周期元素有_______种。
(5)图4是碳化硅的晶胞结构。若碳化硅晶胞边长为apm,阿伏加德罗常数的值为,则碳化硅晶体的密度为_______(列出计算式即可)。
28.(12分)A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1)A元素基态原子占据最高能级的电子云轮廓图为____;B元素原子中未成对电子为_ 。
(2)写出C元素基态原子的电子排布式: 。
(3)D元素的价层电子排布图为: 。
(4)元素B与D的电负性的大小关系是B____(填“>”“<”或“=”,下同)D,E与C的第一电离能大小关系是E____C。
29.(13分)已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为:___________________,Y元素原子最外层电子的电子排布图为:____________。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为________(填“共价键”或“离子键”)。
(3)该化合物的空间结构为______________形,中心原子的轨道杂化类型为__________,分子为______________(填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____________。
(5)该化合物的沸点与SiCl4比较:________(填化学式)的高,原因是_________________。
参考答案:
1.B
【详解】A.气体单质分子中存在π键,故A错误;
B.能层含有的能级数等于能层序数,即第n能层含有n个能级,每一能层总是从s能级开始,同一能层中能级ns、np、nd、nf的能量依次增大,在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态,所以任一能层的能级总是从s能级开始,而且能级数等于该能层序数,故B正确;
C.同是s能级,在不同的能层中所能容纳的最多电子数都是2个,故C错误;
D.泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子,故D错误;
故选B。
2.C
【详解】由题干选项可知,A、C为F原子的激发态,而C为2个2p上的电子激发到3p上,A为1个2p上的电子激发到3s上,故C比A的能量更高,B为Ne原子的激发态,D为B原子的激发态,故答案为:C。
3.B
【详解】A.能级和能层只是表示电子在该处出现的概率大小,并不代表电子运动的位置,故基态原子的2s电子的能量较高,不一定在比1s电子离核更远的区域运动,A错误;
B.某元素+3价离子的电子排布式为1s22s22p63s23p63d5,离子的核外电子数是23,所以原子序数是26,即是铁元素,位于第四周期第Ⅷ族,属于d区,B 正确;
C.1s22s22px1→1s22s22py1,2P轨道上的能量一样,两者之间没有能量变化,也就没有光谱,C错误;
D.最外层电子数为ns2的元素在元素周期表第2列或第12列,还有第18列的He,还有一些过渡元素最外层电子数也为ns2,D错误;
故选B。
4.D
【分析】元素原子的价电子排布式为,则M为Al,元素位于周期表中第三周期,其原子最外层轨道为半充满状态,即3p3,则N为P,据此分析解答。
【详解】A.为Al属于金属元素,为P属于非金属元素,故A正确;
B.M为Al,则N为P ,都在第三周期,故B正确;
C.同周期元素电负性依次增大,的电负性大于,故C正确;
D.M为Al,则N为P,磷元素的p轨道为半充满状态,较稳定,第一电离能P>Al,故D错误;
答案选D。
【点睛】最外层处于全满、半满状态时较稳定,第一电离能偏高。
5.B
【分析】由四种元素基态原子电子排布式可知,①是元素,②是元素,③是元素,④是元素。
【详解】A.同周期自左而右第一电离能增大,由于P为半充满状态,较稳定,所以第一电离能,,同主族自上而下第一电离能降低,所以第一电离能,因此第一电离能:F>N>P>S,即④>③>②>①,故A错误;
B.同一周期从左往右主族元素原子半径依次减小,同一主族从上往下元素原子半径依次增大,故原子半径:P>S>N>F,即②>①>③>④,故B正确;
C.同一周期从左往右元素电负性依次增大,同一主族从上往下元素电负性依次减小,故电负性:F>N>S>P,即④>③>①>②,故C错误;
D.最高正化合价等于最外层电子数,但F元素没有正化合价,所以最高正化合价,即①>②=③,故D错误;
故选B。
6.D
【详解】由该原子电子排布式知,其最高能层为第5层,故位于第五周期,根据其价电子排布特点确定其位于ds区,对应族为IB,故答案选D。
7.D
【详解】A.第一周期元素的最外层电子排布由1s1过渡到1s2,A错误;
B.元素周期表共分成5个区,s区(ⅠA、ⅡA)、p区(ⅢA~ⅦA、0族)、d区(ⅢB~ⅦB、Ⅷ族)、ds区(ⅠB、ⅡB)、f区(镧系、锕系),B错误;
C.最外层电子数为8的粒子可能是稀有气体原子,也可能是离子,比如Na+、F-等,C错误;
D.周期表ⅢB~ⅡB称过渡元素,又这10列均为金属元素,所以又叫过渡金属元素,D正确;
故答案选D。
8.C
【详解】A.中心原子采取杂化的分子, VSEPR模型是正四面体形,但其空间结构不一定是正四面体形,如水和氨分子的中心原子采取杂化,但H2O是V形,是三角锥形,A错误;
B.分子中的杂化轨道是由碳原子的1个轨道和3个轨道重新组合形成的,B错误;
C.杂化轨道是由同一个原子中能量相近的1个轨道和3个轨道重新组合形成的一组新轨道,C正确;
D.型共价化合物,如中心原子没有孤电子对,则为杂化,例如,D错误。
故选:C。
9.B
【分析】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,根据碳原子连接的原子或原子团分析。
【详解】A项、A、CCl2F2分子中碳原子所连接的四个基团中两个是Cl原子,两个是F原子,不是手性碳原子,故A错误;
B项、分子中2号碳原子上连接4个不同的原子或原子团,该碳原子属于手性碳原子,故B正确;
C项、CH3CH2OH分子中两个碳原子所连接的四个基团都有相同的氢原子,不是手性碳原子,故C错误;
D项、CH3—OH分子中碳原子所连接的四个基团有相同的氢原子,不是手性碳原子,故D错误;
故选B。
10.D
【详解】由题所给条件,在N2F2分子中,所有原子均符合8电子稳定结构可知,其结构式应为:F-N=N-F,两个氮之间是氮氮双键,一个为σ键一个为π键,氮氟之间是单键,为σ键,所以该分子中的共价键类型是三个σ键,一个π键。故D正确。
综上所述,本题应选D。
【点睛】原子轨道以“头碰头”方式重叠的称为σ键,原子轨道以“肩并肩”方式重叠称为π键。σ键原子轨道重叠程度比π键原子轨道重叠程度大,所以σ键比π键牢固,在化学反应中π键易断裂。另外σ键只能形成单键,而双键或三键中既有σ键又有π键。
11.A
【分析】如果该微粒中不存在孤电子对,则该微粒的VSEPR模型和其空间立体构型就一致,否则不一致,据此分析解答。
【详解】A.BF3中心B原子的价层电子对数为=3,不含孤对电子对,VSEPR模型和立体构型相同,均为平面三角形,A符合题意;
B.SO2中心S原子的价层电子对数为=3,含一对孤电子对,VSEPR模型为平面三角形,立体构型为V形,B不符合题意;
C.H2O中心O原子的价层电子对数为=4,含两对孤电子对,VSEPR模型为四面体形,立体构型为V形,C不符合题意;
D.SO中心S原子价层电子对数为=4,含有一个孤电子对,VSEPR模型为四面体形,立体构型为三角锥形,D不符合题意;
综上所述答案为A。
12.A
【详解】CO2是直线形结构,键角是180°;是正四面体形结构,键角是109°28′;是三角锥形结构,键角是107°18′;是V型结构,键角是104.5°,则键角最大的是CO2,故选A。
13.B
【详解】A.氢键属于分子间作用力,不属于化学键,故A项错误;
B.物质熔化与沸腾时需要破坏氢键,而破坏氢键需要一定能量,所以分子间形成氢键使物质的熔点和沸点都升高,故B项正确;
C.第VIIA族元素中,只有氟化氢分子间存在氢键,沸点较高,出现反常,因此沸点为HF>HI>HBr>HCl,故C项错误;
D.水之所以化学性质稳定是因为分子内氢氧键比较稳定,与氢键无关,故D项错误。
答案为B。
14.D
【详解】A.CH4和CCl4中的C-H键和C-Cl键均为极性键,CH4和CCl4分子均为正四面体构型,高度对称,分子中正负电荷的中心重合,均为非极性分子,故A不符合题意;
B.NH3含有N-H极性键,分子空间结构为三角锥型,正负电荷中心不重合,为极性分子;CH4含有C-H极性键,为正四面体构型,高度对称,分子中正负电荷的中心重合,为非极性分子,故B不符合题意;
C.CO2含有C=O极性键,空间结构为直线形,正负电荷的中心重合,是非极性分子;CS2含有C=S极性键,空间结构为直线形,正负电荷的中心重合,是非极性分子,故C不符合题意;
D.H2S含有H-S极性键,正负电荷的中心不重合,是极性分子;HCl含有H-Cl极性键,正负电荷的中心不重合,是极性分子,故D符合题意;
答案选D。
15.C
【详解】根据价层电子对互斥理论来分析解答,3个σ键且不含孤电子对采用sp2杂化,含有4个σ键且不含孤电子对采用sp 3杂化。在CH3COCH3(丙酮)分子中,羰基碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,甲基碳原子含有4个σ键且不含孤电子对,所以采用sp3杂化,故C正确。
故选:C。
16.C
【详解】A. 晶体的形成都有一定的形成条件,如温度、压强、结晶速率等,但并不是说结晶速率越快越好,速率太快可能导致晶体质量下降,A错误;
B. 晶体都有固定的熔沸点,则晶体硅一定有固定的熔沸点,B错误;
C. X射线衍射实验能够测出物质的内部结构,根据微粒是否有规则的排列可区分晶体与非晶体,C正确;
D. 晶体的形成与晶体的自范性和各向异性都有密切关系,D错误;
故合理选项是C。
17.B
【详解】A.冰融化时,水分子没有改变,改变的是分子间的距离,所以分子中H-O键没有发生断裂,A错误;
B.共价晶体中,共价键的键能越大,破坏共价键所需的能量越大,该晶体的熔点越高,B正确;
C.分子晶体熔化或沸腾时,只改变分子间的距离,不需要破坏分子内的共价键,所以该晶体的熔沸点高低与键能无关,C错误;
D.分子晶体中,物质的稳定性与分子内原子间的共价键有关,与分子间作用力无关,D错误;
故选:B。
18.D
【详解】A.根据表格可知I1和I2之间差距较大,故X常见化合价为+1价,A正确;
B.X常见化合价为+1价,元素X与氯形成化合物时,化学式可能是XCl,B正确;
C.根据表格,Y的I3和I4差距较大,故Y的常见化合价为+3价,是第IIIA族元素,C正确;
D.若元素Y处于第三周期,则Y为Al,不可与冷水剧烈反应,D错误;
故选D。
19.C
【详解】A.键能的大小决定着物质的化学性质,键能越大,物质越稳定,H—Cl比H—I键能大,HCl比HI稳定,选项A正确;
B.由于Cl3C-比ClH2C-多一个氯原子,使Cl3C-的极性大于ClH2C-的极性,导致三氯乙酸的羧基中的羟基的极性更大,更易电离出氢离子,选项B正确;
C.乙醇在水中的溶解度大于丁醇(CH3CH2CH2CH2OH),是因为CH3CH2CH2CH2OH中烃基较大,其中的-OH占比少,溶解度明显减小,选项C错误;
D.分子晶体熔化时破坏分子间作用力,共价晶体熔化时破坏共价键,分子间作用力比共价键弱的多,所以分子晶体的熔点一般比共价晶体的熔点低,选项D正确;
答案选C。
20.C
【详解】分子晶体中的共价键有方向性,而分子间作用力中的氢键也有方向性,故A错误;在分子晶体中不一定存在氢键,如甲烷分子间及分子内都不存在氢键,故B错误;冰和Br2均由分子构成,均属于分子晶体,故C正确;稀有气体构成微粒是单原子分子,可形成分子晶体,故D错误。
21.B
【详解】A.原子晶体的熔点高,但不能导电,因此熔点700℃,导电性好,延展性强应该是金属晶体,A错误;
B.无色晶体,熔点3500℃,不导电,质硬,难溶于水和有机溶剂,符合原子晶体的性质特点,B正确;
C.无色晶体,能溶于水,质硬而脆,熔点800℃,熔化时能导电,符合离子晶体的性质,属于离子晶体,C错误;
D.熔点-56.6℃,微溶于水,硬度小,固态或液态时不导电,符合分子晶体的性质,属于分子晶体,D错误;
故选B。
22.A
【详解】A.金刚石和水晶是共价晶体,干冰是分子晶体,A错误;
B.共价晶体中存在共价键,故金刚石中存在共价键,分子晶体中可能存在共价键,如水中存在共价键,也可能不存在共价键,如稀有气体中不存在共价键,B正确;
C.共价晶体中共价键的强度强于分子间作用力,故共价晶体的硬度通常比分子晶体的大,C正确;
D.HCl为分子晶体,溶于水后的溶液盐酸可以导电,D正确;
故选A。
23.D
【详解】A.由表中数据可知,四氯化硅是熔、沸点较低的分子晶体,故A正确;
B.由表中数据可知,单质B是熔、沸点很高的共价晶体,故B正确;
C.由表中数据可知,氯化铝的沸点比熔点低,所以氯化铝加热能发生升华,故C正确;
D.由表中数据可知,单质B是熔、沸点很高的共价晶体,氯化铝是熔、沸点较低的分子晶体,两者晶体类型不同,故D错误;
故选D。
24.A
【详解】根据图示可知:在该晶胞中含有A粒子数目为8×=1,含有B粒子为12×=3,含有C粒子数目为6×=3,含有D粒子数目为1,因此该晶体中A、B、C、D 4种粒子的个数比为1∶3∶3∶1,故合理选项是A。
25.C
【详解】因为金属钠晶体为钾型,所以在晶胞中含有钠原子数为1+8×=2,设晶胞边长为x,根据ρ=得,ρ=,所以x=所以晶胞的体对角线长度为×,所以钠原子半径,
故选:C。
4 直线形 180° CO2属AX2E0,n+m=2,故为直线形 折线形(或V形) 水分子属AX2E2,n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′。根据Ⅲ-i,应有∠H-O-H<109°28′ 四面体 >
【分析】(1)当n+m=4时,VSEPR模型为四面体形,当n+m=2时,VSEPR模型为直线形;
(2) 根据 CO2属AX2E0,n+m=2,故为直线形;
(3)根据H2O属AX2E2,n+m=4,VSEPR模型为四面体形,但氧原子有2对孤电子对来判断分子的立体构型;水分子属AX2E2,n+m=4,VSEPR模型为正四面体,价层电子对之间的夹角均为109°28′,根据Ⅲ-i来判断键角;
(4)当n+m=4时,VSEPR模型为四面体形,硫原子无孤电子对来判断分子的立体构型;X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;
【详解】(1)当n+m=4时,VSEPR模型为四面体形,其键角是109°28′,当n+m=2时,VSEPR模型为直线形,其键角是180°;
(2) 根据 CO2属AX2E0,n+m=2,故为直线形;
(3)H2O属AX2E2,n+m=4,VSEPR模型为四面体形,但氧原子有2对孤电子对,所以分子的构型为V形;
水分子属AX2E2,n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′,根据Ⅲ-i,应有∠H-O-H<109°28′,故答案为V形;∠H-O-H<109°28′;
(4)当n+m=4时,VSEPR模型为四面体形,硫原子无孤电子对,所以分子构型为四面体形,F原子的得电子能力大于氯原子,因为X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强,所以SO2Cl2分子中∠Cl-S-Cl>SO2F2分子中∠F-S-F;
【点睛】本题主要考查价层电子对互斥模型判断分子的结构,难度不大,注意概念的把握。
27.(1)12
(2) 第二周期的元素的氢化物没有分子间氢键的是,为第ⅣA族元素,因此a为
(3)共价
(4)三
(5)
【详解】(1)该元素的第二电离能和第三电离能的差距较大,说明能层发生变化,故元素为Mg,最外层有12中运动状态不同的电子,故答案为:12;
(2)如图2所示,每条折线表示周期表第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化中,N、O、F三种氰化物可以形成分子间氢键,会造成熔沸点反常,第二周期的元素的氢化物没有分子间氢键的是CH4,为第ⅣA族元素,因此a为SiH4,故答案为:SiH4;第二周期的元素的氢化物没有分子间氢键的是,为第ⅣA族元素,因此a为;
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示,该晶胞结构与二氧化硅类似,故形成了共价晶体二氧化碳,故答案为:共价;
(4)同周期主族元素第一电离能随原子序数增大呈增大趋势,但IIA族的np为全充满、VA族的np为半充满稳定状态,第一电离能高于同周期相邻元素的,则第一电离能:Al<Mg<Si<S<P,介于Al、P之间的第三周期元素有3种,故答案为:三;
(5)晶胞中,C原子的数目为4,Si原子的数目为8×+6×=4,晶胞质量为m=g,晶胞体积为V=(a×10-10)3cm3,晶胞密度ρ=g/cm3,故答案为:。
28.(1) 球形 2 19
(2)1s22s22p63s23p1
(3)
(4) > <
【分析】A、、C、D、E五种元素,它们的核电荷数依次增大,且都小于;和D也属同一族,它们原子最外层的能级电子数是能级电子数的两倍,故最外层电子排布为,故B为元素,D为元素,和元素原子的最外层电子排布为,处于第Ⅰ族,为金属,的原子序数大于元素,故A为元素,为元素,C原子最外层上电子数等于D原子最外层上电子数的一半,故C原子最外层电子数为,原子序数介于O与之间,故C为元素。
【详解】(1)A为元素,的基态原子中电子占据最高能级为,轨道的电子云轮廓图为球形;为O元素,基态原子核中核外含有8个电子,核外电子排布式为1s22s2sp4,未成对电子为;E为K元素,基态原子核中核外含有19个电子,则有19种运动状态不同的电子;
(2)C为原子,基态原子的电子排布式为;
(3)D为元素,原子价层电子排布为,价电子排布图为
(4)同主族自上而下电负性降低,故电负性,金属性越强,第一电离能越小,故第一电离能。
29. 1s22s22p63s23p63d104s24p2 共价键 正四面体 sp3杂化 非极性分子 范德华力 GeCl4 组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔、沸点越高
【详解】X元素与碳元素同主族且位于周期表中的第一长周期,X为Ge元素,Y原子是短周期元素且最外层电子数比内层电子总数少3,Y为Cl元素,化合物XY4为GeCl4。
(1)Ge元素是32号元素,基态原子核外电子排布式为 [Ar] 3d104s24p2或1s22s22p63s23p63d104s24p2;氯元素原子最外层电子的电子排布图为;
(2)Cl元素与Ge元素的电负性差为2.85-2.1=0.75,小于1.7,所以GeCl4为共价化合物,分子内只含有共价键;
(3)Ge元素与C元素处于相同主族,GeCl4与CCl4具有相似的结构和性质,Ge原子采取sp3杂化,GeCl4为正四面体形,空间对称,是非极性分子;
(4)GeCl4在常温下为液体,熔点低,由分子构成.微粒间作用力为范德华力;
(5)这两种化合物的结构相似,GeCl4相对分子质量大,分子间作用力强,沸点高。
【点睛】本题考查原子、分子以及晶体的结构和性质,注意判断GeCl4的化合物类型时要结合电负性差值进行分析,不能因为Ge为金属就直接判断GeCl4为离子化合物,为易错点。
同课章节目录
