1.1.2分散系及其分类 课件(共34张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1.2分散系及其分类 课件(共34张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 66.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-10 00:00:00 | ||
图片预览







文档简介
(共34张PPT)
1.1 物质的分类及其转化
第二课时 分散系及其分类
你能解释这些生活中的现象吗?
阳光灿烂的清晨,在茂密的树林里,你会看到什么景象?
素养要求
1.熟知溶液、浊液、胶体三种分散系的本质区别。
2.认识胶体是一种常见的分散系,了解胶体的性质及其应用,会鉴别胶体和溶液。
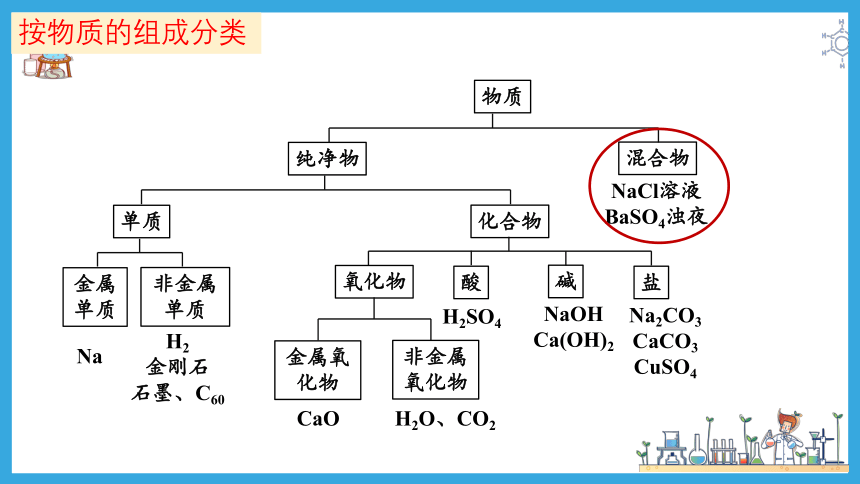
按物质的组成分类
物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
氧化物
酸
碱
盐
Na
H2
金刚石
石墨、C60
金属氧化物
非金属氧化物
CaO
H2O、CO2
H2SO4
NaOH
Ca(OH)2
Na2CO3
CaCO3
CuSO4
NaCl溶液
BaSO4浊夜
1
分散系
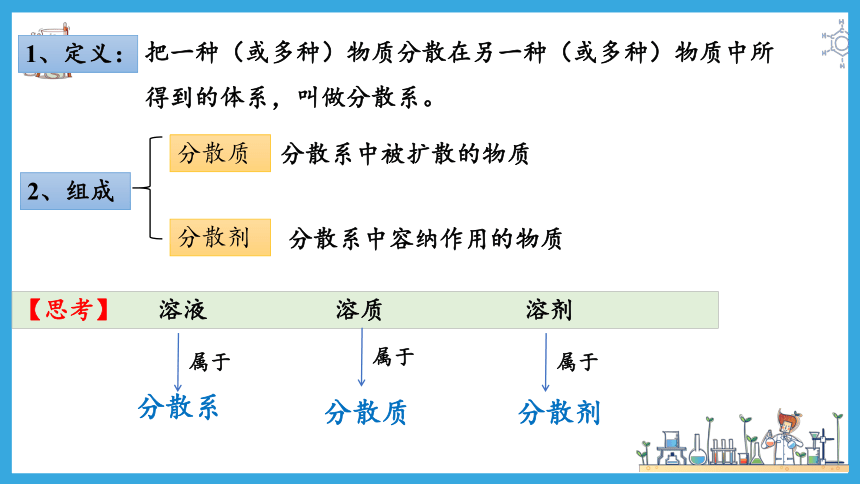
1、定义:
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫做分散系。
2、组成
分散系中被扩散的物质
分散质
分散系中容纳作用的物质
分散剂
【思考】 溶液 溶质 溶剂
属于
属于
属于
分散系
分散质
分散剂
溶液:
一种或几种物质分散到另一种物质里,形成均一、稳定的混合物
悬浊液:
固体小颗粒悬浮于液体里形成的混合物
乳浊液:
小液滴分散到液体里形成的混合物
[相同点]
一种或几种物质分散到另一种物质里,形成的分散系。
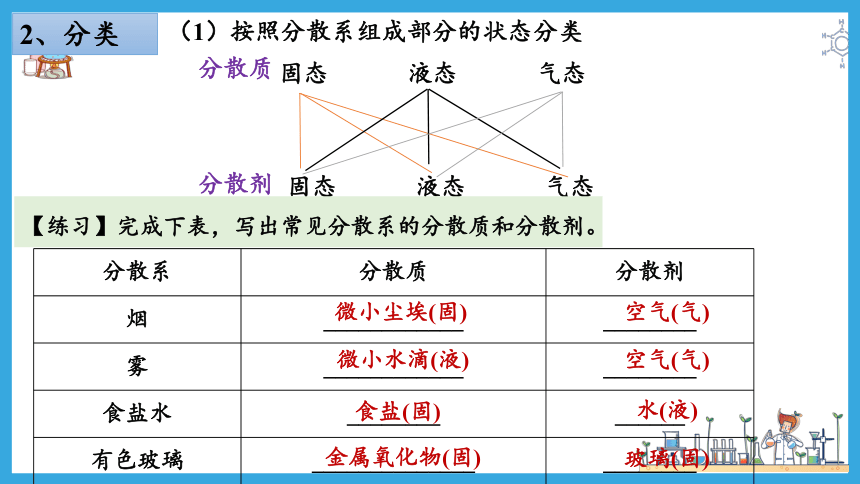
2、分类
(1)按照分散系组成部分的状态分类
分散质
分散剂
固态 液态 气态
固态 液态 气态
【练习】完成下表,写出常见分散系的分散质和分散剂。
分散系 分散质 分散剂
烟 ____________ ________
雾 ____________ ________
食盐水 ________ ______
有色玻璃 ______________ ________
微小尘埃(固)
空气(气)
微小水滴(液)
空气(气)
食盐(固)
水(液)
金属氧化物(固)
玻璃(固)
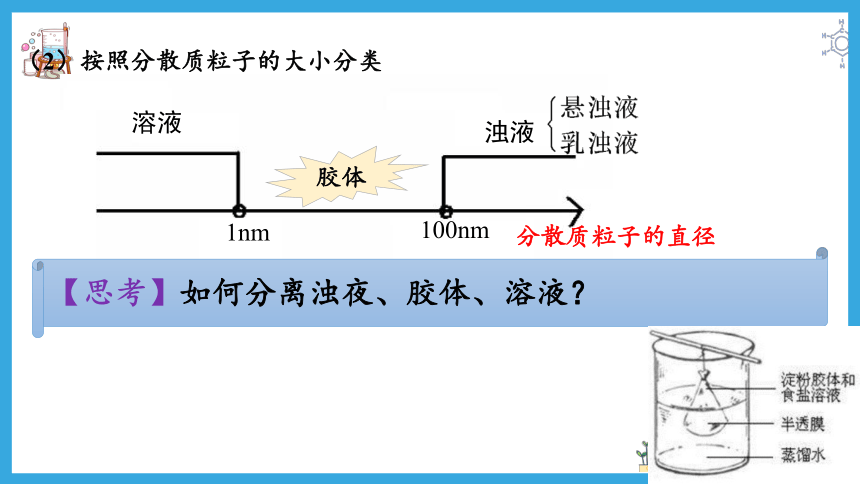
(2)按照分散质粒子的大小分类
分散质粒子的直径
溶液
浊液
1nm
100nm
胶体
【思考】如何分离浊夜、胶体、溶液?
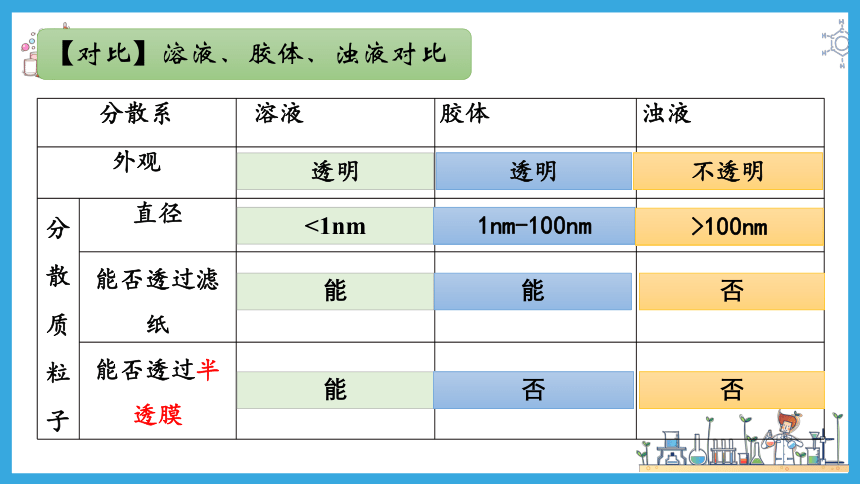
分散系 溶液 胶体 浊液
外观
分散质粒子 直径
能否透过滤纸
能否透过半透膜
透明
不透明
透明
<1nm
1nm-100nm
>100nm
能
能
能
否
否
否
【对比】溶液、胶体、浊液对比
判断正误
(1)氯化钠溶液均一、稳定、透明,不是分散系( )
(2)“冰水混合物”是一种分散系( )
(3)分散系有的是纯净物,有的是混合物( )
(4)分散系可以是固态、液态或气态( )
(5)油水混合物属于乳浊液( )
(6)直径为1~100 nm的粒子称为胶体( )
×
×
×
√
√
×
思想在线
2.溶液、胶体和浊液三种分散系的本质区别是
A.是否是大量分子或离子的集合体
B.是否能通过滤纸
C.分散质粒子直径的大小
D.是否均一、透明、稳定
C
2
胶 体
1.胶体的树状分类
胶体
根据分散剂的状态
气溶胶
液溶胶
固溶胶
分散质粒子的直径为1 100 nm的分散系称为胶体 。
P8 【实验1-1】
【演示实验】Fe(OH)3胶体的制备及性质探究
2.氢氧化铁胶体的制备
(1)实验操作
实验现象:
反应方程式: FeCl3+3H2O=== Fe(OH)3(胶体)+3HCl
△
烧杯中液体呈透明的红褐色
特别提醒:
①不能用玻璃棒搅拌。
②不能过度加热,加热至液体呈红褐色,停止加热。
3.胶体的性质
(1)丁达尔效应
【实验探究】
操作 在与光束垂直的方向观察现象 原因分析
一条光亮的“通路” 胶体粒子的直径__________ nm,能对光线散射
无明显现象 溶液中粒子的直径________ nm,散射极其微弱
1~100
小于1
由于胶体粒子对光束的散射(物理方法)
【生活中的丁达尔效应】
电影院投射在银幕的光柱
树林中光线透过树叶间隙形成光束
(2)应用:丁达尔效应常用来区分 和 。
胶体
溶液
思考:在盛有氯化铁溶液的烧杯中,加入氢氧化钠溶液反应后,得到的分散系为悬浊液。分析两溶液混合生成悬浊液而不是生成胶体的原因。
提示 生成的Fe(OH)3多,聚集成大颗粒而沉淀下来。
思想在线
【思维提炼】AlCl3具有与FeCl3类似的性质,写出AlCl3常温下溶于水生成Al(OH)3胶体的化学方程式:___________________________________。
AlCl3+3H2O===Al(OH)3(胶体)+3HCl
(2)介稳性
胶体的稳定性介于溶液和浊夜之间,属于介稳性,在一定条件下能稳定存在
(3)吸附性
胶体粒子课通过吸附溶液中的电离子带电,但胶体粒子本身不带电
eg:Fe(OH)3胶体通过吸附作用带有正电荷
H2SiO3胶体通过吸附作用带有负电荷
(4)聚沉
一定条件下,中和或减弱胶体的电荷,胶体就会聚集成较大颗粒而析出,这种性质叫胶体的聚沉。
①概念:
Ⅰ加酸、碱、盐等电解质溶液
Ⅱ加带相反电荷的胶体
Ⅲ加热凝聚(加热较长时间)
②聚沉的常见方法
三、胶体的应用
农业生产:
土壤的保肥等
医疗卫生:
血液透析、电泳分离蛋白质和氨基酸等
日常生活:制豆腐、明矾净水等
工业生产:
有色玻璃的制备等
自然地理:
江河入海口三角洲的形成等
明矾净水
明矾净水原理:Al3+ +3H2O = Al(OH)3(胶体)+3H+
【思想在线】下列胶体和溶液的区别,下列叙述正确的是( )
A、溶液呈电中性,胶体带有电荷
B、溶液中溶质粒子能通过滤纸、胶体中分散质粒子不能透过滤纸
C、溶液中通过一束光没有特殊现象,胶体中通过一束光线会出现光亮的“通路”
D、溶液稳定,放置后不会生成沉淀,胶体不稳定,放置后会生成沉淀
C
溶液、胶体、浊液三类分散系的比较
分散系 溶液 胶体 浊液
分散质粒子种类 分子、离子 大量分子聚集体或大分子 大量粒子聚集体
分散质粒子的直径 小于1 nm 1~100 nm 大于100 nm
外部特征 均一、透明、稳定 较均一、透明、较稳定 不均一、不透明、不稳定,久置沉淀(或分层)
能否透过滤纸 能 能 不能
鉴别方法 胶体和浊液可通过静置鉴别;胶体和溶液可通过丁达尔效应鉴别 3
课 堂 检 测
1.(2022·北京汇文中学高一期末)下列分散系中不会出现丁达尔效应的是( )
①氢氧化铁胶体 ②CuSO4溶液 ③雾
④蔗糖溶液 ⑤FeCl3溶液 ⑥稀豆浆
A.②④⑤ B.③④ C.②④⑥ D.①③④
A
2.(2023·成都高一期末)下列有关分散系的说法不正确的是( )
A.乳浊液和悬浊液都属于浊液,它们的分散质粒子的直径均大于100 nm
B.直接加热氯化铁饱和溶液制取Fe(OH)3胶体
C.按照分散剂的不同,胶体可分为液溶胶、气溶胶和固溶胶
D.可用丁达尔效应区分CuSO4溶液和Fe(OH)3胶体
B
3.FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述不正确的是( )
A.胶体和溶液能透过滤纸,而浊液不能透过滤纸
B.分别用一束光照射三种分散系,只有Fe(OH)3胶体能产生丁达尔效应
C.三种分散系的稳定性:FeCl3溶液>Fe(OH)3胶体>Fe(OH)3浊液
D.根据能否产生丁达尔效应,将分散系分为溶液、浊液和胶体
D
4.某小组进行了如下实验:
①将1 g KCl加入100 g水中
②将1 g可溶性淀粉加入100 g水中,搅拌均匀后煮沸
③将1 g CaCO3粉末加入100 g水中,充分振荡
④将0.1 g 植物油加入10 g水中,充分振荡
⑤将96 mL酒精与5 mL水充分混合
(注:淀粉分子的直径为1~100 nm)
其中所得到的分散系,属于溶液的有_______(填序号,下同),属于胶体的有____,属于浊液的有______。
①⑤
②
③④
溶液
胶体
悬浊液
乳浊液
溶液
5.Fe2O3又称铁红,请根据要求完成下列问题。
(1)Fe2O3固体(红棕色)属于________(填“纯净物”或“混合物”)。将其加入适量盐酸中,反应的化学方程式:__________________________________。
(2)用上述所得溶液进行下列实验:取少量溶液于试管中,滴入NaOH溶液,可观察到有红褐色沉淀产生,反应的化学方程式:______________________________。
纯净物
Fe2O3+6HCl=2FeCl3+3H2O
FeCl3+3NaOH=3NaCl+Fe(OH)3↓
(3)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向烧杯中加入几滴FeCl3饱和溶液,继续煮沸至出现________色,停止加热即可制得Fe(OH)3胶体。
(4)另取一小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡摇匀后,将此烧杯(甲)与盛有Fe(OH)3胶体的烧杯(乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到________(填“甲”或“乙”)烧杯的液体中产生了丁达尔效应。
红褐
乙
1.1 物质的分类及其转化
第二课时 分散系及其分类
你能解释这些生活中的现象吗?
阳光灿烂的清晨,在茂密的树林里,你会看到什么景象?
素养要求
1.熟知溶液、浊液、胶体三种分散系的本质区别。
2.认识胶体是一种常见的分散系,了解胶体的性质及其应用,会鉴别胶体和溶液。
按物质的组成分类
物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
氧化物
酸
碱
盐
Na
H2
金刚石
石墨、C60
金属氧化物
非金属氧化物
CaO
H2O、CO2
H2SO4
NaOH
Ca(OH)2
Na2CO3
CaCO3
CuSO4
NaCl溶液
BaSO4浊夜
1
分散系
1、定义:
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫做分散系。
2、组成
分散系中被扩散的物质
分散质
分散系中容纳作用的物质
分散剂
【思考】 溶液 溶质 溶剂
属于
属于
属于
分散系
分散质
分散剂
溶液:
一种或几种物质分散到另一种物质里,形成均一、稳定的混合物
悬浊液:
固体小颗粒悬浮于液体里形成的混合物
乳浊液:
小液滴分散到液体里形成的混合物
[相同点]
一种或几种物质分散到另一种物质里,形成的分散系。
2、分类
(1)按照分散系组成部分的状态分类
分散质
分散剂
固态 液态 气态
固态 液态 气态
【练习】完成下表,写出常见分散系的分散质和分散剂。
分散系 分散质 分散剂
烟 ____________ ________
雾 ____________ ________
食盐水 ________ ______
有色玻璃 ______________ ________
微小尘埃(固)
空气(气)
微小水滴(液)
空气(气)
食盐(固)
水(液)
金属氧化物(固)
玻璃(固)
(2)按照分散质粒子的大小分类
分散质粒子的直径
溶液
浊液
1nm
100nm
胶体
【思考】如何分离浊夜、胶体、溶液?
分散系 溶液 胶体 浊液
外观
分散质粒子 直径
能否透过滤纸
能否透过半透膜
透明
不透明
透明
<1nm
1nm-100nm
>100nm
能
能
能
否
否
否
【对比】溶液、胶体、浊液对比
判断正误
(1)氯化钠溶液均一、稳定、透明,不是分散系( )
(2)“冰水混合物”是一种分散系( )
(3)分散系有的是纯净物,有的是混合物( )
(4)分散系可以是固态、液态或气态( )
(5)油水混合物属于乳浊液( )
(6)直径为1~100 nm的粒子称为胶体( )
×
×
×
√
√
×
思想在线
2.溶液、胶体和浊液三种分散系的本质区别是
A.是否是大量分子或离子的集合体
B.是否能通过滤纸
C.分散质粒子直径的大小
D.是否均一、透明、稳定
C
2
胶 体
1.胶体的树状分类
胶体
根据分散剂的状态
气溶胶
液溶胶
固溶胶
分散质粒子的直径为1 100 nm的分散系称为胶体 。
P8 【实验1-1】
【演示实验】Fe(OH)3胶体的制备及性质探究
2.氢氧化铁胶体的制备
(1)实验操作
实验现象:
反应方程式: FeCl3+3H2O=== Fe(OH)3(胶体)+3HCl
△
烧杯中液体呈透明的红褐色
特别提醒:
①不能用玻璃棒搅拌。
②不能过度加热,加热至液体呈红褐色,停止加热。
3.胶体的性质
(1)丁达尔效应
【实验探究】
操作 在与光束垂直的方向观察现象 原因分析
一条光亮的“通路” 胶体粒子的直径__________ nm,能对光线散射
无明显现象 溶液中粒子的直径________ nm,散射极其微弱
1~100
小于1
由于胶体粒子对光束的散射(物理方法)
【生活中的丁达尔效应】
电影院投射在银幕的光柱
树林中光线透过树叶间隙形成光束
(2)应用:丁达尔效应常用来区分 和 。
胶体
溶液
思考:在盛有氯化铁溶液的烧杯中,加入氢氧化钠溶液反应后,得到的分散系为悬浊液。分析两溶液混合生成悬浊液而不是生成胶体的原因。
提示 生成的Fe(OH)3多,聚集成大颗粒而沉淀下来。
思想在线
【思维提炼】AlCl3具有与FeCl3类似的性质,写出AlCl3常温下溶于水生成Al(OH)3胶体的化学方程式:___________________________________。
AlCl3+3H2O===Al(OH)3(胶体)+3HCl
(2)介稳性
胶体的稳定性介于溶液和浊夜之间,属于介稳性,在一定条件下能稳定存在
(3)吸附性
胶体粒子课通过吸附溶液中的电离子带电,但胶体粒子本身不带电
eg:Fe(OH)3胶体通过吸附作用带有正电荷
H2SiO3胶体通过吸附作用带有负电荷
(4)聚沉
一定条件下,中和或减弱胶体的电荷,胶体就会聚集成较大颗粒而析出,这种性质叫胶体的聚沉。
①概念:
Ⅰ加酸、碱、盐等电解质溶液
Ⅱ加带相反电荷的胶体
Ⅲ加热凝聚(加热较长时间)
②聚沉的常见方法
三、胶体的应用
农业生产:
土壤的保肥等
医疗卫生:
血液透析、电泳分离蛋白质和氨基酸等
日常生活:制豆腐、明矾净水等
工业生产:
有色玻璃的制备等
自然地理:
江河入海口三角洲的形成等
明矾净水
明矾净水原理:Al3+ +3H2O = Al(OH)3(胶体)+3H+
【思想在线】下列胶体和溶液的区别,下列叙述正确的是( )
A、溶液呈电中性,胶体带有电荷
B、溶液中溶质粒子能通过滤纸、胶体中分散质粒子不能透过滤纸
C、溶液中通过一束光没有特殊现象,胶体中通过一束光线会出现光亮的“通路”
D、溶液稳定,放置后不会生成沉淀,胶体不稳定,放置后会生成沉淀
C
溶液、胶体、浊液三类分散系的比较
分散系 溶液 胶体 浊液
分散质粒子种类 分子、离子 大量分子聚集体或大分子 大量粒子聚集体
分散质粒子的直径 小于1 nm 1~100 nm 大于100 nm
外部特征 均一、透明、稳定 较均一、透明、较稳定 不均一、不透明、不稳定,久置沉淀(或分层)
能否透过滤纸 能 能 不能
鉴别方法 胶体和浊液可通过静置鉴别;胶体和溶液可通过丁达尔效应鉴别 3
课 堂 检 测
1.(2022·北京汇文中学高一期末)下列分散系中不会出现丁达尔效应的是( )
①氢氧化铁胶体 ②CuSO4溶液 ③雾
④蔗糖溶液 ⑤FeCl3溶液 ⑥稀豆浆
A.②④⑤ B.③④ C.②④⑥ D.①③④
A
2.(2023·成都高一期末)下列有关分散系的说法不正确的是( )
A.乳浊液和悬浊液都属于浊液,它们的分散质粒子的直径均大于100 nm
B.直接加热氯化铁饱和溶液制取Fe(OH)3胶体
C.按照分散剂的不同,胶体可分为液溶胶、气溶胶和固溶胶
D.可用丁达尔效应区分CuSO4溶液和Fe(OH)3胶体
B
3.FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述不正确的是( )
A.胶体和溶液能透过滤纸,而浊液不能透过滤纸
B.分别用一束光照射三种分散系,只有Fe(OH)3胶体能产生丁达尔效应
C.三种分散系的稳定性:FeCl3溶液>Fe(OH)3胶体>Fe(OH)3浊液
D.根据能否产生丁达尔效应,将分散系分为溶液、浊液和胶体
D
4.某小组进行了如下实验:
①将1 g KCl加入100 g水中
②将1 g可溶性淀粉加入100 g水中,搅拌均匀后煮沸
③将1 g CaCO3粉末加入100 g水中,充分振荡
④将0.1 g 植物油加入10 g水中,充分振荡
⑤将96 mL酒精与5 mL水充分混合
(注:淀粉分子的直径为1~100 nm)
其中所得到的分散系,属于溶液的有_______(填序号,下同),属于胶体的有____,属于浊液的有______。
①⑤
②
③④
溶液
胶体
悬浊液
乳浊液
溶液
5.Fe2O3又称铁红,请根据要求完成下列问题。
(1)Fe2O3固体(红棕色)属于________(填“纯净物”或“混合物”)。将其加入适量盐酸中,反应的化学方程式:__________________________________。
(2)用上述所得溶液进行下列实验:取少量溶液于试管中,滴入NaOH溶液,可观察到有红褐色沉淀产生,反应的化学方程式:______________________________。
纯净物
Fe2O3+6HCl=2FeCl3+3H2O
FeCl3+3NaOH=3NaCl+Fe(OH)3↓
(3)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向烧杯中加入几滴FeCl3饱和溶液,继续煮沸至出现________色,停止加热即可制得Fe(OH)3胶体。
(4)另取一小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡摇匀后,将此烧杯(甲)与盛有Fe(OH)3胶体的烧杯(乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到________(填“甲”或“乙”)烧杯的液体中产生了丁达尔效应。
红褐
乙
